El cáncer oculto de mama (COM), con una incidencia del 0,3-1%, aún plantea retos diagnósticos y terapéuticos. El objetivo del trabajo fue determinar las características patológicas de nuestra serie de COM, evaluar los resultados de las técnicas diagnósticas y terapéuticas empleadas (cirugía mamaria con linfadenectomía axilar o solo linfadenectomía axilar) y la supervivencia global.
Pacientes y métodosAnálisis retrospectivo de 21 pacientes con metástasis ganglionares de cáncer mamario con mamografía y ecografía mamaria negativas. Desde 2003 se incluyó la resonancia magnética nuclear (RMN) en el protocolo de estudio. Se valoró la supervivencia en 2 grupos; grupo A: pacientes con COM tratadas con cirugía mamaria (15 casos), bien mastectomía radical (10 pacientes) bien cirugía conservadora (5 casos), y grupo B: 4 pacientes tratadas quirúrgicamente con linfadenectomía axilar niveles i y ii de Berg. Se asoció radioterapia sobre la mama tras cirugía conservadora (50Gy) y sobre la axila si >3 adenopatías axilares tumorales.
ResultadosEn 9 pacientes (7 de las mastectomías y 2 de las cirugías conservadoras) se identificó histológicamente un carcinoma de mama, de tipo ductal infiltrante en 8 casos y un carcinoma medular. La RMN (6 casos) demostró en 2 pacientes tumor mamario con confirmación histológica de carcinoma. Con una mediana de seguimiento de 87 meses, la supervivencia global fue de 101,2 meses (rango: 12-235 meses) con una supervivencia a 5 años del 69%. La supervivencia media en el grupo A fue de 120 meses, superior a los 41 meses del grupo B (p=0,05).
ConclusionesEn nuestra serie el tratamiento quirúrgico sobre la mama mejora la supervivencia global respecto al grupo tratado solo con linfadenectomía axilar. La RMN ha sido útil para evidenciar nódulos tumorales ante un supuesto COM y permite seleccionar a pacientes para realizar cirugía conservadora de la mama.
Occult breast cancer (OBC) has an incidence of 0.3-1% but nevertheless represents a diagnostic and therapeutic challenge. The aim of our study was to determine the pathologic characteristics of patients in our OBC series, compare the results of the different diagnostic and therapeutic techniques available (breast surgery with axillary lymphadenectomy or axillary lymphadenectomy alone), and overall survival.
Patients and methodsA retrospective analysis was carried out in 21 patients with axillary lymph node metastases and negative mammography and breast ultrasonography. From 2003 onward, our group included magnetic resonance imaging (MRI) in the study protocol of OBC. Overall survival was determined and 2 groups were compared: Group A consisted of patients with OBC treated with breast surgery (n=15), either with radical breast mastectomy (n=10) or breast-conserving surgery (n=5); and group B consisted of patients (n=4) treated surgically with Berg level i or ii axillary lymphadenectomy. We added breast radiotherapy (50Gy) in patients treated with breast-conserving therapy and axillary radiotherapy when there were more than 3 metastatic axillary nodes.
ResultsIn 9 patients (7 mastectomies, 2 breast-conserving interventions), one breast carcinoma, 8 infiltrating ductal carcinomas and one medullar carcinoma were identified by histology. Two breast carcinomas were detected by MRI in 6 patients, which were later confirmed by histologic study. The median follow-up was 87 months, with an overall survival of 101.2 months (range: 12-235 months) and a 5-year survival of 69%. The mean survival was 120 months in group A and 41 months in group B (P=.05).
ConclusionsIn our series, surgical treatment of OBC improved overall survival compared with lymphadenectomy alone. MRI was useful in the identification of malignant tumors in suspected OBC and allowed patient selection for breast-conserving surgery.
El cáncer oculto de mama (COM) se manifiesta como metástasis ganglionar, axilar o extraganglionar sin alteraciones clínicas ni radiológicas de tumor primario en la glándula mamaria. Es una forma infrecuente de presentación del cáncer de mama (CM), descrita por Halsted en 19071 y con una incidencia del 0,3 al 1%2. El COM continúa planteando problemas diagnósticos y terapéuticos. El diagnóstico diferencial de metástasis axilares de un adenocarcinoma debe incluir además del posible origen mamario, una etiología en útero, ovario, pulmón, tiroides, tubo gastrointestinal e hígado, melanomas y riñón, aunque en las pacientes que presenten una adenopatía axilar infiltrada por adenocarcinoma lo más probable es que el origen sea mamario3. Técnicas de imagen más sensibles que la mamografía y la ecografía, como la resonancia magnética nuclear (RMN), PET-TAC, SPECT, y 99mTc-MIBI4,5 permiten detectar lesiones subclínicas sugestivas de cáncer de mama, minimizando actualmente la presentación clínica del COM.
Respecto al tratamiento, está bien establecida la utilidad de la linfadenectomía asociada a radioterapia axilar en el control locorregional de la enfermedad, sin embargo no hay un acuerdo en el tratamiento local de la mama bien sea quirúrgico6 bien con radioterapia7 y su verdadero impacto en la supervivencia global.
Los objetivos de este estudio son determinar las características patológicas de los pacientes que cumplen los criterios de COM, evaluar los resultados de las diferentes técnicas diagnósticas y terapéuticas empleadas, y determinar la supervivencia global en nuestra serie.
Pacientes y métodosSe trata de un estudio retrospectivo de las pacientes diagnosticadas de COM y registradas en una base de datos de cáncer de mama, durante el periodo de 28 años entre enero de 1982 y diciembre de 2009.
Se incluyeron las pacientes con criterios de COM vigentes del diagnóstico; examen clínico, mamografías y ecografía mamaria negativas. Se excluyeron del estudio pacientes con antecedentes de CM o sospecha de tumor maligno de mama en alguna prueba diagnóstica previa. A partir de 2003, se incluyó la RMN en el protocolo diagnóstico de COM.
Las variables estudiadas fueron la edad, receptores de estrógenos (RE) y de progesterona (RP), expresión de Her2 neu en tejido linfático axilar, tipo y grado histológico del carcinoma así como los tratamientos realizados, quirúrgico, radioterápico y de quimioterapia y/u hormonoterapia.
La expresión de RE y RP se obtuvo mediante técnicas inmunohistoquímicas sobre tejido tumoral fijado en formol e incluido en parafina, (anticuerpos anti-RE [clon 6F11] y anti-RP [clon 1A6], Novocastra, Newcastle, Reino Unido) hasta 2008 y con anticuerpos monoclonales (clon SP1 y clon 1E2, Ventana, Tucson, EE. UU.) en 2009. Se consideraron RE y RP positivos con tinción nuclear >10%. La determinación de la proteína Her2 neu se realizó manualmente hasta 1999 (clon CB11, Novocastra, Newcastle, Reino Unido) y posteriormente con técnica de Herceptest© (clon A0485, Dako, Dinamarca) considerando 3+ como positivo (tinción intensa y circunferencial en más del 30% de las células), 2+ se consideró como «indeterminado» realizando hibridación in situ con fluorescencia (FISH) (Dako HER2 FISH pharmDxKit, K5331). Se consideró 0 y 1+ en el Herceptest© como Her2 neu negativo.
Para la valoración de los resultados se definieron 2 grupos según el tratamiento empleado; grupo A: pacientes con COM a las que se realizó linfadenectomía axilar y cirugía sobre la mama, bien mastectomía (subgrupo MX) bien cuadrantectomía y radioterapia mamaria con 50GY (subgrupo CC), y grupo B: pacientes con COM tratadas quirúrgicamente solo con linfadenectomía axilar.
En ambos grupos se asoció radioterapia axilar en caso de >3 adenopatías tumorales y sobre la mama tras cirugía conservadora. Se indicó quimioterapia adyuvante según estadificación TNM y hormonoterapia (tamoxifeno 20mg/día en pacientes premenopáusicas e inhibidores de aromatasas en las posmenopáusicas) en función del estado de los receptores hormonales.
Como quimioterápicos se emplearon inicialmente AC x4 o AT x4+CMF x4; en la actualidad se aplica un esquema con taxol semanal x12+FEC x4. En pacientes Her2+++ se administró trastuzumab iv (dosis inicial de 8mg/kg y mantenimiento con 6mg/kg cada 3 semanas) durante 12 meses. El tratamiento radioterápico se realizó mediante radioterapia externa de la mama y fosa supraclavicular, con 2 campos tangenciales mediante acelerador lineal de 6Mv, a 250 c Gy/fracción/día hasta una dosis de 50Gy.
Por último se señalaron las recaídas sistémicas identificadas durante el periodo de seguimiento según protocolo de oncología (TAC toracoabdominal, rastreo óseo, marcadores tumorales) y se analizó la supervivencia global de la serie según tipo de tratamiento quirúrgico empleado.
El análisis estadístico se realizó mediante el programa IBM® SPSS® Statistics v17, utilizando el método de Kaplan-Meier para el análisis y elaboración de curvas de supervivencia, y el test de log-rank para la comparación entre las curvas. Se consideró valor estadísticamente significativo p≤0,05.
ResultadosDe 5.946 pacientes diagnosticados de cáncer de mama, 21 cumplieron los criterios de COM, lo que representa una incidencia del 0,35%.
Todos los casos fueron mujeres con una media de edad de 54±12,5 años (rango: 33-73 años). La mayor incidencia ocurrió entre 51 y 70 años (n=11) predominando en pacientes posmenopáusicas (n=13). Ninguna presentaba antecedentes familiares de carcinoma mamario.
La forma de presentación más común fue la detección de una adenopatía axilar en 19 pacientes (90,5%) y adenopatía supraclavicular otros 2 casos.
El diagnóstico de adenopatías axilares metastásicas por adenocarcinoma de probable origen mamario se obtuvo por biopsia, mediante PAAF en 7 casos (33,3%) y BAG en 14 pacientes (66,6%). Los RE y RP fueron positivos en 8 pacientes (38%), 3 casos de Her2 neu+ (15%) y 8 pacientes con fenotipo triple negativo (38%).
Tanto la mamografía como la ecografía mamaria fueron negativas para CM. En 3 casos (14%) en la mamografía se detectaron calcificaciones no patológicas (BI-RADS 3) y en la reevaluación radiológica a posteriori en 2 (9,5%) se consideró una densidad asimétrica de la mama homolateral. De las 19 exploraciones ecográficas inicialmente normales, en 4 (21,5%) al revisarlas se detectaron alteraciones del patrón ecográfico. En estas pacientes se realizó BAG de las zonas sospechosas con resultado histopatológico negativo para CM. La RMN realizada en 6 pacientes (28,6%) identificó en 2 casos nódulos de 1 y 1,5cm, ambos en CSE, confirmados como CM en el estudio histológico posquirúrgico. En ambos casos la ecografía no localizó los nódulos y fueron incluidos como COM en nuestra serie.
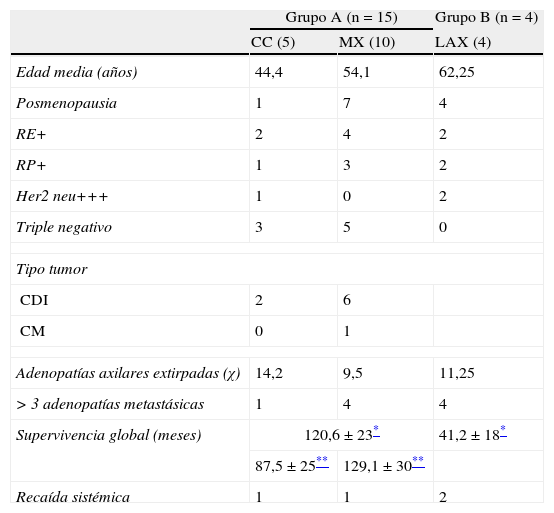
Como se señala en la tabla 1, en 19 pacientes se realizó tratamiento quirúrgico; en el grupo A se incluyeron 15 pacientes, 5 tratadas con cuadrantectomía superoexterna y linfadenectomía axilar (subgrupo CC) y 10 pacientes a las que se les realizó mastectomía radical modificada (subgrupo MX). Al grupo B, compuesto por 4 pacientes, se les practicó solo linfadenectomía axilar de los niveles i y ii de Berg. Se asoció radioterapia mamaria en las 5 pacientes con cirugía conservadora y radioterapia axilar (50Gy) en 6 pacientes por presentar >3 ganglios afectos.
Características clínicas e histológicas de la serie de COM según tratamiento quirúrgico realizado (n=19)
| Grupo A (n=15) | Grupo B (n=4) | ||
| CC (5) | MX (10) | LAX (4) | |
| Edad media (años) | 44,4 | 54,1 | 62,25 |
| Posmenopausia | 1 | 7 | 4 |
| RE+ | 2 | 4 | 2 |
| RP+ | 1 | 3 | 2 |
| Her2 neu+++ | 1 | 0 | 2 |
| Triple negativo | 3 | 5 | 0 |
| Tipo tumor | |||
| CDI | 2 | 6 | |
| CM | 0 | 1 | |
| Adenopatías axilares extirpadas (χ) | 14,2 | 9,5 | 11,25 |
| >3 adenopatías metastásicas | 1 | 4 | 4 |
| Supervivencia global (meses) | 120,6±23* | 41,2±18* | |
| 87,5±25** | 129,1±30** | ||
| Recaída sistémica | 1 | 1 | 2 |
CC: cirugía conservadora; CDI: carcinoma ductal infiltrante; CM: carcinoma medular; LAX: linfadenectomía axilar; MX: mastectomía radical modificada, RE+: receptores estrogénicos positivos; RP+: receptores de progesterona positivos; χ: media.
En el grupo A, el estudio histopatológico del tejido mamario resecado identificó tumor en 9 casos (60%), en 7 de las 10 mastectomías y en los 2 casos de cuadrantectomías con RMN preoperatoria sospechosa de CM. En 8 pacientes se trataba de carcinomas ductales infiltrantes y en un caso de carcinoma medular, con grado histológico 3 en 4 casos, grado 2 en otros 4 casos y grado 1 en la otra paciente. En los 6 pacientes restantes (40%) con cirugía mamaria (3 mastectomías y 3 cuadrantectomías) no se identificó tumor mamario.
En la linfadenectomía axilar se extirparón una media de 12 adenopatías/paciente (rango 4-26) con una media de 4 ganglios tumorales (rango 1-16) y en 6 casos (31%) se encontraron más de 3 ganglios axilares metastásicos.
De las 19 pacientes operadas, 8 eran RE+ y/o RP+ (42%), Her2 neu+++ en 3 casos (16%) y 8 (42%) fueron considerados triple negativos en el estudio inmunohistoquímico (tabla 1).
Recibieron quimioterapia adyuvante 20 (95,2%) de las 21 pacientes, asociando radioterapia locorregional en 9 de ellas (5 pacientes del grupo A y 4 pacientes del grupo B). Se indicó hormonoterapia antiestrogénica en 8 casos y anticuerpos monoclonales (trastuzumab) en las 3 pacientes Her2 neu+++.
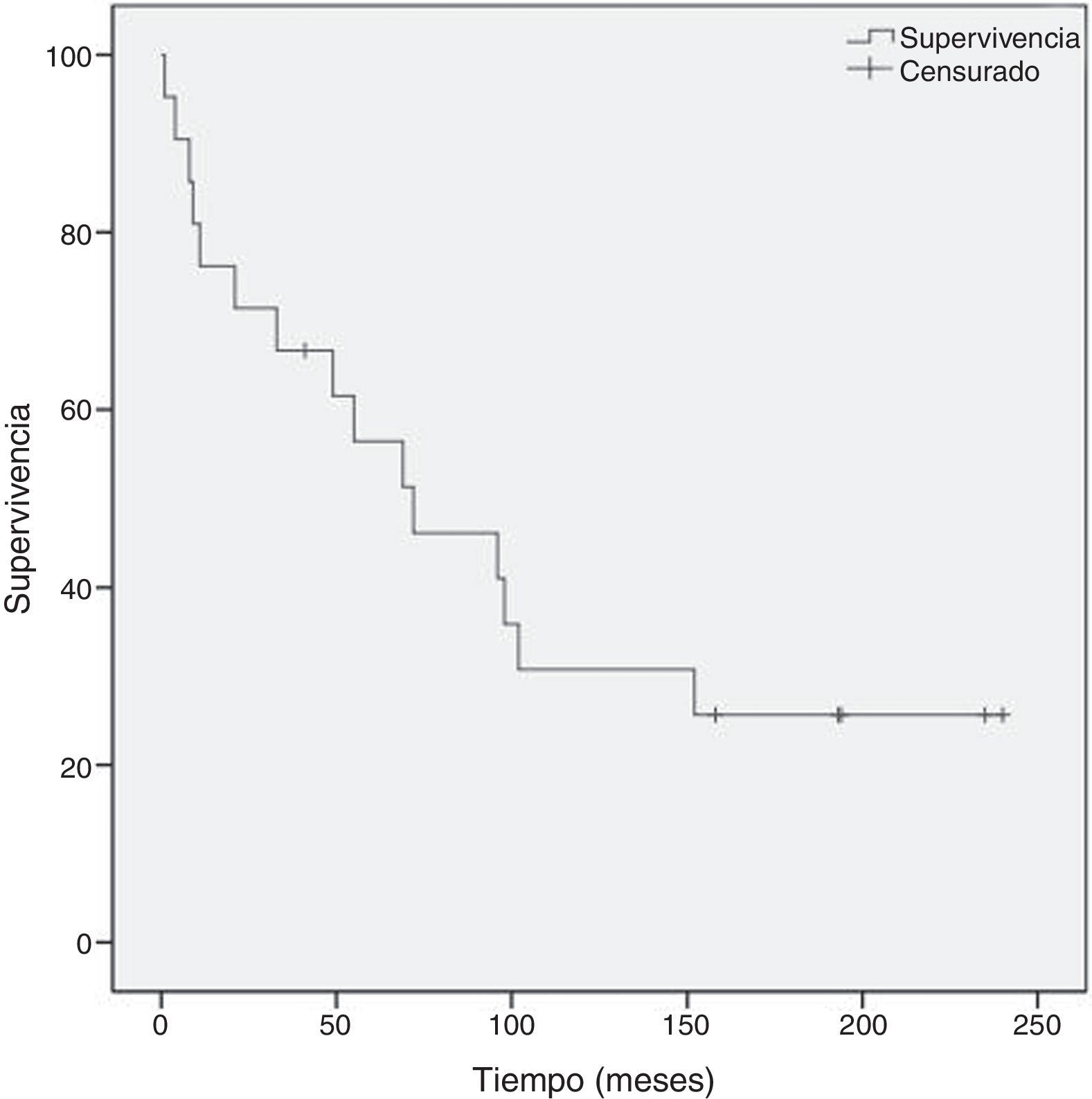
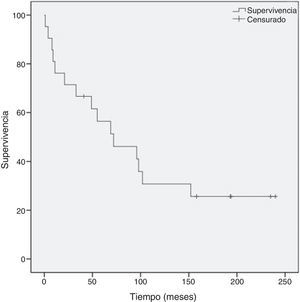
La mediana de seguimiento de los pacientes de nuestra serie fue de 87 meses (rango: 12-235), siendo la supervivencia global de 101,2±19,9 meses, y la supervivencia a 5 años del 69% (fig. 1).
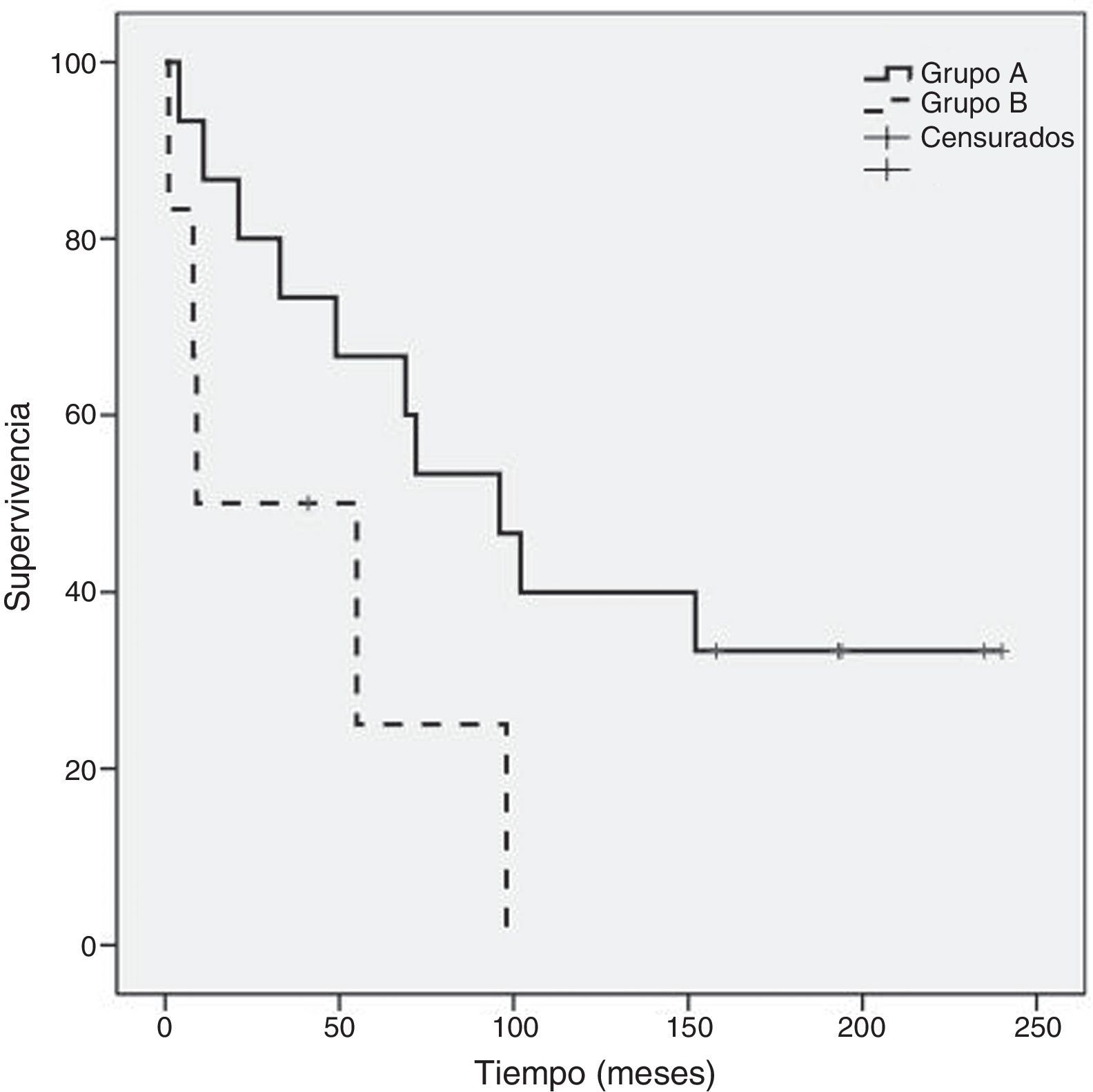
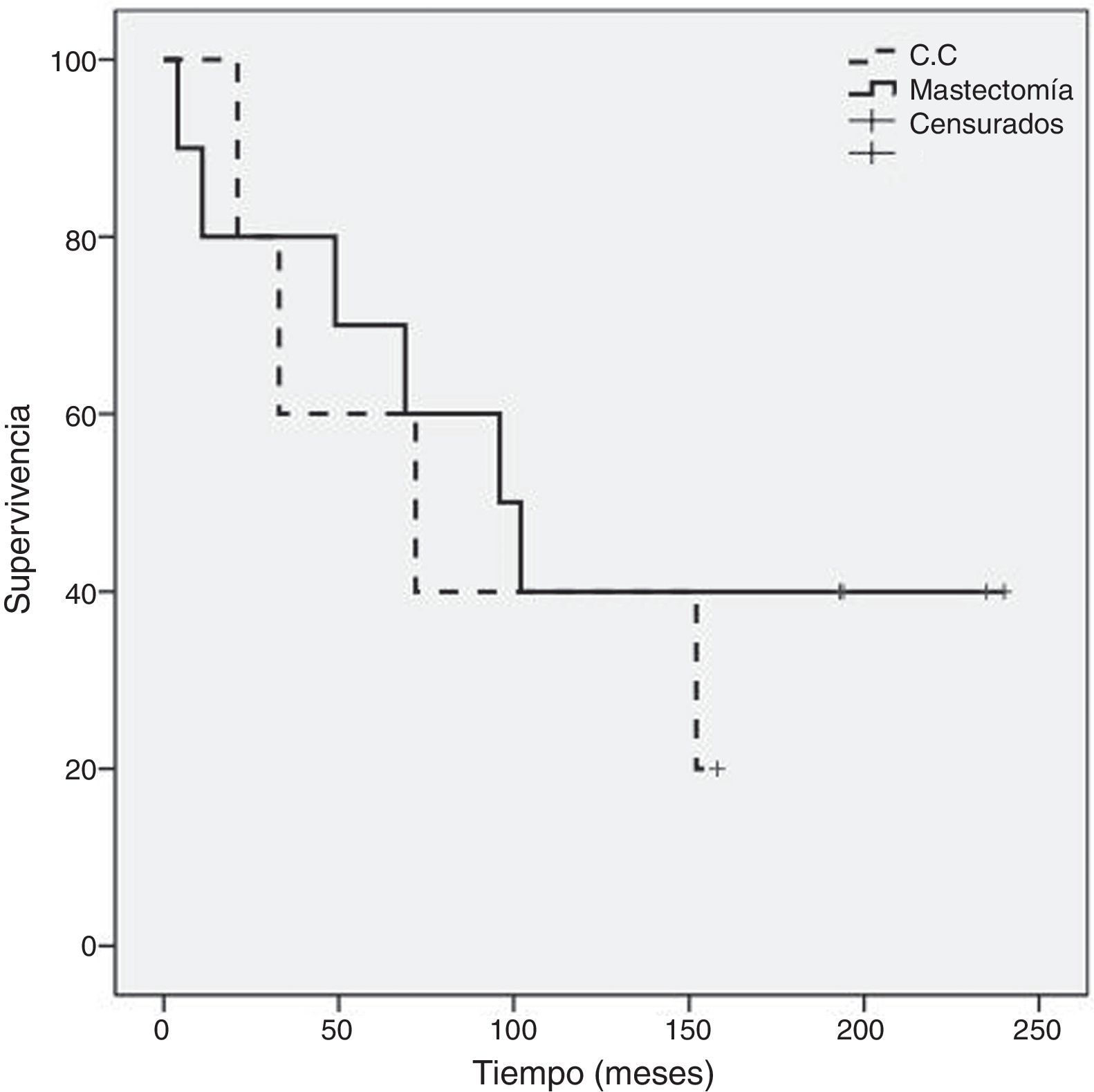
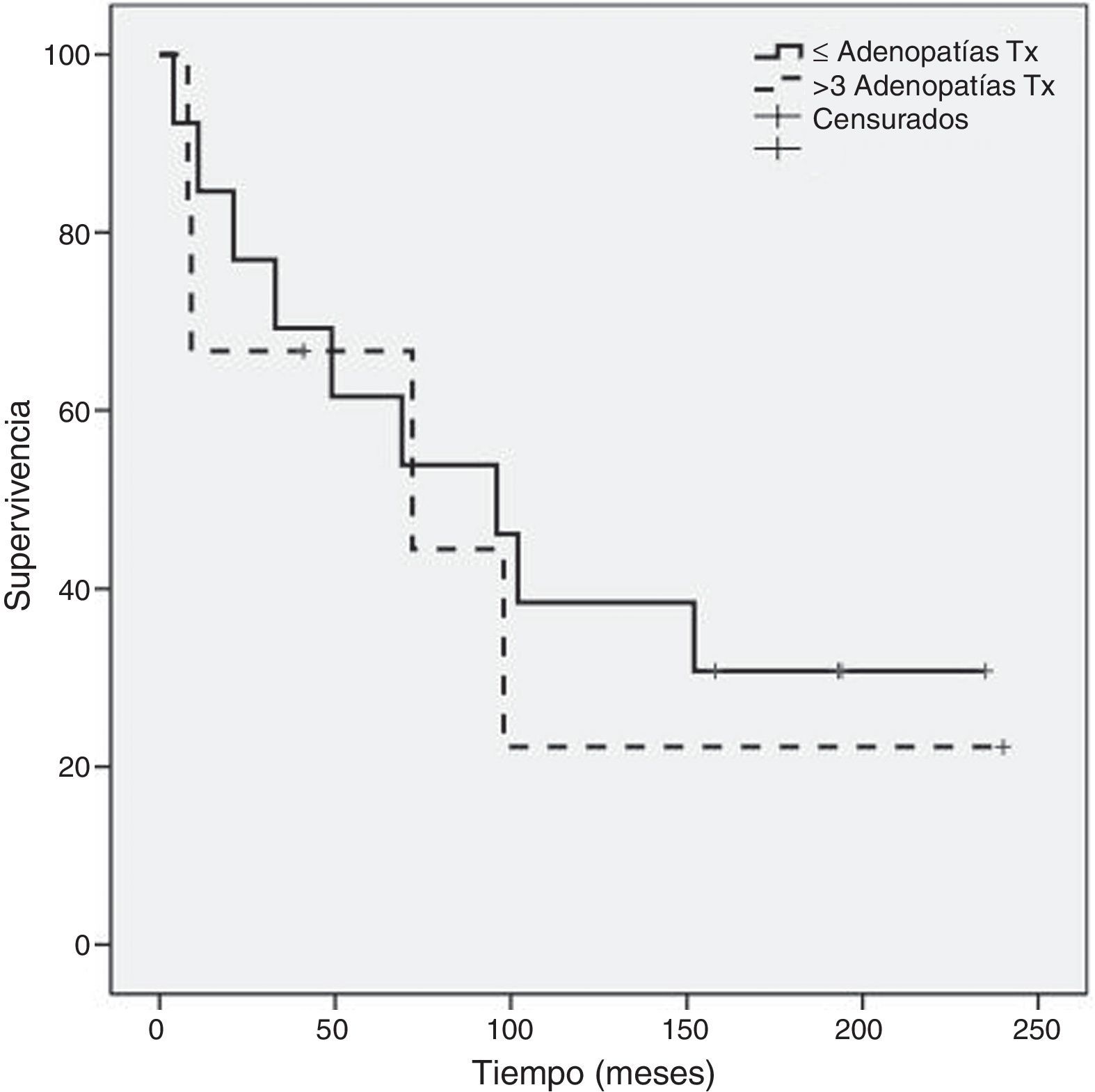
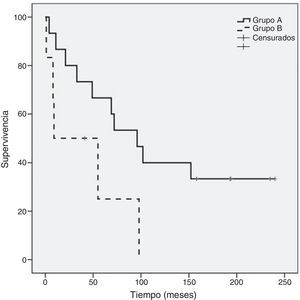
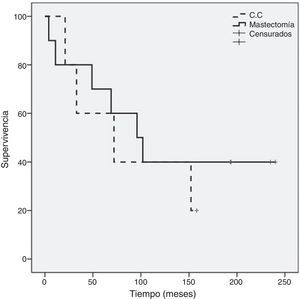
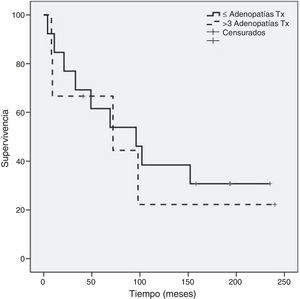
Como se evidencia en la figura 2, al comparar la supervivencia global entre los grupos A y B hay diferencia significativa (p=0,05) a favor del grupo A (120,6±23 meses frente a 41,2±18 meses) sin diferencia significativa en supervivencia global entre el subgrupo de mastectomía (129,1±30 meses) respecto al de cirugía conservadora (87,5±25 meses) (fig. 3). Tampoco un número de adenopatías axilares tumorales >3 influyó en la supervivencia global en nuestra serie (113,6±24 meses vs. 93,9±37 meses: p=0,68) (fig. 4).
En el seguimiento se objetivaron 4 recaídas sistémicas (tabla 1), en adenopatía supraclavicular, sistema nervioso central, ósea y en pared torácica pero ningún caso de recaída locorregional en mama o axila.
DiscusiónNuestra experiencia consta de 21 pacientes tratados en la Unidad de Cirugía Mamaria del Hospital Clínico de Valencia lo que supone una incidencia del 0,35%, comparable a la publicada en la literatura2 y es una de las series amplias aportadas en la literatura3,6,8,9.
Ante una adenopatía axilar metastásica es necesario descartar causas tumorales no mamarias como linfomas, neoplasias de tiroides, pulmón, hígado, estómago, páncreas, colon, riñón, piel y glándulas sudoríparas4,10. Sin embargo, cuando aparece una adenopatía axilar metastásica por adenocarcinoma primario desconocido la probabilidad de que sea de origen mamario es del 55-100% y según al AJCC deben considerarse y tratarse como de origen mamario3. En la clasificación TNM se considera al COM como T0N1-2M0, estadio IIA-IIIA, reestadificando la T si después del tratamiento quirúrgico se descubre el tumor primario11.
La positividad de los marcadores hormonales de estrógenos y progesterona y Her2 neu en la adenopatía axilar ni confirman ni excluyen un origen mamario, ya que otros carcinomas de origen ginecológico, gastrointestinales y de pulmón, tiroides o riñón también pueden expresarlos3,12. Asimismo, entre el 30-40% de los cánceres de mama son receptores hormonales negativos6 como también evidenciamos en nuestra serie. Otros marcadores útiles pero no específicos en el carcinoma metastásico de mama son la expresión de citoqueratina CK7, la mamoglobina, aunque se expresa también en el cáncer endometrial y de glándulas salivares y sudoríparas, y los receptores androgénicos que se expresan en el 90% de un CM primario y en sus metástasis10. Recientemente Wang et al.6 señalan la alta especificad (93%) para CM del anticuerpo monoclonal M4G3.
Ante un COM, la mamografía es la primera prueba diagnóstica que se debe realizar, pero la tasa de falsos negativos está alrededor del 30% en una mama con densidad normal y hasta un 45% en las mamas densas4,13 con una sensibilidad que desciende al 25% en el COM6,10,14,15. La ecografía, más sensible que la mamografía para la detección de lesiones en mamas muy densas, de mujeres jóvenes y en carcinomas no palpables no suele ser útil para el diagnóstico de COM11,16.
Para mejorar el diagnóstico ante un COM se ha recurrido a la RMN12,17, a la PET-TAC13,14,18,19 o técnicas isotópicas con 99mTc-MIBI5. La RMN, con o sin gadolinio, ha demostrado una mayor sensibilidad para la detección de lesiones sospechosas de malignidad hasta en un 86%4,13, pero con una especificidad más baja15,20. En la revisión de de Bresser et al.20 la detección de tumor mamario primario en la RMN oscila entre 35-86%, acorde con nuestra experiencia del 33% de RMN positivas. Además ante una lesión sospechosa en la RMN en un 95% de los casos se identifica tumor en la anatomía patológica de la biopsia o pieza quirúrgica21. Así, la RMN puede hacer aparente un COM en algunas pacientes y permite cirugía conservadora20 de la mama en mujeres seleccionadas como sucedió en 2 de nuestras pacientes. Actualmente la guía NCCN de EE. UU. recomienda la utilización de la RMN como prueba diagnóstica ante un supuesto COM7,17. Por nuestra experiencia consideramos interesante la reevaluación mamográfica y ecográfica que pueden poner en evidencia alteraciones estructurales de la mama susceptibles de ser biopsiadas, hecho también señalado por otros autores20.
El manejo terapéutico de la mama en pacientes con COM es controvertido. No se recomienda mantener una actitud expectante sobre la mama, y sí plantear tratamientos activos como cirugía o radioterapia cuando el tumor se haga evidente por la alta tasa (50%) de recaídas locales y sistémicas y disminución de la supervivencia global22,23.
La mastectomía radical fue inicialmente el tratamiento de elección1. En la actualidad algunos autores consideran esta cirugía como un sobretratamiento, argumentando que en un 30% de los análisis anatomopatológicos de las mamas resecadas no se encuentra tumor24, cifra similar a la observada en nuestro estudio. Sin embargo, consideramos interesante resaltar que en nuestra serie, al igual que en la más amplia de Wang et al.6, la mastectomía identifica un 70% de CM inicialmente oculto y además en el grupo tratado con mastectomía o cirugía conservadora encontramos un incremento de la supervivencia global respecto a las pacientes tratadas solo con linfadenectomía axilar, como también se señala en el estudio multiinstitucional de Walker et al.7.
La irradiación mamaria se ha propuesto como tratamiento del COM sin necesidad de cirugía, obteniendo un control de la enfermedad en el 72-100% de los casos8,23,25,26. Además, algunas series8 no evidencian recidivas mamarias tras 57 meses de seguimiento, con supervivencia global equiparable a la mastectomía27. No tenemos experiencia con esta estrategia en COM. Indicamos la radioterapia como parte del tratamiento adyuvante de la cirugía conservadora de la mama o tras la linfadenectomía axilar.
El beneficio de la resección mamaria en la supervivencia global del COM aún está en entredicho y otras publicaciones no evidencian este efecto con mastectomía radical frente al tratamiento radioterápico único27, si bien en la revisión de González Blanco et al.23 se señala una mayor tasa de recidiva local y disminución de la supervivencia libre de enfermedad con radioterapia.
Para algunos autores4,28 la cuadrantectomía superoexterna de la mama puede ser una opción terapéutica por ser esta la localización más frecuente de los tumores primarios y por el posible desarrollo de CM en tejido ectópico mamario, o en la grasa axilar. En su opinión, extirpar la prolongación axilar de la mama no incrementa la morbilidad operatoria ni ocasiona alteraciones cosméticas severas y sí puede localizar un carcinoma oculto. Consideramos que la cirugía conservadora de la mama debe reservarse solo a pacientes con RMN sugestivas de CM, pues en nuestra experiencia la cuadrantectomía superoexterna no ha identificado COM en los 3 casos realizados.
De nuestros resultados destacamos que el tipo de cirugía mamaria (mastectomía o cuadrantectomía) no influyó en la supervivencia global de las pacientes. Por último, señalar que no encontramos influencia significativa sobre la supervivencia en pacientes con más de 3 adenopatías axilares metastásicas, si bien otros autores6,8 objetivan que el número de ganglios axilares afectos ofrece información pronóstica, con supervivencia a los 5 años del 91% con menos de 3 adenopatías afectas y del 65% si hay 4 o más ganglios axilares tumorales. Junto al tratamiento quirúrgico y/o radioterápico ante un COM se sugiere asociar quimioterapia adyuvante al considerar el COM en estadios ii o iii, y hormonoterapia según la condición de los receptores hormonales4,23.
Nuestros resultados deben interpretarse con cautela por el sesgo que supone el ser un estudio retrospectivo y por el beneficio aportado por la radioterapia asociada a la cirugía conservadora de la mama y a la linfadenectomía axilar.
El COM es una patología infrecuente y un reto diagnóstico-terapéutico para el cirujano debido a que las series publicadas en la literatura son pequeñas y retrospectivas. En conclusión, en nuestra serie, la mastectomía identifica el 70% de CM inicialmente ocultos y en nuestra opinión la cirugía conservadora de la mama puede tener indicación ante lesiones sugestivas de CM en la RMN. El tratamiento quirúrgico sobre la mama mayoritariamente con mastectomía, se asoció, en nuestra experiencia, a una mejoría en la supervivencia respecto al grupo tratado únicamente con linfadenectomía axilar, con una supervivencia global del 69%, similar29 a la esperada para pacientes con CM en el mismo estadio tumoral.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.