La hepatitis C crónica afecta a unos 150 millones personas y provoca el fallecimiento anual de 350.000 pacientes en el mundo. Aunque los datos de la historia natural son incompletos, tras la infección aguda la mayoría de los pacientes desarrollan formas crónicas con estadios variables de fibrosis. En estos pacientes la actividad inflamatoria continuada puede originar fibrosis significativa, cirrosis, descompensación de la hepatopatía o desarrollar hepatocarcinoma. Durante los próximos años se espera que se produzca un incremento significativo de la cirrosis por VHC y sus complicaciones, así como de la incidencia de hepatocarcinoma en nuestro país. En esta revisión se presentan los datos de la historia natural y el impacto que el tratamiento antiviral pudiera tener en los diferentes estadios evolutivos de la enfermedad.
Chronic hepatitis C virus infection affects around 150 million persons, and 350,000 persons worldwide die of this disease each year. Although the data on its natural history are incomplete, after the acute infection, most patients develop chronic forms of hepatitisC with variable stages of fibrosis. In these patients, continual inflammatory activity can cause significant fibrosis, cirrhosis, decompensation of the liver disease, or hepatocarcinoma. In the next few years, it is expected that hepatitisC virus infection and its complications will significantly increase, as will the incidence of hepatocarcinoma in Spain. This review presents the data on the natural history of hepatitisC virus infection and discusses the potential impact of antiviral therapy on the distinct stages of the disease.
La hepatitis C crónica afecta a unos 150 millones personas y provoca el fallecimiento anual de 350.000 pacientes en el mundo1. Aunque los datos de la historia natural son incompletos, tras la infección aguda la mayoría de los pacientes desarrollan formas crónicas con estadios variables de fibrosis. En estos pacientes, la actividad inflamatoria continuada puede originar fibrosis significativa, cirrosis, descompensación de la hepatopatía o hepatocarcinoma. Durante los próximos años se espera que se produzca un incremento significativo de la cirrosis por VHC y sus complicaciones, así como de la incidencia de hepatocarcinoma en nuestro país2.
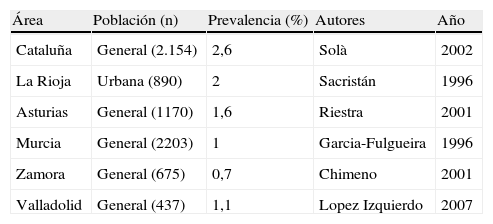
No existen datos recientes de la prevalencia por VHC en España, pero se estima que es del 1,15%3-8, aunque es muy baja en la población menor de 20años y asciende con la edad, lo que indica un efecto de cohorte3,5,9 (tabla 1). Su incidencia ha disminuido al 1 por 100.000 en países desarrollados10-12, y en España la incidencia descendió del 6 al 2,3 por 100.000 en el periodo 1997-200313. Los estudios de historia natural de la enfermedad están limitados por la naturaleza asintomática o paucisintomática del proceso agudo en el 85% de los casos14, lo que supone la imposibilidad de incorporar muchos pacientes a los estudios observacionales y de conocer la fecha de la infección y así estimar el tiempo de duración de la infección. Por este motivo, existen pocos estudios prospectivos con seguimiento prolongado sin sesgos15. Otros factores de confusión en el estudio de la historia natural incluyen la coinfección VIH y VHB, dado que estos virus comparten mecanismos de transmisión con el VHC, u otros factores como el consumo de alcohol, que tampoco se ha definido con precisión en la mayoría de los estudios. Otras limitaciones en el estudio de la historia natural de la infección crónica por VHC fue la imposibilidad de utilizar técnicas sensibles de detección del VHC, como la PCR en tiempo real y la ausencia de genotipado a principios de los años noventa. Afortunadamente, la mayoría de los pacientes infectados en Occidente tienen acceso al tratamiento antiviral, lo que por un lado puede prevenir la progresión, pero por otra hace éticamente imposible el estudio longitudinal de la infección por VHC en ausencia de intervención16. En esta revisión se abordan aspectos claves de la historia natural de la infección por VHC y factores que modifican esta evolución, y se resume la evidencia disponible sobre el impacto del tratamiento en la historia natural.
Seroprevalencia en diferentes áreas geográficas de España
| Área | Población (n) | Prevalencia (%) | Autores | Año |
| Cataluña | General (2.154) | 2,6 | Solà | 2002 |
| La Rioja | Urbana (890) | 2 | Sacristán | 1996 |
| Asturias | General (1170) | 1,6 | Riestra | 2001 |
| Murcia | General (2203) | 1 | Garcia-Fulgueira | 1996 |
| Zamora | General (675) | 0,7 | Chimeno | 2001 |
| Valladolid | General (437) | 1,1 | Lopez Izquierdo | 2007 |
La prevalencia ponderada se ha calculado: Log transformación=ln(seroprevalencia/1-seroprevalencia). Seroprevalencia ponderada=1,65%; IC95%=1,36-1,94%). Si el 70% son positivos para ARN-VHC, la prevalencia global en la población Española será 1,15%; IC95% 0,91-1,39%.
Durante la infección aguda por VHC, el ARN-VHC circulante se detecta entre una y 3 semanas después del comienzo de la infección17. Inicialmente estos niveles pueden fluctuar y se elevan rápidamente, aunque pueden observarse periodos prolongados en caso de inóculos de carga viral reducida, y por lo tanto la duración de la incubación puede variar según la ruta de transmisión18. La ALT sérica se eleva entre 4 y 12semanas después de la infección18,19, frecuentemente más de 10veces el límite superior de la normalidad junto con elevación variable de la bilirrubina, lo que refleja el daño hepatocelular20,21. Las manifestaciones clínicas aparecen entre 2 y 12semanas después de la infección, aunque la mayoría de los pacientes permanecen asintomáticos o paucisintomáticos17. Cuando aparecen síntomas, son inespecíficos; los más frecuentes son astenia, dolor abdominal, anorexia, febrícula, mialgia o prurito. La mayoría de los pacientes sintomáticos desarrollan ictericia, que es el síntoma más específico del proceso22,23. Los anticuerpos VHC aparecen semanas después, pero su aparición pueden retrasarse en presencia de inmunosupresión o coinfeccion por VIH23,24. En definitiva, el carácter inespecífico e infrecuente de los síntomas ha sido un factor limitante en el estudio de la historia natural de la infección por VHC.
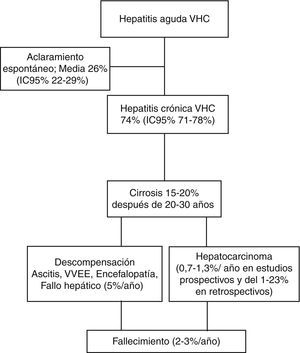
La tasa de cronicidad de la hepatitisC aguda oscila entre el 50 y el 90% de los casos21,24–32. Se han descrito diversos factores que influyen en la eliminación espontánea del VHC (tabla 2), como el polimorfismo IL28BCC33–35; sin embargo, puede existir eliminación diferida del virus hasta 46 semanas después en presencia del haplotipo IL-28BCC36. Asimismo, los pacientes que presentan una respuesta potente CD4+ tienen mayores posibilidades de eliminar espontáneamente la infección37,38. Los niveles séricos bajos de la proteína inducible por interferón (IP-10), que refleja cuantitativamente los complejos intrahepáticos de replicación del VHC, se han propuesto como factor predictivo del aclaramiento espontáneo del VHC39, y su utilización mejora la predicción de la resolución espontánea del VHC del IL28BCC40; igualmente, un descenso rápido del ARN-VHC en las primeras 4 semanas es un factor predictivo de eliminación espontánea durante la fase aguda del VHC41. Recientemente se ha propuesto una escala con todos estos datos para predecir la probabilidad de aclaramiento espontáneo en la fase aguda, que incluye la presencia de IL28BCC, un pico de bilirrubina igual o superior a 6mg/dl, descenso del ARN-VHC en las primeras 4 semanas más de 2,5log, edad inferior a 35años, niveles del factor de inducción de la proteína 10 (IP-10) superiores a 546pg/ml y presencia de respuesta CD4+TH142. La edad de infección superior a 38años, el sexo masculino y el abuso de alcohol también fueron factores de riesgo de cronicidad30,31. La resolución espontánea suele ocurrir en los primeros 3-4meses de la infección, pero es improbable que se produzca a partir del 6.° mes30. Si bien la tasa de cronicidad, basada en estudios longitudinales, oscila entre el 50 y el 90%, la media ponderada es del 26%, con un intervalo de confianza del 22-29%32.
Factores modificadores del curso evolutivo de la hepatitis aguda por VHC
| • Género femenino |
| • IL28BCC |
| • IP-10>540 UI/ml |
| • Curso clínico sintomático |
| • Descenso rápido de la viremia en las primera 4 semanas |
| • Respuesta precoz y potente CD4+ |
| • Coinfección VIH |
| • Inmunosupresión |
| • Tratamiento antiviral VHC |
El tratamiento antiviral es quizá el factor más importante que modifica la historia natural de la hepatitis aguda VHC, induce mayores tasas de resolución de la infección que la eliminación espontánea, y las tasas de RVS oscilan entre el 60 y el 100%43–48. Se desconoce aún la eficacia de los antivirales directos solos o en combinación con peginterferón alfa con o sin ribavirina y la duración óptima del tratamiento. Recientemente, el tratamiento durante 12 semanas con 1,5μg/kg/semana de peginterferón alfa-2b, iniciado a las 12semanas del comienzo de la infección, consiguió tasas de RVS del 70-72%, resultados similares al tratamiento durante 24 semanas o a la combinación con ribavirina durante 12 semanas49.
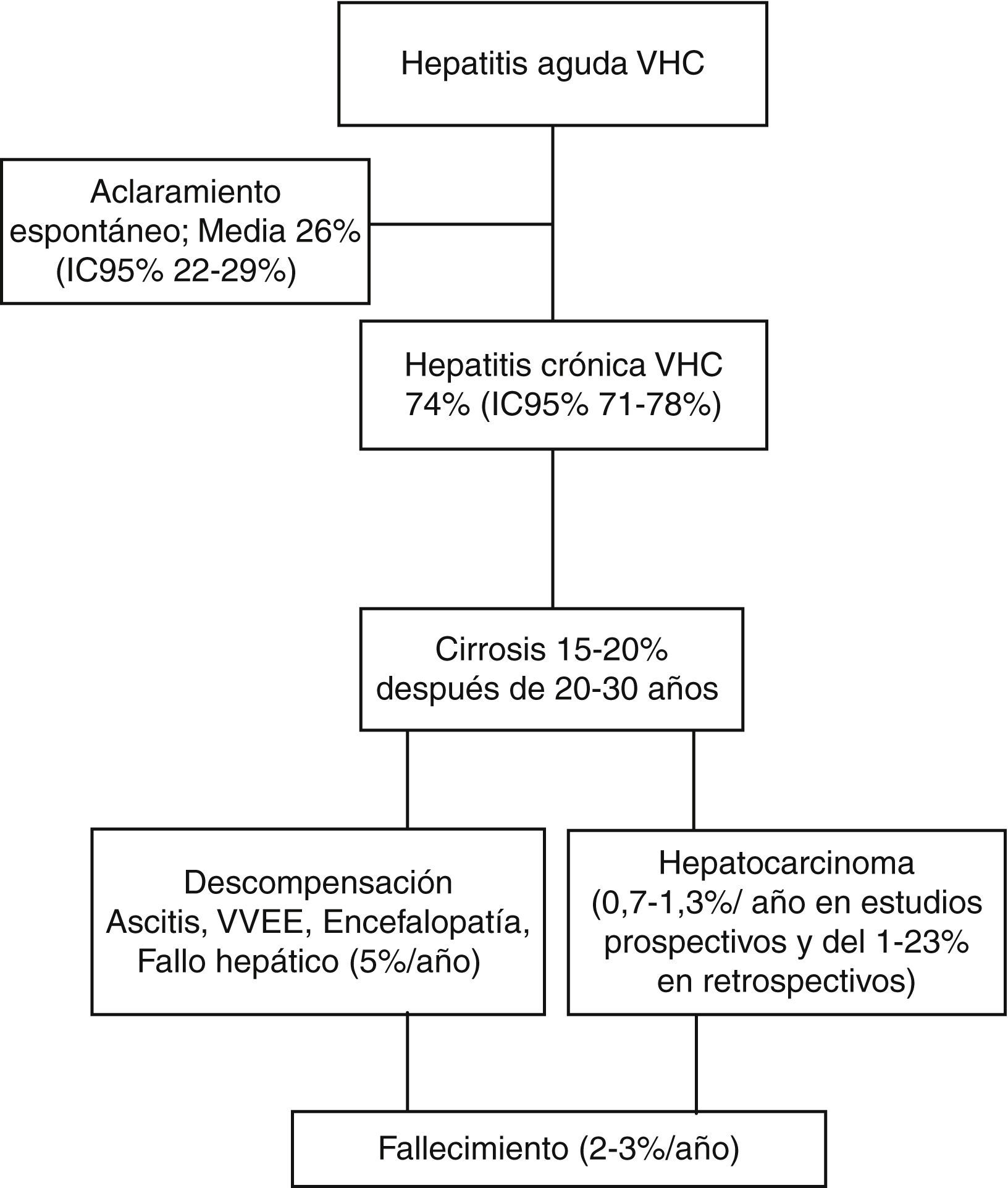
Historia natural de la infección crónica por virus de la hepatitis CSe define hepatitis crónica por VHC como la persistencia del ARN-VHC que se prolonga más de 6meses desde la exposición al virus. La eliminación espontánea en este periodo es muy improbable, y la mayoría de los pacientes derivados a las consultas especializadas se encuentran en este estadio30. Suele haber ausencia de manifestaciones clínicas en este estadio, y los pacientes desarrollan grados variables de fibrosis o incluso cirrosis25. La manifestación clínica más frecuente en este estadio, en ausencia de manifestaciones extrahepáticas, es la astenia, que ocurre en el 53% de los pacientes, es la que mayor impacto tiene sobre su calidad de vida y es más frecuente en hombres y en estadio de cirrosis50. Afortunadamente, la astenia disminuye con la eliminación del virus con tratamiento antiviral51. Las manifestaciones extrahepáticas más frecuentes son la crioglobulinemia mixta, trastornos linfoproliferativos como el linfoma de Hodgkin, porfiria hepatocutánea tarda, liquen plano, diabetes mellitus tipo2 y resistencia a la insulina; estas manifestaciones no solo empeoran el curso clínico e impactan sobre la calidad de vida, sino que también muchas veces limitan las actuales opciones terapéuticas52.
En la cohorte REVEAL-C, con un seguimiento de 1.095 pacientes seropositivos para VHC y 18.541 seronegativos, todos ellos seronegativos para VHB, se observó que los pacientes que aclararon espontáneamente la infección tuvieron la misma supervivencia que los pacientes seronegativos, mientras que la mortalidad de los pacientes infectados era significativamente mayor en relación tanto con enfermedades hepáticas como extrahepáticas53. En otro estudio de seguimiento de pacientes transfundidos en los años setenta, los infectados tuvieron significativamente más mortalidad por hepatopatía a los 25años de seguimiento; sin embargo, la mortalidad por esta causa fue solo del 3% y no se observó mayor mortalidad global en los pacientes infectados por VHC54.
En conjunto, la tasa de progresión a cirrosis es muy variable y oscila a los 20-30años entre el 2 y el 20% según los diferentes estudios55. Sin embargo, la frecuencia de progresión más aceptada es del 15-20% en 20-30años56; una vez se ha instaurado la cirrosis el riesgo de descompensación es del 2%/año55, y el de hepatocarcinoma, en estudios prospectivos, oscila entre el 0,7 y el 1,3%/año y en estudios restrospectivos del 1 al 23%/año57.
Se han identificado diversos factores dependientes del huésped, del virus y ambientales en la evolución de la hepatitis crónica por VHC (tabla 3).
Factores modificadores de la evolución natural en la hepatitis crónica VHC
| Factores del huéspedActividad necroinflamatoriaEdad y géneroEsteatosis y resistencia a la insulinaHiperferritinemiaIL28BCC (peor curso clínico pero no mayor progresión de la fibrosis)Sobrecarga de hierro |
| Factores del virus¿Genotipo-3?Coinfección VIHCoinfección VHB |
| Factores ambientalesAlcoholTabacoCannabisVitamina DConsumo de café |
La actividad necroinflamatoria persistente se asoció a mayor tasa de progresión. Así, los pacientes con ALT persistentemente normal no mostraron progresión en una segunda biopsia realizada 5años después58,59; por el contrario, los sujetos que manifiestan brotes de citólisis manifestaron mayor progresión de la fibrosis60. Asimismo, el sexo femenino y la edad joven se asocian a menor progresión61. Otros factores dependientes del huésped que se asocian a mayor progresión son la presencia de esteatosis hepática y la resistencia a la insulina62-65; la resistencia a la insulina, además, empeora la respuesta virológica al tratamiento con peginterferón y ribavirina66.
Los niveles de hierro en los hepatocitos y tractos portales se asociaron a una mayor progresión de la hepatopatía por VHC en la cohorte HALT-C67. La hiperferritinemia se asoció de forma independiente a una mayor velocidad de la fibrosis63. La hiperferritinemia y la sobrecarga férrica de los pacientes con hepatitis crónica VHC se asocia a niveles séricos más bajos de hepcidina y revierte con la RVS68,69.
Los pacientes con genotipo IL28B CC tienen más inflamación portal y niveles de ALT y mayor probabilidad de peor curso clínico69, lo que sugiere un estado de inmunidad muy activado; sin embargo, no se observó mayor tasa de progresión de fibrosis (incremento de 2 puntos en la escala de Ishak)61,70,71. Recientemente, en un estudio de asociación de genómica amplia realizado en una cohorte europea de 2.342 individuos infectados con VHC, los polimorfismos únicos del nucleótido rs16851720, localizado en la región RFN7, que codifica una proteína antioxidante protectora de la apoptosis, y del rs4374383, que codifica factores implicados en la fagocitosis por macrófagos de células apoptóticas, se asociaron en los pacientes que tenían infección postransfusional y de forma significativa a progresión de la fibrosis72. La edad es otro factor relacionado con la tasa de progresión de la fibrosis73,74, y los pacientes infectados con más de 36años en el momento de la infección tenían una tasa de descompensación de su hepatopatía de 1,9%/año frente al 0,7%/año en los que tenían 24años o menos en el momento de la infección73.
Factores ambientalesEl consumo de alcohol acelera la progresión de la hepatopatía crónica por VHC63,74,75, si bien esta asociación no influye en la tasa de respuesta virológica sostenida por peginterferón y ribavirina76.
Un estudio reciente ha relacionado el consumo de cigarrillos con una mayor tasa de progresión de la fibrosis77,78, y se ha especulado que podría ser a través de un aumento de la concentración de VEGF y VEGF-D inducido por la hipoxia77.
Por el contrario, el consumo de café se asocia con un curso evolutivo más benigno de la hepatitisC, y se ha observado una correlación inversa entre consumo de café y grado de fibrosis, esteatosis, resistencia a la insulina y niveles de ALT, siendo el efecto más beneficioso en sujetos con un consumo igual o superior a 3 tazas diarias79,80. El consumo de café también aumenta la probabilidad de alcanzar RVS con el tratamiento antiviral80.
Se han relacionado los niveles de vitaminaD séricos y la respuesta al tratamiento basado en el interferón81,82, lo que se ha explicado por el efecto inmunomodulador de la vitaminaD83. En un metaanálisis reciente se ha demostrado una alta prevalencia de déficit de vitaminaD en sujetos con hepatitis crónica por VHC y niveles altos en pacientes con más RVS o en los que recibían suplementos de vitaminaD84.
Factores del virusAlgunos factores como la carga viral no influyen en la historia natural de forma directa, si bien pueden afectar negativamente a la respuesta de los tratamientos basados en el interferón. Tampoco existe clara evidencia de que el genotipo influya en la evolución55,57,85–87, si bien un metaanálisis ha documentado un mayor riesgo de hepatocarcinoma con el genotipoIb88 y un estudio ha relacionado la infección con el genotipo3 con una fibrogénesis más acelerada y con mayor riesgo de desarrollo de hepatocarcinoma89. La infección por genotipo3 produce más frecuentemente esteatosis hepatocitaria por efecto citopático directo90 e interfiere durante su replicación con la fase distal de la síntesis de colesterol91, por lo que induce hipocolesterolemia. Los niveles séricos de colesterol se correlacionan inversamente con el grado de esteatosis hepatocitaria asociada a esteatosis92,93, y tanto la esteatosis como la hipocolesterolemia revierten con la RVS93,94.
La progresión de la fibrosis es más rápida en el caso de coinfección por VIH o por VHB95,96.
Frecuencia y factores de riesgo de descompensación de la cirrosis por el virus de la hepatitis CLa predicción de la evolución clínica en pacientes con cirrosis compensada por VHC se ha basado en parámetros analíticos basales. Sin embargo, la gravedad de la hepatopatía varía con el tiempo, y también los parámetros analíticos que reflejan la función hepática, por lo que los modelos pronósticos deberán incluir también la evolución de los mismos en un periodo determinado de tiempo. Recientemente se han analizado datos de los pacientes de la cohorte HALT-C que no recibieron intervención. Basándose en este análisis, se construyó un modelo que mejor predecía la descompensación, que incluyó las cifras de plaquetas basales ≤150.000/mm, el cociente AST/ALT ≥0,8, la bilirrubinemia ≥0,7mg/dl y el descenso en los siguientes 24meses superior al 15% de las plaquetas y de la albúmina, y el ascenso de la bilirrubina. De 190 pacientes cirróticos compensados, seguidos durante una mediana de 6,3años, se produjeron 60 episodios de descompensación, lo que supone una tasa del 5%/año97.
Impacto del tratamiento sobre la historia naturalEl objetivo del tratamiento de la hepatitisC ha sido tradicionalmente alcanzar la respuesta virológica sostenida. Sin embargo, recientemente se ha podido demostrar que la RVS se traduce en beneficio clínico, con una disminución de episodios negativos en pacientes con hepatitis crónica VHC (fig. 1). En un análisis de la cohorte de veteranos infectada por VHC la infección se asoció de forma independiente a mayor riesgo de mortalidad (HR=1,37; IC95%: 1,31-1,47)98. Los pacientes tratados durante 48semanas o más tenían la mortalidad más baja (HR=0,41 [0,27-0,64]), mientras que los que recibieron tratamientos más cortos presentaron HR=0,71 para 0-23 semanas y HR=0,60 para 24-47 semanas en comparación con sujetos no tratados98,99.
Efecto de la RVS sobre la fibrosis hepáticaExisten varios estudios que analizan los cambios histológicos después del tratamiento, y la mejoría de la fibrosis se observa en los pacientes que alcanzaron RVS100-105. Esta regresión se observó en 18 de 96 pacientes y se asocia a una mejoría en la supervivencia global102. En un metaanálisis de 3 ensayos clínicos con peginterferón alfa-2a se comparó con el efecto del interferón convencional y se concluyó que la regresión de la fibrosis estaba estrechamente relacionada con la RVS (con una diferencia media estandarizada de –0,53) y en recidivantes (–0,34), pero sin diferencia significativa en no respondedores105.
Efecto de la RVS en la evolución clínica de la cirrosis por virus de la hepatitis CSe ha comprobado un descenso de la presión portal en pacientes con fibrosis avanzada por VHC tratados con peginterferón y ribavirina, descenso que fue mayor en los pacientes que mostraban respuesta virológica al final del tratamiento106. En consonancia con estos resultados, se ha comprobado mediante seguimiento prospectivo que los pacientes con cirrosis compensada que presentan RVS no desarrollan varices esofágicas; por lo tanto, en este subgrupo se puede evitar el seguimiento endoscópico107. Existen varios estudios retrospectivos que analizan el efecto de la RVS en pacientes con cirrosis por VHC, y todos ellos encuentran una disminución de la tasa de descompensación de la cirrosis y una disminución de la mortalidad asociada a hepatopatía108–111, así como una disminución de la mortalidad de todas las causas110,111. En el caso del hepatocarcinoma, la mayoría de los estudios han encontrado una tendencia a la disminución de su incidencia con la RVS110,112–115.
Las tasas de RVS alcanzadas en ensayos clínicos faseii y iii con diferentes combinaciones de agentes antivirales directos oscilan entre el 87 y el 100% para el genotipo1116, y es previsible que en los próximos meses se perfilen las mejores combinaciones en términos de eficacia, seguridad y costes. Con este escenario en el horizonte próximo se prevé que aumentará el número de pacientes candidatos a tratamiento117.
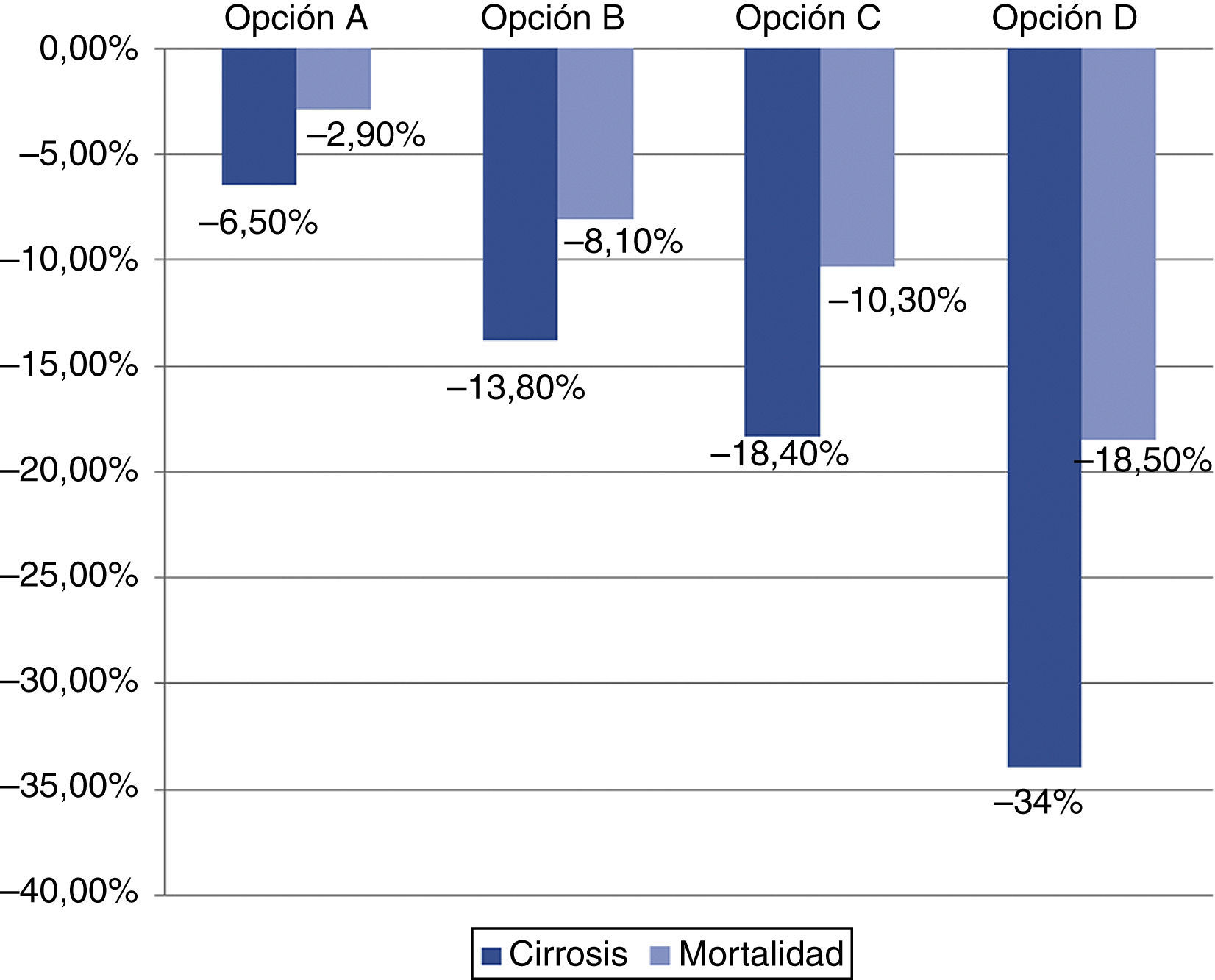
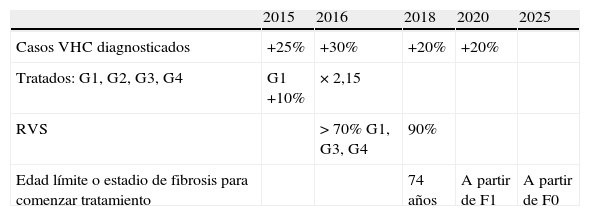
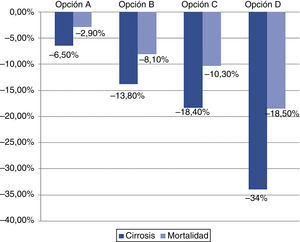
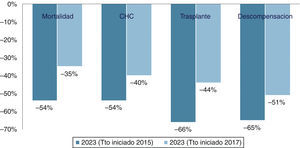
Efecto del tratamiento en la prevalencia global del virus de la hepatitis CEn nuestro país, las complicaciones relacionadas con la infección por VHC causan unos 4.500 fallecimientos al año2 y son la causa más frecuente de trasplante de hígado118. Se ha propuesto un modelo que estima el efecto del tratamiento sobre la cirrosis y la mortalidad por VHC (fig. 2)2. La opción A es la biterapia con peginterferón y ribavirina en el periodo 2002-2011; la B es la biterapia en el periodo 2012-2021; la C es una opción conservadora, que incluye la triple terapia con inhibidores de la proteasa y la misma tasa de cribado que la actual, y la D es triple terapia con cribado del 75% de la población y tratamiento del 50%. La figura 2 recoge la reducción estimada de estas opciones sobre la incidencia de cirrosis y la mortalidad por VHC. Más recientemente se ha propuesto un modelo transicional basado en la evidencia científica y la opinión de expertos; los supuestos del modelo se resumen en la tabla 4. Los resultados de esta estrategia sobre la reducción en mortalidad, incidencia del hepatocarcinoma, descompensación y trasplante se compararon con los resultados del manejo actual de la hepatitisC en España y con los de iniciarla en 2017 (fig. 3)117.
Efecto del tratamiento sobre la reducción de la incidencia de cirrosis y mortalidad por VHC. La opciónA es la biterapia en el periodo 2002-2011, la B es la biterapia en el periodo 2012-2021, la C es una opción conservadora, que incluye la triple terapia con IP y la misma tasa de cribado que la actual, y la D es triple terapia con cribado del 75% de la población y tratamiento del 50%. Modificado de Deuffic-Burban et al.2.
Supuestos para el periodo 2015-2025 basados en un modelo transicional
| 2015 | 2016 | 2018 | 2020 | 2025 | |
| Casos VHC diagnosticados | +25% | +30% | +20% | +20% | |
| Tratados: G1, G2, G3, G4 | G1 +10% | × 2,15 | |||
| RVS | > 70% G1, G3, G4 | 90% | |||
| Edad límite o estadio de fibrosis para comenzar tratamiento | 74 años | A partir de F1 | A partir de F0 |
De Buti et al.117.
Predicción del impacto del tratamiento con antivirales directos si se inician sobre una población diagnosticada de hepatitis crónica VHC sobre la mortalidad por hepatitis C, hepatocarcinoma, necesidad de trasplante hepático y descompensación en el año 2023, según las condiciones resumidas en la tabla 4. De Buti et al.117.
La historia natural de la infección por el virus de la hepatitisC está condicionada por una compleja interacción de factores genéticos, inmunológicos y metabólicos del huésped, edad y género del huésped, factores ambientales y la coinfección con otros virus como el VIH y el VHB. El objetivo del tratamiento es la respuesta virológica sostenida, que se traduce en beneficio clínico sobre la fibrosis hepática, la disminución de episodios asociados a hepatopatía, mejoría y disminución de la mortalidad de todas las causas. En pacientes con cirrosis por VHC, la RVS puede revertir la fibrosis y disminuir el riesgo de descompensación y de desarrollar hepatocarcinoma. Las tasas de RVS con los nuevos tratamientos, actualmente en fases finales de desarrollo, sobrepasa el 90% en una amplia variedad de subgrupos de pacientes, incluyendo respondedores nulos y con fibrosis avanzada o cirrosis, por lo que el nuevo escenario permite predecir un cambio favorable en la historia natural de la infección por virusC, un aumento del cribado y del número de pacientes candidatos a tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.