El reino Fungi está representado por innumerable cantidad de organismos entre los cuales se encuentran hongos patógenos que deterioran los principales componentes estructurales de la madera, como celulosa, hemicelulosa y lignina. El objetivo de nuestro trabajo fue caracterizar la actividad antifúngica y la producción de diversas aminas de Arthrobacter agilis UMCV2 con acción antagónica sobre hongos xilófagos. Para ello, se aislaron 4 organismos fúngicos (designados en conjunto UMTM) a partir de madera en descomposición en un bosque de pino encino de la comunidad de Cuanajo, Michoacán, México. Dos de ellos presentaron una clara actividad enzimática de celulasas, xilanasas y enzimas accesorias óxido-reductoras, y fueron identificados como pertenecientes a 2 géneros agresivos para la madera: Hypocrea (aislado UMTM3) y Fusarium (aislado UMTM13). In vitro, las aminas evaluadas mostraron tener efecto inhibitorio sobre el crecimiento de los UMTM y la dimetilhexadecilamina; uno de estos compuestos mostró un fuerte potencial para ser utilizado como tratamiento preventivo contra el ataque de hongos destructores de madera.
The kingdom Fungi is represented by a large number of organisms, including pathogens that deteriorate the main structural components of wood, such as cellulose, hemicellulose and lignin. The aim of our work was to characterize the antifungal activity in Arthrobacter agilis UMCV2 and diverse amines against wood-decaying fungi. Four fungal organisms (designated as UMTM) were isolated from decaying wood samples obtained from a forest in Cuanajo-Michoacán, México. Two of them showed a clear enzymatic activity of cellulases, xylanases and oxido-reducing enzymes and were identified as Hypocrea (UMTM3 isolate) and Fusarium (UMTM13 isolate). In vitro, the amines showed inhibitory effect against UMTM growth and one of the amines, dimethylhexadecylamine (DMA16), exhibited strong potential as wood preventive treatment, against the attack of decaying fungi.
El reino Fungi está representado por un diverso grupo de organismos que abarca entre 1,5 y 5 millones de especies, entre las que se encuentran los hongos filamentosos patógenos de plantas14. Los hongos se han adaptado a diversos nichos ecológicos que les han permitido prosperar en casi todos los hábitats del planeta. Una gran cantidad son saprofitos, lo cual facilita la descomposición de la materia orgánica y permite el reciclaje de nutrientes esenciales para el desarrollo y el crecimiento de otros los organismos vivos1. La descomposición posibilita la incorporación de un alto porcentaje de materia orgánica al suelo y suministra fuentes de carbono, hidrógeno, oxígeno, nitrógeno, azufre, hierro y fósforo que son aprovechables por las plantas. Esto ocurre como resultado del metabolismo microbiano sobre hidratos de carbono, grasas, aceites, lignina y proteínas, entre otros28,29.
Por su capacidad para descomponer las paredes celulares lignificadas mediante sistemas tanto enzimáticos como no enzimáticos21, los hongos destructores de la madera, también llamados xilófagos, presentan características especiales. Por un lado, los xilófagos desempeñan un papel positivo como los principales descomponedores bióticos de la madera y sus remanentes, pero por otro, en entornos urbanos, representan un grave riesgo al afectar la integridad estructural de construcciones de madera, en forma análoga a las raíces y troncos de árboles en pie. La pérdida de resistencia mecánica de la madera causada por estos organismos está intrínsecamente ligada a situaciones peligrosas, ya que a menudo ocasionan un daño significativo tanto a las construcciones como a las personas18,21.
La madera está compuesta principalmente por 3 grupos de macromoléculas: celulosa, poliosas (hemicelulosas) y lignina. Algunos organismos fúngicos tienen la capacidad de degradar estas macromoléculas que conforman la pared celular en plantas; a consecuencia de esto, se alteran las propiedades fisicoquímicas de la madera19,26,27. Entre esos organismos se pueden mencionar Agaricomycetes causantes de la pudrición marrón (Serpula lacrymans, Coniophora puteana, Antrodia vaillantii, Lentinus lepideus, etc.), Basidiomycetes causantes de la pudrición blanca (Trametes versicolor, Trametes hirsuta, Schizophyllum commune, etc.), Ascomycetes causantes de la pudrición suave (Chaetomium globosum, Monodictys putredinis, etc.) y Sordariomycetes (Hypocrea muroiana, Cryphonectria parasitica y Fusarium oxysporum), con más de 600 géneros y 3000 especies conocidas17,24. Estos organismos fúngicos logran la despolimerización de macromoléculas a partir de la producción de diversas enzimas hidrolíticas, por ejemplo, la degradación de la celulosa cristalina se consigue con endo-1,4-ß-glucanasas, exo-1,4-ß-glucanasas y 1,4-ß-glucosidasas27. En cambio, la lignina presenta una mayor resistencia a la degradación por organismos xilófagos y confiere una protección física a la celulosa y hemicelulosa contra un posible ataque biológico enzimático.
La lignina es un polímero complejo tridimensional, formado por la unión de ácidos y alcoholes fenilpropílicos. Para la degradación de la lignina, los organismos utilizan un complejo enzimático de oxidasas y peroxidasas que catalizan las primeras reacciones y rompen las uniones dentro de la molécula. La vía metabólica utilizada por los hongos xilófagos se inicia con la acción de la enzima lignina peroxidasa, la cual rompe enlaces carbono-carbono o enlaces éter. Otra enzima de amplia distribución entre los hongos de pudrición blanca es la lacasa, una oxidasa constituida por un cofactor con 4 átomos de cobre, cuyo aceptor de electrones es el O2. La lacasa ataca principalmente los sustratos fenólicos en presencia de 1-hidroxibenzotriazol (1-HBT), 2,2′-azinobis (ácido 3-etilbenzotiazolin-6-sulfónico) o ácido violúrico, que actúan como cooxidantes, y la habilitan para atacar los sustratos más difícilmente oxidables, como los de tipo no fenólico23.
Entre las estrategias actuales para controlar el daño que provocan estos hongos xilófagos está la aplicación de fungicidas. Algunos fungicidas, además de actuar contra el crecimiento fúngico, pueden tener actividad dual contra el crecimiento de insectos y bacterias. También se pueden diferenciar de acuerdo con el modo de aplicación y la condición del material lignocelulósico en el que se aplican. Por ejemplo, los productos que se citan para su empleo principalmente en la madera seca son el ácido bórico (antibacterial, fungicida e insecticida); los carbamatos (antibacteriales); compuestos inorgánicos de cobre (antibacteriales y fungicidas) y compuestos cuaternarios de amonio (fungicidas). Los utilizados preferentemente en árboles en pie y, en menor medida, en los cultivos para consumo humano son el mancozeb (fungicida) y los triazoles (fungicidas), además de otros4,5,27. La mayoría de estos activos son formulados a base de metales pesados26. Entre las acciones reportadas por el uso de estos compuestos se cita el daño a corto plazo por alterar las comunidades microbianas del suelo, así como efectos negativos en la salud humana12,16,20,27,30. Para afrontar esta problemática existe una variedad de sustancias de origen natural que prometen ser excelentes alternativas para el control de hongos destructores de la madera. Entre estas se conocen sustancias como los extractos de plantas, los aceites esenciales, los extractivos de madera, las ceras y las resinas, entre otros, con capacidad para proteger a la madera contra estos patógenos32. Asimismo, ciertos compuestos aminados han demostrado una elevada actividad fungistática contra diversos hongos fitopatógenos. En un trabajo realizado por Xu et al.38, se encontró que la trimetilamina y la dimetiloctilamina tuvieron una clara actividad fungistática, con la inhibición de la germinación de esporas y el crecimiento del micelio de Paecilomyces lilacinus, Pochonia chlamydosporia y Clonostachys rosea.
Además de las sustancias mencionadas, existen compuestos orgánicos volátiles (COV) con capacidad para inhibir el crecimiento de patógenos de plantas. En particular, un análisis cromatográfico de COV producidos por la bacteria Arthrobacter agilis UMCV2 condujo a la identificación de la amina dimetilhexadecilamina (DMA16), que al ser aplicada en bajas concentraciones mostró ejercer un efecto de represión sobre el crecimiento de los fitopatógenos Botrytis cinerea y Phytophthora cinnamomi22,34,36. Otro COV producido por diversos aislados bacterianos con una elevada actividad inhibitoria contra P. lilacinus y P. chlamydosporia fue la butamina40.
Esta información muestra el potencial de las aminas para preservar el adecuado estado de la madera al contrarrestar el daño provocado por el ataque de hongos xilófagos, y se las considera una valiosa alternativa al uso de compuestos peligrosos, como el ácido bórico, los carbamatos, los triazoles y otros agentes preservadores de la madera11,13.
El propósito de nuestro trabajo fue determinar la actividad antifúngica de la cepa bacteriana A. agilis UMVV2 y de los compuestos volátiles expresados in vitro sobre el crecimiento de hongos xilófagos aislados en la comunidad de Cuanajo, Michoacán, México.
Materiales y métodosSitio y colecta de los hongos xilófagosEl área de estudio se localizó en la comunidad de Cuanajo, municipio de Pátzcuaro, Michoacán, México (longitud: −101,5167, latitud: 19,4833). Se seleccionó la madera de ejemplares del género Pinus infectada con los organismos xilófagos, tanto de árbol en pie como de madera derribada o aserrada. Luego, se procedió a tomar una muestra del hongo a partir del corte de los carpóforos en contacto con el tronco. A continuación, las muestras fueron trasladadas al laboratorio de Microbiología de la Madera (FITECMA-UMSNH), donde se procedió al aislamiento de los organismos xilófagos.
Para el aislamiento de los organismos colectados (llamados UMTM) se trabajó en campana de flujo laminar (Novatech, México), donde las muestras se lavaron con agua esterilizada por 5min, para después ser colocadas en cajas de Petri en medio agar dextrosa Sabouraud (ADS) (BD Bioxon®, México). Esas placas se incubaron en oscuridad a 28°C durante 10 días37. A partir de las cajas con presencia de crecimiento se hicieron subcultivos hasta obtener cultivos puros.
Identificación molecular de los aislados xilófagos UMTMSe realizó la extracción del ADN de 2 aislados UMTM con el método descrito por Reader y Broda25, con algunas modificaciones, como se describe a continuación:
- 1.
Se pesaron 100mg de micelio en un tubo de 1,5ml (Eppendorf, EE. UU.) y se colocaron 0,4g de perlas de vidrio, 200μl de buffer de lisis (0,2M Tris-HCl pH 7,5; 0,5M NaCl; 0,01M EDTA; 1% de SDS) y 200μl de fenol:cloroformo:isoamílico (25:24:1).
- 2.
El contenido del tubo se mezcló en un vórtex (Scientific Industries Inc., EE. UU.) durante 6min.
- 3.
Se adicionaron 300μl de fenol:cloroformo:isoamílico y 300μl de buffer de lisis. Las muestras se mezclaron nuevamente en vórtex durante 30 s.
- 4.
Se centrifugaron (Eppendorf, EE. UU.) a 14000 r.p.m. durante 30 s.
- 5.
La primera fase se transfirió a un tubo limpio y se agregaron 300μl de cloroformo:isoamílico (24:1). Se mezcló nuevamente en vórtex durante 10 s.
- 6.
Se centrifugaron las muestras a 14000 r.p.m. durante 30 s.
- 7.
La fase acuosa fue transferida a un tubo limpio y se le agregaron 2,5 volúmenes de isopropanol. Las muestras se mantuvieron en un congelador a −20°C (Torrey, México) durante 30min.
- 8.
Se centrifugaron a 14000 r.p.m. durante 5min.
- 9.
La pastilla se lavó con 500μl de etanol al 70% y se centrifugó durante 3min a 14000 r.p.m.
- 10.
La pastilla obtenida se dejó en campana hasta que se secó. Posteriormente, se resuspendió en 30μl de agua desionizada estéril.
Finalmente, la pastilla de ácidos nucleicos fue purificada utilizando el PureLink Plant DNA Purification Kit (InvitrogenR, EE. UU.), de acuerdo con las especificaciones del producto. El ADN fue visualizado en gel de agarosa al 1% (Sigma-Aldrich, EE. UU.) y luego se llevó a cabo la cuantificación de la densidad óptica a 260nm con un espectrofotómetro UV-VIS (Thermo Scientific, Genesys, EE. UU.), empleando para las lecturas 3μl de ADN y 997μl de agua desionizada estéril. La concentración de ADN se calculó de acuerdo con la fórmula empleada por Barbas III et al.6 (concentración de ADN = A260 * 50 * 1000/3).
Para la identificación de los aislados fúngicos, se llevó a cabo la amplificación del gen 18S utilizando los oligonucleótidos NS1 y NS636. La reacción de PCR se efectuó en un equipo BioRad-iCycler (EE. UU.) en un volumen final de 20μl, obtenido como sigue: 3 a 8ng de ADN; 0,5μM de NS1; 0,5μM de NS6; PCR Master Mix (Promega Corp., EE. UU.), 12μl. Las muestras fueron centrifugadas y calentadas a 94°C durante 2min. Se llevaron a cabo 35 ciclos de PCR bajo las siguientes rampas de temperatura: 94°C por 1min, 55°C por 1min y 72°C 1 min; por último, se dio un ciclo de extensión adicional a 72°C durante 3 min. Los productos de amplificación fueron visualizados en gel de agarosa al 1%. Una vez corroborada la amplificación del gen 18S, se llevó a cabo la purificación del producto de PCR con el Wizard SV Gel and PCR Clean-Up System (Promega Corp., EE. UU.), de acuerdo con las especificaciones del fabricante. Este material fue secuenciado con la técnica de Sanger en sistemas automatizados de tecnología capilar y de fluorescencia (http://www.langebio.cinvestav.mx/). Las secuencias obtenidas fueron comparadas con otras secuencias depositadas en la base de datos GenBank, y para ello se utilizó la herramienta de búsqueda de alineamientos básicos (BLAST) (http://blast.ncbi.nlm.nih.gov), con el objeto de encontrar las secuencias homólogas más cercanas. Dichas secuencias fueron alineadas con el programa MEGA 6 (http://www.megasoftware.net/) y luego fueron recortadas manualmente para uniformizar el tamaño de las secuencias en 1076 bases. Con estas secuencias se construyó un árbol filogenético para la búsqueda de homologías, y para ello se empleó el algoritmo del método de agrupamiento de máxima parsimonia y una prueba de soporte de la topología bootstrap de 500 seudorréplicas del mismo programa MEGA 6.
Actividad holocelulolítica de los aislados fúngicos UMTMLa exploración de la presencia de celulasas, xilanasas y enzimas accesorias óxido-reductoras extracelulares en cada aislado fúngico silvestre se realizó después de 5 días de fermentación líquida de las fuentes de carbono carboximetil celulosa (1%), xilana de abedul (1%) o lactosa (2%) disueltas en un volumen inicial de 10ml de medio mínimo mineral con suplemento de vitaminas y sulfato de amonio, de acuerdo con lo descrito por Alvarez-Navarrete et al.2. La presencia de celulasas y xilanasas se determinó con la medición de azúcares reductores por el método del ácido 3,5-dinitrosalicílico9. Para determinar la actividad óxido-reductora se utilizó la técnica de reducción del 2,6-diclorofenolindofenol10.
Inhibición del crecimiento de aislados fúngicos UMTM por COV emitidos por A. agilis UMCV2La bacteria A. agilis UMCV2 fue proporcionada por el Instituto de Investigaciones Químico-Biológicas de la UMSNH33. Para la evaluación del efecto de los volátiles emitidos por dicha cepa sobre el crecimiento en hongos UMTM aislados en la comunidad de Cuanajo, se empleó un sistema de cajas de Petri divididas (100×15mm), con el propósito de evitar el contacto físico de ambos organismos. En una mitad de la caja se inoculó un fragmento de micelio (0,25cm3) en medio ADS. En la otra mitad de la caja se estrió A. agilis UMCV2 sobre agar nutritivo (BD Bioxon, México). A continuación, las cajas de Petri fueron selladas y colocadas en una cámara de incubación a 28°C en oscuridad por un período aproximado de 5 días. Los valores de crecimiento micelial de los aislados UMTM se evaluaron teniendo en cuenta el diámetro mayor.
Inhibición del crecimiento de aislados fúngicos UMTM por aminasMuestras de 0,25 cm3 de los aislados fúngicos UMTM se sembraron en medio ADS adicionado con las aminas dimetilbutanamina (DMA4), dimetiloctilamina (DMA8), dimetildecilamina (DMA10), dimetildodecilamina (DMA12), dimetiltetradecilamina (DMA14) y dimetilhexadecilamina (DMA16), en concentraciones de 50 y 100μM. Todas las aminas empleadas fueron elaboradas por Sigma-Aldrich (EE. UU.). Las cajas se sellaron e incubaron a 28°C por un período aproximado de 5 días. El crecimiento de los aislados UMTM se evaluó registrando el mayor diámetro de crecimiento del micelio.
Efecto fungistático de la madera adicionada con DMA16Se utilizaron muestras de la albura de Pinus radiata con dimensiones de 1,5×0,25×0,25cm (también llamadas «probetas»), las cuales fueron previamente esterilizadas por autoclave (AESA, México), 30min a 120°C y 15 lb. La adición de la DMA16 a las probetas se llevó a cabo de la siguiente manera: utilizando un frasco de 500ml se sumergieron las probetas en una mezcla alcohol: agua:DMA16 (1:1:100μM) por un período de 24h a 30°C en oscuridad. Pasado ese lapso, las probetas se extrajeron del frasco para dejar secar en oscuridad y a temperatura ambiente durante otras 24 h. Luego, las probetas se colocaron en un sistema de cajas de Petri adicionado con el medio ADS y se conformaron los siguientes 4 tratamientos: 1) control (el aislado UMTM crecido en medio ADS); 2) madera-hongo (probetas y el aislado UMTM en ausencia de la mezcla alcohol:agua:DMA16); 3) disolvente (el aislado UMTM crecido en presencia de probetas tratadas únicamente con una mezcla alcohol:agua 1:1), y 4) DMA16-hongo (el aislado UMTM crecido en presencia de probetas tratadas con la mezcla alcohol:agua:DMA16). Este experimento se realizó a 28°C en oscuridad por un período aproximado de 5 días y se evaluó el crecimiento de aislados UMTM mediante el registro del diámetro mayor del crecimiento micelial.
Análisis estadísticoTodos los experimentos se repitieron de forma independiente 2 veces y tuvieron 4 réplicas cada vez. Para la comparación de medias entre 2 tratamientos los resultados se analizaron mediante la prueba estadística de t (t de Student), o bien una prueba de análisis de varianza (ANOVA) y una separación de medias con la prueba de Duncan para comparaciones múltiples (p<0,05).
ResultadosAislados fúngicos encontrados en la comunidad de Cuanajo-MichoacánDe los muestreos realizados en campo, en total se obtuvieron 10 cultivos microbianos, de los cuales solo 4 lograron crecer y fueron aislados en forma pura. Los ejemplares fueron nombrados UMTM2, UMTM3, UMTM7 y UMTM13. Los sustratos en los cuales se encontraron estos organismos fueron madera aserrada (UMTM2), árbol en pie (UMTM3 y UMTM7) y ejemplar arbóreo ya derribado (UMTM13).
Identificación molecular de los aislados UMTMDe los 4 aislados obtenidos, se seleccionaron 2 para ser identificados según la técnica molecular descrita en el apartado de materiales y métodos. Estos fueron los aislados UMTM3 y UMTM13, por la mayor sensibilidad y la mayor tolerancia que mostraron, respectivamente, a las aminas evaluadas en este trabajo, según se muestra más adelante.
En la figura 1 se muestra el agrupamiento de las secuencias de los genes ribosomales 18S de los aislados UMTM3 y UMTM13 con las secuencias más cercanas encontradas en la base de datos GenBank. El aislado UMTM13 se agrupó en un racimo muy compacto soportado con un valor de bootstrap de 71/100, junto con organismos identificados como F. oxysporum. En ese mismo racimo encontramos organismos del género Gibberella, y un subracimo de este grupo concentró otras especies del género Fusarium y Gibberella. Si bien este resultado no nos permitió determinar con certeza la especie del aislado UMTM13, nos posibilitó inferir que es un organismo del género Fusarium.
Árbol filogenético realizado a partir de la secuenciación del gen 18S de los aislados UMTM usando el método de agrupamiento máxima parsimonia. Se muestra el aislado UMTM3 dentro de agrupamiento del género Hypocrea. El aislado UMTM13 forma parte del agrupamiento de los géneros Fusarium-Gibberella. Los números contiguos a los nodos representan el porcentaje de aparición del nodo con base en un bootstrap de 500 repeticiones. Las secuencias de referencia fueron obtenidas del GenBank y sus números de acceso se muestran entre paréntesis.
Por otra parte, la secuencia del gen ribosomal de 18S del aislado UMTM3 se agrupó en un racimo soportado con un valor de bootstrap de 100/100 junto con 10 especies del género Hypocrea, de manera que concluimos que el aislado UMTM3 corresponde a dicho género, pero no fue posible precisar la especie.
Actividad holocelulolítica de los aislados UMTMEn los aislados UMTM se detectó actividad celulolítica, xilanolítica y óxido-reductora (tabla 1). La mayor actividad celulolítica correspondió al aislado UMTM3, con 2,88U/ml. Por otra parte, el aislado UMTM13 mostró los valores más altos de actividad tanto xilanolítica como óxido-reductora.
Inhibición del crecimiento de aislados UMTM por COV de A. agilis UMCV2Con la metodología descrita de cajas divididas se demostró que los COV emitidos por la cepa bacteriana A. agilis UMCV2 reprimieron el crecimiento de 3 de los 4 aislados UMTM evaluados (fig. 2A). Los organismos UMTM2, UMTM3 y UMTM7 mostraron una significativa inhibición del crecimiento micelial (p≤0,05) en relación con el tratamiento control. En cambio, el organismo UMTM13 no fue inhibido por los COV bacterianos. El organismo UMTM3 fue el que mostró la mayor sensibilidad a la presencia de A. agilis UMCV2 después de 5 días de incubación bajo el sistema de cajas de Petri en compartimentos separados: mientras que el desarrollo del micelio en el tratamiento control alcanzó a tocar los bordes de la caja de Petri (fig. 2B), en el tratamiento con A. agilis UMCV2 el desarrollo del aislado UMTM3 fue apenas visible durante el período considerado.
Efecto de los COV emitidos por A. agilis UMCV2 sobre el crecimiento de aislados UMTM. El panel A muestra los valores promedio del crecimiento micelial en los organismos expuestos a los COV. El panel B muestra el crecimiento del aislado UMTM3 bajo el sistema de cajas de Petri en compartimentos separados. Los resultados se analizaron mediante la prueba t de Student (p<0,05; n=4), el asterisco indica una diferencia estadística entre tratamientos.
En la figura 3 A se muestra el efecto de aminas de cadena corta (DMA4 y DMA8), de cadena mediana (DMA10 y DMA12) y de cadena larga (DMA14 y DMA16) sobre el crecimiento de los aislados UMTM, a concentraciones de 50 y 100μM. Los resultados fueron comparados a una misma concentración e indicaron que los compuestos de cadena corta tuvieron una menor efectividad para inhibir el crecimiento fúngico en comparación con los compuestos de cadena mediana y larga. También resultó evidente que dicha inhibición aumentó con el aumento de la concentración de las aminas. Los aislados UMTM2, UMTM3 y UMTM7 fueron más sensibles al efecto de las aminas en comparación con el aislado UMTM13, que a una concentración de 50μM de las aminas DMA4, DMA8 y DMA10 no presentó diferencias significativas con el control.
Efecto de las aminas sobre el crecimiento de aislados UMTM. El panel A muestra los valores observados para el crecimiento micelial de los aislados UMTM2, UMTM3, UMTM7 y UMTM13 en presencia de las aminas dimetilbutanamina (DMA4), dimetiloctilamina (DMA8), dimetildecilamina (DMA10), dimetildodecilamina (DMA12), dimetiltetradecilamina (DMA14) y dimetilhexadecilamina (DMA16) en concentraciones de 50 y 100μM. El panel B muestra la imagen de la represión sobre el crecimiento de aislado UMTM13 por las aminas utilizadas. Los datos se analizaron mediante un ANOVA seguido de una prueba de Duncan (p<0,05; n=4) para cada aislado a una misma concentración. Medias con la misma letra no muestran diferencia de significación estadística.
En la figura 3 B se muestra, a modo de ejemplo, el impacto sobre el crecimiento micelial del aislado UMTM13 de las distintas aminas utilizadas a concentraciones de 50 y 100μM. Las aminas DMA4, DMA8 y DMA10 mostraron una menor actividad inhibitoria que las DMA12, DMA14 y DMA16, ya sea a 50 o a 100μM. Resulta interesante hacer notar que el efecto de inhibición es dependiente de la concentración y de la longitud de la cadena hidrocarbonada de la amina.
Las aminas no solo causaron una fuerte represión del crecimiento de estos aislados, sino también cambios morfológicos. La observación con microscopio óptico (40X) mostró diferencias en la estructura del micelio del aislado UMTM7 en el tratamiento control (fig. 4A) comparado con el expuesto a la amina DMA16 a 50μM (fig. 4B) y a 100μM (fig. 4C). En presencia de dicha amina a 50μM se verificó una mayor densidad de las fibras miceliares, a pesar de que la colonia fue de menor tamaño (fig. 3A). A una concentración de 100μM de DMA16, se observó una considerable disminución de la densidad y del crecimiento micelial (fig. 4C).
Efecto de la dimetilhexadecilamina (DMA16) sobre el crecimiento del aislado UMTM7. La imagen A muestra la estructura del micelio de dicho aislado en el medio. La imagen B muestra la estructura del micelio de ese mismo aislado en presencia de DMA16 a 50μM y la imagen C muestra el micelio del mismo aislado en presencia de DMA16 a 100μM. Las imágenes fueron tomadas con un microscopio óptico a 40x.
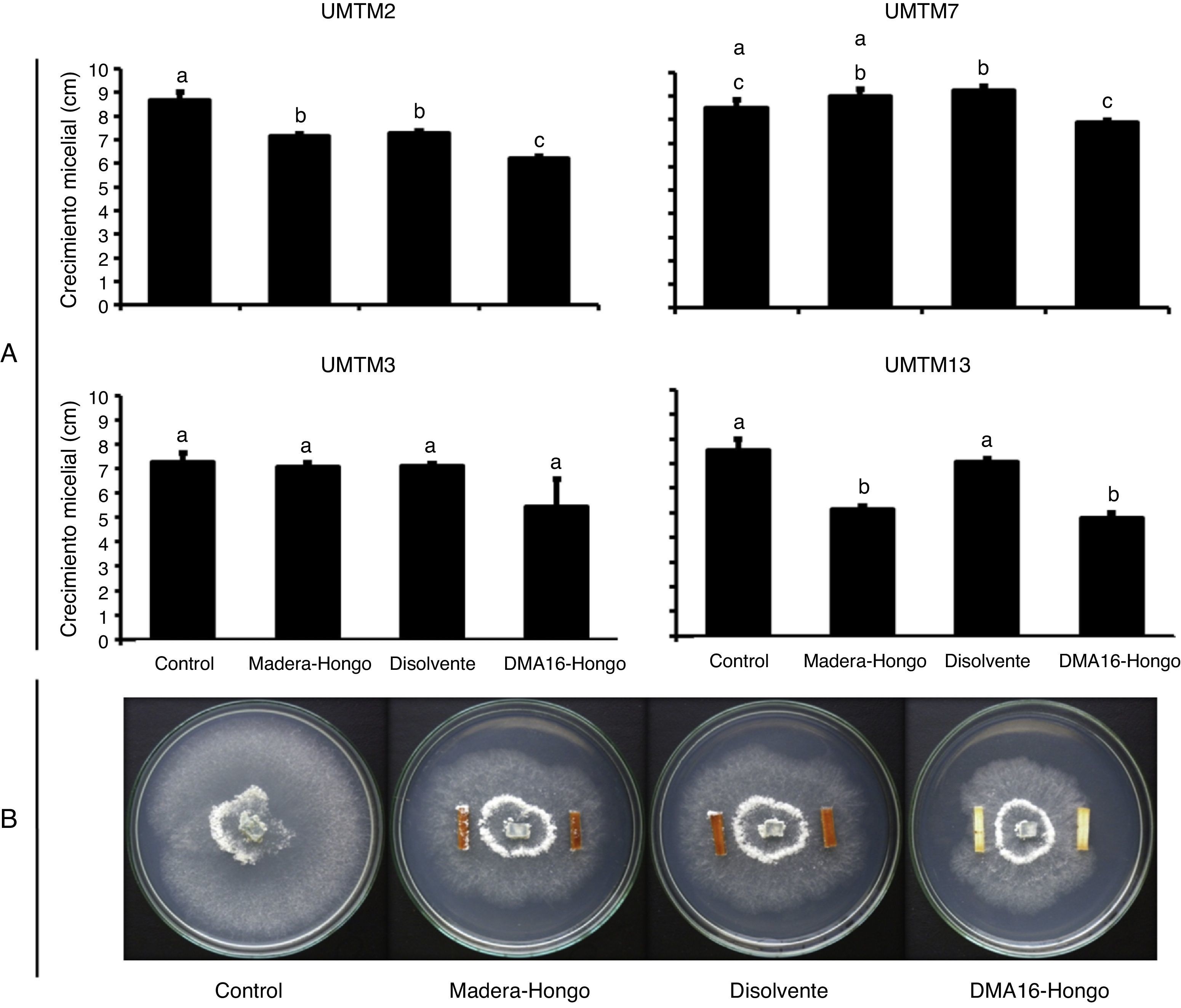
En la figura 5 A se observa el efecto «protector» que tuvo el compuesto DMA16 sobre los aislados UMTM al aplicarse en la madera de P. radiata. Los aislados UMTM2, UMTM7 y UMTM13 mostraron una inhibición de su crecimiento estadísticamente significativa en el tratamiento DMA16-hongo. Esta respuesta significativa no se encontró con el aislado UMTM3, pero se evidenció una clara tendencia. Por otra parte, el tratamiento disolvente solo mostró una inhibición del crecimiento en el aislado UMTM2, ya que en el organismo UMTM7 el crecimiento fue mayor que en el tratamiento control.
Efecto de los aislados xilófagos sobre la madera sin tratar o tratada con el compuesto dimetilhexadecilamina (DMA16). El panel A muestra crecimiento micelial de los aislados UMTM en los diversos tratamientos. El panel B muestra «probetas» de madera de P. radiata expuestas a los distintos tratamientos en presencia del aislado UMTM2 en cajas de Petri. Los resultados fueron analizados mediante un ANOVA seguido de una prueba de Duncan (p<0,05; n=4), las barras con la misma letra indican respuestas sin diferencias de significación estadística.
En la figura 5 B se muestra cómo fue el crecimiento del aislado UMTM2 en presencia o ausencia de DMA16. Se observó que cuando este organismo creció en madera sin tratamiento (tratamiento madera-hongo), el desarrollo fúngico se extendió por toda la caja de Petri e incluso sobre la madera. De igual manera, el disolvente en ausencia de la amina no reprimió su desarrollo y alcanzó valores promedio de 7,3cm (fig. 5A). Finalmente, notamos que cuando la madera fue previamente tratada con esta amina (DMA16-hongo) hubo una clara inhibición en el desarrollo del aislado, lo que limitó su crecimiento sobre la madera.
DiscusiónEn nuestros ensayos, la emisión de COV de A. agilis UMCV2 bajo el sistema de cajas de Petri divididas limitó de forma significativa el crecimiento de los aislados fúngicos UMTM2, UMTM3 y UMTM7. Sin embargo, el aislado UMTM13 mostró resistencia a los volátiles bacterianos y generó un crecimiento micelial similar al control.
Se ha señalado en diversos trabajos que los COV prometen ser una buena alternativa para el control de patógenos. En un trabajo reciente se descubrió que la bacteria Bacillus amyloliquefaciens NJN-6 produce una serie de compuestos volátiles que inhiben el crecimiento y la germinación de esporas en F. oxysporum f. sp. cubense; entre estos se identificaron fenoles, bencenos, alcoholes, aldehídos y otros39. La cepa A. agilis UMCV2 produce, además de la dimetilhexadecilamina, compuestos que en su conjunto pueden contribuir a la inhibición de los organismos xilófagos, ya que dentro del perfil de compuestos volátiles identificados se detectaron alcoholes, dimetil pirazina, quinolina y otros34. Asimismo, y en relación con el estudio exploratorio para detectar la presencia de celulasas, xilanasas y enzimas accesorias óxido-reductoras extracelulares en estos aislados nativos, encontramos que los 4 mostraron tales actividades enzimáticas vinculadas con el deterioro de la madera, propia de organismos xilófagos2,23.
Por otra parte, mostramos un efecto dependiente de la concentración y de la longitud de la cadena hidrocarbonada perteneciente al grupo lipídico sobre el crecimiento de los aislados UMTM. En el análisis comparativo de las aminas dimetilbutanamina (DMA4), dimetiloctilamina (DMA8), dimetildecilamina (DMA10), dimetildodecilamina (DMA12), dimetiltetradecilamina (DMA14) y dimetilhexadecilamina (DMA16), se observó un mayor efecto inhibitorio a mayor longitud de la cadena. Este resultado se vincula con lo reportado por Velázquez-Becerra et al.35, quienes advirtieron también un efecto dependiente de la longitud de la cadena con los compuestos aminados. En este último trabajo citado, los compuestos dimetilbutanamina, dimetiloctilamina y dimetildecilamina mostraron un efecto menos agresivo sobre los organismos fitopatógenos B. cinerea y P. cinnamomi que las aminas dimetildodecilamina, dimetiltetradecilamina y dimetilhexadecilamina, las cuales tuvieron un efecto significativamente mayor.
Además de los compuestos aminados, los ácidos grasos son otro grupo de sustancias que han sido identificadas y utilizadas como agentes antifúngicos. Se ha demostrado que estos compuestos tienen un fuerte potencial como inhibidores de patógenos. Por ejemplo, Andrew y Smith3 mostraron la actividad de diversos ácidos grasos capaces de erradicar o inhibir el crecimiento de una amplia variedad de organismos. Distintos trabajos comunican las propiedades antimicrobianas de los ácidos grasos; entre otros, los ácidos grasos C10:0 y C12:0 fueron reportados como compuestos con actividad antifúngica3,7; asimismo, los ácidos grasos C10:0, C12:0, C14:0, C16:1 presentaron actividad antimicrobiana3,8 y los C18:1, C18:2, C18:3, C20:4 fueron identificados como antivirales3,31.
Aún no se tiene en claro el mecanismo por el cual los ácidos grasos limitan el crecimiento microbiano. De acuerdo con las evidencias, se piensa que el objetivo o blanco principal de acción es la membrana de la célula, donde los ácidos grasos interrumpen la cadena de transporte de electrones y la fosforilación oxidativa. Además de interferir con la producción de energía celular, también pueden llegar a inhibir la actividad enzimática, así como desencadenar una alteración en la absorción de nutrientes y liberar una actividad de peroxidación y productos de degradación3,15.
Pudimos también notar cómo la presencia del compuesto DMA16 en probetas de madera (P. radiata) se asoció con un efecto protector contra los aislados UMTM. Si bien es cierto que los hongos Hypocrea spp. UMTM3 y UMTM7 no mostraron una diferencia estadísticamente significativa en relación con el tratamiento control, sí se observó que el crecimiento de estos aislados quedó limitado al medio de cultivo y no pasó a las probetas de madera, lo cual resulta importante comentar, ya que este fenómeno indica un efecto protector en la madera que impide el crecimiento fúngico.
Finalmente, cabe señalar que el compuesto DMA16 promete ser útil como un posible tratamiento protector contra organismos destructores de la madera, aunque cuando se condensa y se aplica a la madera aparentemente pierde eficacia. Por esa razón creemos que se requieren más y mejores estudios, a fin de encontrar una forma de aplicación más efectiva y una eficaz concentración del compuesto que funcione contra un amplio rango de organismos destructores de la madera.
ConclusionesLos organismos fúngicos encontrados en la comunidad de Cuanajo-Michoacán se correspondieron con géneros que deterioran la madera y alteran sus propiedades fisicoquímicas; el aislado UMTM3 se asoció con Hypocrea spp. y el aislado UMTM13 con Fusarium spp. Por otra parte, tanto los COV emitidos por la cepa A. agilis UMCV2, como las aminas probadas en este estudio, mostraron efecto inhibitorio sobre el crecimiento de nuestros aislados UMTM y revelaron capacidad para limitar su desarrollo en condiciones in vitro. En especial, el compuesto DMA16 deja abierta la posibilidad para su uso como tratamiento preventivo contra el ataque de xilófagos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Consejo Nacional de Ciencia y Tecnología, y a la Coordinación de la Investigación Científica-UMSNH, por el apoyo a este trabajo.