La neumonía adquirida en la comunidad (NAC) continúa siendo una causa importante de morbimortalidad en adultos. El objetivo de este documento es actualizar la guía práctica de prevención de la NAC mediante vacunación en España desarrollada en 2016 en función de las vacunas y evidencias disponibles mediante revisión bibliográfica y opinión de expertos. Las vacunas frente al neumococo y la gripe continúan siendo las principales herramientas preventivas disponibles frente a la NAC, y pueden contribuir a disminuir la carga de enfermedad por NAC y sus complicaciones asociadas. La evidencia disponible avala las indicaciones prioritarias establecidas en esta guía, y sería recomendable tratar de lograr una difusión e implementación amplia en la práctica clínica rutinaria de estas recomendaciones.
Community-acquired pneumonia (CAP) continues to be an important cause of morbidity and mortality in adults. The aim of this study is to update the 2016 practical prevention guidelines for CAP through vaccination in Spain, based on the available vaccines, as well as the evidence using a literature review and expert opinion. Vaccines against pneumococcus and influenza continue to be the main prevention tools available against CAP, and can contribute to reduce the burden of disease due to CAP and its associated complications. The available evidence supports the priority indications established in these guidelines, and it would be advisable to try to achieve a widespread dissemination and implementation of these recommendations in routine clinical practice.
La importancia de la neumonía adquirida en la comunidad (NAC) en el contexto de la salud global y la práctica clínica diaria, las posibilidades de prevención mediante vacunación de una fracción importante de esta patología y la ausencia de calendarios o recomendaciones específicas nacionales motivaron que en el año 2016 el grupo de Neumoexpertos en Prevención desarrollase una guía práctica de vacunación frente a la NAC en el adulto1. Transcurridos 2años, el presente trabajo pretende re-evaluar y actualizar el calendario recomendado de vacunación frente a la NAC en el adulto en función de las nuevas evidencias disponibles.
MétodosHemos aplicado una metodología basada en la revisión bibliográfica extensa en Medline, PubMed y Cochrane sobre recomendaciones preventivas de vacunación en la NAC en el adulto desde julio de 2016. Durante el proceso se realizaron dos reuniones de trabajo presenciales y tres teleconferencias durante el primer semestre de 2018. Después de la revisión se discutieron y consensuaron las recomendaciones de vacunación frente a la NAC en el adulto basándose en la mejor evidencia disponible y en la opinión de expertos según los criterios de Oxford2.
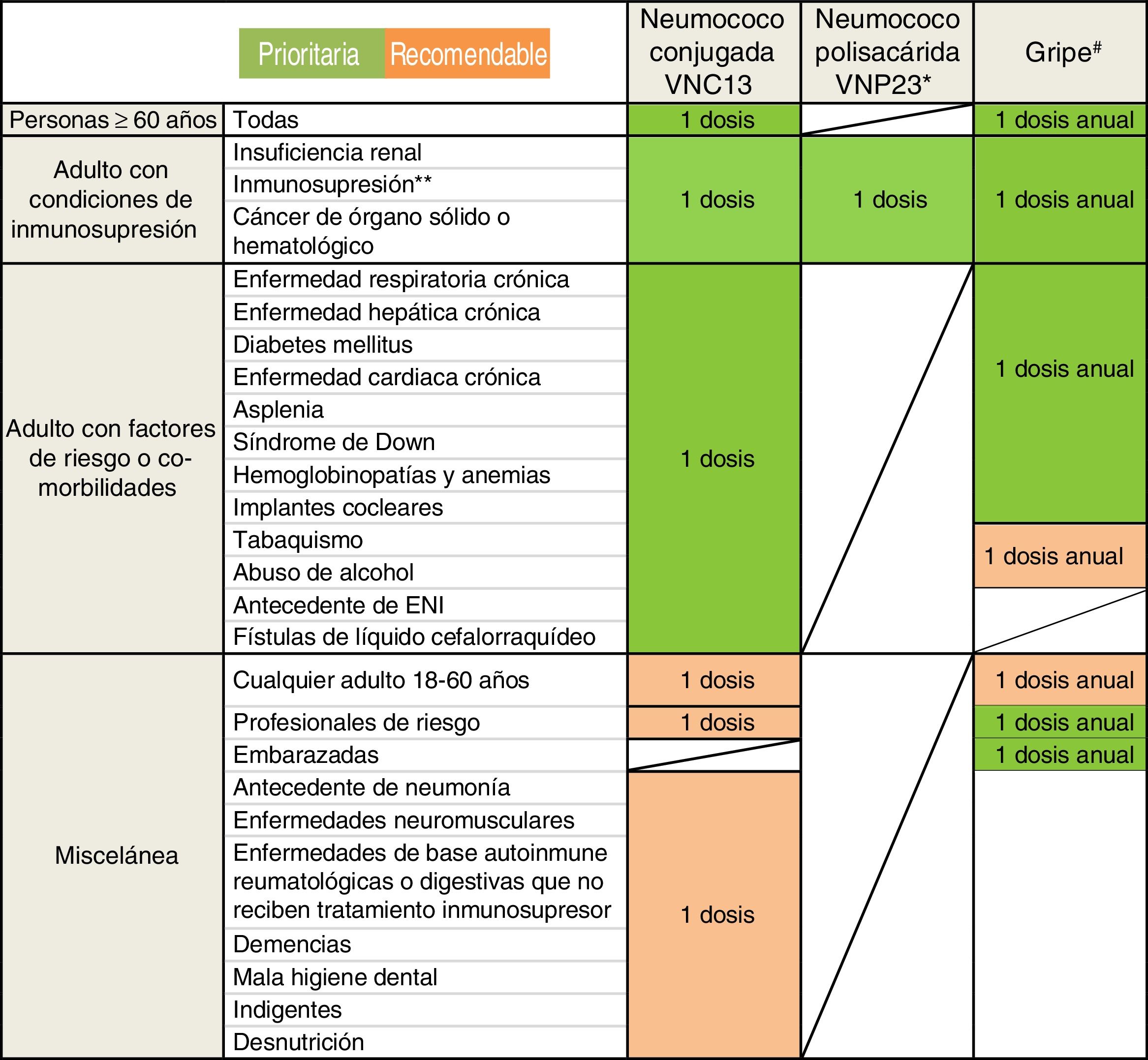
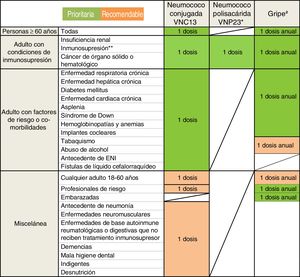
ResultadosComo consecuencia de la revisión se establece la propuesta de recomendaciones de vacunación frente a la neumonía de la figura 1 y se resumen a continuación las principales novedades.
Guía de vacunación frente a la neumonía adquirida en la comunidad (NAC) en el adulto. Se establecen indicaciones prioritarias (sombreadas en verde) y recomendables (sombreadas en naranja).Ver texto para más especificaciones.
ENI: enfermedad neumocócica invasora.
* Aunque la VNP23 no proporciona protección demostrada frente a la NAC, en los casos en que se considere igualmente su administración como parte de una pauta secuencial, buscando una protección global frente a cualquier forma de enfermedad neumocócica y no solo frente a la neumonía, VNC13 se administrará en primer lugar. VNP23 se podrá administrar al menos 8 semanas después. Para pacientes previamente vacunados con VNP23, esperar 1 año para administrar VNC13.
** Incluida la originada por la infección de VIH, por fármacos, en los receptores de trasplantes, u otras causas de inmunosupresión o inmunodeficiencia.
# La vacuna de la gripe debe administrarse únicamente durante la estación de gripe y repetirse cada año. Por el contrario, la vacuna antineumocócica puede administrarse en cualquier momento del año.
Un trabajo reciente de Wang et al.3 teoriza que la hiporrespuesta generada por exposición repetida a VNP23 en realidad podría ser simplemente una menor respuesta asociada a la mayor edad de los sujetos; sin embargo, no aporta ningún dato experimental o clínico que contravenga toda la experiencia documentada hasta la fecha de hiporrespuesta vacunal tras dosis repetidas de VNP234,5.
Según la Agencia de Protección de la Salud del Reino Unido, su efectividad disminuye con el tiempo transcurrido desde su administración (2-5años), la edad y la presencia de comorbilidades6. En nuestro país, su inclusión en 2004 en el calendario de vacunación del adulto de al menos 60/65años ha tenido un escaso impacto sobre la ENI en esta población. Así, por ejemplo, en la Comunidad de Madrid no se ha observado disminución de los casos producidos por serotipos incluidos en esta vacuna en los adultos mayores7.
En cuanto a su eficacia/efectividad frente a neumonía neumocócica no bacteriémica o frente a NAC, la evidencia no es concluyente. Los resultados de metaanálisis publicados en los últimos años8-10 indican que no ofrece una clara eficacia a este respecto. Así, según Schiffner-Rohe et al.8 no se ha demostrado que VNP23 pueda prevenir neumonía neumocócica en adultos mayores. Sin embargo, el metaanálisis realizado por Falkenhorst et al.9, que incluye 17 estudios, indica una eficacia vacunal del 46% (IC95%: 35-80), aunque este resultado se basaba fundamentalmente en un único estudio, el realizado por Maruyama et al.11. Por otra parte, un metaanálisis realizado con 33 estudios observacionales10 indica una eficacia vacunal no significativa de un 10% (IC95%: −12,6-33,0) frente a hospitalización por NAC de todas las causas, y de entre un 32% (IC95%: −18-61) y un 51% (IC95%: 16-71) frente a hospitalización por neumonía neumocócica.
En cuanto a la eficacia en pacientes EPOC, y según una revisión de Cochrane12, al analizar 6 de los 9 ensayos clínicos en los que se evaluaba VNP23, el riesgo de desarrollar NAC era menor en los pacientes vacunados (OR: 0,62; IC95%: 0,43-0,89) que en los no vacunados, sin observarse diferencias entre ambos grupos para neumonía neumocócica. Cabe destacar que estos resultados sobre el riesgo de NAC se contradicen con lo publicado por los mismos autores en 201013 basándose en los mismos estudios, y que la diferencia se debe a una reclasificación de los eventos de uno de ellos. Por otra parte, y según los autores12, no se disponía de evidencia suficiente para poder hacer comparaciones entre diferentes vacunas antineumocócicas.
Vacunación conjugada antineumocócica 13-valenteLos resultados de un análisis post-hoc del CAPiTA muestra una eficacia de VNC13 del 40,3% (IC95%: 11,4-60,2) frente a NAC por serotipos vacunales en adultos con patologías crónicas de base14. En un estudio recientemente publicado de McLaughlin sobre la efectividad de VNC13 frente a hospitalización por NAC por serotipos vacunales en adultos de 65años o mayores de Estados Unidos en el que el 87,9% presentaban al menos una patología crónica (insuficiencia cardiaca congestiva, diabetes mellitus, enfermedad pulmonar obstructiva crónica, asma, enfermedad hepática o fumador o alcoholismo) o alguna condición de inmunosupresión (VIH/sida, oncológico, hematológico, enfermedad que requiera tratamiento con inmunosupresores, síndrome nefrótico, fallo renal crónico), se demostró que la efectividad vacunal fue del 72,8% (IC95%: 12,8-91,5)15.
Por el contrario, el trabajo de Vila-Corcoles et al.16 analiza la efectividad de VNC13 frente a NAC en adultos de edad media y mayores en Cataluña y encuentra que no hay ventajas de la utilización de la VNC13, y que incluso el riesgo de una neumonía de cualquier etiología está aumentado en los sujetos que reciben la vacuna. No obstante, este trabajo tiene importantes limitaciones en su diseño y análisis estadístico. Las coberturas con VNC13 en la población diana son muy reducidas (<0,5%) y la población vacunada con VNC13 es totalmente distinta de la no vacunada, hasta el punto de que los pacientes inmunodeprimidos representan el 33,9% del grupo de vacunación del estudio frente al 5,3% del grupo no vacunado; solo este dato justificaría por sí mismo la existencia de una tasa de mortalidad dos veces superior y una tasa basal de incidencia de neumonía 3 veces superior a la del grupo no vacunado16. Además, para los cálculos de tamaño muestral asumen una efectividad vacunal errónea17. Todo ello hace difícil interpretar cualquier conclusión de este trabajo.
En Italia, un estudio observacional sobre la vacunación con VNC13 identificaba su papel protector frente a la mortalidad por NAC en adultos de al menos 65años hospitalizados con diagnóstico primario de NAC (OR ajustado: 0,599; IC95%: 0,390-0,921)18. De forma similar, en Argentina un programa de vigilancia de NAC en sujetos de al menos 65años demostró una efectividad ajustada frente a la hospitalización por NAC del 53% (IC95%: 24-70%) y para los episodios de NAC del 62% (IC95%: 40-75%)19.
EPOCEl trabajo de Figueira-Gonçalves et al.20 en pacientes EPOC con obstrucción al flujo aéreo moderada-muy grave muestra que los pacientes no vacunados con VNC13 casi triplicaban el riesgo de ingreso hospitalario frente a los vacunados (OR ajustado: 2,77; IC95%: 1,03-7,50).
En la misma línea, Hernández Mezquita et al.21 publicaron los resultados de un estudio piloto con 90 pacientes EPOC y 32 pacientes con asma vacunados con VNC13 y a los que se les hizo un seguimiento de 2años para ver el impacto de la vacunación en las exacerbaciones. En los pacientes con EPOC se observó una reducción del 58% (IC95%: 16-100) en el número de exacerbaciones en el segundo año tras la vacunación. En cuanto a los pacientes con asma, se observó una reducción del 27% (IC95%: 18-39) ya en el primer año tras la vacunación.
El estudio realizado por Rodríguez González-Moro et al.22 analizando el coste incremental de la vacunación de pacientes EPOC de al menos 50años en comparación con la vacunación con la VNP23 mostraba que la administración de VNC13 sería una estrategia de vacunación coste-efectiva en el contexto español.
Diabetes mellitusUn estudio reciente de Ramírez et al.23 ratifica que los pacientes con diabetes mellitus tienen una de las tasas más altas de hospitalizaciones por NAC, estimada en 1.806 casos por 100.000 habitantes24. Un análisis post-hoc del CAPiTA realizado para estimar el posible efecto de las comorbilidades en la eficacia de VNC13 frente a la NAC por serotipos vacunales indica que en pacientes con diabetes mellitus la eficacia vacunal es del 85% (IC95%: 65,5-96,8).
Cambios en recomendaciones oficiales de vacunación antineumocócicaDesde la publicación de nuestras recomendaciones se han producido cambios en las recomendaciones oficiales de vacunación en diferentes comunidades autónomas. En abril de 2016 se incluyó VNC13 para la vacunación sistemática de la cohorte de 60años en Madrid, así como en Castilla y León y Melilla, en octubre del mismo año, para la cohorte de 65años, incluyéndose también en La Rioja y en Galicia en marzo y julio de 2017, respectivamente25-29 Además, en Asturias se ha incluido la vacunación con VNC13 para sujetos con patologías crónicas a partir de los 6años30. Como novedad, desde el 23 de enero de 2018 la Comunidad de Madrid recomienda la siguiente pauta de vacunación frente a neumococo en adultos: personas de 60años o mayores sin vacunación previa y sin factores de riesgo, una única dosis de VNC13, eliminando la necesidad de vacunar con VNP23; personas de 18años o mayores con patología crónica de base, una única dosis de VNC13; personas de cualquier edad que pertenezcan a grupos de alto riesgo, pauta secuencial de VNC13 +VNP23. Justifican esta decisión basándose en la respuesta inmune superior mostrada por VNC13 en comparación a VNP23 en población ≥50años, así como la eficacia y la seguridad mostradas por VNC13 en la prevención de enfermedad neumocócica invasiva (ENI) y de neumonía neumocócica comunitaria en población adulta, con o sin factores de riesgo31.
En cuanto a las indicaciones de vacunación antineumocócica recogidas en otras guías, destaca que la guía española para el diagnóstico y tratamiento de pacientes con EPOC (GesEPOC) recomienda la vacunación con VNC13 para todos los pacientes con EPOC32. A nivel nacional, 18 sociedades científicas se ratifican en la recomendación de vacunación con VNC13 de los adultos con patologías crónicas33.
A nivel internacional, desde 2016, han añadido a su calendario de vacunación por edad la recomendación de VNC13 países como Italia, Australia y Argentina34,35, y Francia recomienda la vacunación para sujetos con patologías crónicas36. Por el contrario, en agosto de 2016 el Standing Committee on Vaccination (STIKO) de Alemania publicó unas recomendaciones en las que indica que todas las personas ≥16años y ≥60años con patologías crónicas (sin inmunodeficiencia) se deben vacunar con VNP2337. Dicha decisión se basa en el metaanálisis de Falkenhorst et al.9, que, como se ha comentado anteriormente, se sustenta de forma casi exclusiva en el estudio de Maruyama et al.11, un estudio con importantes limitaciones y que tiene una incidencia basal de neumonía neumocócica muy alta y una edad media de los participantes de 85años, lo que hace difícilmente extrapolables los resultados a la población general. Además, este estudio no proporciona ninguna evidencia de reducción de ENI, ni demuestra efectividad específica frente a ningún serotipo vacunal.
Novedades en vacunación frente a la gripeInfraestimación de la carga de enfermedadLa gripe, según datos recientes del European Centre for Disease Prevention and Control (ECDC), es la enfermedad infecciosa de mayor incidencia en Europa38. En todas las temporadas que hemos podido consultar en España, la mayor proporción de hospitalizaciones y defunciones por casos graves de gripe se concentró en >64años con algún factor de riesgo, siendo la complicación más frecuente, en el 70% de los casos, la neumonía39. Respecto al estado de vacunación antigripal previo de las personas hospitalizadas o fallecidas por gripe en nuestro país, prácticamente la mitad no habían sido vacunadas esa temporada39.
Si bien la mortalidad asociada a la gripe se debe fundamentalmente a sobreinfecciones bacterianas (principalmente neumocócicas) o a descompensaciones de una enfermedad de base, la coinfección neumocócica posterior a la gripe puede ocasionar una sinergia letal40. El virus gripal causa daño epitelial alveolar y disrupción del surfactante, lo que conduce a la exposición de la membrana basal y de las células epiteliales respiratorias progenitoras, determinando este hecho dos importantes consecuencias: facilitar la adherencia bacteriana en el epitelio expuesto y dificultar la reparación del epitelio, de forma que el daño se perpetúa41. Además, el virus influenza produce una disminución del aclaramiento mucociliar, lo que impediría la limpieza de los gérmenes adheridos al epitelio respiratorio dañado. En esta sinergia, y de forma simultánea, el neumococo respondería con distintos factores de virulencia que le permitirían adherirse a los receptores epiteliales expuestos. Por otro lado, la respuesta inmune innata desencadenada por las toxinas virales y bacterianas en el punto de infección produciría una respuesta inflamatoria exagerada con gran afluencia de neutrófilos y liberación de citoquinas que perpetuarían el daño tisular epitelial y favorecerían la progresión de la neumonía hacia formas invasivas40. Ahondando en este mismo mecanismo etiopatogénico, un trabajo reciente señala la relación entre las infecciones respiratorias por virus gripal y la respuesta inflamatoria desencadenada a nivel del miocardio, lo que facilitaría la ruptura o la erosión de la placa de ateroma y fenómenos de agregación plaquetaria que favorecerían la aparición del infarto de miocardio con un mayor riesgo, hasta 6 veces superior, en pacientes >77años y en los primeros 7días de la infección gripal41.
Recomendaciones de vacunación antigripalSiendo la vacunación antigripal la forma más efectiva de prevenir la enfermedad y sus complicaciones, actualmente en algunos países de la UE se tiende a reducir la edad recomendada para la vacunación antigripal, aproximándose más a los 50-55años que a los 65, como una estrategia para cubrir una mayor población con enfermedad crónica subyacente, que suele acumularse por encima de esa edad42, en la misma línea que nuestra recomendación de vacunación antigripal en los 60años (fig. 1)1.
En cuanto a las vacunas antigripales que se emplean en España, son vacunas inactivadas, bien sean de virus enteros, fraccionados o vacunas de subunidades y se pueden utilizar a partir de los 6meses de edad43-48. Los diferentes tipos de vacunas antigripales ya fueron revisadas, por lo que solo trataremos ciertos aspectos de actualidad. En la tabla 1 se muestran las vacunas antigripales actualmente autorizadas en España43.
Vacunas antigripales autorizadas en España
| Nombre | Laboratorio | Composición | Edad | Vía |
|---|---|---|---|---|
| Afluria | Seqirus | Trivalente/Fraccionado/Inactivado | ≥ 5 años | IM/SCP |
| Chiroflu | Seqirus | Trivalente/Antígeno de superficie/Inactivado | ≥ 6 meses | IM/SCP |
| Chiromas | Seqirus | Trivalente/Antígeno de superficie/Inactivado/adyuvante MF59C.1 | ≥ 65 años | IM |
| Influvac | Mylan | Trivalente/Antígeno de superficie/Inactivado | ≥ 6 meses | IM/SCP |
| Mutagrip | Sanofi Pasteur Europe | Trivalente/Fraccionado/Inactivado | ≥ 6 meses | IM/SCP |
| Vaxigrip | Sanofi Pasteur Europe | Trivalente/Fraccionado/Inactivado | ≥ 6 meses | IM/SCP |
| Fluarix tetra | Glaxo Smith Kline | Tetravalente/Fraccionado/Inactivado | ≥ 6 meses. | IM |
| Vaxigrip tetra | Sanofi Pasteur Europe | Tetravalente/Fraccionado/Inactivado | ≥ 6 meses | IM/SCP |
| Fluenz Tetra | Astra Zeneca | Tetravalente/Viriones enteros/Atenuado | 2 a 18 años | I |
I: intranasal; ID: vía intradérmica; IM: vía intramuscular; SCP: vía subcutánea profunda.
En el Sistema Nacional de Salud las vacunas empleadas son trivalentes y solo incluyen un tipo de linajeB; sin embargo, se encuentran disponibles nuevas vacunas antigripales tetravalentes que incluyen los dos linajesB existentes (Victoria y Yamagata) con el fin de evitar discordancias (mismatch) entre la cepaB vacunal y la circulante en cada temporada, y conseguir aumentar el nivel de protección frente a la enfermedad sin que se modifique la seguridad y la inmunogenicidad, en comparación con las vacunas trivalentes49. En España, en 5 de las últimas 10 temporadas ha existido discordancia entre las cepas contenidas en la vacuna y las circulantes, y lo mismo ha ocurrido en la temporada 2017-2018, por lo que la utilización de vacunas tetravalentes podría ser el futuro próximo en inmunización antigripal50. En la temporada gripal 2017-2018, a pesar de haberse dado una alta discordancia entre el virusB circulante y el virus vacunal, la efectividad vacunal global en España ha sido similar a la de temporadas anteriores, bien por la protección conferida por exposiciones previas al virus o por la posible protección cruzada de la vacuna, a pesar de que metaanálisis anteriores confirmaban una protección cruzada subóptima entre ambos linajesB51.
Es significativo que la OMS en sus recomendaciones para la temporada 2018/2019 cambie la redacción, presentando en primer lugar la composición de la vacuna tetravalente, y en segundo lugar describiendo la composición de la trivalente, justo a la inversa de como lo hacía hasta ahora52. Así mismo, los ECDC advierten a los estados miembros de la UE/AEE que, debido a que en las últimas temporadas las cepasB incluidas en las vacunas trivalentes han sido discordantes con las cepasB circulantes, deberían considerar incrementar la disponibilidad y la utilización de vacunas tetravalentes para la próxima temporada53.
Teniendo en cuenta que la mayoría de los casos graves de gripe con complicaciones neumónicas suceden en mayores de 65años, y en ellos la respuesta inmune es menos efectiva debido a la inmunosenescencia, se debería contemplar el uso preferente de vacunas específicas para este grupo etario. Las vacunas antigripales adyuvadas consiguen mayor inmunogenicidad, de mayor duración y con mejor inmunización cruzada, y un reciente estudio español concluye que la utilización de estas vacunas en >65años supondría un incremento de la eficiencia de los programas de vacunación antigripa54. El Joint Committee on Vaccination and Immunisation (JCVI) británico las recomendaba como primera opción, frente a no adyuvadas, para la prevención de la gripe estacional en mayores de 65años durante la próxima campaña 2018-201955.
Las vacunas antigripales producidas en cultivo celular presentan ventajas frente a las producidas en huevos embrionados, como son: una menor variabilidad antigénica de los virus, lo que reduce la discordancia entre la cepa vacunal producida y la circulante de la temporada; una mayor flexibilidad y fiabilidad en la cadena de producción, y en consecuencia también una previsible mayor disponibilidad. Además, por las características del proceso de producción no necesitan adición de antibióticos ni conservantes56. Hay que tener en cuenta que, con las actuales vacunas producidas en huevos, durante el proceso de producción pueden ocurrir pequeñas mutaciones respecto a la cepa original inoculada. Esta parece ser una de las causas de la deriva antigénica cambiante a lo largo de la temporada 2017/2018, ofreciendo menor protección frente al virusAH3N256.
La aparición de una vacuna antigripal universal que proporcionase protección cruzada y duradera frente a diversas cepas del virus, y que solventara el problema de la prevención de la gripe y sus complicaciones57, está todavía lejos de la práctica clínica.
DiscusiónLa revisión actualizada de las evidencias disponibles aporta nuevos argumentos para soportar las indicaciones en el calendario original propuesto por NEP(6)1, dando lugar a ligeras modificaciones respecto a las recomendaciones previas (fig. 1). Las evidencias recientes sobre efectividad de la vacuna VNC13 confirman en general los datos de eficacia inicialmente demostrados en el estudio CAPiTA17, incluyendo pacientes inmunodeprimidos y pacientes previamente vacunados con la vacuna polisacárida. El único trabajo publicado que no encuentra dicho beneficio muestra importantes limitaciones metodológicas9.
En la edición anterior de nuestras recomendaciones ya preconizábamos que el futuro de la protección frente al neumococo se iría decantando por un uso más generalizado de la vacuna conjugada y una utilización más selectiva de la vacuna polisacárida, restringida a pacientes inmunodeprimidos o por asociación de más de dos comorbilidades. Las recientes recomendaciones de vacunación frente a neumococo de la Comunidad de Madrid apuntan definitivamente en esta línea, priorizando el uso de la vacuna conjugada y relegando el uso de la vacuna polisacárida como complemento en los pacientes con inmunodepresión31.
No mejora lo que hacemos en términos de vacunación antigripal, con cobertura por debajo de lo deseable en la población diana y vergonzante en el contexto de la vacunación del profesional sanitario. Sí parece que las recomendaciones oficiales apuntan a una composición vacunal de elección que debería de ser cuadrivalente, es decir, con dos cepas tipoB, para evitar los problemas de mismatching.
El calendario que proponemos posee las limitaciones inherentes a la metodología aplicada, sobre todo por aquellas recomendaciones en las que la evidencia es menor y la recomendación que realiza el grupo es arbitraria. Además, consideramos exclusivamente las patologías de NAC para las que existen vacunas con indicación en el adulto.
Nuestras recomendaciones no pretenden interferir con las recomendaciones oficiales vigentes en cada comunidad o ciudad autónoma de nuestro país, ya que en algunos casos no están financiadas por el Sistema Nacional de Salud. No obstante, este calendario tiene una perspectiva de salud individual y persigue orientar la recomendación del profesional sanitario a cada usuario individual, de modo que se pueda realizar una información y una educación individualizadas que permitan al potencial candidato vacunal la decisión que más le convenga en función de la indicación y las circunstancias particulares del individuo.
En conclusión, este documento de posicionamiento sobre la vacunación frente a la NAC del adulto por parte del grupo de Neumoexpertos en Prevención, a través de las evidencias disponibles, pone de relieve la importancia de la vacunación frente al neumococo y la gripe como medidas de prevención frente a una patología de alta prevalencia como es la NAC del adulto.
Conflicto de interesesNeumoexpertos en prevención (NEP) ha recibido fondos de Pfizer a través del Instituto de Investigación Sanitaria de Santiago para cobertura logística de reuniones de sus miembros.
El trabajo de investigación de FMT ha tenido el apoyo de becas del Instituto CarlosIII (Intensificación de la actividad investigadora y FIS PI13/02382) y de fondos del Plan Nacional I+D+I y de FEDER.
FMT ha recibido becas de investigación y/u honorarios como consultor/asesor y/o ponente así como en el desarrollo de ensayos clínicos en vacunas de GlaxoSmithKline, Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer, Novartis y MedImmune Inc.
ERM ha recibido honorarios como consultor/asesor y/o ponente, así como becada para asistir a conferencias o cursos por GlaxoSmithKline, Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer y Novartis.
AGM ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Pfizer, GlaxoSmithKline, Janssen, MSD y Sanofi Pasteur.
JMP ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Astra-Zeneca, Boehringer Ingelheim, Esteve, GSK, MSD, Menarini, Mundifarma, Novartis, Pfizer, Roche, Rovi, Sandoz, Takeda y TEVA.
DVO ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Astra-Zeneca, Boehringer Ingelheim, Esteve, GSK, MSD, Menarini, Mundifarma, Novartis, Pfizer, Roche, Rovi, Sandoz, Takeda y TEVA.
IRC ha colaborado como ponente y/o asesor y/o ha sido becada para asistir a congresos o cursos y/o ha participado en el desarrollo de ensayos clínicos en vacunas de GlaxoSmithKline, Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer, Novartis y MedImmune Inc.
JLDM ha colaborado como ponente y/o asesor en iniciativas y proyectos de Pfizer y Astra Zeneca, así como becado, para asistencia a congresos o cursos, por parte de Pfizer y Astra Zeneca.
EMB ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Astra-Zeneca, Boehringer Ingelheim, Esteve, GSK, MSD, Menarini, Mundifarma, Novartis, Orion, Pfizer, Roche, Rovi, Takeda y TEVA.
DOR ha colaborado como ponente y/o asesor y/o investigador en iniciativas y proyectos promovidos por Lilly, Boehringer Ingelheim, Novartis, Pfizer, Takeda, Esteve, Almirall, GlaxoSmithKline, Astra-Zeneca, Chiesi, Mundipharma, Teva, Solvay Pharma, Rovi, Gebro Pharma, Janssen, MSD, Novo Nordisk y Menarini
Ningún conflicto de intereses declarado para el resto de los autores.