El uso de inhibidores de la proproteína convertasa subtilisina/kexina tipo9 (iPCSK9) es una opción de tratamiento para los pacientes con hipercolesterolemia familiar (HF) o en prevención secundaria que no alcanzan el objetivo de cLDL con otras medidas terapéuticas. El objetivo del estudio es valorar la efectividad y la seguridad de estos fármacos en vida real.
Material y métodosEstudio descriptivo retrospectivo multicéntrico. Se han revisado todos los pacientes en tratamiento con iPCSK9 en tres centros hospitalarios de Asturias desde el inicio de su uso en 2016. Se han recogido los cambios en el perfil lipídico así como los efectos adversos relacionados con el uso de iPCSK9.
ResultadosSe obtuvieron datos de 98 pacientes, 75 de ellos afectos de HF y 23 no afectos. A los dos meses del inicio del tratamiento con iPCSK9 se aprecia una reducción del cLDL del 61% en pacientes afectos de HF y del 52% en no afectos. Esta reducción, estadísticamente significativa, se mantuvo estable durante el seguimiento. Se observó una disminución significativa del colesterol total, sin cambios significativos en cHDL y triglicéridos. El 96% de los pacientes no presentaron efectos adversos.
ConclusionesLos iPCSK9 son fármacos seguros que consiguen reducciones marcadas en los valores de cLDL de una manera rápida y mantenida en el tiempo. Por lo tanto, suponen una alternativa para el control del cLDL en aquellos pacientes en los que no se alcanza el cLDL objetivo con otras medidas terapéuticas.
Inhibitors of proprotein convertase subtilisin/kexin type9 (PCSK9 inhibitors) are a treatment option for those patients with familial hypercholesterolemia or in secondary prevention who do not reach the LDL-C target with other therapeutic measures. The aim of this study is to assess the effectiveness and safety of these drugs.
MethodsRetrospective, multicentric, descriptive study. We collected data from all patients that have started PCSK9 inhibitors treatment in three hospitals in Asturias since the beginning of its use in 2016. We analysed changes in lipid profile with PCSK9 inhibitors and its side effects.
ResultsWe registered 98 patients, 75 of them affected by familial hypercholesterolemia (FH) and 23 unaffected. Two months after the beginning of PCSK9 inhibitors treatment, a 61% reduction rate in LDL-C in patients with FH and 52% in those without this condition was observed. This statistically significant reduction remained stable during follow-up. A significant decrease in total cholesterol was observed, without significant changes in HDL-C and triglycerides. 96% of patients had no complications.
ConclusionsPCSK9 inhibitors are safe drugs that rapidly achieve significant reductions in LDL-C after the beginning of treatment, which are maintained over time. Hence, the use of PCSK9 inhibitors is an alternative for the control of LDL-C in those patients in which the LDL-C target is not reached with other therapeutic measures.
El colesterol LDL (cLDL) elevado es un factor de riesgo para el desarrollo de la enfermedad cardiovascular ateroesclerótica. Se ha demostrado la relación entre la disminución de las cifras de cLDL y la reducción de los eventos cardiovasculares como infarto agudo de miocardio e ictus, sin que descensos marcados del cLDL se hayan visto acompañados de efectos adversos1.
Desde las diversas sociedades científicas se ha establecido una cifra de cLDL objetivo en función del riesgo cardiovascular del paciente, calculado a partir del conjunto de factores de riesgo y antecedentes personales y familiares2,3. Para la consecución de estos objetivos del cLDL como primera medida se recomienda la mejora en los hábitos de vida (principalmente dieta equilibrada, abstención tabáquica y actividad física).
En los pacientes que precisen tratamiento farmacológico para alcanzar su objetivo de cLDL, el primer escalón terapéutico lo ocupan las estatinas, grupo de fármacos cuyo uso está muy extendido por su alta efectividad hipolipemiante2,3. Las estatinas de alta potencia a dosis máxima —atorvastatina 80mg y rosuvastatina 40mg— reducen el cLDL el 55 y el 53%, respectivamente4; sin embargo, su utilización se encuentra limitada por sus efectos secundarios, principalmente en forma de mialgias. En ensayos clínicos se observa la aparición de mialgias en torno al 1-5% de los pacientes, mientras que en estudios observacionales la frecuencia aumenta hasta el 11-29%5.
En un segundo escalón del tratamiento farmacológico se encuentra ezetimiba2,3. Este fármaco ha demostrado incrementar en un 22% adicional la disminución del cLDL conseguida con el uso de estatinas, reduciendo aún más el número de eventos cardiovasculares6.
Si la reducción del cLDL conseguida con la mejora en hábitos de vida y los fármacos previamente mencionados no es suficiente para alcanzar el objetivo de cLDL, o en casos de intolerancia farmacológica, disponemos actualmente de un tercer escalón terapéutico, los inhibidores de la proproteína convertasa subtilisina/kexina tipo9 (iPCSK9)2,3.
Los iPCSK9 son anticuerpos monoclonales que se unen a la PCSK9 circulante y evitan la degradación de los receptores de cLDL7,8. Estos receptores están situados en la superficie de los hepatocitos y son el principal mecanismo de regulación del cLDL sérico. La PCSK9 es una enzima proteolítica que promueve la endocitosis y la posterior degradación en los lisosomas de los receptores de cLDL. Ante esto, la inhibición de dicha enzima supone un aumento en el retorno de los receptores de cLDL a la superficie de los hepatocitos y, con ello, una disminución del cLDL sérico7,8.
Los iPCSK9 han demostrado descensos del cLDL del 53,9% en comparación con placebo a las 24semanas del inicio del tratamiento, así como potenciar el efecto conseguido con estatinas y ezetimiba tanto en reducción del cLDL como de los eventos cardiovasculares9. Además, son fármacos con un buen perfil de seguridad, comparable a placebo, y cuyos efectos secundarios más notificados son reacciones cutáneas leves en relación con la administración del fármaco y mialgias10,11. Sin embargo, su elevado coste provoca que su uso sea restringido. Actualmente hay comercializados dos fármacos iPCSK9: evolocumab y alirocumab.
En Asturias, la Comisión de Uso Racional de los Medicamentos y Productos sanitarios (CURMP) dictaminó en septiembre de 2017 la inclusión en la guía farmacoterapéutica de alirocumab (75-150mg solución inyectable subcutánea cada 14días) y evolocumab (140mg solución inyectable subcutánea cada 14días)12. La prescripción de estos fármacos está limitada al servicio de Endocrinología y Nutrición y al de Cardiología. Antes de valorar su uso se exige un adecuado cumplimiento terapéutico en cuanto a hábitos de vida y tratamiento farmacológico (considerando así estatinas y ezetimiba a dosis máximas toleradas). Si la prescripción de iPCSK9 se realiza por intolerancia a estatinas, la intolerancia se debe demostrar al menos a dos fármacos de dicha familia. Cumplidos estos criterios, el uso de iPCSK9 se especifica para dos supuestos:
- •
Prevención primaria con diagnóstico clínico certero de hipercolesterolemia familiar monogénica (HF):
- ∘
Evolocumab si cLDL >100mg/dl en la forma homocigota.
- ∘
Alirocumab o evolocumab si cLDL >130mg/dl en la forma heterocigota con riesgo cardiovascular moderado-alto.
- ∘
Alirocumab o evolocumab si cLDL >160mg/dl en la forma heterocigota con riesgo cardiovascular bajo.
- ∘
- •
Prevención secundaria en los pacientes mayores de 18años si cLDL >100mg/dl.
El objetivo principal del estudio es valorar la reducción conseguida en el cLDL. Los objetivos secundarios son conocer las modificaciones en el resto del perfil lipídico debidas al uso de fármacos inhibidores de PCSK9 así como la aparición de efectos adversos. De esta forma queremos aportar nuevos datos que orienten sobre su efectividad y su seguridad en vida real, así como acercar esta herramienta terapéutica a otros especialistas.
Material y métodosPoblación de estudioSe realizó un estudio observacional longitudinal retrospectivo multicéntrico. En el estudio se incluyeron todos los pacientes que iniciaron tratamiento con iPCSK9 en los servicios de Endocrinología y Nutrición de tres centros hospitalarios de Asturias desde el inicio de su prescripción en abril de 2016. El diagnóstico de hipercolesterolemia familiar se hizo según los Criterios de la Red de Clínicas de Lípidos de Holanda. El único criterio de exclusión aplicado era el diagnóstico de HF homocigota.
El estudio fue aprobado por el Comité de Ética de la Investigación del Principado de Asturias, que permitió la exención del consentimiento informado.
Variables del estudioMediante el acceso a la historia clínica se recogieron datos correspondientes a la edad al inicio del tratamiento, sexo, diagnóstico de HF (no se incluyeron datos del análisis genético dado que en la mayoría de los pacientes el diagnóstico es clínico), situación de prevención primaria o secundaria y perfil lipídico basal y a los 2, 6, 12 y 24meses en el caso de la HF y a los 2, 6 y 12meses en los pacientes en prevención secundaria.
Además se analizó el fármaco utilizado y su dosis, uso o intolerancias a otros hipolipemiantes, cambios en el tratamiento hipolipemiante en el seguimiento, efectos adversos del uso de iPCSK9 e interrupción del mismo.
Se ha calculado también el número de pacientes que alcanzan el objetivo de cLDL tomando como referencia de corte 100mg/dl en prevención primaria y 70mg/dl en prevención secundaria.
Análisis estadísticoSe realizó un análisis descriptivo proporcionando medidas de posición y dispersión (mediana y el rango intercuartílico [RI]).
El análisis de la evolución del perfil lipídico se hizo diferenciando dos grandes grupos: el de los pacientes diagnosticados de HF y el de los no afectos de esta alteración.
La comparativa entre evolocumab y alirocumab se realizó en el grupo de pacientes afectos por HF debido al bajo tamaño muestral en el grupo de prevención secundaria con alirocumab.
En el análisis estadístico se realizó aplicando la t de Student o Wilcoxon criterios de normalidad. Se utilizó el software de análisis GraphPad Prism, versión 8.0.1 (GraphPad Software Inc., San Diego, EE.UU.). El nivel de significación empleado fue de 0,05.
ResultadosSe obtuvieron datos de 98 pacientes tratados con iPCSK9. La edad media fue de 59,6±10,6 años, siendo el 52,0% varones. El 76,5% (n=75) presentaban diagnóstico de HF (47 de ellos en prevención primaria y 28 en prevención secundaria) y el 23,5% restante (n=23) en prevención secundaria sin diagnóstico de HF.
El 79,6% de los pacientes iniciaron tratamiento con evolocumab y el 57,1% además estaban con estatinas de alta potencia. El 44,9% (n=44) de los pacientes presentaban intolerancia a estatinas de alta potencia y/o ezetimiba. De estos pacientes, 30 se encontraban sin ningún tratamiento hipolipemiante por intolerancia.
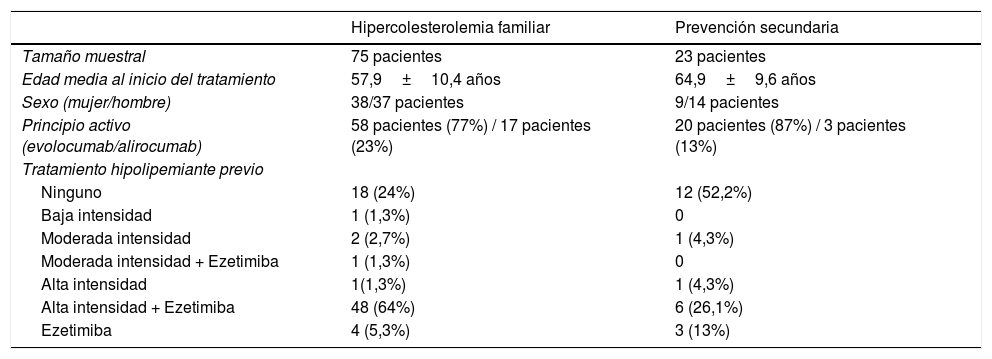
Estas características se analizaron dividiendo a los pacientes según la indicación de iPCSK9 (HF o prevención secundaria). Los datos se expresan en la tabla 1.
Datos basales de los pacientes
| Hipercolesterolemia familiar | Prevención secundaria | |
|---|---|---|
| Tamaño muestral | 75 pacientes | 23 pacientes |
| Edad media al inicio del tratamiento | 57,9±10,4 años | 64,9±9,6 años |
| Sexo (mujer/hombre) | 38/37 pacientes | 9/14 pacientes |
| Principio activo (evolocumab/alirocumab) | 58 pacientes (77%) / 17 pacientes (23%) | 20 pacientes (87%) / 3 pacientes (13%) |
| Tratamiento hipolipemiante previo | ||
| Ninguno | 18 (24%) | 12 (52,2%) |
| Baja intensidad | 1 (1,3%) | 0 |
| Moderada intensidad | 2 (2,7%) | 1 (4,3%) |
| Moderada intensidad + Ezetimiba | 1 (1,3%) | 0 |
| Alta intensidad | 1(1,3%) | 1 (4,3%) |
| Alta intensidad + Ezetimiba | 48 (64%) | 6 (26,1%) |
| Ezetimiba | 4 (5,3%) | 3 (13%) |
La cifra basal de cLDL fue de 176,5mg/dl (138,0-214,0mg/dl), observándose un descenso del 59,5% a los 2meses del inicio del tratamiento, del 55,2% a los 6meses y del 55,5% a los 12meses, con valores de significación en todos los casos de p≤0,001.
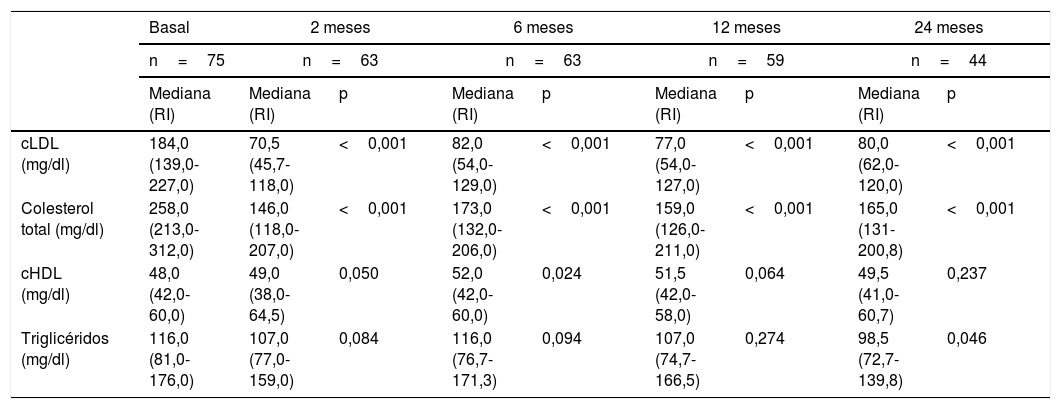
En el grupo de pacientes afectos de HF la mediana de cLDL basal fue de 184mg/dl (178,8-212,2mg/dl). En el seguimiento a los 2, 6, 12 y 24meses se observó una reducción en la mediana de cLDL del 61,7, del 55,4, del 58,2 y del 56,5%, respectivamente. El descenso de cLDL fue significativo en todos los puntos del seguimiento. La evolución del resto de parámetros del perfil lipídico se resume en la tabla 2.
Evolución del perfil lipídico de los pacientes con HF
| Basal | 2 meses | 6 meses | 12 meses | 24 meses | |||||
|---|---|---|---|---|---|---|---|---|---|
| n=75 | n=63 | n=63 | n=59 | n=44 | |||||
| Mediana (RI) | Mediana (RI) | p | Mediana (RI) | p | Mediana (RI) | p | Mediana (RI) | p | |
| cLDL (mg/dl) | 184,0 (139,0-227,0) | 70,5 (45,7-118,0) | <0,001 | 82,0 (54,0-129,0) | <0,001 | 77,0 (54,0-127,0) | <0,001 | 80,0 (62,0-120,0) | <0,001 |
| Colesterol total (mg/dl) | 258,0 (213,0-312,0) | 146,0 (118,0-207,0) | <0,001 | 173,0 (132,0-206,0) | <0,001 | 159,0 (126,0-211,0) | <0,001 | 165,0 (131-200,8) | <0,001 |
| cHDL (mg/dl) | 48,0 (42,0-60,0) | 49,0 (38,0-64,5) | 0,050 | 52,0 (42,0-60,0) | 0,024 | 51,5 (42,0-58,0) | 0,064 | 49,5 (41,0-60,7) | 0,237 |
| Triglicéridos (mg/dl) | 116,0 (81,0-176,0) | 107,0 (77,0-159,0) | 0,084 | 116,0 (76,7-171,3) | 0,094 | 107,0 (74,7-166,5) | 0,274 | 98,5 (72,7-139,8) | 0,046 |
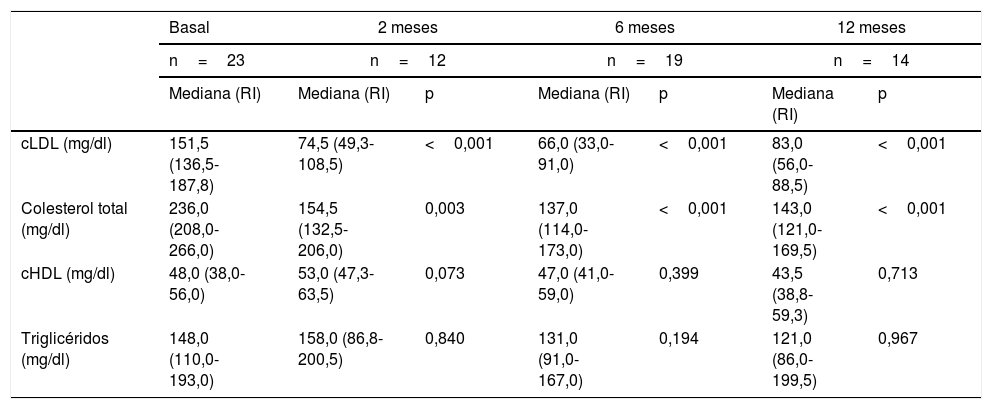
Entre los pacientes no afectos de HF la mediana de cLDL basal fue de 151,5mg/dl (139,2-170,4mg/dl). En el seguimiento a los 2, 6 y 12meses se observó una reducción en la mediana de cLDL del 50,8, del 56,4 y del 45,2%, respectivamente. El descenso de cLDL fue significativo en todos los puntos del seguimiento. La evolución del resto de parámetros del perfil lipídico se resume en la tabla 3.
Evolución del perfil lipídico de los pacientes en prevención secundaria sin diagnóstico de HF
| Basal | 2 meses | 6 meses | 12 meses | ||||
|---|---|---|---|---|---|---|---|
| n=23 | n=12 | n=19 | n=14 | ||||
| Mediana (RI) | Mediana (RI) | p | Mediana (RI) | p | Mediana (RI) | p | |
| cLDL (mg/dl) | 151,5 (136,5-187,8) | 74,5 (49,3-108,5) | <0,001 | 66,0 (33,0-91,0) | <0,001 | 83,0 (56,0-88,5) | <0,001 |
| Colesterol total (mg/dl) | 236,0 (208,0-266,0) | 154,5 (132,5-206,0) | 0,003 | 137,0 (114,0-173,0) | <0,001 | 143,0 (121,0-169,5) | <0,001 |
| cHDL (mg/dl) | 48,0 (38,0-56,0) | 53,0 (47,3-63,5) | 0,073 | 47,0 (41,0-59,0) | 0,399 | 43,5 (38,8-59,3) | 0,713 |
| Triglicéridos (mg/dl) | 148,0 (110,0-193,0) | 158,0 (86,8-200,5) | 0,840 | 131,0 (91,0-167,0) | 0,194 | 121,0 (86,0-199,5) | 0,967 |
En cuanto a la consecución del objetivo de cLDL, en prevención primaria solo se encontraban los 47 pacientes con HF. De este grupo disponemos de datos a los 12meses de 38 pacientes, de los cuales el 55,3% lograron el objetivo de cLDL inferior a 100mg/dl al año de tratamiento con iPCSK9. Con respecto a los pacientes en prevención secundaria, disponemos de datos a los 12meses de 34 pacientes (21 pacientes con HF y 13 en prevención secundaria). El 57,1% de los pacientes con HF en prevención secundaria alcanzaron el objetivo de cLDL inferior a 70mg/dl (9,5% con intolerancia a estatinas), frente al 38,5% de los pacientes en prevención secundaria no afectos de HF (84,6% con intolerancia a estatinas).
Comparativa entre evolocumab y alirocumabDel total de pacientes con HF, 58 se encontraban a tratamiento con evolocumab, 16 con alirocumab y un paciente alternó tratamiento entre uno y otro fármaco, por lo que se excluyó del análisis.
La edad media al inicio del tratamiento fue de 57,5±11,2 años con evolocumab y de 59,6±7,4 con alirocumab (p=0,466), con distribución por sexo al 50% en ambos grupos. El 41,4% de los tratados con evolocumab se encontraban en prevención secundaria, frente al 25,0% de los tratados con alirocumab. El 27,6% de los tratados con evolocumab presentaban intolerancia a estatinas, frente al 50,0% de los tratados con alirocumab.
En el grupo tratado con evolocumab la mediana del cLDL antes de iniciar tratamiento era de 188,0mg/dl (141,3-228,5mg/dl), con una reducción del 68,1, del 57,4 y del 59,6% a los 2, 6 y 12meses, respectivamente. En los pacientes tratados con alirocumab la mediana del cLDL antes de iniciar tratamiento era de 177,0mg/dl (133,5-224,8) mg/dl, con una reducción del 53,1, del 45,8 y del 42,9% a los 2, 6 y 12meses, respectivamente. No se observaron diferencias estadísticamente significativas en la reducción de cLDL entre ambos fármacos a los 2meses (p=0,054) ni a los 12meses (p=0,105).
Ajuste de otros tratamientos hipolipemiantesDurante el seguimiento, el 77,6% de los pacientes (n=76) mantuvieron el mismo tratamiento hipolipemiante. Del 22,4% restante (n=22), se decidió disminuir el número de fármacos o la dosis de los mismos en 18pacientes. El fármaco retirado en el 61,2% de estos casos fue ezetimiba. Por otra parte, precisaron aumento en el número de fármacos o dosis 4pacientes, todos afectos de HF.
Efectos adversos e interrupción del tratamientoEl 4,1% (n=4) presentaron efectos adversos. Dos de ellos recibían tratamiento con evolocumab: uno presentó náuseas y astenia, que remitieron sin la suspensión del fármaco, y el otro un cuadro de urticaria-vasculitis que obligó a retirar el tratamiento. Los otros dos pacientes estaban en tratamiento con alirocumab: uno presentó un cuadro de malestar, taquicardia y diarrea a los pocos días de la administración del fármaco que conllevó su suspensión, y el otro presentó una reacción cutánea local en la zona de administración, por lo que se cambió el tratamiento a evolocumab.
En total, 4 pacientes cesaron el tratamiento con iPCSK9: tres por los efectos secundarios descritos y el otro paciente debido a respuesta insuficiente al tratamiento con evolocumab.
DiscusiónLa irrupción en el mercado de los iPCSK9 nos ha dado una alternativa para el tratamiento de la dislipemia en pacientes con HF o en prevención secundaria que no consiguen alcanzar los niveles objetivo de cLDL. Estos fármacos han conseguido reducciones marcadas de las cifras de cLDL, con descensos del cLDL del 48,8-59,2% en el caso de HF13-16 y del 41,8-66% en no afectos de HF10,17,18. En nuestra muestra de pacientes se han obtenido reducciones importantes en el cLDL. Esta reducción del cLDL es marcada desde los 2meses del comienzo del tratamiento con el fármaco, con descensos del 61,7% en el caso de HF y del 50,8% en los no HF (en ambos casos significativos). Únicamente se ha retirado el fármaco por falta de efectividad en un paciente. Este paciente tiene diagnóstico de HF, pero no disponemos de estudio genético para descartar una mutación en el receptor de la PCSK9. La reducción del cLDL se mantiene en nuestra muestra a lo largo del seguimiento a los 2años, al igual que en otros estudios a largo plazo, donde el efecto persiste tras un seguimiento de 4-5años13,15,19,20.
Como se observa en otras publicaciones17,21,22, en nuestro estudio el colesterol total muestra una reducción estadísticamente significativa a lo largo del seguimiento, observándose un descenso acusado ya desde el primer control. En el caso del cHDL y de los triglicéridos, en nuestro estudio se observan cambios significativos pero no consistentes, aunque en otros estudios se describe un aumento en los valores de cHDL22, acompañado de un descenso en el caso de los triglicéridos17,21,22.
Aunque en nuestro estudio no hemos analizado la presencia de nuevos eventos cardiovasculares, la principal ventaja de estos fármacos es que no solo han demostrado un descenso en las cifras de cLDL, sino que han conseguido una reducción en los eventos. Dos muestras de ello son el estudio FOURIER11, realizado con evolocumab, y el estudio ODYSSEY OUTCOMES23, realizado con alirocumab. En el estudio FOURIER, en el que se incluyeron pacientes en prevención secundaria en tratamiento optimizado con estatinas, se observó una reducción de las cifras de cLDL del 59% en la semana 48 de seguimiento y un descenso del 20% en la variable compuesta de primer infarto de miocardio, ictus o muerte cardiovascular a los 2,2años de seguimiento. En el estudio ODYSSEY OUTCOMES se incluyeron pacientes con antecedente de síndrome coronario agudo en tratamiento con dosis máxima de estatina. En este estudio la reducción de cLDL conseguida en la semana 56 de seguimiento fue del 61%, con un descenso del 15% del objetivo primario de muerte cardiovascular, infarto no fatal, ictus no fatal u hospitalización por angina inestable a los 2,8años de seguimiento.
Otra de las características de este grupo de fármacos son sus escasos efectos adversos24,25. En nuestro estudio solo han sufrido efectos secundarios un número muy reducido de pacientes, menos que en otros artículos publicados10,16,22, y ninguno de ellos graves. En la comparación entre evolocumab y alirocumab, en ambos casos se aprecia una reducción marcada de las cifras de cLDL, ligeramente superior en el caso de evolocumab pero sin alcanzar significación estadística. La única revisión hasta la fecha que compara la efectividad en la reducción de eventos cardiovasculares no encontró diferencias entre ambos fármacos26.
En nuestro estudio destaca el elevado número de pacientes que iniciaron iPCSK9 por intolerancia a las estatinas y/o a ezetimiba. Desconocemos el motivo que justifique este hecho, aunque una posibilidad es que al tratarse de pacientes de alto o muy alto riesgo cardiovascular precisan estatinas de alta potencia a dosis máximas. En otros estudios se han publicado cifras de intolerancia a estatinas del 25%16, frente al 44,9% en nuestro estudio.
En nuestra muestra se retiraron fármacos hipolipemiantes en un alto número de pacientes, especialmente ezetimiba, debido a mala tolerancia a los fármacos o tras alcanzar el objetivo de cLDL. Sin embargo, salvo en caso de intolerancia o contraindicación, se recomienda mantener el tratamiento hipolipemiante previo junto con los iPCSK9. Esto se debe a que, gracias a estudios como IMPROVE-IT6, sabemos que cuanto menor sea la cifra de cLDL, incluso en pacientes que ya se encuentren en su objetivo de cLDL, menor es el riesgo de eventos cardiovasculares. Puede surgir la duda sobre qué ocurre en casos en los que las cifras de LDL bajan de forma drástica, como ocurre en alguno de nuestros pacientes. Tanto evolocumab como alirocumab disponen de ensayos clínicos23,27,28 donde se demuestra que cifras bajas de cLDL no suponen efectos adversos.
El uso de los iPCSK9 nos ofrece la posibilidad de alcanzar los objetivos de cLDL planteados en las guías internacionales, como ocurre en nuestro estudio y como ya se demuestra en otras publicaciones previas15,29. Sin embargo, las limitaciones de prescripción y el escaso número de pacientes tratados aún hoy en día con estos fármacos hacen que sean poco conocidos entre otras especialidades. Teniendo en cuenta que muchos de los pacientes con HF o en prevención secundaria se encuentran en las consultas de atención primaria, es importante dar a conocer esta nueva familia de fármacos que han demostrado su efectividad y su perfil de seguridad y que son la única alternativa a aquellos pacientes que, a pesar de las estatinas y ezetimiba, no alcanzan su cLDL objetivo.
En el año 2019 se publicaron las nuevas recomendaciones de la Sociedad Española de Arteriosclerosis30 sobre las indicaciones de los iPCSK9 en la práctica clínica. Estas indicaciones difieren de los criterios de la CURMP en Asturias. Con la evidencia científica de que disponemos en la actualidad y con el apoyo de las recomendaciones de las sociedades científicas, se deberían valorar cambios en los criterios de prescripción.
Las limitaciones principales del estudio son su diseño retrospectivo, así como el pequeño tamaño muestral, que tiene que ver con el reducido volumen de pacientes aún en tratamiento en nuestra región. Por otro lado, en este estudio se han valorado las modificaciones en el perfil lipídico y la seguridad de los fármacos, pero sin contemplar eventos clínicos de enfermedad cardiovascular durante el seguimiento. Por último, otras limitaciones tienen que ver con la imposibilidad para conocer las mutaciones de los pacientes con HF u otros parámetros lipídicos como la lipoproteína a o la apolipoproteínaB. Sería interesante realizar futuros estudios en los que se valore la influencia de la genética en la respuesta al tratamiento o los cambios que se producen en estos otros parámetros del perfil lipídico.
ConclusiónEl uso de iPCSK9 en vida real demuestra ser un tratamiento efectivo en la reducción de cLDL que permite que un alto porcentaje de pacientes consigan alcanzar su objetivo de cLDL con un buen perfil de seguridad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.