La otitis media aguda es una patología infecciosa del oído medio muy frecuente. El diagnóstico es clínico, por lo que es fundamental un acucioso examen físico y una neumootoscopía para evaluar la movilidad timpánica. Hay dos tendencias respecto al manejo, tratamiento antibiótico inmediato u observación estricta (dependiendo de las características del paciente y del cuadro clínico). Los gérmenes más frecuentes son los virus, Neumococo, Haemophilus influenza y Moraxella catarrhalis. La prevalencia de cada uno de ellos varía según región geográfica y según la presencia de vacunación. La resistencia a antibióticos ha ido en aumento en estos años, pero aún puede considerarse sensible a amoxicilina por lo que se recomienda su uso como primera línea. En el caso de fracaso a tratamiento pueden utilizarse asociaciones con B-lactámicos y/o cefalosporinas, dejando en forma excepcional clindamicina o quinolonas. Aquellos niños con OMA recurrente requerirán evaluación por especialidad para mayor estudio y tratamiento.
Acute otitis media is a very frequent cause of medical visit and antimicrobial use in children. Clinical diagnosis should be performed with pneumatic otoscopy. Management of AOM requires a thorough clinical exam and updated knowledge of local patterns of microorganisms involved and antimicrobial susceptibility profiles, knowing that the presence of these microorganisms in AOM transtimpanic exudate cultures may vary depending on geographical areas and vaccination. AOM can be treated either with inmediate antibiotic or with observation depending on patients and clinical characteristics. The most common microorganism causing AOM are Pneumococcus, Haemophilus Influenzae, and Moraxella catarrhalis. S. pneumoniae has acquired resistance to penicillin in the last decade that cannot be extrapolated to Amoxicillin. Based on this data Amoxicillin is recommended as the first choice. For amoxicillin failure, cefalosporins or B lactamase can be prescribed. Patients that presents with recurrent AOM should be refered to otolaryngologist for further evaluation and treatment.
La otitis media aguda (OMA) corresponde a un proceso séptico-inflamatorio del recubrimiento mucoperióstico del oído medio y/o mastoides con acumulación de efusión retro timpánica. Habitualmente debido a etiología viral o bacteriana.
EPIDEMIOLOGÍALa OMA representa un serio problema de salud pública. Se estima que en la era pre-vacuna, un 80% de los niños menores de 5 años presentaba al menos un episodio de OMA 1. Actualmente se estima que la incidencia ha disminuido según diferentes publicaciones en cerca de un 17 a 19% de las consultas debido a esta causa 2 y un 34% en neonatos vacunados con 11 serotipos del neumococo asociado a una proteína portadora de haemophilus influenza 3. En reportes norteamericanos describen una disminución de las consultas por OMA de 950 por 1000 niños en 1995-1996 a 634 consultas por 1000 en 2005-2006 y una disminución en la indicación de antibióticos de 760 por 1000 a 484 por 1000 niños (aunque manteniéndose la tasa de prescripción de antibióticos por consulta en 80%) 5. La incidencia global de la otitis se estima en 10.85%, lo que corresponde a 709 millones de casos al año, de los cuales 51% es en niños menores de 5 años 6.
La incidencia global varía entre regiones siendo las que tienen menor incidencia Europa Central, con una incidencia de 3.64% (40% en niños entre 0-5 años), Asia Pacífico (3.75%), Este Asiático (3.93%), Europa del Este (3.96%) y Zona sur de América Latina (4.25%).
La incidencia es mayor en niños entre 1 y 4 años de edad (60.99%) y los menores de 1 año (45.28%). Los índices más altos de incidencia en niños entre 1 y 4 años los tienen África subsahariana oeste (154.12%), África subsahariana central (143%) y Oceanía (114.98%), lo que significa más de 1 episodio por niño al año.
En este grupo etario destaca la baja incidencia de 4 zonas en particular, la región latinoamericana andina que presenta una incidencia de sólo 29.39% y la región Latinoamérica sur 25.56%, así como las regiones de Asia Pacífico que tiene una incidencia de 24.21% y la región del este de Asia con 27.38%.
Así como existen algunas poblaciones especialmente susceptibles a la OMA como son los esquimales, aborígenes australianos y norteamericanos 6, encontramos otras poblaciones con menos predisposición a esta como son los residentes de Isla de Pascua 7.
FISIOPATOLOGÍALa patogénesis es multifactorial, jugando un rol primordial la ventilación de la trompa de Eustaquio, la madurez del sistema inmune del niño y factores ambientales.
El mecanismo por el que ocurre una otitis media aguda bacteriana habitualmente está dado por inflamación de la trompa de Eustaquio debido a un cuadro respiratorio alto, luego existe colonización de la trompa por gérmenes de la rinofaringe, los cuales alcanzan el oído medio (mecanismo fue demostrado por Bluestone en 1978 8, mediante cultivos concomitantes de rinofaringe y de oído medio en otitis media en los cuales los gérmenes presentes son idénticos, teniendo en cuenta que en condiciones fisiológicas normales, el oído es una cavidad estéril). La llegada de los microorganismos a la trompa y oído medio provocan una reacción inflamatoria con liberación de interleukinas las que provocaran vasodilatación exudado e infiltración leucocitaria, provocando aumento de la presión retro timpánica, hiperemia del tímpano lo cual provoca dolor. Si este proceso persiste puede ocurrir una perforación timpánica por la que se exterioriza exudado dando origen a la otorrea.
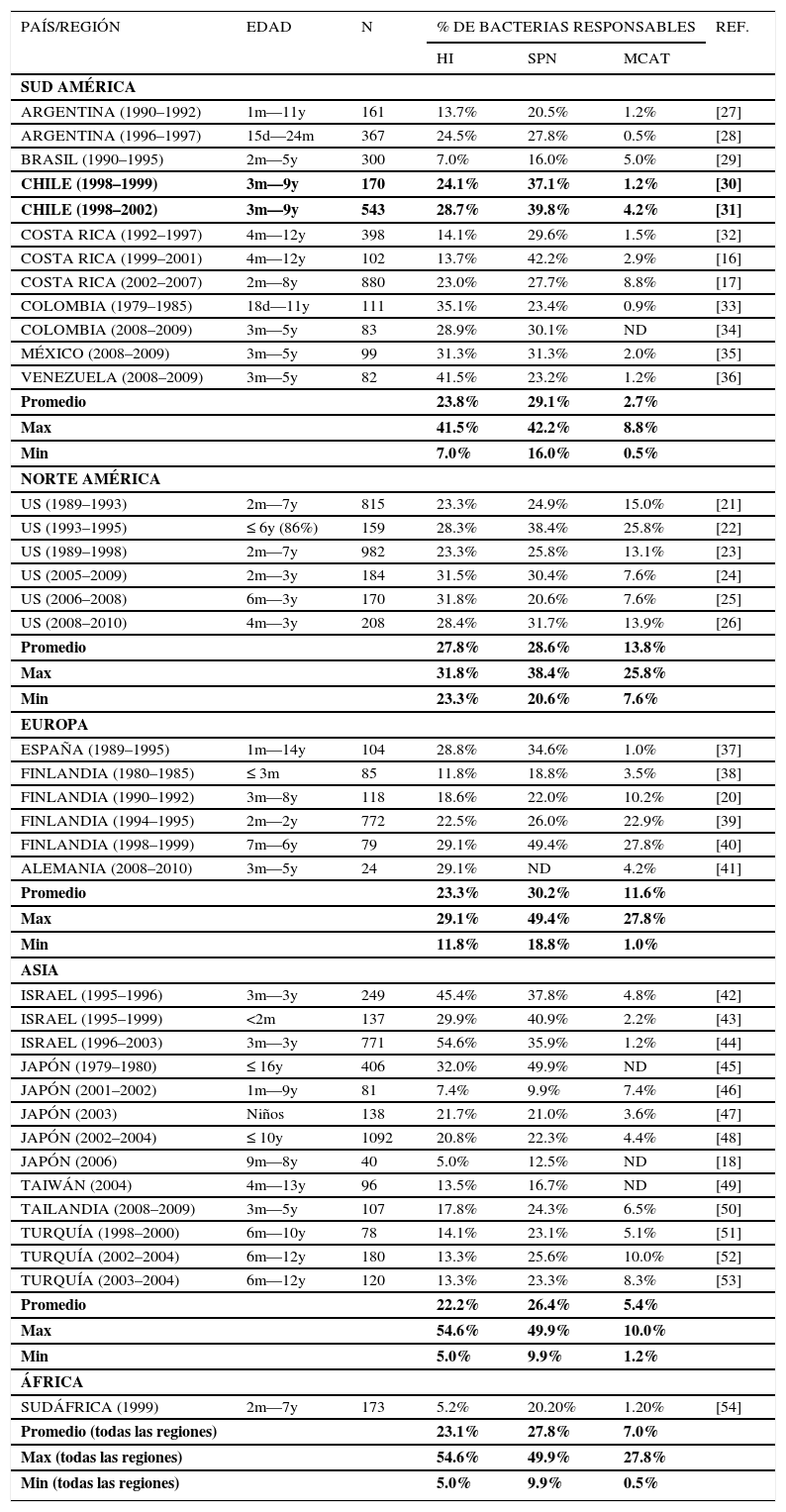
ETIOLOGÍALa causa más frecuente es viral, siendo los virus habituales como el virus respiratorio sincicial, adenovirus, rinovirus, coronavirus e influenza 9–11. En los cultivos y PCR de exudado de OM (obtenidos de otorrea y mediante miringocentesis) se obtienen cultivos positivos para Streptococo pneumoniae, Hemophilus influenza, Moraxella catarrhalis y Streptococo pyogenes. La prevalencia de cada una de estos gérmenes varía de acuerdo a la región que se estudie y la presencia de vacunación masiva (Tablas 1 y 2) 3,9,10,12,13. Efectivamente se han reportado variaciones en la presencia de Hemophilus versus Pneumococo y de los serotipos de Pneumococo no incluidos en la vacuna que se cultivan del exudado de niños con OMA y en enfermedad invasiva en aquellos países con planes de vacunación masiva para estos gérmenes como España 14, Francia 15 y Estados Unidos 16. Esto lleva a cuestionarse como será el comportamiento de esta enfermedad con los nuevos gérmenes detectados y nos debe llevar a tener un comportamiento inquisitivo acerca del manejo y evaluación constante de las recomendaciones y guías de manejo.
MICROBIOLOGÍA DE OTITIS MEDIA AGUDA
| AMÉRICA DEL NORTE1 | CHILE 20012 | CHILE 20073 | |
|---|---|---|---|
| Streptococo pneumoniae | 50% | 37% | 40% |
| Resistencia a PNC | 15 A 50% | 40% | 18% |
| Hemophilus influenzae | 15 A 30% | 24% | 29% |
| Productor de betalactamasa | 50% | 10% | 10% |
| Moraxella Catarrhalis | 3 A 20% | 1% | 4% |
| Producción betalactamasa | 100% | - | 100% |
| Streptococo pyogenes | - | 13% | 7% |
1 Subcommitee on Management of acute Otitis Media. Diagnosis and Management of Acute Otitis Media. Pediatrics 2004; 113(5)1451-1465.
2 Rosenblut A, Santolaya ME, Gonzalez P, et al Bacterial and viral etiology of acute otitis media in Chilean children. Pediatr Infect dis J.2001;20(5):501-7.
3 Santolaya ME, Otitis media aguda. Diagnóstico y tratamiento. Rev Chil Infect 2007; 24 (4): 297-300.
BACTERIOLOGÍA DETECTADA EN EFUSIÓN DE PACIENTES CON OMA
| PAÍS/REGIÓN | EDAD | N | % DE BACTERIAS RESPONSABLES | REF. | ||
|---|---|---|---|---|---|---|
| HI | SPN | MCAT | ||||
| SUD AMÉRICA | ||||||
| ARGENTINA (1990–1992) | 1m—11y | 161 | 13.7% | 20.5% | 1.2% | [27] |
| ARGENTINA (1996–1997) | 15d—24m | 367 | 24.5% | 27.8% | 0.5% | [28] |
| BRASIL (1990–1995) | 2m—5y | 300 | 7.0% | 16.0% | 5.0% | [29] |
| CHILE (1998–1999) | 3m—9y | 170 | 24.1% | 37.1% | 1.2% | [30] |
| CHILE (1998–2002) | 3m—9y | 543 | 28.7% | 39.8% | 4.2% | [31] |
| COSTA RICA (1992–1997) | 4m—12y | 398 | 14.1% | 29.6% | 1.5% | [32] |
| COSTA RICA (1999–2001) | 4m—12y | 102 | 13.7% | 42.2% | 2.9% | [16] |
| COSTA RICA (2002–2007) | 2m—8y | 880 | 23.0% | 27.7% | 8.8% | [17] |
| COLOMBIA (1979–1985) | 18d—11y | 111 | 35.1% | 23.4% | 0.9% | [33] |
| COLOMBIA (2008–2009) | 3m—5y | 83 | 28.9% | 30.1% | ND | [34] |
| MÉXICO (2008–2009) | 3m—5y | 99 | 31.3% | 31.3% | 2.0% | [35] |
| VENEZUELA (2008–2009) | 3m—5y | 82 | 41.5% | 23.2% | 1.2% | [36] |
| Promedio | 23.8% | 29.1% | 2.7% | |||
| Max | 41.5% | 42.2% | 8.8% | |||
| Min | 7.0% | 16.0% | 0.5% | |||
| NORTE AMÉRICA | ||||||
| US (1989–1993) | 2m—7y | 815 | 23.3% | 24.9% | 15.0% | [21] |
| US (1993–1995) | ≤ 6y (86%) | 159 | 28.3% | 38.4% | 25.8% | [22] |
| US (1989–1998) | 2m—7y | 982 | 23.3% | 25.8% | 13.1% | [23] |
| US (2005–2009) | 2m—3y | 184 | 31.5% | 30.4% | 7.6% | [24] |
| US (2006–2008) | 6m—3y | 170 | 31.8% | 20.6% | 7.6% | [25] |
| US (2008–2010) | 4m—3y | 208 | 28.4% | 31.7% | 13.9% | [26] |
| Promedio | 27.8% | 28.6% | 13.8% | |||
| Max | 31.8% | 38.4% | 25.8% | |||
| Min | 23.3% | 20.6% | 7.6% | |||
| EUROPA | ||||||
| ESPAÑA (1989–1995) | 1m—14y | 104 | 28.8% | 34.6% | 1.0% | [37] |
| FINLANDIA (1980–1985) | ≤ 3m | 85 | 11.8% | 18.8% | 3.5% | [38] |
| FINLANDIA (1990–1992) | 3m—8y | 118 | 18.6% | 22.0% | 10.2% | [20] |
| FINLANDIA (1994–1995) | 2m—2y | 772 | 22.5% | 26.0% | 22.9% | [39] |
| FINLANDIA (1998–1999) | 7m—6y | 79 | 29.1% | 49.4% | 27.8% | [40] |
| ALEMANIA (2008–2010) | 3m—5y | 24 | 29.1% | ND | 4.2% | [41] |
| Promedio | 23.3% | 30.2% | 11.6% | |||
| Max | 29.1% | 49.4% | 27.8% | |||
| Min | 11.8% | 18.8% | 1.0% | |||
| ASIA | ||||||
| ISRAEL (1995–1996) | 3m—3y | 249 | 45.4% | 37.8% | 4.8% | [42] |
| ISRAEL (1995–1999) | <2m | 137 | 29.9% | 40.9% | 2.2% | [43] |
| ISRAEL (1996–2003) | 3m—3y | 771 | 54.6% | 35.9% | 1.2% | [44] |
| JAPÓN (1979–1980) | ≤ 16y | 406 | 32.0% | 49.9% | ND | [45] |
| JAPÓN (2001–2002) | 1m—9y | 81 | 7.4% | 9.9% | 7.4% | [46] |
| JAPÓN (2003) | Niños | 138 | 21.7% | 21.0% | 3.6% | [47] |
| JAPÓN (2002–2004) | ≤ 10y | 1092 | 20.8% | 22.3% | 4.4% | [48] |
| JAPÓN (2006) | 9m—8y | 40 | 5.0% | 12.5% | ND | [18] |
| TAIWÁN (2004) | 4m—13y | 96 | 13.5% | 16.7% | ND | [49] |
| TAILANDIA (2008–2009) | 3m—5y | 107 | 17.8% | 24.3% | 6.5% | [50] |
| TURQUÍA (1998–2000) | 6m—10y | 78 | 14.1% | 23.1% | 5.1% | [51] |
| TURQUÍA (2002–2004) | 6m—12y | 180 | 13.3% | 25.6% | 10.0% | [52] |
| TURQUÍA (2003–2004) | 6m—12y | 120 | 13.3% | 23.3% | 8.3% | [53] |
| Promedio | 22.2% | 26.4% | 5.4% | |||
| Max | 54.6% | 49.9% | 10.0% | |||
| Min | 5.0% | 9.9% | 1.2% | |||
| ÁFRICA | ||||||
| SUDÁFRICA (1999) | 2m—7y | 173 | 5.2% | 20.20% | 1.20% | [54] |
| Promedio (todas las regiones) | 23.1% | 27.8% | 7.0% | |||
| Max (todas las regiones) | 54.6% | 49.9% | 27.8% | |||
| Min (todas las regiones) | 5.0% | 9.9% | 0.5% | |||
a: d = día; m = mes; y = año;
b: Hi: H. influenzae; Spn: S. pneumoniae; Mcat: M. catarrhalis;
ND: No detectado
Reproducido y traducido de Chinh C. Ngo, Helen M. Massa, Ruth B. Thornton, and Allan W. Cripps. Predominant Bacteria Detected from the Middle Ear Fluid of Children Experiencing Otitis Media: A Systematic Review, PLoS One. 2016; 11(3):e0150949.
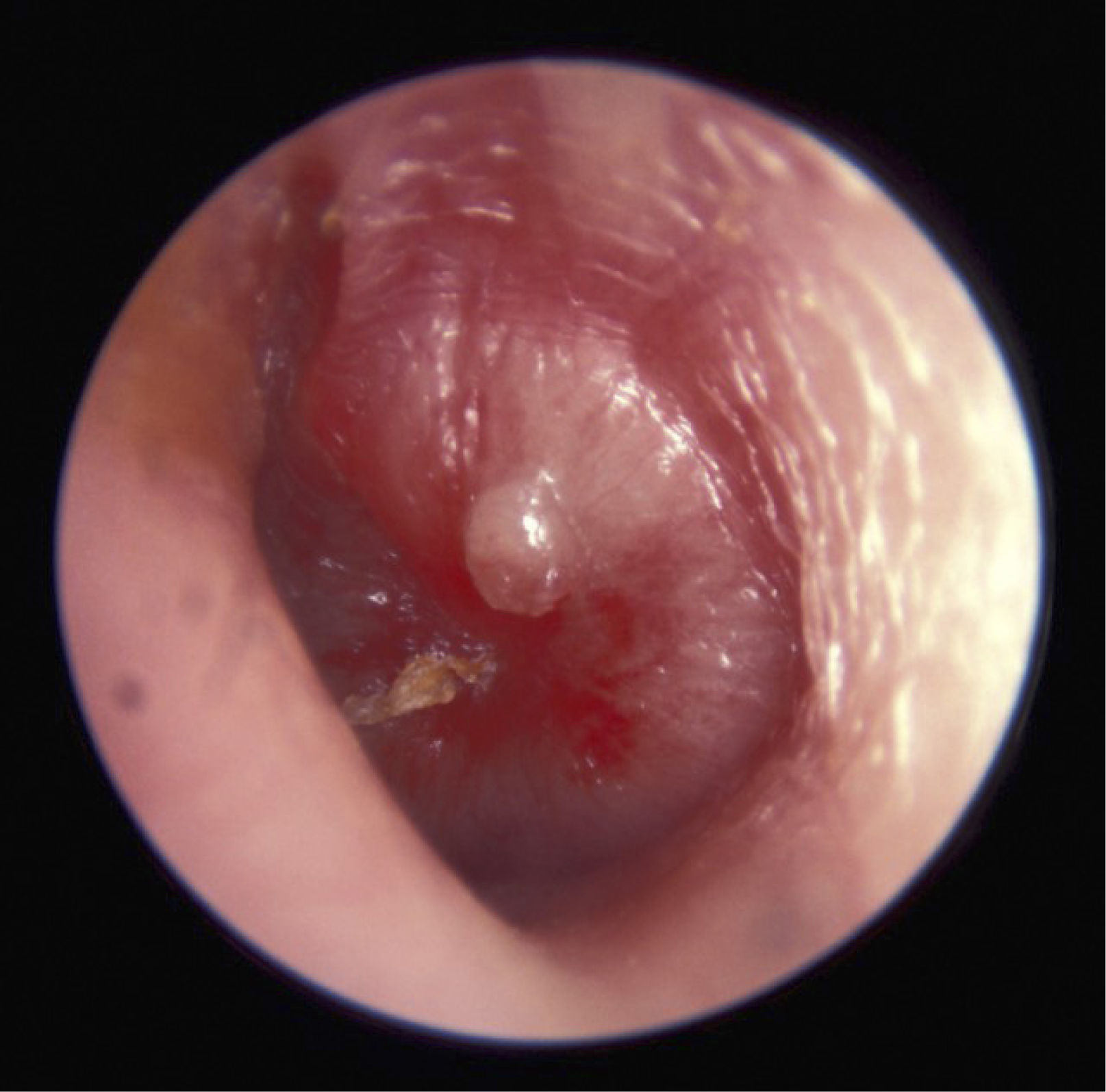
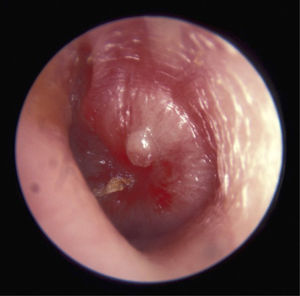
Se manifiesta como otalgia asociada a signos inflamatorios, con o sin hipertermia, frecuentemente durante la evolución de una infección respiratoria viral. Los síntomas más frecuentes son otalgia, fiebre e irritabilidad; y los signos clásicos son otorrea y/o inflamación de la membrana timpánica, engrosamiento y/o abombamiento de esta, opacidad, presencia de bulas (miringitis bulosa), coloración blanco amarillenta y ausencia de movimiento a la neumotoscopia.
Aunque pareciera ser un diagnóstico fácil, destacan reportes de error diagnóstico en la realidad chilena de 56% de 529 niños diagnosticados como OMA en el servicio de urgencias que fueron derivados para ser diagnosticados por especialista (44% tuvo una OMA confirmada por neumotoscopia y punción timpánica, 34% presentaron otoscopia normal, 14% presentaron otitis media aguda con efusión, 5% otitis media crónica y 3% otitis externa) 9. Esta realidad se repite en diversos países por lo que la American Academy of Pediatrics asociado a la American Academy of Family Physicians el año 2004 presentaron guías clínicas para diagnóstico y tratamiento de la OMA, que fue revisada y mejorada el año 2013 3,12,17.
En cuanto al diagnóstico, la recomendación es: “el clínico debe confirmar historia de comienzo agudo identificando signos de efusión en el oído medio y evaluar la presencia de signos y síntomas de inflamación del oído medio”. Si bien esta afirmación ha sido revisada, sigue siendo la más aceptada para el diagnóstico (Tabla 3). Sin embargo, no hay que olvidar que el examen físico es crucial para el diagnóstico incluyendo la otoscopía y la neumo-otoscopía que permite evaluar la movilidad timpánica.
DEFINICIÓN Y ELEMENTOS DIAGNÓSTICOS DE OMA
| Diagnóstico de OMA requiere: |
|---|
| 1. Historia de inicio agudo 2. Presencia de exudado en oído medio 3.Signos y síntomas de inflamación del oído medio |
| Los elementos que definen una OMA son: 1. Inicio abrupto y reciente de inflamación y exudado en oído medio 2. La presencia de exudado en oído medio es sospechada por: Abombamiento de la membrana timpánica, movilidad de la membrana limitada o ausente, nivel de líquido/aire retrotimpánico u otorrea. 3. Signos o síntomas de inflamación de oído medio Eritema de la membrana timpánica. |
Buscando cuáles son los indicadores a la otoscopía que mejor se correlacionan con OMA se realizó un estudio que realizó seguimiento a 2911 niños de 2 localidades en Finlandia entre los 6 meses y 2.5 años. El seguimiento fue realizado por un solo pediatra y un solo otorrino. Se registraron 11804 visitas 18 y se consignó color, posición y movilidad de MT (membrana timpánica). Si había sospecha de efusión retro timpánica se realizó miringocentesis. Cuando se confirmaba la presencia de exudado y el paciente presentaba síntomas agudos se realizaba el diagnóstico de OMA. Esto se correlacionó además con los hallazgos a la neumootoscopía (en cuanto a color: hemorrágico, muy rojo, moderadamente rojo, “nuboso”, inflamación difusa, levemente rojo o normal; según posición de la MT: abombado, retraído o normal y según su movilidad: claramente alterada, levemente alterada o normal. Lo primero que llamó la atención fue la variabilidad de apreciación que presentaban ambos observadores al examen físico. Sin embargo, logró concluir que los hallazgos más significativos son:
- •
Movilidad alterada (neumo-otoscopía). Sensibilidad 95%, especificidad 85%.
- •
Tímpano nuboso “cloudy”. Sensibilidad 74%, especificidad 93%.
- •
Tímpano Abombado. Sensibilidad 51%, especificidad 97%.
- •
La presencia de tímpano muy rojo o moderadamente rojo, también se correlaciona con OMA, pero levemente enrojecido no.
Si correlacionamos los hallazgos a la otoscopía con la etiología viral o bacteriana hallamos algunas publicaciones que demuestran que encontrar un tímpano abombado se correlaciona con cultivos bacterianos positivos a la miringocentesis en un 75% de los casos, lo cual aumenta a 80% si además la MT es amarilla 19.
Evolución ClínicaLa OMA tiende evolucionar hacia la resolución espontánea hasta en 60% de los casos, por lo que antaño se desarrollaron diversos protocolos de manejo conservador y observación de estos cuadros en pacientes de bajo riesgo susceptibles a ser observados 11,12,17,20. Sin embargo, puede tener complicaciones muy severas tanto intrapetrosas en 0.24% de los casos (mastoiditis, laberintitis, parálisis facial) 21,22, como meningoencefálicas aguda (meningitis, abscesos extradurales y abscesos cerebrales) en 0.2% de los casos cursando mastoiditis. Estas fueron muy frecuentes en la era preantibiótica (2%) 21,22.
TRATAMIENTOEl dolor suele ser muy intenso e invalidante y suele provocar angustia en el paciente y en los familiares por lo que debe ser evaluado y manejado. Se recomienda prescribir analgésicos ya sea que se va a comenzar con terapia antibiótica o no. Los analgésicos con más estudios para otitis son el acetaminofeno e ibuprofeno 23.
En un reporte doble ciego, randomizado, controlado con placebo se encontró disminución significativa de la otalgia en los grupos que recibieron paracetamol o ibuprofeno. Este último logró mejor resultado en cuanto a la persistencia del dolor en los días siguientes (7% de los pacientes que recibieron ibuprofeno vs 10% paracetamol y 24% placebo; p<.01)23,24.
Existen además algunos reportes que favorecen el uso de gotas tópicas o naturopáticas, sin embargo, diversas revisiones de medicina basada en evidencia del grupo Cochrane, concluyen que no hay suficiente evidencia para indicarlas como tratamiento de elección 23,25,26.
Los analgésicos opioídes son una alternativa para otalgias muy intensas, pero por sus efectos secundarios y los riesgos de depresión respiratoria, especialmente en niños, hacen desaconsejable su utilización como primera línea, excepto en condiciones que el clínico lo estime, sopesando los riesgos versus beneficios.
No existe consenso en el uso de antibióticos en esta enfermedad dado que con frecuencia es autolimitado y cursa con pocas complicaciones. Sin embargo, dado que las complicaciones pueden ser graves, hay muchas revisiones en curso para definir qué pacientes son susceptibles de ser observados y cuáles deben recibir antibióticoterapia y cuál antibiótico debe prescribirse.
En la revisión del consenso de AAP del 2013 de manejo en otitis media aguda 3 destaca como sugerencia que deben tratarse con antibióticos los pacientes menores de 6 meses, aquellos que cursen con otitis severa (pacientes con otitis media aguda bilateral o unilateral, con otalgia moderada o severa de más de 48 horas de evolución y fiebre mayor o igual a 39° C, niños menores de 24 meses con otitis media aguda bilateral no severa (otalgia leve <48 horas con fiebre <39°C). Se justifica este manejo dado que aumenta la probabilidad de resolución de los síntomas y de la OMA, disminuyendo el riesgo de complicaciones comparado con los riesgos asociados a antibióticos (diarrea, dermatitis del pañal, costos y resistencia antibiótica).
Se define al grupo susceptible de ser observados o tratados inicialmente con antibióticos, aquellos pacientes entre 6 y 23 meses con OMA unilateral leve (otalgia leve <48 horas y T° <39°C) y los pacientes mayores de 24 meses con OMA uni o bilateral sin síntomas de severidad. Esta decisión debe ser previamente discutida con los cuidadores del niño y debe asegurarse un adecuado acceso a control y seguimiento por parte del paciente, así como el entendimiento de que eventualmente requiera uso de antibióticos si el cuadro no se resuelve o empeora en las próximas 48-72 horas 3.
Los beneficios que tiene el uso inicial de antibióticos han sido bien documentados con aumento en las mejorías clínicas entre 26 a 35% de los pacientes al compararlos con placebo, siendo más marcados en pacientes con otitis media aguda bilateral y en aquellos con otorrea. También disminuye la duración del dolor, disminuye la necesidad de analgésicos y reduce la ausencia escolar 3,27,28. Estudios demuestran que los niños menores de 2 años se beneficiarían más de antibióticos dado que la otitis en este grupo etáreo tiende a durar más tiempo, con lo que con el tratamiento se reduciría el período de estado 29.
Se considera como antibiótico de primera línea la Amoxicilina en dosis de 80-100mg/kg/día cada 12 horas (para mantener durante al menos un 40% del tiempo presenta una concentración >Cim90), siempre y cuando el niño no haya recibido amoxicilina en los últimos 30 días ni presenta conjuntivitis concurrente o sea alérgico a penicilina. El uso de amoxicilina, se ve avalada en estudios que revelan que la resistencia a la PNC no es extrapolable a la AM en dosis de 80-100mg/Kg/d. En nuestra realidad en un estudio realizado en 187 cultivos de efusión de pacientes con OMA positivo para Streptococo Pneumoniae se observó resistencia a PNC en 18% de los cultivos, resistencia intermedia en 22% y sensibilidad en 60%. Al comparar la sensibilidad con AMX destaca que sólo 0,5% era resistente, 4,8% tenía resistencia intermedia y 94% era sensible. Lo que avala el uso de esta como antibiótico de primera línea. Aunque debemos estar alerta ya que podemos suponer que 2.9% de las infecciones pueden corresponder a Hemophilus productores de B lactamasa y 4% de Moraxella, dando un total de 7% de resistencia 3,9,10.
Como alternativa al tratamiento inicial, ante falla de éste o agravamiento en las 72 horas siguientes al inicio, o recaída en los primeros 7 días de tratamiento, debe proponerse el uso de amoxicilina más inhibidores de B-lactamasa (amoxicilina 90mg/Kg/d con 6.4mg/kg/d de clavulánico) en 2 dosis o cefalosporinas de segunda generación (cefdinir 14mg/kg/d en 1 o 2 dosis, cefuroximo 30mg/kg/d en 2 dosis, cefpodoximo 10mg/kg/d en 2 dosis o ceftriaxona 50/mg/kg/d intramuscular por 3 días), o en caso de sospecha de prevalencia de H. influenzae productor de b lactamasa o M. Catarrhalis3,9. Ante el fracaso a tratamiento puede plantearse el uso off label (no autorizado por la FDA de levofloxacino si han fracasado otros esquemas antibióticos, sospechando la presencia de Streptococo del serotipo 19ª que es multirresistente 3.
En aquellos alérgicos a penicilina se puede plantear el uso de macrólidos, teniendo en cuenta que en nuestro medio cerca del 10% de los S. Pneumoniae tendrán resistencia y que este antimicrobiano tiene pobre acción frente a H. Influenzae3,9. El uso de sulfametoxazol trimetroprim no está aconsejado ya que hay muy alta resistencia de los patógenos habituales a este. El uso de clindamicina es bastante controversial por la resistencia que presentan estos gérmenes a este antimicrobiano. Sin embargo, la recomendación actual es revisar el antecedente de alergia y si la reacción no ha sido severa y el antecedente de alergia es dudoso el American Academy of Allergy, Asthma and Immunology y American College of Allergy, Asthma and Immunology, en su publicación acerca de alergia drogas plantean que solamente un 0.1% presentará reacción cruzada con penicilinas al usar cefalosporinas, por lo que la recomendación sería sopesar el riesgo de indicar alguna cefalosporina ante fracaso de tratamiento con amoxicilina 3,30.
La duración del tratamiento es otro punto controvertido, se recomienda el uso de 10 días en menores de 2 años. En aquellos con OMA leve a moderada, con edades entre 2 a 5 años, un tratamiento de 7 días ha demostrado ser tan eficiente como el de 10 días y en niños mayores de 6 años con OMA leve a moderada puede plantearse tratamiento de 5 a 7 días 3.
En cuanto al seguimiento, es importante destacar que 0 a 70% tendrá exudado retro timpánico dos semanas después de un tratamiento exitoso con antibióticos, 40% al mes y 10 a 25% a los 3 meses. La presencia de este, en ausencia de signos infecciosos, se denomina otitis media con efusión (OME), esta debe ser reevaluada y debe mantener seguimiento hasta que se solucione, ya que trae acompañada hipoacusia con retraso en el desarrollo cognitivo y desempeño académico.
OTITIS MEDIA AGUDA RECURRENTESe define como la presencia de 3 o más episodios de otitis media aguda en 6 meses, o más de 4 en 1 año, con mejoría total entre eventos y sin exudado entre los episodios. Es más frecuente en niños menores de 36 meses. Cada recurrencia debe tratarse individualmente con antibióticos y las recurrencias tienden a disminuir con la edad. Esta característica se denomina predisposición a la otitis y está asociada a múltiples factores como: deficiencias inmunológicas subclínicas, alteraciones en la síntesis de IgA secretora nasofaríngea o IgG específica sistémica, colonización bacteriana de la nasofaringe, e incluso alergias alimentarias 3.
Las intervenciones para evitar la recurrencia incluyen la timpanostomía y los tubos de ventilación timpánica. En una revisión de MBE se mostró una disminución promedio de 1.5 eventos de OMA hasta 6 meses post colocación de tubos de ventilación 31 y una franca mejoría en la calidad de vida de estos pacientes 32. Otra recomendación son las inmunizaciones contra la influenza, el Neumococo y Hemophilus influenza. La vacuna conjugada para Neumococo ha demostrado una disminución de 6.7% de los episodios de OMA por cualquier germen, un 20% de los episodios por Streptococo neumoniae y una reducción de hasta un 40% de las consultas por OMA 3,33,34. Si bien, por el cambio de cepas que se presentan en las otitis, se espera que esta eficacia vaya disminuyendo, cabe recomendar la inmunización en estos niños. La vacuna para Influenza ha demostrado una disminución de 30 a 55% de los episodios durante el período de infecciones respiratorias estacionales 3,35.
Otros factores protectores son lactancia materna por lo menos hasta los 6 meses de edad, evitar la exposición al humo de tabaco y últimamente se ha agregado una nueva recomendación, que es el uso de goma de mascar con xylitol que ha demostrado una reducción del riesgo de OMA con un riesgo relativo de 0.75 (IC de 95%) 3, para esto debe ser usado 3 a 5 veces al día durante el período de peak de infecciones respiratorias. Sin embargo, el uso de chicle en menores de 3 años (que son la población en riesgo) pone en duda esta recomendación.
SÍNTESISLa OMA es una patología infecciosa de oído media muy frecuente, con alta tendencia a la resolución espontánea, pero con complicaciones graves y letales en caso de presentarse. La etiología ha ido variando con los años y con las inmunizaciones, por lo que se requiere una actualización y vigilancia constante de las guías de manejo según la incidencia, los patógenos y su resistencia bacteriana.
El autor declara no tener conflictos de interés, en relación a este artículo.