El concepto de medicina personalizada actualmente es de uso habitual en el ámbito de la medicina, incluyendo la medicina nuclear, en la que se utilizan radiotrazadores que se fijan a blancos moleculares específicos según la clínica o patología del paciente. La obtención de imágenes que confirman la fijación de un trazador en un tejido tumoral en forma específica abre la posibilidad de utilizar ese mismo trazador para fines terapéuticos. Lo anterior se logra al reemplazar el isótopo radioactivo por uno de mayor capacidad ionizante efectuando radioterapia dirigida molecularmente. Este concepto de teranóstica (terapia y diagnóstico) se utiliza en distintas condiciones en las cuales la medicina nuclear con moléculas radiomarcadas juega un rol destacado. El presente artículo tiene como objetivo revisar estas condiciones: patología tiroidea con yodo; tumores neuroendocrinos con análogos de somatostatina y cáncer de próstata con antígeno prostático específico de membrana (PSMA).
Tailored medicine is a customary concept in current medical practice, including nuclear medicine, which uses radiotracers that bind to specific molecular targets according to a patient's clinical situation or pathology. Once molecular images confirm high tumoral uptake of a specific radiotracer, a therapeutic option becomes available by replacing the radioactive isotope for another radioactive molecule, with higher ionizing capacity. This allows molecular guided radiotherapy, also known as theranostics (therapy and diagnostic), to be used in different pathologies where nuclear medicine plays an important role. The aim of this review will be to explore the following conditions: thyroid diseases and radioiodine; neuroendocrine tumors and radiolabeled somatostatin analogues; and prostatic cancer and radiolabeled prostatic specific membrane antigen (PSMA).
Tradicionalmente la medicina nuclear emplea radiotrazadores con el fin de visualizar, a través de un detector de radiación, el recorrido y/o distribución del radiotrazador en un órgano o sistema específico. Un radiotrazador se compone de un isótopo radioactivo y una molécula que sigue un camino fisiológico definido en el organismo. Este principio ha sido utilizado en medicina por décadas en múltiples patologías, siendo las “imágenes funcionales” que aporta la medicina nuclear empleadas rutinariamente para evaluar la actividad osteoblástica esquelética con los cintigramas óseos, la presencia de isquemia coronaria con la cintigrafía de perfusión miocárdica, la función renal con cintigrafías renales, entre muchas otras. En las últimas décadas y gracias a importantes avances tecnológicos se ha mejorado en la sensibilidad de estas técnicas, tanto por mejoría en la resolución de los detectores como por aparición de nuevas modalidades híbridas. Estas combinan las técnicas de medicina nuclear de tomografía computada por emisión de fotón único (SPECT) y tomografía por emisión de positrones (PET) con las de radiología: tomografía computada (CT) y resonancia magnética (RM), impactando especialmente al ámbito oncológico. La detección de tumores mediante la técnica PET/CT, así como la evaluación precoz de la respuesta tumoral a terapias, ha significado un cambio en conducta y manejo clínico relevante, que ha posicionado rápidamente esta técnica en la gran mayoría de guías internacionales de manejo de diversos tumores.
Además del aporte de las imágenes diagnósticas de carácter funcional, también existe un uso terapéutico de los isótopos radioactivos. El tipo de radiación que se utiliza para poder generar la gran mayoría de las imágenes en medicina nuclear proviene de los fotones gamma emitidos de los núcleos inestables de diferentes isótopos usados, siendo el más común el Tecnecio 99m (99mTc). Estos fotones mayoritariamente atraviesan los tejidos y pueden ser absorbidos por los equipos de detección (gammacámaras y/o equipos PET) y de esa forma obtener imágenes representativas de su distribución en el cuerpo. Algunos isótopos además emiten radiaciones alfa y beta, partículas subatómicas altamente energéticas, que interactúan con la materia en mucho mayor grado, por lo que se generan importantes efectos biológicos en el caso de células y tejidos expuestos a este tipo de partículas. Este principio se ha utilizado en medicina nuclear para dirigir isótopos (por si solos o unidos a moléculas específicas) a tejidos tumorales o en algunos casos a tejidos hiperfuncionantes de modo que absorban este alto nivel de radiaciones ionizantes y así lograr la destrucción celular con objetivo terapéutico, sin afectar significativamente los tejidos circundantes.
Hace unos años se empezó a utilizar el término teranóstico para definir un concepto que se basa en el uso de trazadores que apuntan a blancos moleculares específicos que se marcan con isótopos radioactivos, utilizando isótopos emisores gamma para imágenes diagnósticas y posteriormente marcar la misma molécula con un emisor beta o alfa y así lograr un efecto terapéutico1. Esta modalidad de trabajo implica una demostración de la distribución específica de la molécula en la fase diagnóstica que avala el posterior uso del isótopo terapéutico ya que sigue el mismo recorrido y distribución.
2Radioyodo, ¿el primer uso teranóstico?Algunos de los isótopos radioactivos del yodo se utilizan en medicina desde hace décadas para el manejo de patologías como el hipertiroidismo y el cáncer diferenciado de tiroides. Se ha descrito el efecto de los destilados de algas marinas en el manejo del bocio en la medicina tradicional china desde hace milenios. A comienzos del siglo XIX se aisló el yodo de estas algas y se comenzó a utilizar como terapia dirigida en los bocios. En la década de 1930-1940 se logró la producción de isótopos radioactivos del yodo como el 128I y el 131I2, y pasaron pocos años para que se publicaran los primeros reportes del uso terapéutico de estas moléculas para el manejo de pacientes con hipertiroidismo3–6 y posteriormente para el manejo de metástasis funcionantes de cáncer tiroideo7. Desde entonces los diferentes radioisótopos del yodo se han utilizado ampliamente en patología tiroidea, tanto en diagnóstico como terapia, siendo el 131I el más utilizado globalmente dada su producción a gran escala en los reactores nucleares, su vida media cercana a los 8 días que posibilita su distribución mundial y la emisión de fotones gamma y partículas beta que permiten obtener imágenes y efectos terapéuticos respectivamente. La decisión de tratar con radioyodo a pacientes portadores de hipertiroidismo derivó de la confirmación mediante técnicas diagnósticas de la concentración elevada del trazador en el parénquima tiroideo, tanto por imágenes (cintigramas) y/o mediante el cálculo de captación tiroidea de pequeñas trazas de radioyodo.
El concepto de teranóstica con radioyodo es quizás más evidente en el manejo del cáncer diferenciado de tiroides (CDT). Los pacientes que luego de la tiroidectomía total por cáncer diferenciado de tiroides tienen indicación de terapia adyuvante para disminuir el riesgo de recurrencia, idealmente debieran realizarse un estudio de imágenes con isótopos como el 123I (emisor gamma puro) o 124I (emisor de positrones) con técnicas SPECT/CT y PET/CT respectivamente y así poder demostrar la cantidad de tejido tiroideo remanente en el lecho quirúrgico, así como las posibles metástasis. Estas imágenes, además de la confirmación de tejido tiroideo funcionante ávido de yodo, proveen de información que permite el cálculo dosimétrico para poder entregar una dosis terapéutica individualizada del 131I y así evitar irradiación innecesaria del paciente8,9. Ambos isótopos (123I e 124I) son de alto costo y no están disponibles en Chile ni en gran parte de Latinoamérica, por lo que la demostración de la captación terapéutica se realiza con imágenes cintigráficas posteriores a la administración de las dosis empíricas de 131I.
Otra situación es cuando en el seguimiento de estos pacientes se sospecha presencia de recidiva y se puede realizar una cintigrafía con dosis bajas de 131I (no terapéuticas) y en caso de confirmarse la captación del radioyodo en la recidiva, se administra una dosis mayor con fines terapéuticos.
El uso terapéutico del radioyodo en CDT ha sido ampliamente usado desde la segunda mitad del siglo pasado a la fecha, inicialmente en forma generalizada y con dosis empíricas, avaladas por la experiencia y resultados retrospectivos publicados por Mazzaferri10,11. En los últimos años ha existido una tendencia a personalizar este tipo de terapias, cambiando el enfoque generalizado a uno basado en el riesgo individual del paciente12,13. Este riesgo individual se calcula categorizando según una serie de factores que incluyen la histología tumoral, presencia y magnitud de compromiso extratiroideo, extensión del compromiso ganglionar, presencia de metástasis a distancias y edad, entre otros, que determinan la probabilidad de recurrencia del tumor. De este modo se ha propuesto en las guías clínicas internacionales basarse en esta categorización para definir la necesidad de terapia adyuvante con radioyodo y, en caso de necesitarla, de la actividad del 131I a administrar14. Otro paso hacia la personalización de las terapias con radioyodo se dio con la reducción de la actividad administrada a los pacientes luego de la publicación que demostró que el efecto ablativo era el mismo al disminuir en más de un 60% la actividad empírica utilizada comúnmente15, permitiendo que los pacientes de riesgo bajo o intermedio que fueran derivados a terapia con 131I se trataran con menor exposición radiológica.
2.1Tumores NeuroendocrinosSe define como tumores neuroendocrinos a un grupo heterogéneo de tumores que derivan de células originadas desde la etapa embrionaria, y que se distribuyen por todo el organismo a través de las crestas neurales, las glándulas endocrinas, los islotes y el sistema endocrino difuso. Si bien estos tumores son de baja prevalencia, los más comunes son los tumores carcinoides enteropancreáticos, los tumores de células de los islotes, el cáncer medular de tiroides y los feocromocitomas.
Las imágenes funcionales de medicina nuclear se han usado tradicionalmente para diagnosticar, etapificar y evaluar la respuesta a tratamientos de estos tumores ya que, al ser productores de diferentes neuropéptidos, neuromoduladores o neurotransmisores, poseen una serie de receptores y/o blancos moleculares específicos que pueden ser marcados con radiotrazadores.
Desarrollado originalmente en 1978 para el estudio de la médula adrenal en perros, el metayodobencilguanidina (MIBG) se empezó a usar a mediados de la década de 1980 para el estudio de los tumores derivados de las células cromafines tanto de la glándula suprarrenal (feocromocitomas) como de ganglios simpáticos y/o parasimpáticos (paragangliomas). Al ser un análogo de la norepinefrina, el MIBG es captado selectivamente y almacenado en los gránulos de secreción noradrenérgicos, acumulándose en forma muy específica en los feocromocitomas y paragangliomas funcionantes16. El MIBG se marca con radioisótopos del yodo como el 123I (cintigrafía tradicional, SPECT/CT) o el 124I (PET/CT), que permiten una mejor calidad de imagen y menor dosimetría. Al no estar disponibles localmente estos isótopos, se emplea el 131I que permite obtener imágenes cintigráficas, pero dada la presencia de radiación beta y el riesgo de radiotoxicidad se debe limitar su dosis con el consiguiente deterioro de la calidad de imagen. La principal ventaja de esta técnica es su alta sensibilidad en tumores funcionales cercana al 90% y el valor predictivo positivo de 100%17.
Cuando ocurre malignización de los feocromocitomas y paragangliomas, los pacientes son generalmente metastásicos al momento del diagnóstico, con pocas alternativas terapéuticas. Una de las posibilidades es aplicar el concepto de teranóstica y, luego de confirmar en imágenes diagnósticas la adecuada captación del MIBG por parte de las lesiones, aplicar ciclos de alta actividad de MIBG con objetivo terapéutico. Esta estrategia se ha usado con éxito por varias décadas, existiendo varias aproximaciones terapéuticas específicamente relacionadas con la actividad a administrar, que puede alcanzar altas cantidades18, pero siempre con las precauciones habituales para evitar irradiación innecesaria. En estos pacientes con tumores funcionantes además se agregan las precauciones secundarias a la posible liberación de noradrenalina al torrente sanguíneo como efecto de la terapia. Algo similar ocurre con los neuroblastomas, que son tumores que se dan más frecuentemente en población pediátrica, y derivan de neuroblastos del sistema nervioso simpático. Dentro de sus características celulares también se ha demostrado la concentración de MIBG, lo que permite su uso tanto a nivel diagnóstico como terapéutico19.
En cuanto a los tumores neuroendocrinos más comunes, destacan los gastroenteropancreáticos (gastrinoma, insulinoma o carcinoide), caracterizados por una sobre-expresión de receptores de somatostatina20. Estos receptores tienen afinidad variable por algunos análogos de somatostatina que se han logrado marcar con diferentes radiotrazadores. Desde la década de 1990 se cuenta con el octreotide marcado originalmente con 111In (Octreoscan) y posteriormente con 99mTc, lo que permite obtener imágenes cintigráficas de la distribución de estos tumores. Junto con la irrupción de las imágenes con técnica PET/CT, en Chile está disponible un emisor de positrones, el 68Ga, que puede unirse a los análogos de somatostatina como el DOTATATE y obtener imágenes con significativa mejor calidad y resolución. Los distintos tumores sobre-expresan distintos subtipos de receptores (que van del sst1 al sst5) los que presentan distinta afinidad por los diferentes análogos de somatostatina disponibles. Esto ha motivado que exista una amplia gama de combinaciones entre tumores y posibles radiotrazadores que apuntan a la futura capacidad de poder elegir la mejor modalidad, dependiendo de las características específicas de cada paciente21.
Cabe destacar, además, que otros tumores neuroendocrinos como el feocromocitoma y el cáncer medular de tiroides también sobreexpresan estos receptores, por lo que se puede emplear esta técnica para evaluarlos conjuntamente.
Algunos tumores neuroendocrinos pueden desdiferenciarse con el tiempo, perdiendo la capacidad de sobre-expresar receptores de somatostatina, siendo en general más agresivos. En estos casos se sugiere utilizar el PET con flúordeoxiglucosa (FDG) ya que se vuelven metabólicamente activos y acumulan la glucosa con mayor intensidad22.
El concepto de teranóstica rápidamente se empezó a aplicar a los tumores neuroendocrinos que sobre-expresan receptores de somatostatina, demostrando la captación tumoral con imágenes diagnósticas (cintigrafía tradicional inicialmente y posteriormente con PET/CT con 68Ga) y luego administrando dosis terapéuticas de 90Y o 177Lu marcados con los análogos de somatostatina1.
Los reportes de pacientes tratados con esta modalidad teranóstica fueron muy auspiciosos, por lo que se diseñó un estudio fase 3 denominado NETTER-1 (Neuroendocrine Tumors Therapy)23. Este estudio reclutó a pacientes con tumores neuroendocrinos bien diferenciados (Grado 2, con índice Ki67: 3-20%) localizados en intestino, metastásicos o localmente avanzados, y que presentaban progresión frente a la terapia habitual con octreotide de larga duración (análogo de somatostatina). Se comparó la terapia con radioisótopos unidos a análogos de somatostatina (177Lu-DOTATATE) versus terapia con octreotide, previa confirmación de la captación del DOTATATE en las lesiones mediante un estudio PET/CT con 68Ga-DOTATATE. El análisis de los resultados demostró una significativa mejoría en la sobrevida libre de progresión y en la sobrevida global de los pacientes tratados con 177Lu-DOTATATE, así como en la tasa de respuesta tumoral, con una baja tasa de radiotoxicidad.
Es importante recalcar que el resultado de este tipo de terapias dependerá de una adecuada fijación del trazador en las imágenes diagnósticas iniciales, por lo que si existe baja o nula captación tumoral no estaría indicada la terapia con esa molécula. Esto puede deberse a la variabilidad de expresión de los distintos receptores de somatostatina en los distintos tumores neuroendocrinos, así como del grado de desdiferenciación de los mismos.
Los resultados del estudio NETTER-1 avalaron la incorporación de las terapias radioisotópicas con análogos de somatostatina en los protocolos de tratamiento de este grupo de pacientes. Múltiples series de pacientes con tumores neuroendocrinos de similares características a los reclutados en el estudio NETTER-1, aunque originados en otras localizaciones, han demostrado resultados similares, por lo que esta línea de tratamiento basado en teranóstica parece tener un rol significativo en el arsenal terapéutico actual.
2.2Cáncer de próstataLas imágenes de Medicina Nuclear se han utilizado por muchos años en la etapificación del cáncer de próstata (CaP), con una importante presencia del cintigrama óseo cuyo principal objetivo es demostrar la reacción osteoblástica que generan las metástasis óseas del cáncer prostático. Este examen se sigue utilizando ampliamente en la actualidad, en parte debido a su buena sensibilidad a pesar de no ser muy específico. Desde la incorporación del PET/CT se han utilizado varios trazadores en evaluación de CaP con diferente suerte. El principal radiotrazador utilizado en oncología es el FDG, que en CaP muestra una baja sensibilidad dada la variabilidad en la avidez por la glucosa del tumor, reservándose su uso en aquellos tumores desdiferenciados que ya se han hecho resistentes a las terapias hormonales y que pueden concentrar adecuadamente el trazador. Se dispone además de un trazador (Na18F) para evaluar actividad ósea del mismo modo que el cintigrama, obteniendo mejor calidad de imagen gracias a la mejor resolución del PET/CT, aunque no puede aportar en la evaluación del compromiso ganglionar o visceral del CaP. Los PET/CT utilizando colina marcada con 11C y posteriormente con 18F fueron una mejor alternativa para CaP que el FDG, demostrando una mejor sensibilidad y especificidad para compromiso secundario óseo, ganglionar y visceral, aunque sin presentar altos niveles de exactitud diagnóstica. Esto porque la captación de la colina depende de la síntesis de las membranas celulares, que no es exclusiva del CaP, por lo que existe una amplia distribución fisiológica además de otras patologías que mostraban alta captación24.
A mediados de la década pasada se empezó a utilizar el antígeno prostático específico de membrana (PSMA por sus siglas en inglés) como blanco molecular para el estudio del CaP. Este marcador del CaP tiene la particularidad de aumentar su expresión a medida que el tumor es más agresivo, especialmente en recidivas o metástasis25. Se han desarrollado diversas moléculas que apuntan a diferentes componentes del PSMA, que pueden ser marcadas con diversos isótopos radioactivos para obtención de imágenes con técnica SPECT o PET. Estos trazadores, si bien poseen algunas diferencias en su biodistribución, se han usado con excelentes resultados y han ganado rápidamente un rol en la etapifiación del CaP, siendo el 68Ga-PSMA y 18F-PSMA los más empleados actualmente, ambos para estudios PET/CT26.
La rápida incorporación de los estudios diagnósticos PET/CT con PSMA al manejo clínico del CaP motivó múltiples ensayos clínicos que demostraron la potencial eficacia de un tratamiento con radioisótopos en pacientes metastásicos con alta captación al PET/CT. Recientemente se publicó el estudio VISION27, primer estudio multicéntrico fase 3, que tenía por objetivo demostrar la utilidad de la terapia con 177Lu-PSMA en pacientes con CaP avanzado, refractario a terapia con bloqueo hormonal y a quimioterapia. Los pacientes se aleatorizaron en dos ramas, una con la mejor terapia disponible según evidencia y la segunda con ciclos consecutivos de 150-200 mCi de 177Lu-PSMA. Los pacientes que recibieron la terapia con 177Lu-PSMA debían tener un PET/CT previo con 68Ga-PSMA que confirmara que todas las metástasis concentraban activamente el trazador. Los resultados de este estudio fueron ampliamente favorables para los pacientes que recibieron el 177-Lu-PSMA, mejorando su sobrevida libre de progresión, sobrevida global y con muy baja toxicidad asociada. Al ser estos resultados aplicables en la población de CaP más avanzada, se están desarrollando ensayos clínicos que buscan determinar el rol de esta terapia en etapas previas de la enfermedad, como alternativa y/o complemento a la quimioterapia y hormonoterapia.
3ConclusiónLa medicina personalizada es un concepto amplio que abarca realidades diversas dependiendo de las diferentes patologías y tratamientos disponibles. En medicina nuclear se han utilizado por décadas las terapias moleculares específicas avaladas por una demostración de la avidez y/o hipercaptación de los radiotrazadores en los distintos tumores y sus metástasis.
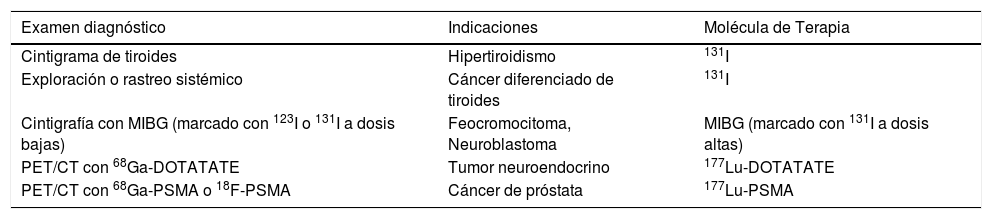
Desde los primeros usos terapéuticos del radioyodo, que marcaron el inicio de las “radioterapias dirigidas”, hasta los tratamientos actuales guiados por técnicas complejas como la captación al PET/CT de las moléculas dirigidas a blancos moleculares específicos como los receptores de somatostatina o al antígeno de membrana prostático específico, la medicina nuclear entrega una alternativa terapéutica con un componente de personalización muy alto (Tabla 1).
Principales exámenes de medicina nuclear utilizados en diagnóstico y terapia según patología
| Examen diagnóstico | Indicaciones | Molécula de Terapia |
|---|---|---|
| Cintigrama de tiroides | Hipertiroidismo | 131I |
| Exploración o rastreo sistémico | Cáncer diferenciado de tiroides | 131I |
| Cintigrafía con MIBG (marcado con 123I o 131I a dosis bajas) | Feocromocitoma, Neuroblastoma | MIBG (marcado con 131I a dosis altas) |
| PET/CT con 68Ga-DOTATATE | Tumor neuroendocrino | 177Lu-DOTATATE |
| PET/CT con 68Ga-PSMA o 18F-PSMA | Cáncer de próstata | 177Lu-PSMA |
La confirmación en cada paciente mediante herramientas visuales y cuantificables de la distribución corporal de un agente terapéutico antes de ser administrado nos da un mayor grado de seguridad en cuanto a evitar efectos secundarios indeseables, así como una mayor confianza en su potencial efecto terapéutico. De la misma forma, un estudio diagnóstico previo que no demuestre altos niveles de captación por parte del tumor o potenciales localizaciones secundarias que contraindicarían las terapias por posibles complicaciones, aporta información determinante en la toma de decisiones ya que evitaría la realización de tratamientos con baja probabilidad de éxito o con potenciales complicaciones.
Si bien el concepto de teranóstica es relativamente reciente, los principios de obtención de imágenes específicas con radiotrazadores y posterior tratamiento con la misma molécula asociada a una dosis de radiación con fines terapéuticos son parte de la historia de la medicina nuclear. El rápido desarrollo de radiotrazadores oncológicos que buscan blancos específicos, especialmente en el área de PET/CT, nos avizora un futuro próximo con más y mejores alternativas terapéuticas que probablemente combinen terapias dirigidas con radioisótopos para poder lograr una potenciación terapéutica.
Declaración de conflicto de interésEl autor declara no tener conflictos de intereses.