Las taquicardias auriculares regulares representan un grupo de arritmias con diferentes mecanismos electrofisiológicos (EEF). La mayoría, en la actualidad, se pueden mapear y tratar con catéter. Ante ello la cirugía tiene una indicación muy ocasional, reservada como última opción terapéutica. No obstante, existen razones por las que un cirujano debe conocer este tipo de arritmias, entre ellas su asociación preoperatoria a cardiopatías quirúrgicas y el efecto arritmógeno de la propia cirugía prevenible con una técnica adecuada. En este capítulo abordamos, para el cirujano, las variedades quirúrgicas de taquicardia auricular regular, exponiendo la electrofisiopatología y anatomía de la arritmia, técnica quirúrgica, indicaciones clínicas de ablación y los resultados de la ablación.
Regular atrial tachycardias represent a group of arrhythmias with different electrophysiological mechanisms. Most can be currently mapped and treated with catheter ablation. Surgery has an unusual indication and it is reserved as a last therapeutic option. However, there are reasons why the surgeon still must know this type of arrhythmia, including its occasional association with structural heart disease and caused by the surgery itself and therefore can be prevented with an appropriate technique. In this chapter we address, for the surgeon, surgical varieties of regular atrial tachycardia, outlining the pathoelectrophysiology and anatomy of the arrhythmia, surgical technique, clinical indications and results of ablation.
Las taquicardias auriculares regulares tienen diferentes mecanismos EEF, en ocasiones difíciles de conocer, aunque el más frecuente es la reentrada1,2. La cartografía de activación puede permitir localizar el origen (focal) o el trayecto circular (reentrante) de estas arritmias, y con ello conducir a su ablación. El gran desarrollo y efectividad de la ablación con catéter han hecho que la cirugía de las taquicardias auriculares regulares sea en la actualidad una opción terapéutica inusual. No obstante, para el cirujano es importante conocer este tipo de arritmias, por dos razones. La primera, tratarlas de forma concomitante cuando están presentes en las cardiopatías quirúrgicas en el momento de su cirugía; la segunda, por el efecto arritmógeno de ciertas técnicas quirúrgicas que puede llegar a comprometer los resultados a largo plazo. En la última década, el cirujano ha adquirido un interés creciente por las arritmias que le lleva a realizar un número creciente de procedimientos de ablación de arritmias en el quirófano y también progresos en el diseño de enfoques quirúrgicos que minimicen la incidencia postoperatoria de arritmias a corto y largo plazo. Esta revisión de los mecanismos de arritmias regulares de la aurícula quiere trazar una perspectiva de los mecanismos de las arritmias en el contexto del paciente cardíaco quirúrgico y facilitar la comprensión de las posibles intervenciones terapéuticas y preventivas.
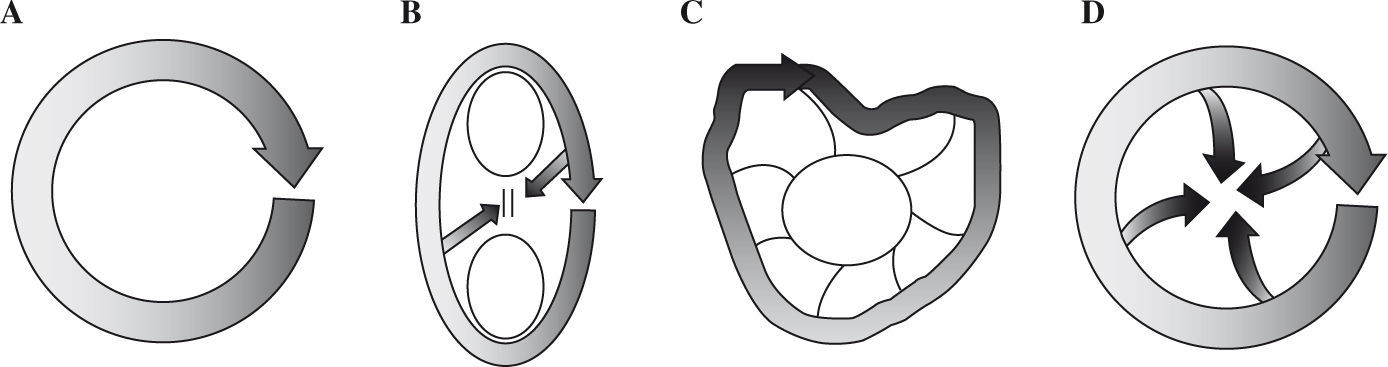
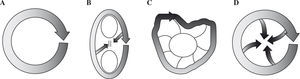
Mecanismos de la macrorreentradaDesde los inicios del siglo pasado se han desarrollado nuevos modelos de arritmias basados en el mecanismo de la reentrada (Fig. 1), introduciéndose los conceptos de obstáculo anatómico y barrera funcional, área dañada con propagación lenta del impulso, bloqueo funcional por anisotropía, reentrada por escara quirúrgica o zona de fibrosis miocárdica primaria, etc. En los últimos años, la cartografía auricular ha mostrado que la activación circular en circuitos de tamaño grande (macrorreentrada) es el mecanismo de la mayoría de las taquicardias auriculares, incluyendo el flutter1,2. La definición de circuito «grande» es arbitraria, pero desde el punto de vista práctico supone un diámetro suficiente (2-3cm) en su núcleo central como para poder registrar independientemente la activación de cada punto del circuito. En contraste una microrreentrada sería un circuito tan pequeño que la cartografía auricular sólo mostraría un patrón radial (focal) de activación a partir de un punto y su diagnóstico sería indirecto, a través de la respuesta a la estimulación.
Modelos de movimiento circular por reentrada. Cuatro modelos distintos de reentrada. La onda de excitación está representada por las flechas. A: circuito por reentrada alrededor de un obstáculo anatómico descrito por Mines59. B: modelo de Lewis que combina obstáculo anatómico y barrera funcional60. C: modelo de Moe que combina un círculo funcional alrededor de un área dañada61. D: modelo de círculo puramente funcional descrito por Allessie62.
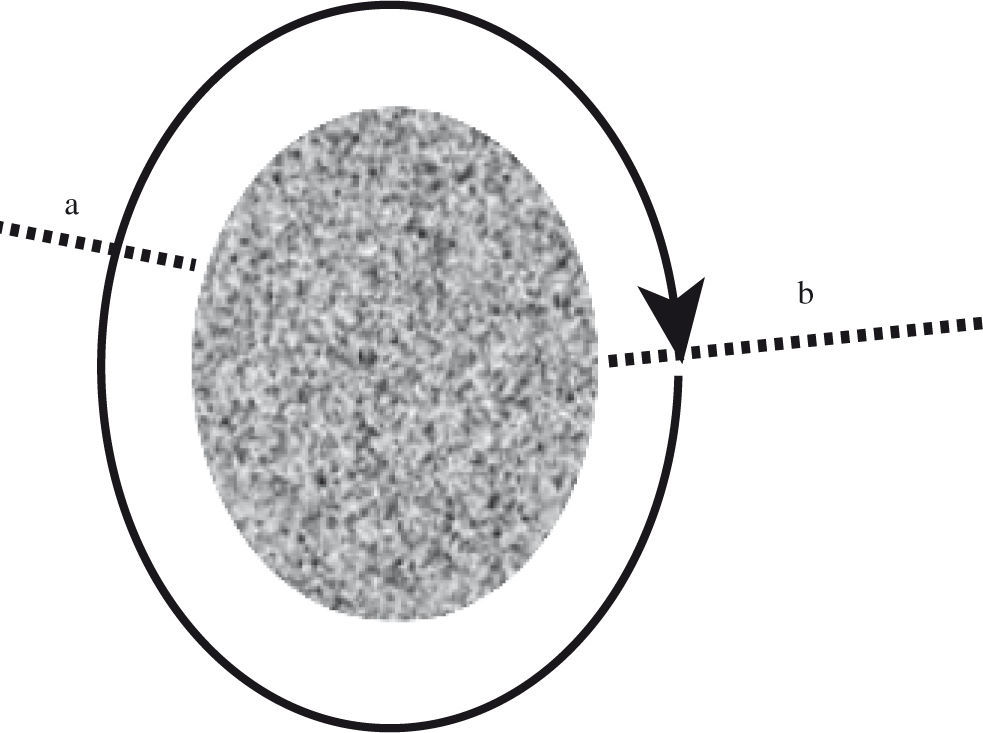
La reentrada es un circuito cerrado, de trayecto estable por lo general, que permite su corte o bloqueo en algún punto de su recorrido mediante la creación de una lesión lineal entre el obstáculo central y alguna estructura anatómica no conductora, tal como un orificio venoso o un anillo valvular (Fig. 2). La cartografía del circuito tiene como paso fundamental la localización del punto más estrecho del mismo (istmo) donde la línea de ablación o incisión sea menos dañina y técnicamente más sencilla de trazar. El concepto de istmo es principalmente anatómico, es decir, una zona estrecha entre los obstáculos fijos, sin relación necesariamente con la presencia o no de conducción lenta localmente. La comprensión de la taquicardia auricular macrorreentrante (TAMR) requiere de la definición de los obstáculos fijos centrales (ya sea anatómica o funcional) y el istmo(s). Conocer la anatomía auricular es esencial para localizar y caracterizar la vía de las reentradas, y con ello su tratamiento.
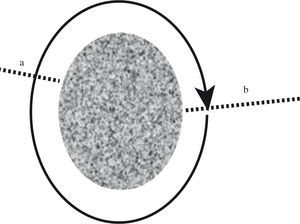
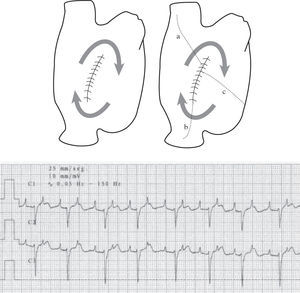
Bloqueo de la reentrada. Podemos realizar diversas aproximaciones para cortar-eliminar el circuito que gira alrededor de un área silente. La más práctica probablemente es la más corta línea a, aunque igual de efectiva es la línea b. La línea de corte del circuito (atriotomía o ablación) está representada por las líneas de puntos.
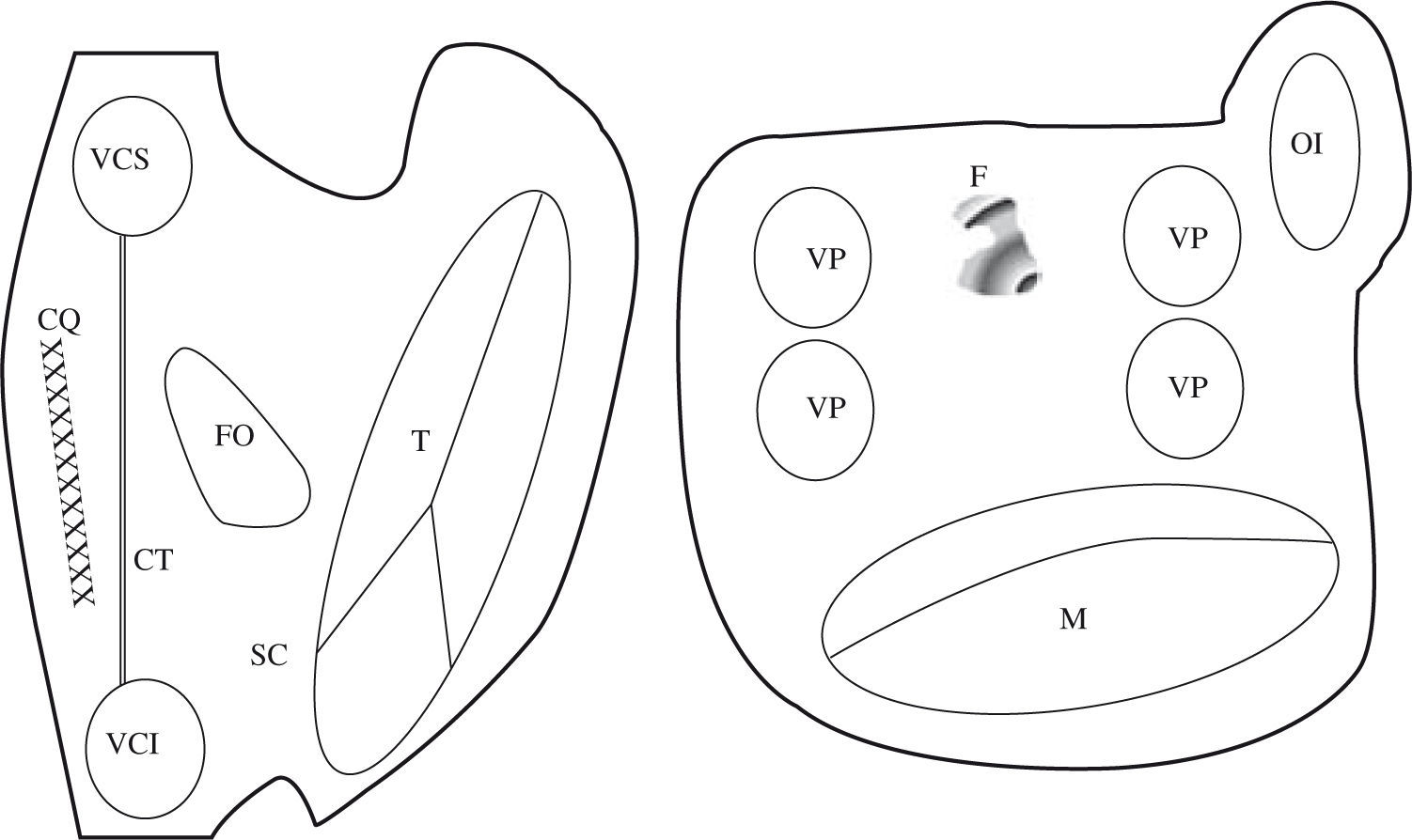
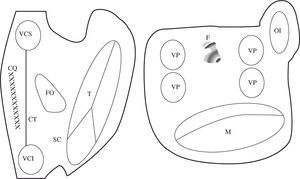
En la figura 3 están esquematizados los obstáculos anatómicos y barrera funcional fisiológicas de las aurículas. En condiciones patológicas pueden existir otros obstáculos relacionados con cicatrices quirúrgicas, parches, o áreas de fibrosis primarias. Las reentradas pueden girar alrededor de cualquiera de estos elementos, lo que implica que las líneas de ablación han de seleccionarse en cada caso, respetando las vías normales de conducción auricular para no aislar la llegada del impulso al nodo auriculoventricular, e intentado minimizar el número y tamaño de las líneas. En la práctica clínica las líneas que han de cortar el circuito (atriotomía o ablación) no tienen por qué ser siempre las más cortas, sino que deberán seleccionarse atendiendo a otros criterios como la accesibilidad, el grosor del tejido a lesionar y la proximidad a estructuras anatómicas esenciales con riesgo de lesión. La multiplicación de lesiones de ablación destruye porciones muy importantes del miocardio auricular, y la función auricular puede deteriorarse. Una cirugía tipo Maze debe preservar caminos de conducción fisiológicos para no desincronizar la aurícula izquierda (AI) y para preservar cuanto más miocardio mejor. En este sentido, el que se excluya todo el miocardio comprendido entre las venas pulmonares se ha demostrado que es importante para la función auricular3,4.
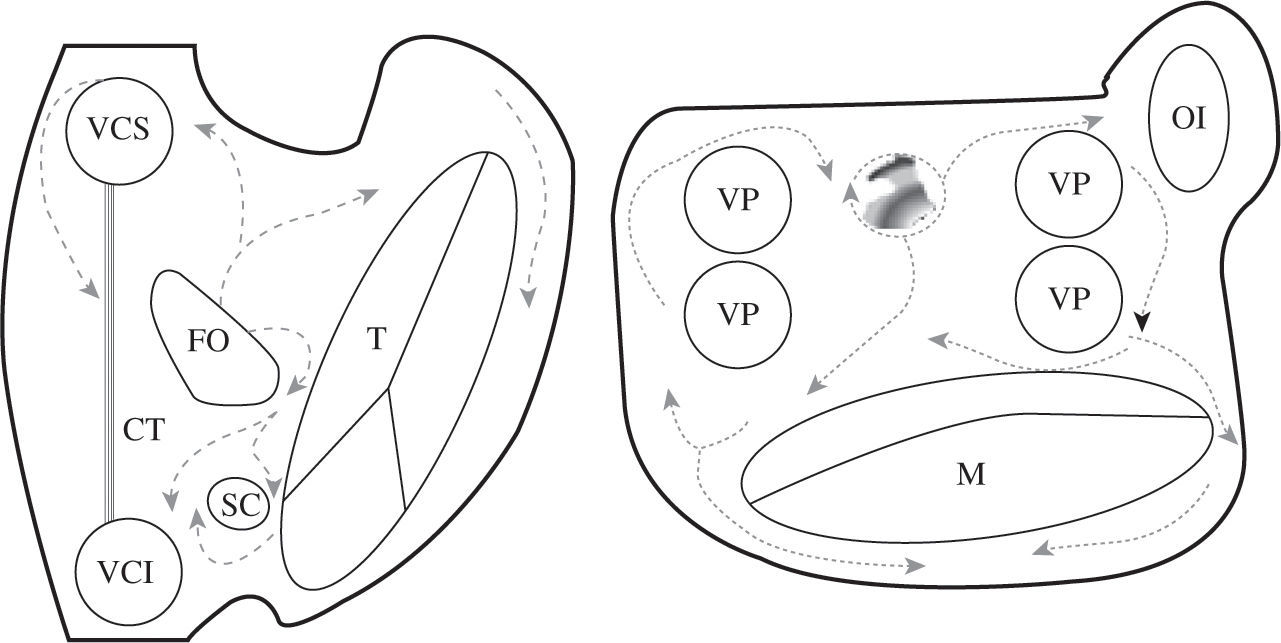
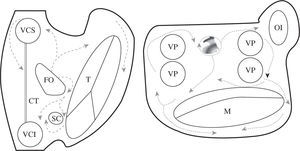
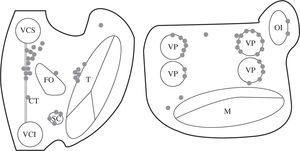
Descripción esquemática de los obstáculos anatómicos y barrera funcional de las aurículas. En esquema están representadas ambas aurículas. VCS: vena cava superior; VCI: vena cava inferior; SC: seno coronario; FO: fosa oval; T: anillo tricúspide; M: anillo mitral; VP: vena pulmonar; CT: cresta terminal (barrera funcional) representada con la línea ; CQ: cicatriz quirúrgica representada con la línea XX; F: área de fibrosis representada con zona sombreada en la cara posterior de la AI.
En situaciones de gran daño miocárdico auricular, como tras intervención tipo Fontan o en valvulopatía mitral, puede haber taquicardias reentrantes de circuitos amplios y otros más pequeños (1cm), girando unas en torno a cicatrices quirúrgicas y otras alrededor de zonas de bajo voltaje, posiblemente cicatriciales o fibrosas, que pueden cubrir grandes porciones de la(s) pared(es) auriculares. A esto se puede añadir la presencia de arritmias focales no reentrantes. Este tipo de situación es la que sólo se puede resolver con un procedimiento tipo Maze, ya sea con catéter o quirúrgico, junto con la localización y ablación selectiva de los focos arritmógenos en su caso.
Clasificación quirúrgicaEn un sentido amplio, pueden considerarse taquicardias auriculares regulares aquellas que asientan en las aurículas, sin precisar para su mantenimiento estructuras ventriculares ni la unión auriculoventricular. Dentro de esta definición se incluyen las diversas formas de taquicardia sinusal, el flutter y las taquicardias propiamente auriculares. Su clasificación quedó establecida, y es la que vamos a seguir en este capítulo, en el documento de consenso del Grupo de Trabajo de Arritmias de la European Society of Cardiology y la Sociedad Norteamericana de Electrofisiología y Estimulación Cardíaca5, y en la puesta al día que posteriormente realizó uno de sus autores6. En esta revisión abordamos las taquicardias auriculares regulares más relacionadas con la cirugía cardíaca, dejando aparte las taquicardias sinusales y otras variedades menos frecuentes.
Las clasificaciones tradicionales basadas en el electrocardiograma (ECG) tienen poca utilidad, excepto para algunos patrones muy clásicos de flutter típico o taquicardia auricular focal en ausencia de cardiopatía estructural y cirugía cardíaca previa con atriotomía. Dado que el cirujano va a buscar siempre una intervención directa sobre el mecanismo, ya sea terapéutica o preventiva, lo que interesa es conocer, por un lado, si es focal o macrorreentrante, y por el otro la localización o configuración del foco o el circuito. Todas las demás nomenclaturas, como flutter atípico, TAMR izquierda, etc. no son útiles. Únicamente el flutter típico sería un término útil porque sólo se aplica a una forma particular de reentrada localizada en la aurícula derecha (AD) y con participación necesaria del istmo cavotricuspídeo (ICT). El flutter atípico es un término electrocardiográfico que significa realmente que no se puede reconocer el patrón de flutter típico. Algunos llaman flutter atípico a taquicardias auriculares, desde el punto de vista del ECG, porque son macrorreentrantes.
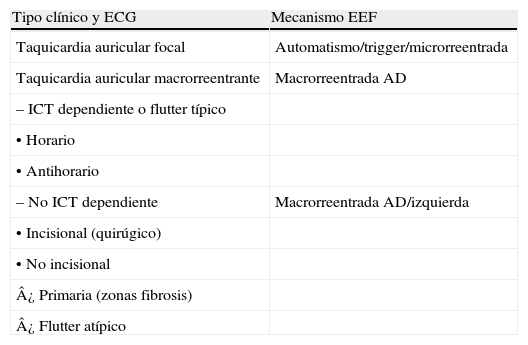
Por lo tanto, para el cirujano, existen dos formas de taquicardias auriculares regulares claramente definidas por sus mecanismos EEF: las TAMR y la taquicardia auricular focal (Tabla I). El estudio EEF de estos pacientes debe definirnos el mecanismo de la taquicardia si queremos realizar un abordaje específico de ablación.
Taquiarritmias auriculares regulares de interés quirúrgico
| Tipo clínico y ECG | Mecanismo EEF |
| Taquicardia auricular focal | Automatismo/trigger/microrreentrada |
| Taquicardia auricular macrorreentrante | Macrorreentrada AD |
| – ICT dependiente o flutter típico | |
| • Horario | |
| • Antihorario | |
| – No ICT dependiente | Macrorreentrada AD/izquierda |
| • Incisional (quirúgico) | |
| • No incisional | |
| ¿ Primaria (zonas fibrosis) | |
| ¿ Flutter atípico |
CT: cavotricuspídeo.
Como elemento común las TAMR tienen su origen, en general, en circuitos de activación reentrantes alrededor de un sustrato anatómico determinado y con un tamaño, no establecido, pero de varios centímetros5,6. Los circuitos se establecen alrededor de obstáculos anatómicos (anillo tricuspídeo, mitral, venas cavas, ostium de venas pulmonares), funcionales (cresta terminal [CT]) o patológicos (cicatrices quirúrgicas, parches o gaps de ablación), todas ellas estructuras barrera no excitables. El circuito puede estar localizado en la AD o AI, dependiendo del mecanismo EEF desencadenante. Y en todas podemos hablar de uno o más istmos, que corresponden a las zonas del circuito anatómicamente más estrechas por la que circula la reentrada. El circuito del flutter típico es un buen modelo, basado en la peculiar anatomía de la AD que facilita la formación de un obstáculo central compuesto por los orificios de las venas cavas unidos por el obstáculo funcional formado por la CT, que por su marcada anisotropía bloquea la conducción a su través. Así, bloqueada la conducción por la AD posterior, el único paso para la activación circular es el miocardio situado entre la vena cava inferior (VCI) y el anillo tricúspide, que, sin ser la causa primaria, se convierte en accesorio imprescindible del flutter y que por su anchura menor que otras porciones del circuito se conoce como ICT. En otros tipos de TAMR será necesario estudiar la secuencia de activación y delimitar el istmo o istmos más accesibles técnicamente y suficientemente alejados de estructuras esenciales (unión auriculoventricular, arterias coronarias, nervio frénico) para que su ablación sea factible.
La definición anatómica de los circuitos y los istmos lleva a una nomenclatura o clasificación de aplicación tanto al cirujano como al electrofisiólogo.
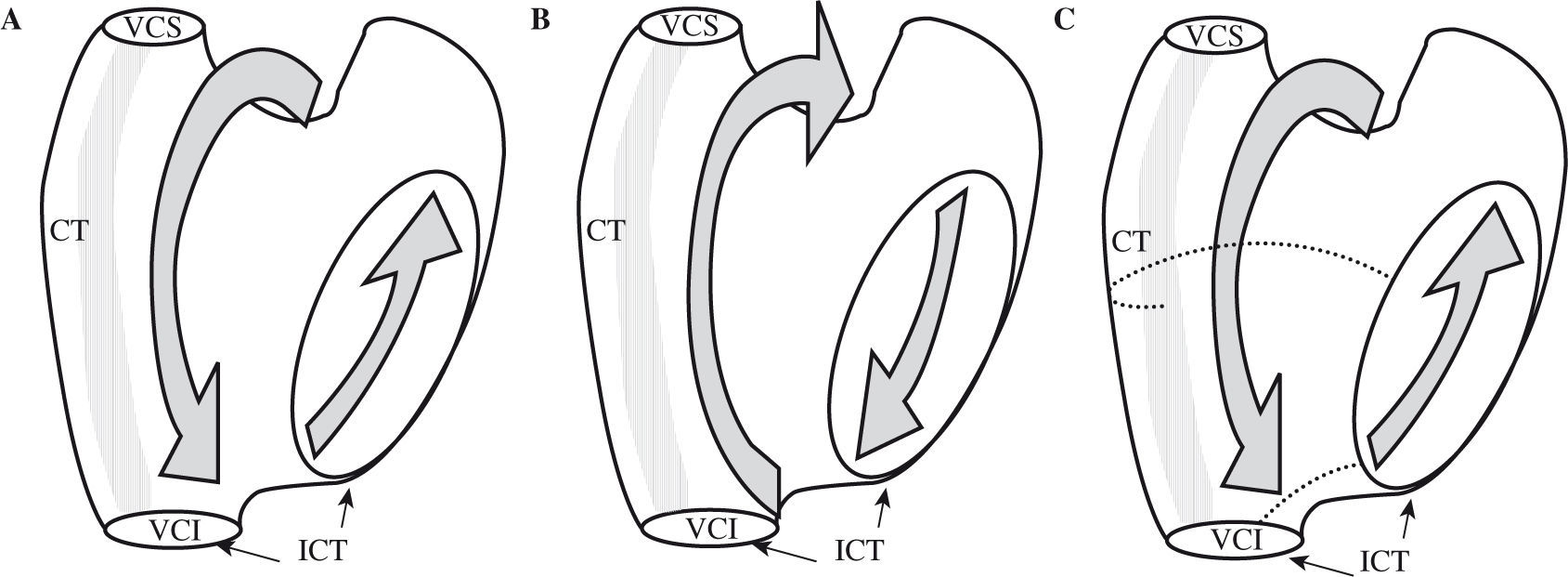
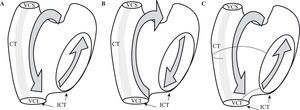
– Las TAMR de la AD dependientes del ICT pueden tener varias configuraciones, según el giro de la activación sea antihorario (descendente en AD anterior y ascendente en AD septal) u horario (descendente en AD septal y ascendente en AD anterior) (Fig. 4). También puede variar la configuración de la línea de bloqueo a nivel de la CT, de modo que el giro superior se haga por delante de la vena cava superior (VCS) (techo de AD) o por debajo, atravesando la CT a algún nivel. Todas estas TAMR se consideran «flutter típico» y en todas ellas el ICT es un paso esencial de la activación y el objetivo del tratamiento, ya sea curativo o preventivo. El flutter típico («istmo dependiente») es facilitado por la presencia de obstáculos de conducción adicionales en la AD posterolateral, de modo que es una arritmia muy frecuente en presencia de cicatrices de atriotomía extensas, aunque la cicatriz en sí no produzca TAMR.
Flutter típico. Topografía de las líneas de lesión para la ablación. A: esquema de flutter típico (antihorario) con reentrada que asciende, en sentido caudocraneal, por el septo auricular y desciende por la pared libre de la AD. B: esquema de flutter típico (horario). C: dos opciones quirúrgicas para la ablación. Opción con línea desde el anillo tricuspídeo y la CT, es decir, a lo largo de toda la pared libre de la AD. Y la opción más simple, y habitual, el istmo cavotricuspídeo (ICT) o línea entre la VCI y el anillo tricuspídeo, a nivel del origen quirúrgico de la arteria coronaria descendente posterior. Mismas abreviaturas que en figuras anteriores.
– Las TAMR no dependientes del ICT son mucho menos frecuentes en pacientes no sometidos a cirugía con atriotomía, pero se van haciendo un hallazgo más común tras la adopción amplia de tratamientos de ablación con catéter o quirúrgicos para el tratamiento de la fibrilación auricular (FA). También pueden encontrarse TAMR en la AD y en la AI cuyo circuito gira en torno a obstáculos no quirúrgicos, que en la cartografía se identifican como áreas de miocardio con muy bajo voltaje, no conductoras de la activación. Estas zonas de bajo voltaje se consideran generalmente de origen «cicatricial», pero en realidad se desconoce su origen y constitución.
De las TAMR atípicas o no dependientes del ICT nos interesan particularmente aquellas cuyo centro es una cicatriz quirúrgica. El conocimiento de la estructura anatómica de los circuitos causantes nos permite suprimirlas por ablación quirúrgica o con catéter de sus istmos críticos, pero además nos permite también conocer lo que hace arritmogénica una cicatriz y modificar la técnica quirúrgica para prevenir la incidencia posterior de TAMR. En pacientes con gran dilatación auricular posquirúrgica, típicamente tras la operación de Fontan, se dan frecuentemente zonas de bajo voltaje de origen no quirúrgico junto con las cicatrices quirúrgicas con múltiples mecanismos de taquicardia que resultan muy difíciles de tratar salvo con procedimientos quirúrgicos tipo Maze.
Con estos conceptos establecidos se puede separar un primer grupo de pacientes sin cardiopatía ni cirugía cardíaca previa, en los que el ECG puede ser muy informativo y claramente está indicada, en principio, la ablación con catéter. El segundo grupo sería el de pacientes que han sido sometidos a cirugía o a ablación con catéter y tienen taquicardia auricular. Aquí todo es posible, casi sin importar el patrón electrocardiográfico. El diagnóstico del mecanismo es por cartografía con una definición anatómica del circuito, ya sea focal o macrorreentrante, y es esencial para el tratamiento, que será en muchos casos de ablación con catéter y en otros quirúrgicos.
Taquicardia auricular focalLos mecanismos focales de taquicardia son frecuentes en aurículas enfermas con o sin atriotomía previa. Es importante delimitar estos mecanismos focales porque una intervención tipo Maze no elimina las taquicardias. De hecho las arritmias de origen probablemente focal son muy frecuentes en los primeros 3-6 meses del postoperatorio del Maze y también tras ablación con catéter de FA.
La multiplicidad de mecanismos de taquicardia auricular hace muy evidente la necesidad de una colaboración estrecha entre el cirujano y el electrofisiólogo a la hora de plantear estrategias de prevención y tratamiento en pacientes con taquicardias recurrentes, especialmente si han sido intervenidos previamente o han sido sometidos a ablación con catéter.
Indicación de ablación quirúrgicaEl tratamiento de las taquicardias auriculares será inicialmente la estabilización de la frecuencia ventricular, seguida de la cardioversión a ritmo sinusal, ya sea por estimulación programada o por cardioversión externa. Los fármacos antiarrítmicos pueden ser de apoyo ante las recurrencias. Es ante las taquicardias auriculares recidivantes cuando se planteará la alternativa de ablación con catéter, que alcanza elevadas tasas de éxito en algunas formas de arritmias7–9. La indicación de ablación con catéter dependerá, pues, de la sintomatología del paciente y la repuesta al tratamiento médico. Son recogidas en el documento de consenso de la American College of Cardiology (ACC), la American Heart Association (AHA), y la European Society of Cardiology (ESC)10. En la mayoría de estas arritmias la ablación con catéter tiene recomendación clase I, con nivel de evidencia B. En ningún momento se contempla la ablación quirúrgica aun en los casos refractarios al catéter, quizá porque se considere de excesiva agresividad para el riesgo propio de este tipo de arritmias, o por la escasa experiencia actual de la mayoría de los grupos quirúrgicos. No obstante, las más recientes guías publicadas por la AHA y el ACC11 indican la cirugía Maze en pacientes adultos con cardiopatías congénitas y cirugía previa, como posteriormente comentaremos. Y en los casos de TAMR asociada preoperatoriamente con cardiopatía estructural quirúrgica, la ablación puede estar indicada siempre que no implique mayor riesgo quirúrgico y existan garantías de éxito en el procedimiento. Además, en la indicación quirúrgica siempre se tendrá en consideración la sintomatología del paciente, la respuesta al tratamiento médico, el fracaso de la ablación con catéter, y la experiencia del equipo en ablación quirúrgica.
Otro aspecto es la prevención quirúrgica de arritmias. Conocemos cada vez más de la relación de ciertas técnicas quirúrgicas con el origen de TAMR incisionales. Lo indicado es cambiar estas técnicas, que están asociadas a largo plazo con una mayor incidencia de arritmias.
Flutter típicoEl flutter típico es la TAMR clínica más frecuente, paradigma de las taquicardias auriculares regulares. El flutter típico es una arritmia condicionada totalmente por la anatomía de la AD, lo que hace el circuito bastante reproducible y, por ende, el patrón ECG bastante reconocible. Sin embargo, el patrón puede ser menos reconocible cuando hay cardiopatía estructural y la conducción intraauricular está dañada12. Así, en pacientes con cirugía previa o cardiopatía puede haber taquicardias atípicas, sin participación activa del ICT, que tengan una morfología en el ECG indistinguible de éste12.
Estudio electrofisiológicoLa utilidad mayor del reconocimiento del ECG del flutter típico es que se puede indicar ablación del ICT en estos casos con mucha seguridad de haber escogido el objetivo correcto, aunque en el momento de la ablación no se induzca el flutter. Pero si ha habido cirugía cardíaca previa con atriotomía auricular derecha no se puede estar seguro de si un patrón de flutter típico es lo que parece o, por el contrario, es otra TAMR. Es decir, aun con un ECG típico de flutter, en pacientes con cardiopatía o cirugía/ablación previa debemos considerar cualquier tipo de reentrada y, por lo tanto, a priori, no podemos intuir el patrón de ablación sin un EEF previo.
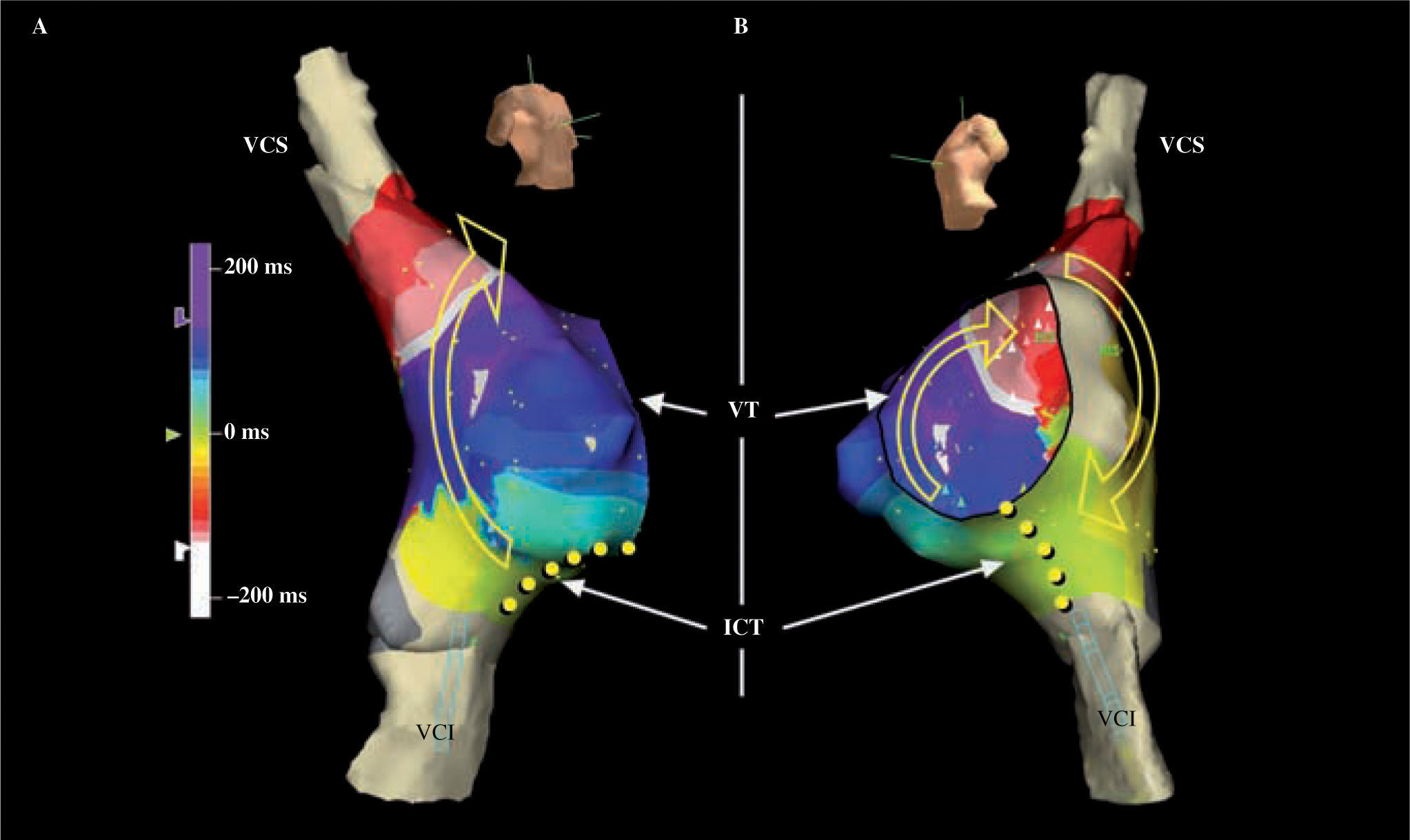
Con un catéter multielectrodo y/o un sistema de mapeo electroanatómico se establece la secuencia de activación de la AD (Fig. 5)1. En el flutter típico la reentrada circula a través del ICT, la pared libre auricular hasta la VCS, y desciende por el septo auricular y de nuevo el ICT. La dirección de la reentrada clasifica el flutter en antihorario, el más frecuente, e inverso u horario (Fig. 4). Si el paciente está en ritmo sinusal es necesario inducir el flutter mediante un protocolo básico de estimulación y/o infusión de isoproterenol.
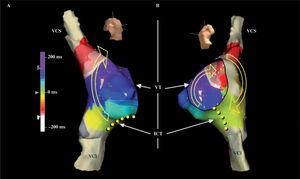
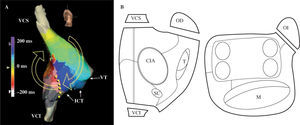
Mapa de activación auricular de flutter típico. Reconstrucción electroanatómica de la AD en proyección oblicua anterior derecha (A) y oblicua anterior izquierda con angulación caudal (B)en un caso de flutter típico de giro inverso (horario). La escala muestra los valores de tiempo de las líneas de activación según el color. Las flechas marcan la dirección ascendente de la activación en pared anterior y descendente en la pared posterior y septal, pasando luego por el ICT. VCI: vena cava inferior; VCS: vena cava superior; VT: válvula tricúspide. La línea de puntos amarillos indica la ablación eficaz del ICT.
La ablación con catéter es de elección (recomendación clase I, nivel de evidencia B). La ablación quirúrgica del ICT sólo se recomienda en pacientes que vayan a ser intervenidos de cirugía cardíaca con una historia típica documentada de flutter auricular, y en flutter inducible con ablación con catéter no exitosa o recurrente10. Algunos autores propugnan la ablación sistemática del ICT en la cirugía de la FA, para prevenir el flutter típico postablación13. Sería interesante estudiar la posibilidad de prevenir la aparición de flutter auricular en corazones trasplantados haciendo una sección del ICT en el momento del implante. La creación de una incisión en la pared posterior de la AD del donante es la causa más probable de la frecuencia relativamente elevada del flutter tras el trasplante.
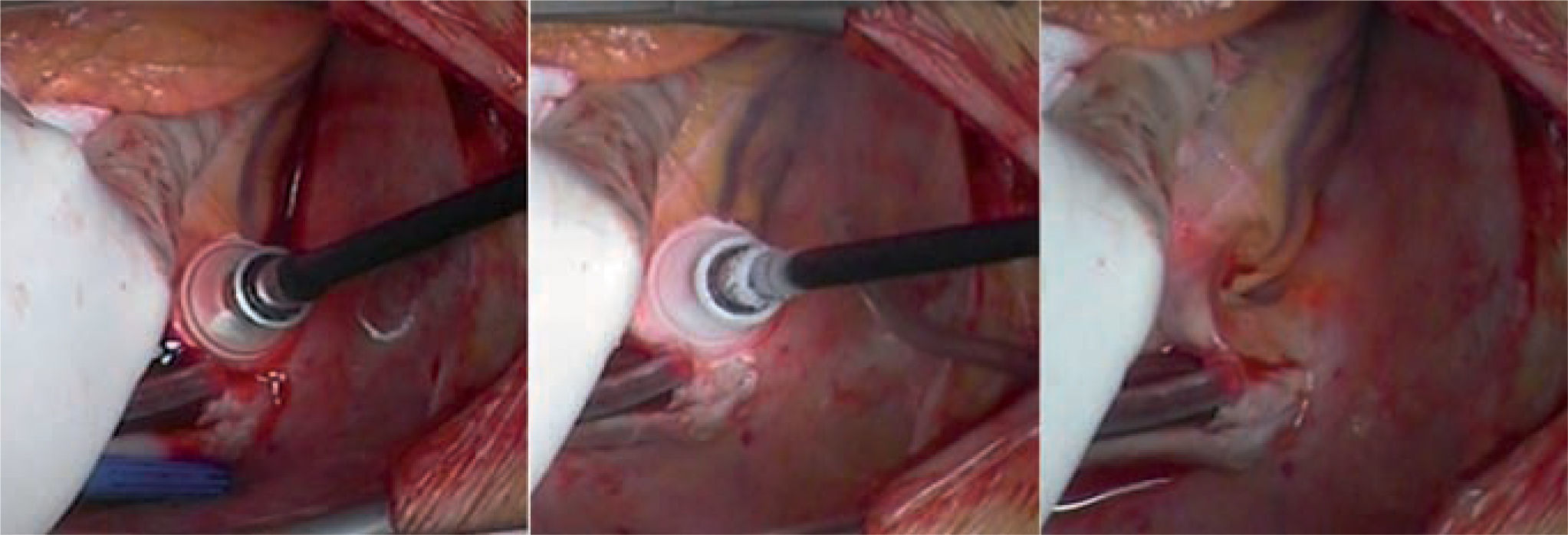
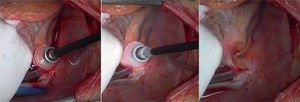
Técnica quirúrgicaEl tratamiento va encaminado a cortar el circuito a nivel del ICT, existiendo quirúrgicamente otras opciones técnicas (Fig. 4). Esta ablación e interrupción del ICT es parte del procedimiento quirúrgico Maze de la FA14,15. La línea de ablación se puede realizar con distintas fuentes de energía quirúrgica. La vía de abordaje de la ablación, a diferencia del catéter, en la cirugía depende del procedimiento asociado. Se puede realizar ablación quirúrgica del ICT sin circulación extracorpórea (Fig. 6), accediendo a través de una bolsa de tabaco en frente del seno coronario16. Si se realiza bajo circulación extracorpórea, asociado a cirugía valvular o coronaria, se puede acceder al istmo a través de una atriotomía derecha o con pequeñas bolsas de tabaco sin atriotomía si se quieren evitar.
Crioablación epicárdica del ICT. Crioablación epicárdica con criodo conal, a –60 °C, que abarca la extensión del área del ICT. Puede apreciarse la cara inferior del ventrículo izquierdo con el trayecto de la arteria coronaria descendente posterior. La ablación es aplicada en el espacio situado entre la cara inferior interna de la vena cava al punto de origen de la arteria coronaria descendente posterior.
La ablación quirúrgica del flutter típico es ocasional y, por lo tanto, es difícil documentar resultados en la literatura17. Los resultados de ablación por catéter según el registro de la Sociedad Española de Cardiología del año 20078 tiene un éxito inmediato superior al 96%, con un 0,65% de complicaciones mayores (vasculares, bloqueo auriculoventricular, accidente cerebrovascular, edema pulmonar). La recidiva del flutter típico a largo plazo es del 15-20%18–20.
Asociación entre el flutter típico y fibrilación auricularEn los últimos años conocemos cada vez más de la relación y asociación entre ambas5,21. La ablación del flutter no mejora la historia natural en la progresión de nuevas arritmias auriculares22. Según algunos autores, un 68% de pacientes desarrollan FA durante los primeros 3 años de la ablación de un flutter típico, siendo el tamaño auricular un factor predictivo23,24. El remodelado eléctrico, con el acortamiento de los periodos refractarios, inducido con anterioridad por el flutter podría predisponer al desarrollo posterior de FA. Esta evolución podría justificar realizar durante la cirugía, además de la ablación del istmo, otras lesiones que pudieran prevenir la FA, en especial por la simplicidad, rapidez, efectividad y seguridad de las ablaciones quirúrgicas. Aunque aún no existen estudios a este respecto, es probable que este planteamiento terapéutico adquiera más relevancia en un futuro próximo, como lo demuestra un similar sentir ya presente en la ablación con catéter25.
Taquicardia auricular macrorreentrante incisionalEn pacientes sometidos a cirugía las incisiones de atriotomía pueden convertirse en el centro en torno al cual gire la activación, dando así lugar a TAMR «incisional», no dependiente del ICT. Aquí la terminología se hace confusa, porque con frecuencia estas taquicardias son llamadas flutter aunque el ECG no muestre frecuencia auricular igual o superior a 240 lpm ni la línea de base ondulante característica del flutter. Muchas TAMR incisionales producen patrones de ECG clasificables como «taquicardia auricular» y sólo el estudio EEF puede determinar el mecanismo preciso y los componentes anatómicos del circuito. Además de las cicatrices de atriotomías pueden contribuir a la reentrada los parches quirúrgicos y también zonas de conducción lenta pericicatriz probablemente por fibrosis.
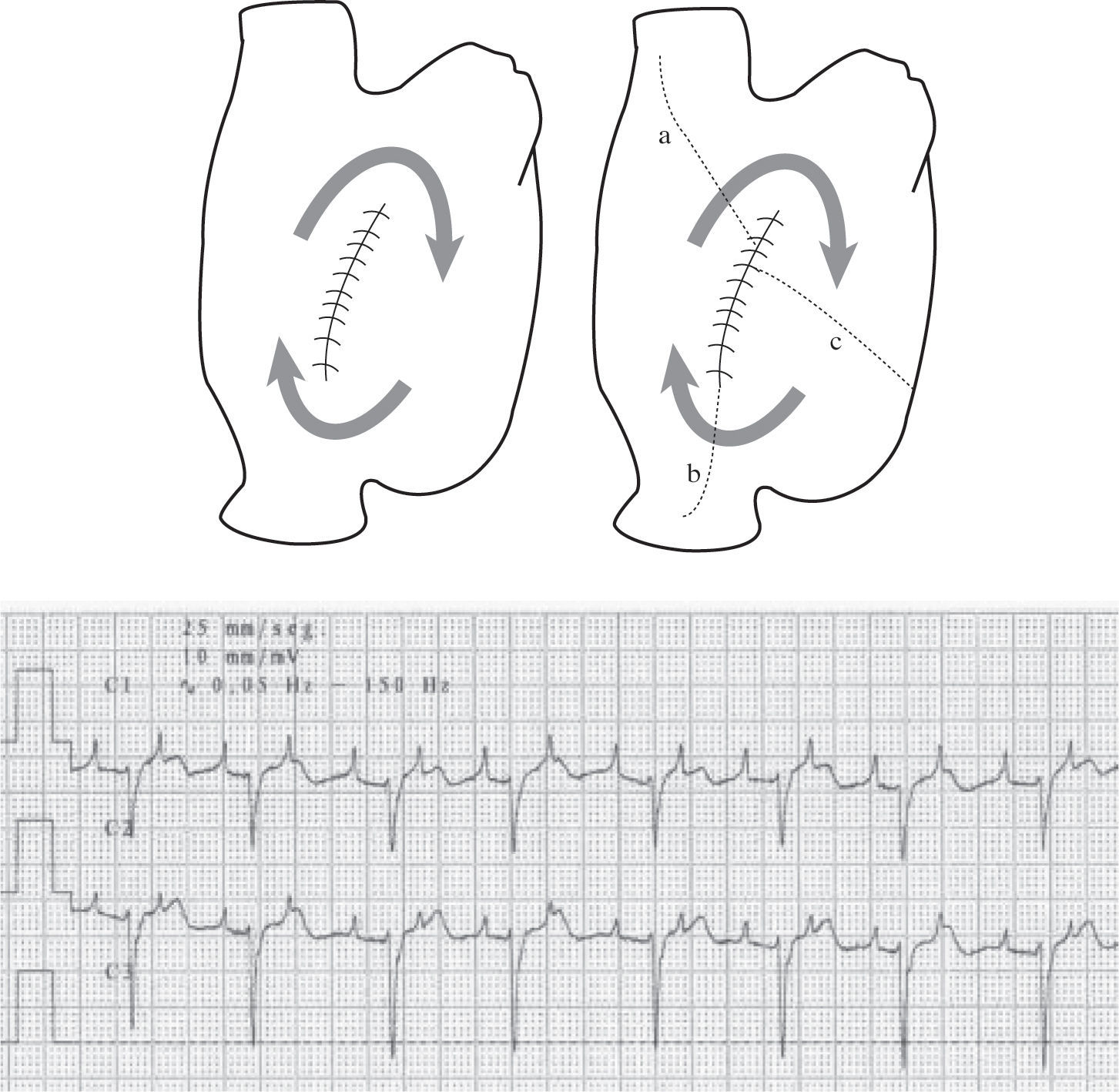
El circuito dependerá de la localización anatómica de la cicatriz quirúrgica, tamaño de la cicatriz, grado remodelado auricular asociado a la cardiopatía quirúrgica, las anomalías congénitas asociadas y la anatomía de la reparación quirúrgica. De este modo, existe un amplio abanico de reentradas, con circuitos diversos de complejidad variada. Desde formas simples de TAMR que asientan alrededor de una incisión en la pared libre de la AD (Fig. 7), a otras formas más graves de arritmias, como por ejemplo las asociadas a la enfermedad auricular posquirúrgica de la intervención de Fontan (Fig. 8). Esta variabilidad en sustratos hace muy difícil el diagnóstico por el ECG. Aquí todo es posible, y el diagnóstico del mecanismo tan sólo lo conoceremos mediante cartografía, con una definición anatómica del circuito, ya sea focal o macrorreentrante, esencial para el tratamiento, que será en muchos casos de ablación con catéter, y en otros quirúrgicos, quizá intervenciones tipo Maze.
TAMR incisional. Izquierda: representa en esquema un trayecto de TAMR incisional sobre una atriotomía de pared libre AD. Derecha: las diversas alternativas quirúrgicas para cortar la reentrada; a: línea de ablación desde la cicatriz a la VCS; b: línea a VCI; c: línea al anillo tricúspide. El registro electrocardiográfico epicárdico de la TAMR, aproximadamente a frecuencia de 150/min, que hace difícil su caracterización sin un estudio electrofisiológico previo con mapeo.
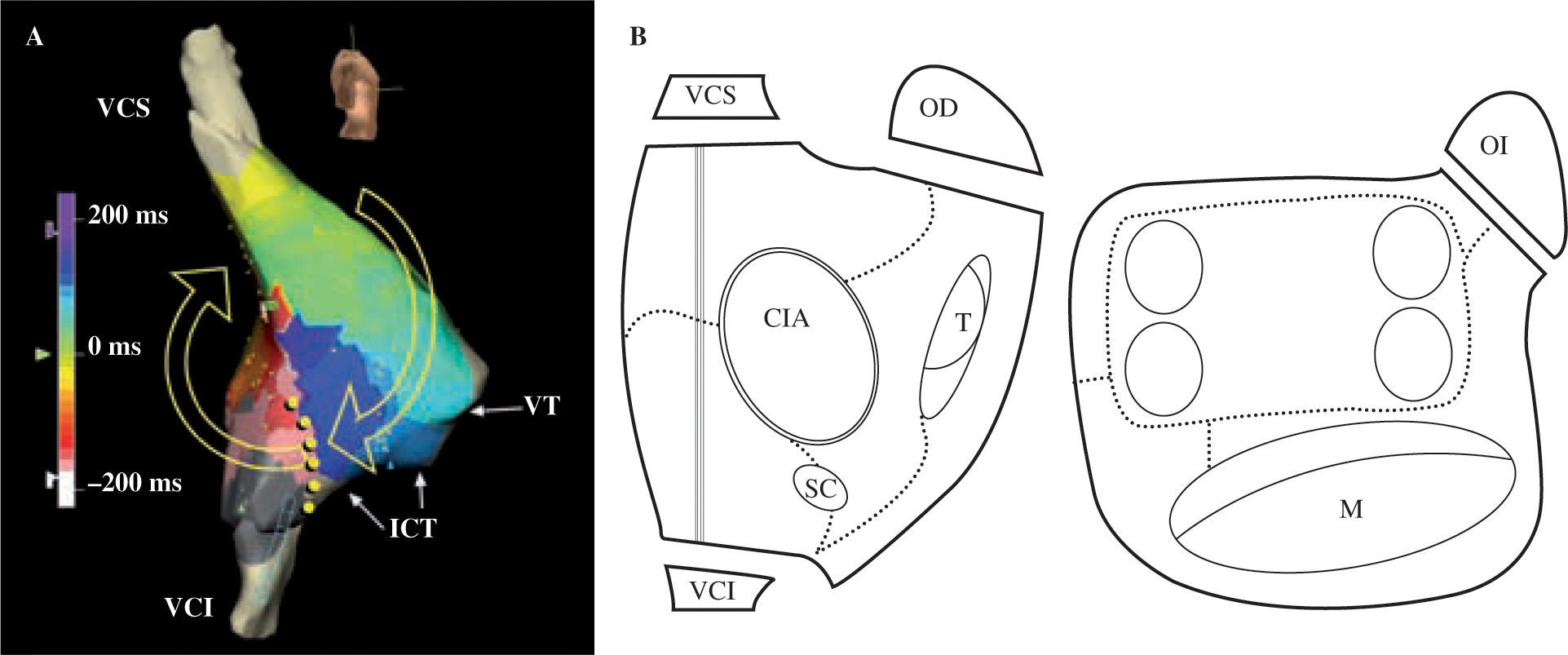
TAMR incisional en corrección quirúrgica tipo Fontan. A: reconstrucción anatómica y cartografía de activación de una TAMR de AD en un paciente operado de atresia pulmonar que clínicamente mostraba dos patrones de taquicardia auricular. La escala muestra la equivalencia de los colores con respecto a tiempos de activación. La línea quebrada entre el azul y el rojo –rosa– es una línea de bloqueo que hace girar la activación a su alrededor sin pasar por el ICT. La parte superior del circuito incluye también la VCS y el giro inferior se hace entre la línea de bloqueo y la VCI. El circuito se interrumpió con una línea de aplicaciones (puntos amarillos) desde el extremo inferior de la línea de bloqueo hasta la VCI. B: esquema de líneas de ablación de la AD con similar patrón al Maze derecho, con la desconexión de ambas cavas. Derecha: patrón de Maze izquierdo. Este patrón de lesiones es propuesto por Mavroudis, et al.26. CIA: comunicación interauricular. Resto de abreviaturas similares a las empleadas en figuras anteriores.
En pacientes con cicatrices en la AD lateral éstas casi siempre se suman al obstáculo «normal» que supone la CT para facilitar la reentrada en torno al anillo tricúspide que caracteriza al flutter típico, dependiente del ICT. Por este motivo, además de hacer una ablación del istmo de la TAMR de cicatriz, está indicada la ablación del ICT, aunque no se haya documentado previamente un flutter típico.
Indicación ablaciónLa ablación con catéter es de elección (recomendaciones clase IIa, nivel de evidencia B), y efectiva en numerosos casos. La ablación con catéter en algunas ocasiones es imposible realizar por la complejidad de las anomalías cardíacas y/o reparaciones quirúrgicas (operaciones de Mustard o Senning y algunas variaciones de la de Fontan). En los últimos años la experiencia con la ablación intraoperatoria está siendo mayor, de tal forma que las recientes guías clínicas de la AHA y el ACC sobre el manejo de adultos con cardiopatía congénita11 y TAMR incisional consideran la cirugía del Maze indicada en dos grupos de pacientes con cirugía previa:
– En pacientes con D-transposición de grandes vasos operados previamente con procedimientos de Mustard o Senning si se van a reoperar por algún motivo (recomendación clase IIa, con nivel de evidencia C). Estos pacientes necesitan con frecuencia reintervenciones por disfunción del ventrículo sistémico o complicaciones en el parche auricular, en las que se puede realizar un procedimiento de Maze.
– En la reoperación para reconversión de Fontan (paso de una conexión atriopulmonar a un túnel lateral intracardíaco, un conducto intraauricular o conducto extracardíaco) está indicada la ablación quirúrgica en la recurrencia de taquicardia/flutter o FA aun sin alteraciones hemodinámicas en la conexión atriopulmonar. En este caso debe realizarse un procedimiento de Maze asociado (recomendación clase IIa, con nivel de evidencia C). En el Fontan la anatomía auricular es muy variable, y por esta razón algunas líneas de ablación son imposibles de realizar con catéter, con tan sólo la cirugía como alternativa.
Técnica quirúrgicaLa interrupción del circuito se logra creando una línea de ablación entre el parche o cicatriz y una estructura barrera no excitable, como la VCI, el anillo tricúspide, fosa oval, o seno coronario (Fig. 7). En los casos asociados a cardiopatías complejas, como las mencionadas antes, la técnica quirúrgica debería ser un procedimiento de Maze III (Fig. 8). En el Maze III no es necesario el EEF preoperatorio, ya que el patrón de lesiones es biauricular completo, anulando, a priori, cualquier posibilidad de reentrada, aunque podría haber recurrencias originadas por focos. Al diseñar las incisiones del Maze debe procurarse que se preserve en lo posible la activación auricular una vez recuperado el ritmo sinusal, sin que queden zonas de las aurículas aisladas.
ResultadosLa ablación con catéter alcanza diferentes grados de efectividad en función de su complejidad electrofisiológica y anatómica. Entre estos pacientes cabe destacar los que tienen taquicardias de cicatriz en la AD, que son más fácilmente tratables y con buenos resultados a largo plazo. Casos más complejos, como las cardiopatías congénitas, pueden ser abordados con un procedimiento Maze III, que a su vez previenen recurrencias y/o la aparición de nuevas arritmias en la evolución de la cardiopatía. Un ejemplo es la intervención de Fontan, que tiene una incidencia a largo plazo de arritmias supraventriculares superior al 50%, frente al 13% en los intervenidos para reconversión de Fontan atriopulmonar con intervención Maze III26,27. En reoperaciones con técnica Mustard o Senning no hay publicaciones acerca de la cirugía de sus arritmias. En estos pacientes la incidencia de taquicardias por macrorreentradas puede ser de hasta el 30%28. Algún autor ha publicado con la ablación percutánea un 90% libre de recurrencia en el seguimiento a corto plazo, con un 14% de aparición de FA en el seguimiento29.
Las TAMR de la AI pueden ser muy complejas, con substratos que incluyen amplias zonas de bajo voltaje sugerentes de fibrosis miocárdica. Hay pocas publicaciones sobre el tratamiento de estas taquicardias con catéter o cirugía, y el pronóstico a largo plazo es desconocido. La indicación de una intervención de Maze o incluso una ablación de la unión AV en estos casos ha de individualizarse dependiendo de la experiencia del equipo de cirujanos y electrofisiólogos.
Profilaxis de la taquicardia auricular macrorreentrante incisionalLa prevención primaria de las arritmias es un aspecto imprescindible dentro de la técnica de las correcciones quirúrgicas de las cardiopatías, en especial congénitas. La mejor técnica quirúrgica antiarrítmica ha de prevenir las arritmias. Cualquier incisión quirúrgica es un potencial foco/sustrato para una futura arritmia30. Las incisiones (líneas de suturas) y parches aislados son la causa más frecuente de futuras reentradas5. En la técnica quirúrgica debemos integrar los actuales conocimientos sobre los mecanismos de las arritmias. Y así evitar factores proarrítmicos como los gaps en las líneas de ablación, las incisiones aisladas, incisiones anfractuosas, parches aislados, la atrición de la función contráctil auricular que favorece un remodelado proarrítmico, aurículas dilatadas con amplias áreas de tejido, etc. Evitar las correcciones no anatómicas, paliativas, incompletas, y las situaciones residuales de sobrecarga de volumen y presión. La cirugía no debe crear barreras eléctricas aisladas en la pared auricular, prolongando alguno de sus extremos a estructuras barrera no excitables, por ejemplo las venas cavas, y los anillos auriculoventriculares.
Macrorreentrada auricular tras cirugía de la fibrilación auricularExisten arritmias postablación de la FA que merecen una mención especial por tratarse de TAMR que en cierto modo podrían ser consideradas incisionales. Como hemos comentado, el empleo de ablación condiciona la posibilidad de una lesión no transmural o discontinua (gap) que puede sostener una reentrada y, por lo tanto, ser un factor proarrítmico añadido31,32. La incidencia de TAMR, taquicardia/flutter, tras la cirugía de la FA, varía según series del 3-10%33. El mecanismo o sustrato arrítmico es variable en las diferentes series, probablemente por pacientes con cardiopatías variadas, los distintos patrones de lesión, la transmuralidad de la energía empleada, áreas de fibrosis auricular, etc. En pacientes con aurículas muy dilatadas, cardiopatía estructural evolucionada y FA de larga duración la incidencia de arritmias en el seguimiento es mayor34,35. Y no todas las taquiarritmias tras la ablación de la FA son por reentradas, pues existe un 30% con origen focal o microrreentrada36. Como hemos comentado, es difícil diagnosticar el tipo de mecanismo mediante el ECG de superficie, por lo que se requiere un estudio EEF12.
Entre los tipos de TAMR postablación quirúrgica de la FA, hay autores que han descrito principalmente flutter típico dependiente del ICT37,38, recomendando realizar siempre de forma conjunta la ablación del istmo con las líneas de la AI (mini-Maze)13,38. Sin embargo, no existen estudios quirúrgicos prospectivos aleatorizados a este respecto. En oposición, estudios de ablación de FA con catéter no han encontrado una mayor incidencia de flutter postablación cuando no se realiza el ICT39,40, aunque quizás estos resultados los debemos considerar los cirujanos con cautela por provenir de poblaciones diferentes a las habituales en la cirugía.
Otros autores han encontrado, con más frecuencia, flutter atípico derecho o izquierdo no dependiente del ICT, con reentradas de localización variable, la mayoría en relación con gaps o lesiones incompletas41,42.
Respecto al manejo de estas arritmias, no existen indicaciones quirúrgicas. Por el momento la experiencia de cada grupo define el protocolo de actuación. Su ablación suele ser con catéter, y en los casos refractarios se indica la ablación del nodo auriculoventricular con implantación de marcapasos. Es imprescindible un EEF para mapear y ablacionar la reentrada, a veces difícil tras una cirugía cardíaca, por ejemplo con prótesis mitral. No se contempla la reintervención quirúrgica para tratar estas arritmias.
Existen otras formas de tratamiento en la cirugía de la FA que intentan disminuir o prevenir la aparición de recurrencias y nuevas arritmias auriculares en el postoperatorio de estos pacientes. En los últimos años, diferentes estudios han mostrado un papel importante del tono autónomo parasimpático43,44. En concreto, se ha demostrado que desempeñan un papel sinérgico con los focos ectópicos auriculares disminuyendo el umbral de inducción para la FA45. Hay estudios en ablación de la FA que demuestran menor recurrencia de FA, flutter y taquicardia auricular cuando se asocia la ablación de los plexos ganglionares cardíacos46. Sin embargo no existe consenso a este respecto, ni estudios prospectivos que avalen dichas prácticas.
Taquicardia auricular macrorreentrante no incisionalEn los últimos años, y con una incidencia baja, la cartografía y los estudios de ablación han definido macrorreentradas diversas a lo largo de toda la anatomía auricular. El sustrato de estas TAMR es primario, no asociado a lesión auricular iatrogénica. Se asocia a cardiopatía estructural y alteraciones a nivel auricular como la dilatación, la sobrecarga de presión o volumen, etc. En ocasiones está descrita su aparición tras la ablación de la FA, como antes hemos mencionado. Suele corresponder a áreas anisotrópicas de fibrosis, de menor voltaje, cercana a una estructura anatómica como los orificios de las venas cava47,48, anillo mitral o las venas pulmonares49,50. El mapeo EEF es imprescindible para su diagnóstico y tratamiento. En ocasiones pueden ser tratadas mediante la ablación con catéter (recomendaciones clase IIa, nivel de evidencia B). Si bien hay series de ablación con catéter de taquicardias macrorreentrantes atípicas (distintas del flutter típico) que hablan de éxito en torno al 50% o superior, no existe ningún seguimiento a medio-largo plazo. Tampoco nadie ha demostrado que la cartografía y ablación de taquicardias macrorreentrantes atípicas sea superior a la ablación de la unión auriculoventricular con implante de marcapasos.
La TAMR de AI y el flutter atípico por circuito no ICT dependiente, son dos de sus formas. El flutter atípico es una arritmia a menudo inestable, con reentradas de trayecto variable, asociándose a flutter típico y FA, en un 80%. Y en el 35% de los casos evolucionan a FA durante el seguimiento. En el Registro Español de Ablación por Catéter del año 20079, se recogen un total de 82 procedimientos. La ablación se completó con éxito en 57 casos (70,3%). El tratamiento fue efectivo en el 83% cuando se trató la AD, y 52% en la izquierda. En las series de cirugía de ablación, el flutter atípico aislado es una indicación anecdótica17.
El cirujano debe conocer y comprender sus mecanismos por si se asocia antes de la intervención a alguna cardiopatía quirúrgica. En estos casos la intervención debería realizar un patrón selectivo de lesiones encaminado a aislar la zona escara y/o unirla con una lesión lineal a alguna estructura anatómica próxima. Este patrón selectivo ofrece la ventaja de la simplicidad, aunque ha de sustentarse en un buen EEF pre e intraoperatorio que defina la anatomía exacta de los circuitos y con ello el patrón de lesiones, lo cual por el momento no se realiza. Como desventaja, el patrón simple y selectivo de lesión tiene el riesgo de recurrencias de otros circuitos desde otras áreas. En la actualidad, sin control intraoperatorio, sólo es posible un patrón Maze completo biauricular que interrumpa todas las posibles macrorreentradas (Fig. 9), aunque con el riesgo de recurrencia por no tratar específicamente las zonas de fibrosis51.
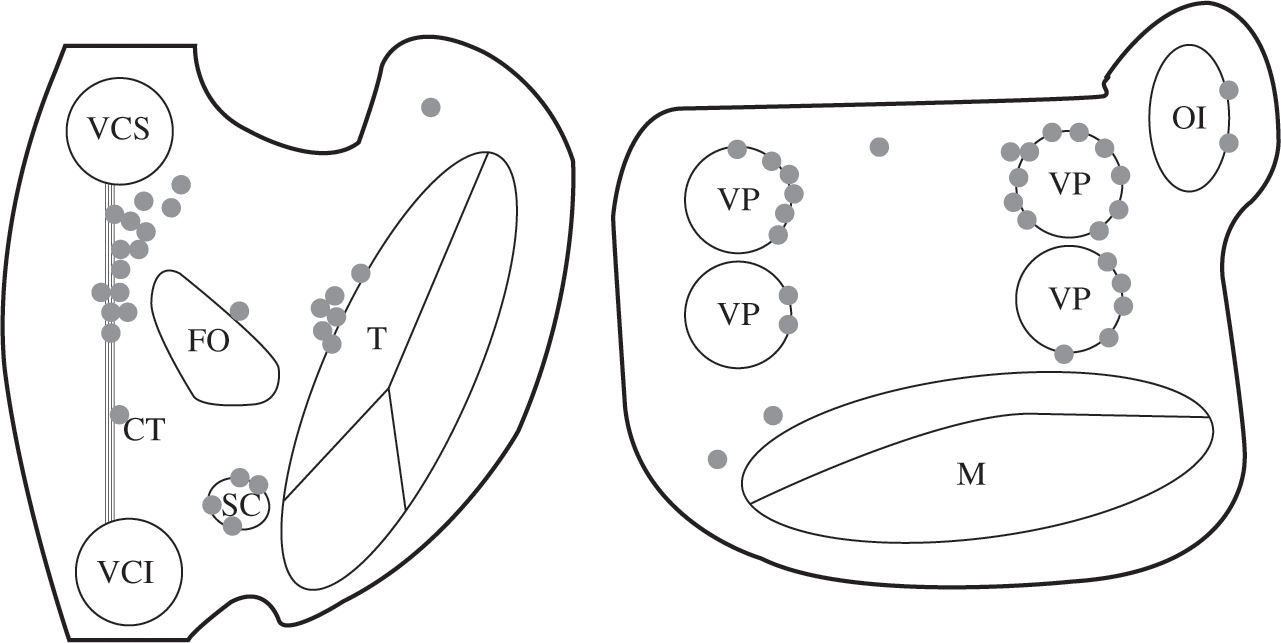
Taquicardia auricular focalFocal es una taquicardia que se origina desde un punto o pequeña área anatómica desde la que la activación se propaga radialmente a las dos aurículas. Puede haber un trayecto relativamente largo entre el foco mismo y su «salida» o conexión con el miocardio auricular. Se puede especular si el mecanismo del foco es automatismo anormal o un circuito de reentrada de radio muy pequeño, pero no tiene utilidad clínica. La mayoría asientan en la AD, aunque un 18% están en la izquierda, y en el 10% son de origen multifocal52. Estos puntos de origen suelen situarse en las zonas de intersección o cambio de orientación de las fibras miocárdicas, como son las orejuelas, CT y venas pulmonares (Fig. 10)53.Tiene un buen pronóstico, excepto las formas incesantes que provocan una taquimiocardiopatía. El tratamiento farmacológico es ineficaz en un 66% de casos, habiendo sido la cirugía la única alternativa terapéutica en los pacientes más graves54,55, aunque en la actualidad el catéter es de elección. El tratamiento percutáneo con catéter precisa de su localización mediante mapeo EEF.
Distribución anatómica más frecuente de la taquicardia auricular focal. En 186 pacientes con 196 taquicardias focales, Lee, et al.53 localizan un 31% en CT, 11% perinodales, 8% ostium seno coronario, 2% seno coronario, 0,6% orejuela izquierda, 19% venas pulmonares, 0,6% orejuela derecha. Mismas abreviaturas que en figuras anteriores.
Un patrón clásico de taquicardia auricular con frecuencia auricular entre 100-200 lpm, con ondas P bien definidas, es sugerente de taquicardia focal, si no hay cardiopatía estructural grave ni intervención previa. En pacientes con intervención previa, especialmente si se trata de un procedimiento de Fontan o Mustard/Senning e incluso en pacientes sin intervención previa, pero con cardiopatía estructural importante, las TAMR pueden tener frecuencias relativamente bajas, en torno a 200 lpm, y registrar ondas P bien definidas. Algunas taquicardias posquirúrgicas pueden ser focales, a pesar de la existencia de obstáculos anatómicos iatrogénicos.
Las taquicardias auriculares conocidas como multifocales no tienen mucho que ver con ablación o cirugía, ya que se deben la mayoría a alteraciones difusas de la membrana del miocardio auricular con automatismo anormal, generalmente relacionadas con descarga adrenérgica, hipoxemia, hipocaliemia, hipomagnesemia, fármacos inhibidores de fosfodiesterasa.
En pacientes sintomáticos el tratamiento de elección es con catéter (recomendaciones clase I, nivel de evidencia B). El tratamiento percutáneo es efectivo en el 80 y el 95% de los casos56, con una incidencia de recidivas a medio plazo del 10-20%.
La indicación quirúrgica es ocasional, incluso entre los grupos quirúrgicos con experiencia, reservándose a los casos sintomáticos, con formas incesantes refractarias al tratamiento médico y ablación percutánea, como suelen ser algunos focos epicárdicos, taquicardias por focos múltiples, o con indicación quirúrgica asociada por enfermedad cardíaca. En caso de intervención es necesario su localización mediante un EEF, y un protocolo intraoperatorio postablación que confirme la efectividad del procedimiento. La técnica quirúrgica es la destrucción del foco o su aislamiento con ablación o incisiones circunferenciales en torno al mismo57. En los casos de taquicardias auriculares multifocales puede realizarse el aislamiento eléctrico de la aurícula58. La experiencia quirúrgica actual es muy limitada pero altamente efectiva54,55,57.