Aunque la bioprótesis aórtica Trifecta™ (Abbott Vascular, Santa Clara, California) presenta un buen comportamiento hemodinámico a corto plazo, se ha descrito un aumento de deterioro estructural precoz. El objetivo principal de nuestro estudio es analizar la incidencia de degeneración protésica precoz en nuestro centro.
MétodosSe realizó un análisis retrospectivo de todos los pacientes sometidos a cirugía de sustitución valvular aórtica por prótesis Trifecta™ desde julio de 2013 a julio de 2021 en nuestro centro. Se analizó la incidencia de deterioro estructural protésico mediante un análisis de riesgos competitivos de Fine & Gray.
ResultadosUn total de 453 pacientes fueron sometidos a sustitución valvular aórtica por una prótesis Trifecta™. La media de edad fue de 71,6±10,1 años, y el 55,4% (n=251) eran varones. La mediana de seguimiento fue de 40 (IQR 20-58) meses. La incidencia de deterioro estructural moderado-severo fue del 5,5% (n=25). La supervivencia libre de deterioro estructural moderado-severo al año, a los 3años y a los 5años fue del 99,7%, del 97,5% y del 92,7%, respectivamente. En el análisis multivariable se detectó como factor protector independiente de deterioro precoz la edad mayor a 80años (sHR 0,21 [0,05-0,86], p=0,03). No detectamos una mayor incidencia en tamaños protésicos menor o igual a 21mm (sHR 0,46 [0,21-1,01], p=0,054).
ConclusionesLa prótesis Trifecta™ presenta una tasa de deterioro estructural precoz mayor a la esperada. Los pacientes con prótesis Trifecta™ deberían ser sometidos a un estrecho seguimiento con ecocardiogramas anuales.
Although most studies have shown that the Trifecta™ bioprosthesis (Abbott Vascular, Santa Clara, California) has an excellent hemodynamic performance, there have been an increase of premature structural failure of the Trifecta™ bioprosthesis. The main objective of this study weas to report our single-center experience.
MethodsWe performed a retrospective analysis including all patients undergoing aortic valve replacement with Trifecta™ prosthesis from 2013 July to 2021 July in our center. Fine-Gray regression model was created with structural valve degeneration and death as competing risk events.
Results453 patients underwent an aortic valve replacement with a Trifecta™ aortic bioprosthesis. Mean age was 71.6±10.1 years, with 55.4% (n=251) men. Median follow-up was 40 (IQR 20-58) months. The incidence of moderate-severe structural valve deterioration was 5.5% (n=25). Overall freedom from moderate-severe structural valve degeneration at 1year, 3years and 5years was 99.7%, 97.5% and 92.7%, respectively. The multivariable analysis age over 80years was detected as an independent protective factor for early structural valve deterioration (sHR 0.21 [0.05-0.86], P=.03). A higher incidence in prosthetic sizes less than or equal to 21mm was not detected (sHR 0.46 [0.21-1.01], P=.054).
ConclusionsThe Trifecta™ bioprosthesis presented a rate of early structural deterioration higher than expected. Patients with Trifecta™ prostheses should be closely followed-up with yearly echocardiograms.
La elección del implante de un determinado tipo de prótesis, ya sea biológica o mecánica, se debe realizar de manera individualizada atendiendo a la edad, las comorbilidades asociadas y las preferencias de cada paciente1. Las prótesis biológicas presentan la ventaja de no requerir anticoagulación a largo plazo, siendo su principal inconveniente la mayor susceptibilidad al deterioro estructural protésico, que resulta en una mayor necesidad de reintervención2-6.
La bioprótesis Trifecta™ (Abbott Vascular, Santa Clara, California) es una prótesis biológica formada por tres velos de pericardio bovino montados externamente sobre un stent de titanio que obtuvo la marca de conformidad europea (CE) en 20091. Se trata de una prótesis diseñada para un implante supraanular y con un tratamiento anticalcificante con etanol que reduce la calcificación del tejido7,8.
Aunque se ha demostrado que la prótesis Trifecta™ presenta un excelente comportamiento hemodinámico a corto plazo, se ha observado una incidencia de deterioro estructural protésico precoz mayor a lo esperado7,9,10.
El principal objetivo de nuestro estudio es presentar la experiencia de nuestro centro con la bioprótesis aórtica Trifecta™.
MétodosSe realizó un análisis retrospectivo de todos los pacientes sometidos a cirugía de sustitución valvular aórtica por prótesis Trifecta™ desde julio de 2013 a julio de 2021 en nuestro centro.
Las intervenciones fueron realizadas por todos los cirujanos miembros del equipo de cirugía cardiaca de nuestro centro siguiendo la misma técnica quirúrgica. El implante de la prótesis se realizó con sutura doble de polifilamento trenzado irreabsorbible de 2/0 apoyado en parche de teflón en la cara ventricular. Los puntos se anudaron en todos los casos tras la retirada del soporte de la prótesis.
Las características basales preoperatorias, intraoperatorias y postoperatorias se extrajeron de la base de datos de nuestro servicio. En todos los pacientes se realizó un ecocardiograma al alta, a los 6meses, al año de seguimiento y posteriormente anualmente. Se evaluó el último ecocardiograma realizado en nuestro centro durante el seguimiento de cada uno de los pacientes. La mortalidad se obtuvo del Índice Nacional de Defunciones (INDEF). El objetivo primario fue analizar la supervivencia libre de deterioro estructural moderado-severo. Los objetivos secundarios fueron analizar la supervivencia global de la muestra y la supervivencia libre del evento combinado de muerte, reoperación, infarto agudo de miocardio (IAM), accidente cerebrovascular (ACV) y endocarditis.
El deterioro estructural protésico se definió ecocardiográficamente según el documento de consenso de la European Association for Cardio-Thoracic Surgery (EACTS) y la European Society of Cardiology (ESC)11. El deterioro estructural moderado se definió como la presencia de un gradiente medio >20 y <40mmHg, cambios de >10 y <20mmHg del ecocardiograma de base posquirúrgico o la presencia de un jet de regurgitación intraprotésico moderado. El deterioro estructural severo se definió como la presencia de un gradiente medio >40mmHg, cambios en el gradiente medio del ecocardiograma de base >20mmHg y/o la presencia de un jet de regurgitación severo intraprotésico11.
El estudio fue aprobado por el comité ético del hospital y se obtuvo el consentimiento informado de todos los pacientes.
Análisis estadísticoSe aplicó el test de normalidad de Shapiro Wilk a todas las variables continuas. Las variables continuas se expresaron como media y desviación estándar o mediana e IQR según la normalidad de la distribución. Las variables categóricas se expresaron con frecuencia absoluta y relativa (%). La comparación de variables cuantitativas se realizó mediante un análisis de la varianza (ANOVA) o con el test de Kruskal-Wallis para muestras independientes. Se consideraron diferencias estadísticamente significativas aquellas con una p<0,05. La supervivencia se estimó utilizando el método de Kaplan Meier. Se realizó un modelo de regresión de riesgos competitivos de Fine-Gray utilizando el deterioro estructural y la muerte como eventos competitivos. El modelo de regresión se estimó a partir de la función de incidencia acumulada del deterioro estructural protésico. La edad se estratificó en cuatro subgrupos de edad. Las variables en la que se obtuvo una p<0,2 en el análisis univariable se incluyeron en el análisis multivariable. El análisis estadístico se llevó a cabo utilizando el programa Stata 15 (StataCorp 2015, College Station, TX, Estados Unidos).
ResultadosDurante el periodo de estudio un total de 453 pacientes fueron sometidos a sustitución valvular aórtica por una prótesis aórtica Trifecta™ (tabla 1). La media de edad fue de 71,6±10,1 años, y el 55,4% (n=251) eran varones. La media del EuroScoreI yII fue de 7,6±3,1% y de 6,7±9,8%, respectivamente. Se realizó una cirugía programada en el 66,2% (n=300) de los pacientes. Setenta y un pacientes (15,7%) fueron sometidos a cirugía coronaria concomitante. Se realizó cirugía valvular múltiple en el 19,4% (n=88) de los pacientes y cirugía de la aorta torácica en el 15,7% (n=71). El tamaño de prótesis más utilizado fue 21 (34,9%) y 23 (34,7%).
Características basales
| Trifecta™ (n=453) | |
|---|---|
| Sexo masculino | 251 (55,4%) |
| Edad (años) | 71,6±10,1 |
| >80 años | 96 (21,2%) |
| 79-79 años | 204 (45,0%) |
| 60-69 años | 103 (22,7%) |
| <59 años | 50 (11,0%) |
| IMC | 28,4±4,8 |
| Superficie corporal | 1,8±0,2 |
| Cirugía cardíaca previa | 87 (19,2%) |
| Cirugía valvular aórtica previa | 64 (14,1%) |
| Hipertensión arterial | 327 (72,2%) |
| Diabetes | 135 (29,8%) |
| Fumador | 10 (2,2%) |
| Dislipemia | 283 (62,5%) |
| EPOC | 41 (9,1%) |
| Enfermedad renal (aclaramiento <60ml/1,73m2/min) | 62 (13,7%) |
| NYHA III-IV | 162 (35,8%) |
| Cirugía programada | 300 (66,2%) |
| Cirugía durante el ingreso | 143 (31,6%) |
| Cirugía emergente | 10 (2,2%) |
| ACV previo | 30 (6,6%) |
| IAM previo | 50 (11,0%) |
| Shock cardiogénico preoperatorio | 7 (1,6%) |
| EUROSCORE I (%) | 7,6±3,1 |
| EUROSCORE II (%) | 6,7±9,8 |
| Degenerativa | 225 (49,7%) |
| Bicúspide | 59 (13,0%) |
| Endocarditis | 45 (9,9%) |
| Reumática | 43 (9,5%) |
| Disfunción protésica | 42 (9,3%) |
| Anulectasia | 32 (7,1%) |
| Prolapso | 5 (1,1%) |
| Fallo plastia previa | 2 (0,4%) |
| Estenosis aórtica moderada-severa | 318 (70,2%) |
| Insuficiencia aórtica moderada-severa | 209 (46,1%) |
| Valvulopatía mitral concomitante | 54 (11,9%) |
| Valvulopatía tricúspide concomitante | 20 (4,4%) |
| Patología aórtica | 74 (16,3%) |
| PSAP>55mmHg | 36 (7,9%) |
| FEVI | |
| >60% | 335 (74,0%) |
| 51-60% | 62 (13,7%) |
| 31-50% | 47 (10,4%) |
| 20-30% | 9 (2,0%) |
| Miniesternotomía | 44 (9,7%) |
| Tiempo CEC (min) | 98,3±50,3 |
| Tiempo isquemia (min) | 77,2±35,2 |
| Tiempo parada circulatoria (min) | 32,3±24,8 |
| CABG | 71 (15,7%) |
| Cirugía valvular múltiple | 88 (19,4%) |
| Cirugía aorta torácica | 71 (15,7%) |
| Tamaño prótesis Trifecta™ | |
| 19 | 55 (12,1%) |
| 21 | 158 (34,9%) |
| 23 | 157 (34,7%) |
| 25 | 77 (17,0%) |
| 27 | 5 (1,1%) |
| 29 | 1 (0,2%) |
Las variables continuas se presentan con la media y la desviación estándar o la mediana e IQR, y las variables categóricas se presentan con la frecuencia relativa y la absoluta.
ACV: accidente cerebrovascular; CABG: coronary artery bypass grafting; CEC: circulación extracorpórea; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IMC: índice de masa corporal; NYHA: New York Heart Association; PSAP: presión sistólica de la arteria pulmonar.
La mediana de seguimiento fue de 40 (IQR 20-58) meses. Las principales características ecocardiográficas durante el seguimiento se resumen en la tabla 2. La media del gradiente aórtico medio fue de 9,5 ±6,2mmHg.
Resultados ecocardiográficos durante el seguimiento
| Trifecta™ ≤ 21 | Trifecta™ >21 | n=453 | |
|---|---|---|---|
| Gradiente máximo (mmHg) | 20,8±10,6 | 17,4±10,6 | 18,9±10,7 |
| Gradiente medio (mmHg) | 10,4±6,2 | 8,8±6,1 | 9,5±6,2 |
| Velocidad máxima (cm/s) | 219,4±52,3 | 196,2±58,4 | 206,6±56,9 |
| FEVI% | 61,2±7,1 | 59,9±8,3 | 60,5±7,8 |
| Área del orificio efectiva (cm2) | 1,5±0,5 | 1,9±0,4 | 1,8±0,5 |
Las variables continuas se presentan con la media y la desviación estándar o la mediana e IQR, y las variables categóricas se presentan con la frecuencia relativa y la absoluta.
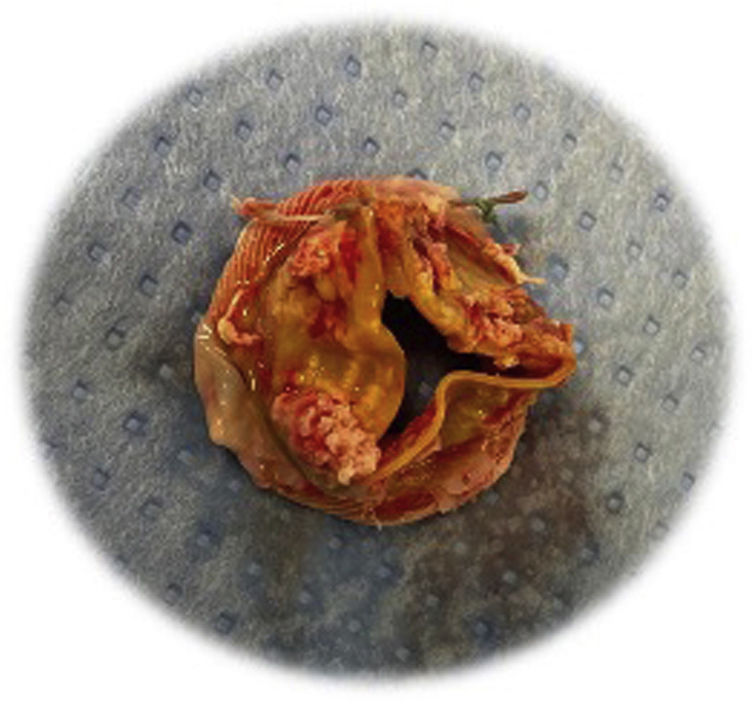
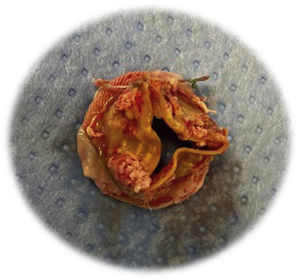
La incidencia de deterioro estructural moderado-severo fue del 5,5% (n=25) (tabla 3). Con respecto a la presencia de regurgitación intraprotésica, el 4,9% (n=22) presentaron regurgitación intraprotésica leve y el 1,8%, moderada-severa. La incidencia de regurgitación periprotésica moderada-severa fue del 0,66% (n=3). La figura 1 muestra una prótesis biológica Trifecta™ degenerada.
Modelo de riesgos competitivos de Fine-Gray
| Univariable | Multivariable | |||
|---|---|---|---|---|
| Covariable | Subdistribución HR (IC 95%) | p | Subdistribución HR (IC 95%) | p |
| Edad (años) | ||||
| 60-69 | 0,99 (0,33-3,02) | 0,987 | 0,92 (0,29-2,92) | 0,883 |
| 70-79 | 0,51 (0,15-1,71) | 0,274 | 0,38 (0,11-1,32) | 0,127 |
| >80 | 0,27 (0,06-1,15) | 0,076 | 0,21 (0,05-0,86) | 0,030 |
| Sexo | 0,64 (0,29-1,47) | 0,649 | − | − |
| Cirugía cardiaca previa | 0,67 (0,20-2,24) | 0,517 | − | − |
| Cirugía valvular aórtica previa | 0,87 (0,38-1,99) | 0,748 | − | − |
| Tamaño Trifecta™ | ||||
| 19-21 | 1,69 (0,79-3,64) | − | − | |
| >21 | 0,59 (0,27-1,27) | 0,177 | 0,46 (0,21-1,01) | 0,054 |
| Fracaso renal | 0,38 (0,05-2,8) | 0,343 | − | − |
| Diabetes | 0,99 (0,70-1,41) | 0,983 | − | − |
| Válvula aórtica bicúspide | 1,15 (0,34-3,85) | 0,819 | − | − |
| CABG | 1,84 (0,74-4,56) | 0,176 | 1,72 (0,67-4,41) | 0,262 |
| Fibrilación auricular | 0,98 (0,91-1,04) | 0,483 | − | − |
CABG: coronary artery bypass grafting; HR: hazard ratio.
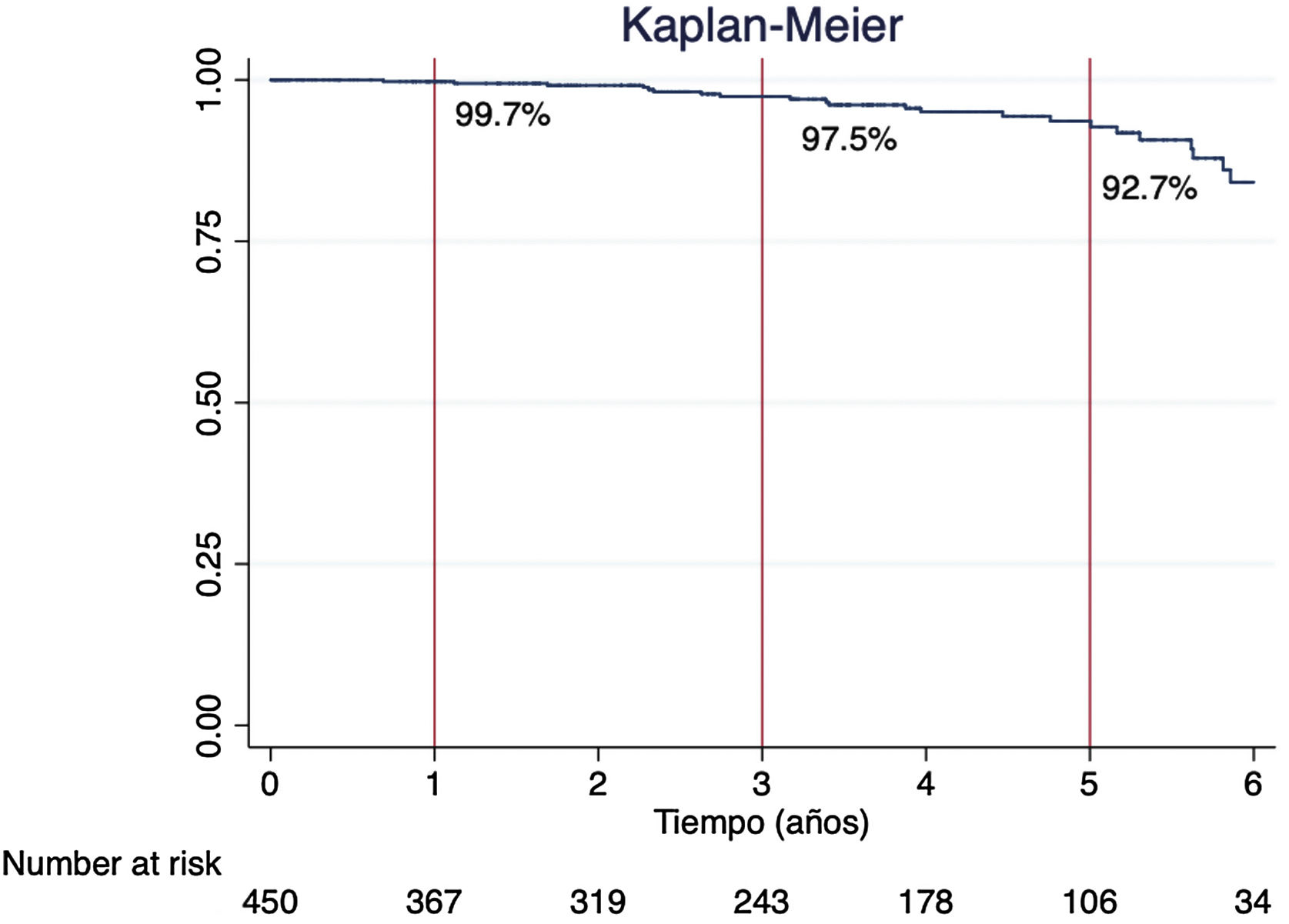
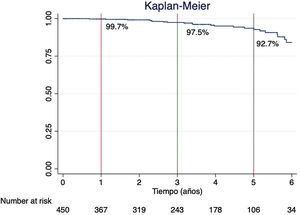
El tamaño protésico de las bioprótesis degeneradas fue: 19 (n=5, 20%), 21 (n=9, 36%), 23 (n=6, 24%) y 25 (n=5, 20%). La mediana de tiempo de desarrollo de deterioro estructural moderado-severo fue de 38,4 (IQR 20,3-58,5) meses. La supervivencia libre de deterioro estructural moderado-severo al año, a los 3años y a los 5años fue del 99,7%, del 97,5% y del 92,7%, respectivamente (fig. 2).
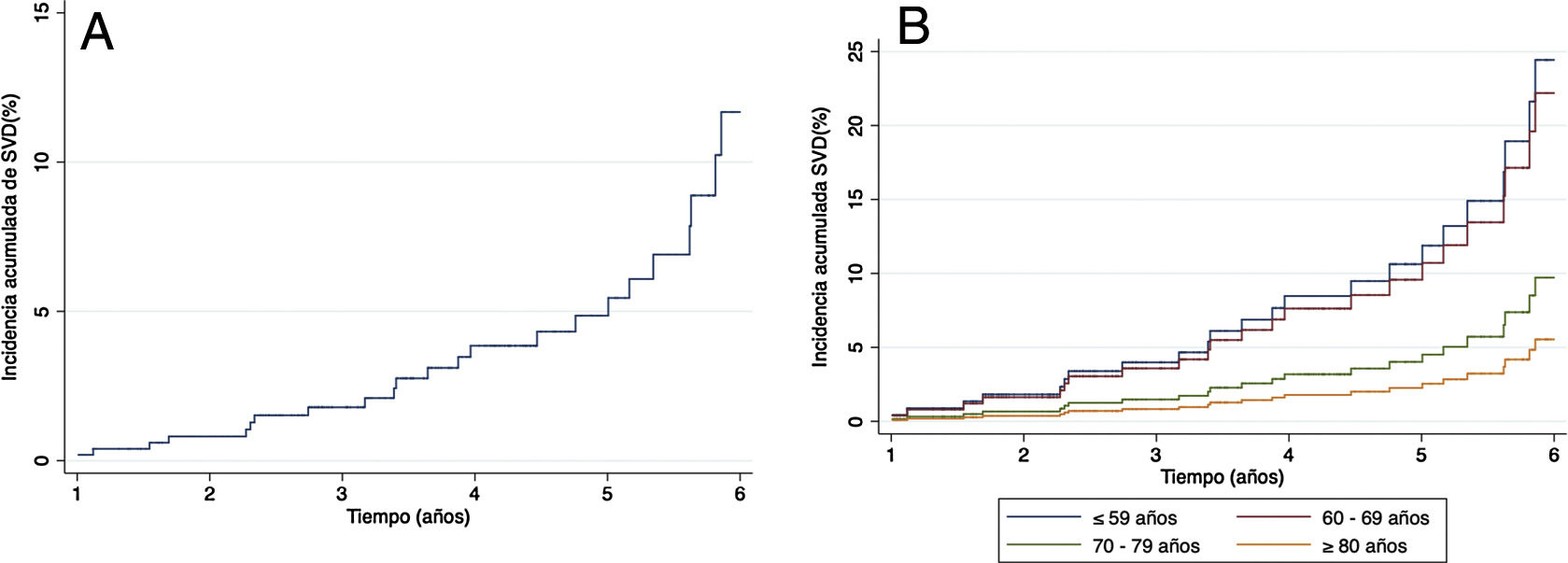
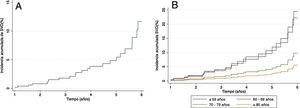
Se realizó un análisis de riesgos competitivos de Fine-Gray utilizando la variable muerte como factor competitivo. De las variables analizadas, se obtuvieron diferencias estadísticamente significativas en los pacientes mayores de 80años (p=0,003) (tabla 3). La figura 3A representa la incidencia acumulada de deterioro estructural moderado-severo a los 3años y a los 5años del 2,5% y del 7%, respectivamente. La figura 3B muestra la incidencia de deterioro estructural estratificado por subgrupos de edad. Podemos observar dos patrones de curva diferenciados entre los pacientes menores de 69años y los mayores de 70años, y cómo los menores de 69años presentaban una mayor incidencia acumulada de deterioro estructural.
Función de incidencia acumulada de deterioro estructural protésico. A)Función de incidencia acumulada de deterioro estructural moderado-severo global. B)Función de incidencia de deterioro estructural moderado-severo estratificado por subgrupos de edad.
SVD: deterioro estructural protésico.
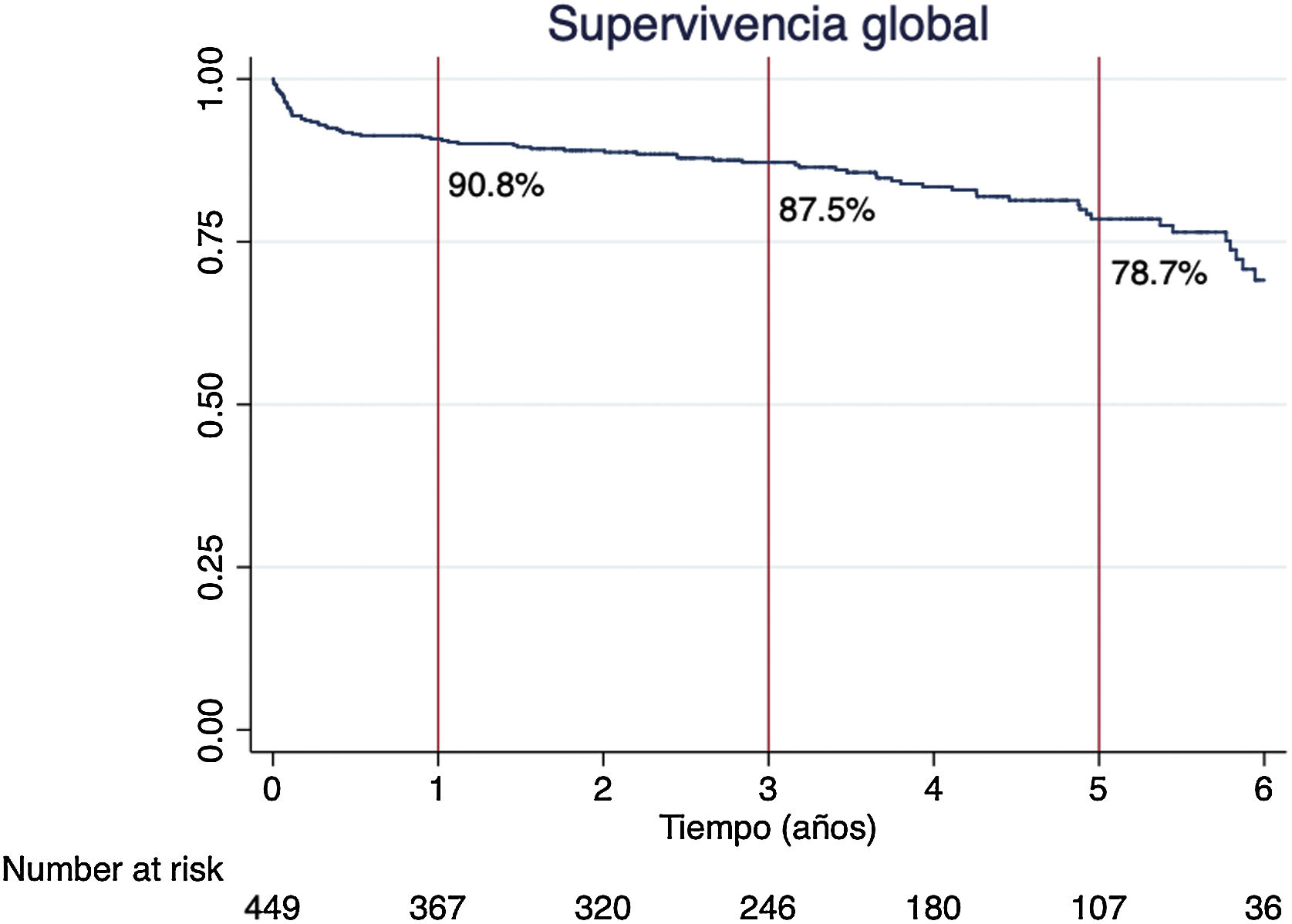
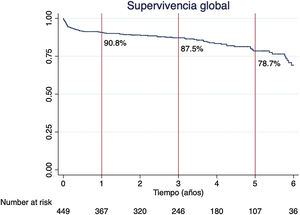
La supervivencia global al año, a los 3años y a los 5años fue del 90,8%, del 87,5% y del 78,7%, respectivamente (fig. 4).
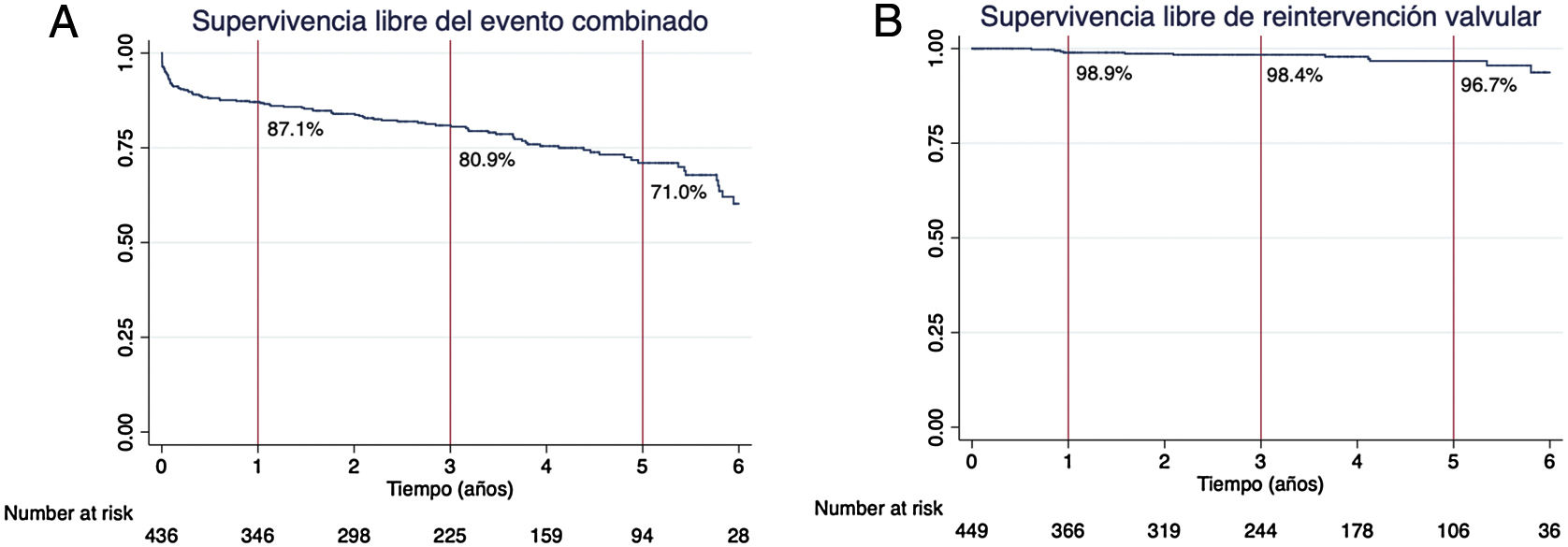
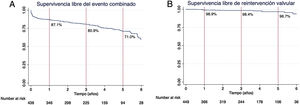
Durante el seguimiento, 13 pacientes (2,9%) presentaron un IAM, 43 pacientes (9,5%) presentaron algún evento cerebrovascular, 14 pacientes (3,1%) desarrollaron una endocarditis y 11 pacientes (2,4%) tuvieron que ser reoperados. Las principales causas de reintervención fue endocarditis en 8 (72,7%) pacientes y deterioro estructural protésico en 3 (27,3%) pacientes. La supervivencia libre del evento combinado de muerte, endocarditis, reintervención, ACV e IAM fue del 87,1%, del 80,9% y del 71,0% al año, a los 3años y a los 5años (fig. 5A). La supervivencia libre de reintervención valvular al año, a los 3años y a los 5años fue del 98,9%, del 98,4% y del 96,7%, respectivamente (fig. 5B).
Supervivencia libre del evento combinado y de reintervención valvular. A)Supervivencia libre del evento combinado de muerte, accidente cerebrovascular, infarto agudo de miocardio, endocarditis y reintervención. B)Supervivencia libre de reintervención valvular por todas las causas.
La primera generación de la prótesis Trifecta™ obtuvo su certificado CE en 2009. La segunda generación de la bioprótesis, el modelo Trifecta™ GT, comercializada en 2016, introdujo cambios para facilitar de implante y mejoró el sistema anticalcificante. La tercera generación de la prótesis, que comenzó a utilizarse en 2020, presentó un nuevo soporte con un perfil menor que optimizó el comportamiento funcional del dispositivo, y se añadió un tratamiento anticalcificante basado en la tecnología Lynx que produce una estabilización del colágeno, minimiza el consumo de colesterol y reduce los aldehídos libres12.
Una de las primeras grandes series publicadas sobre el seguimiento de las primeras prótesis Trifecta™ implantadas fue el estudio de Goldman et al.13. Se trataba de un estudio multicéntrico prospectivo no aleatorizado realizado entre 2007 y 2009 que incluía a 710 pacientes con prótesis Trifecta™. Se obtuvo una supervivencia libre de deterioro estructural del 95,7% a los 6años tras la intervención.
Otro estudio con resultados a medio plazo sobre las prótesis Trifecta™ fue el realizado por Kilic et al.14 con un total de 1.953 pacientes. Mostraron una supervivencia global del 69,8% a los 5años, con una supervivencia libre de deterioro estructural del 98,7% a los 5años.
Aunque se ha demostrado que la prótesis Trifecta™ presenta un buen comportamiento hemodinámico tras el implante, en términos de durabilidad se ha asociado una mayor tasa de deterioro estructural, con incrementos precoces de los gradientes transprotésicos y con tasas de reintervención más altas que otras bioprótesis aórticas15-18.
En 2014, Saxena et al.19 describieron los primeros casos de recambio valvular por deterioro estructural protésico de la prótesis Trifecta™.
En su estudio de 1.058 pacientes que comparaba la prótesis Trifecta™ frente a otras bioprótesis aórticas, Fukuhara et al.20 obtuvieron una incidencia acumulada de deterioro estructural protésico del 2,1% en el grupo Trifecta™ frente al 0,7% en el grupo de otras bioprótesis a los 5años del implante. A los 7años de la intervención se produjo un incremento mayor de las cifras de deterioro estructural protésico, con una incidencia acumulada del 13,3% en el grupo Trifecta™ frente al 4,6% en el grupo de otras bioprótesis, con diferencias estadísticamente significativas.
Otro de los grupos que presentaron una alta incidencia de deterioro estructural protésico ha sido el descrito por Werner et al.21 en su serie de 347 pacientes con prótesis Trifecta™, quienes presentaron una incidencia de deterioro estructural protésico del 7% a los 6años del implante.
En nuestro estudio, la supervivencia libre de deterioro estructural moderado-severo fue al año, a los 3años y a los 5años del 99,7%, del 97,5% y del 92,7%, respectivamente. Estos datos comparables con lo obtenido en otras series22,23.
Además, se ha descrito un mayor riesgo de deterioro estructural protésico precoz en pacientes jóvenes con prótesis Trifecta™17,20. En nuestro estudio, ser mayor de 80años resultó ser un factor protector independiente de deterioro estructural protésico. Podemos observar que en nuestros resultados los pacientes menores de 69años presentaron una mayor incidencia acumulada de deterioro estructural protésico precoz en comparación con los mayores a 70años.
No están definidos los mecanismos exactos implicados en el desarrollo del deterioro estructural de la prótesis Trifecta™. La causa más común descrita es el desgarro de uno de los velos valvulares, especialmente del velo no coronariano. El estrés mecánico al que son sometidos los tejidos de los velos de la prótesis podría ser el mecanismo implicado en este proceso. El propio fabricante ha reconocido que debido al diseño de la prótesis, en el cual los velos están suturados externamente al stent, junto con la característica de que el stent puede deformarse durante el implante, produce un aumento de deterioro estructural precoz24. La fibrosis y la calcificación de los velos de la prótesis alrededor de los postes también contribuyen al deterioro estructural de la misma, provocando restricción del movimiento de los velos que se manifiesta en estenosis o en regurgitación protésica19,25-27. Aunque estas observaciones se basan principalmente en la primera generación de la prótesis Trifecta™, las modificaciones en el diseño realizadas en los modelos más actuales parecen no ser capaces de prevenir en su totalidad el desarrollo de deterioro estructural precoz18.
Las guías británicas de manejo de las valvulopatías, junto con la Agencia Reguladora de productos Médicos y Sanitarios Británicos (MHRA), recomiendan realizar un ecocardiograma anual de control en pacientes portadores de prótesis Trifecta™ de primera generación o Trifecta™ GT24. Esto se debe a que desde el año 2010 la MHRA ha recibido más de 65 eventos adversos de degeneración precoz de la prótesis Trifecta™24. La mayoría de los eventos ocurrieron entre los 2 y los 3años tras la intervención, y se debieron principalmente al deterioro de uno de los velos valvulares, o a la presencia de insuficiencia intraprotésica. Además, el tamaño valvular no se asoció con el deterioro protésico precoz16,24.
LimitacionesLa principal limitación de nuestro estudio es que se trata de un estudio retrospectivo realizado en un único centro. Los resultados obtenidos podrían no ser comparables con los obtenidos en otros centros.
ConclusionesAunque la prótesis Trifecta™ garantiza un buen comportamiento hemodinámico precoz tras el implante, se ha observado una alta tasa de deterioro estructural protésico precoz a medio plazo. De esta manera, en pacientes con prótesis Trifecta™ se debería realizar un estrecho seguimiento con ecocardiogramas anuales de rutina.
Responsabilidades éticasEl estudio fue aprobado por el Comité del Hospital Clínico San Carlos y se obtuvo el consentimiento informado por escrito de todos los pacientes participantes en el mismo.
FinanciaciónEste estudio no recibió ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.