Los pseudoaneurismas son una rara y grave complicación de endocarditis infecciosa, cirugía cardiaca previa, traumatismo torácico etc. Pueden conllevar serias complicaciones, como su rotura, compresión de estructuras cardiacas o fistulización. Describimos el caso de un varón de 42 años intervenido en 2015 de sustitución de raíz aórtica con preservación valvular (técnica de David), anuloplastia mitral y cierre de foramen oval permeable. En agosto del 2017 ingresó por síndrome febril de origen urinario, que no respondió al tratamiento convencional. Con la sospecha de endocarditis infecciosa, se obtuvieron hemocultivos que fueron positivos para Staphylococcus aureus meticilino-sensible. Se realizó un ecocardiograma observándose una imagen en raíz aórtica compatible con absceso. Se optó por tratamiento conservador y revaluación. Dos semanas después, el ecocardiograma mostró un pseudoaneurisma en el tracto de salida del ventrículo izquierdo. Una angiotomografía computarizada cardiaca confirmó este hallazgo y además, su fistulización a la aurícula derecha. Es trasladado a nuestro hospital donde es intervenido. En la cirugía observamos un absceso originado en la base del seno no coronariano con rotura del velo aórtico que se continuaba hasta fistulizar en aurícula derecha. Se realizó reconstrucción del anillo aórtico con parche de pericardio heterólogo y sustitución valvular aórtica mediante prótesis mecánica desde la raíz aórtica, y cierre de fístula desde aurícula derecha. Los cultivos de las muestras quirúrgicas resultaron estériles y el ecocardiograma postoperatorio no mostró complicaciones. La cirugía es fundamental para evitar las posibles complicaciones de un pseudoaneurisma y, si se asocia a una endocarditis infecciosa, erradicar la extensión de la infección.
Pseudoaneurysms are rare and severe complications of infective endocarditis, previous heart surgery, thoracic trauma, etc. They can lead to serious complications, such as their rupture, compression of cardiac structures, or fístula formation. A case is presented of a 42 year-old male who underwent aortic root replacement with valve preservation (David procedure), mitral valve annuloplasty, and patent foramen ovale closure in 2015. In August 2017 he was admitted to hospital with a fever of urinary origin that did not respond to standard treatment. Suspecting an infective endocarditis, blood cultures were collected, which were positive for Methicillin-sensitive Staphylococcus aureus. An echocardiogram was performed, in which was observed an image compatible with an abscess in the aortic root. The chosen course of action was conservative management and subsequent re-evaluation. Two weeks later the echocardiogram showed a left ventricular outflow tract pseudoaneurysm. A CT angiography confirmed this finding, as well as a right auricular fistula. The patient was transferred to our hospital where he underwent surgery. During the surgery, an abscess was observed that originated from the base of the non-coronary aortic sinus with rupture of the aortic valve that continued into a right auricular fistula. The aortic annulus was re-constructed with a heterologous pericardial patch and the aortic valve was replaced from its root with a mechanical prosthesis. Closure of the fistula from the right atrium was also performed. Cultures from the surgical specimens were sterile, and the post-surgery echocardiogram did not show any complications. Surgery is essential to avoid any possible pseudoaneurysm complications and should the pseudoaneurysm be associated with an infective endocarditis, surgery is necessary to eradicate the spreading of the infection.
En la literatura podemos encontrar pseudoaneurismas cardiacos en diferentes localizaciones y con distintas etiologías.
Un pseudoaneurisma es una rotura contenida de un vaso sanguíneo o de la pared miocárdica. Un verdadero aneurisma se forma como resultado de la debilidad de la pared y no de su disrupción. Diferenciar estas 2entidades tiene relevancia clínica, ya que los pacientes con un pseudoaneurisma deben intervenirse de manera precoz para evitar complicaciones como su rotura1.
Los pseudoaneurismas pueden ser agudos o crónicos. Los agudos son muy inestables y suelen acabar rompiéndose, mientras que los crónicos normalmente son diagnosticados al aparecer síntomas, y menos frecuentemente de manera incidental, siendo su historia natural todavía desconocida.
Pueden aparecer como una complicación de numerosas entidades, entre las que podemos encontrar: un infarto de miocardio, cirugía cardiaca previa, infección, traumatismo torácico, etc.2.
La formación de un pseudoaneurisma, en relación con una endocarditis infecciosa, supone un signo de infección localmente incontrolada3. Pueden ser el resultado de una embolia séptica coronaria que provoque un infarto de miocardio, o bien producirse por la progresiva erosión del endocardio por la invasión bacteriana y consiguiente disección de la pared miocárdica4. Son una importante complicación y se asocian frecuentemente a daño valvular y perivalvular muy grave3.
En los pacientes con endocarditis infecciosa complicada con pseudoaneurisma, la cirugía con carácter urgente tiene una indicación clase i nivel B (guías ESC 2015 sobre el tratamiento de la endocarditis infecciosa)3. Se debe realizar un extenso desbridamiento y escisión de todo el tejido necrótico e infectado para evitar la aparición de sepsis o mediastinitis y la recurrencia del pseudoaneurisma5.
El manejo conservador se puede plantear realizando un estrecho seguimiento clínico y ecocardiográfico, cuando no existen otras indicaciones quirúrgicas y la fiebre se controla fácilmente con antibióticos3.
Aunque históricamente la angiografía era la técnica de imagen de elección para el diagnóstico de esta malformación, el avance en las técnicas no invasivas ha mejorado la habilidad para diagnosticar esta patología1. Actualmente, la evaluación preoperatoria incluye diferentes modalidades diagnósticas, entre las que encontramos: la ecocardiografía transtorácica, que nos sirve como una primera evaluación y para comparar con estudios previos; la ecocardiografía transesofágica, usada tanto antes de la intervención como durante la misma para guiar el proceso quirúrgico, y la tomografía computarizada (TAC), usada para identificar con mayor exactitud la relación anatómica del pseudoaneurisma con el resto de las estructuras6. Otra prueba diagnóstica que podemos utilizar es la resonancia magnética, que ofrece una alta resolución espacial y una excelente caracterización de los tejidos, por lo que es ideal para la evaluación de esta complicación y distinguirla de un aneurisma verdadero1.
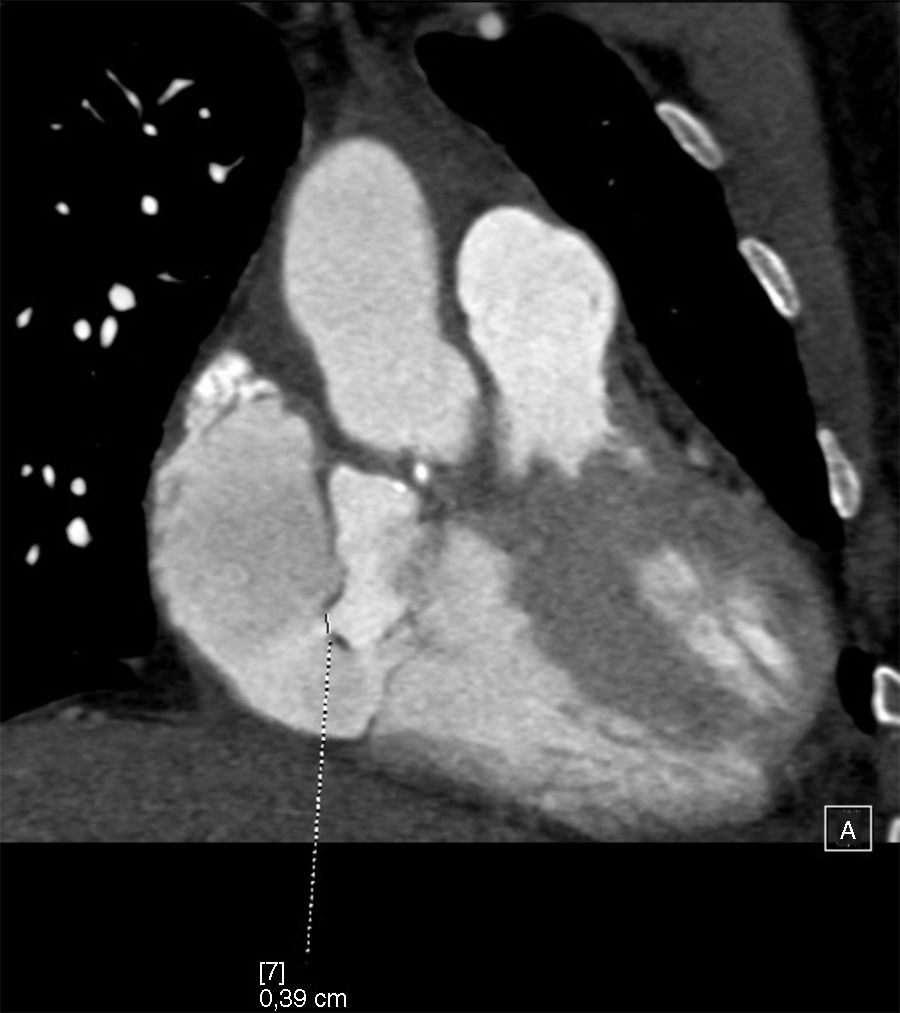
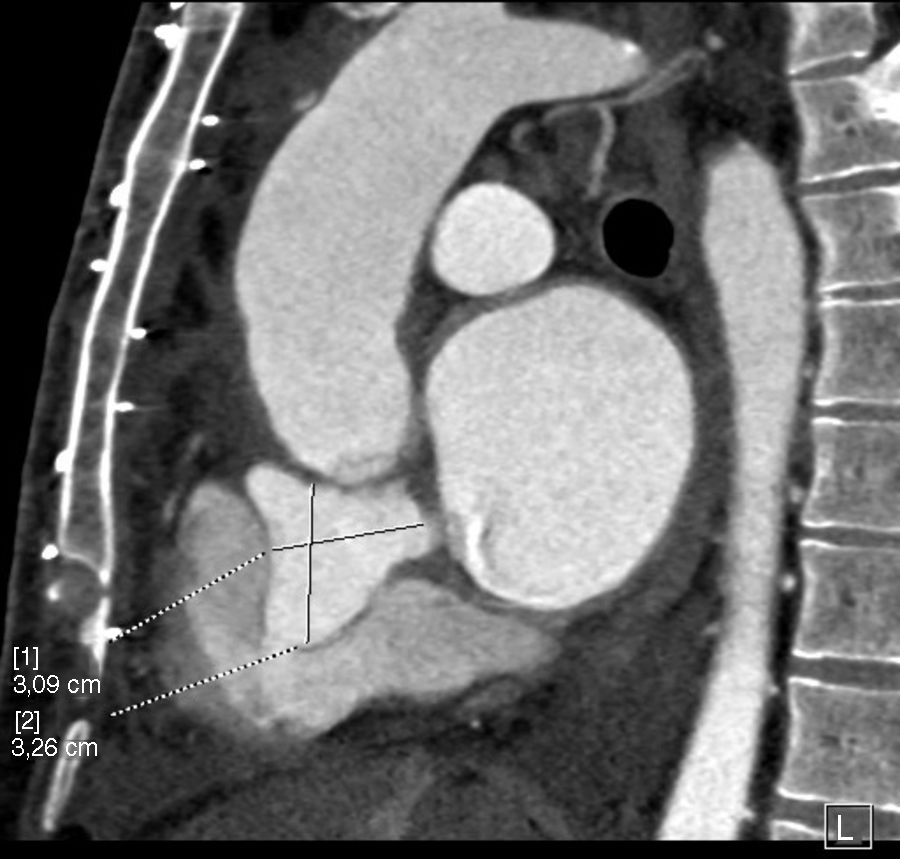
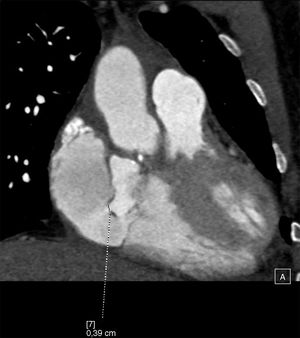
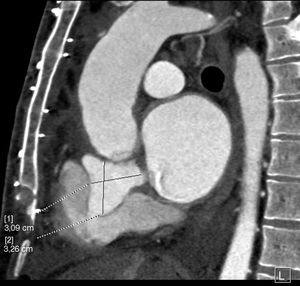
Describimos el caso de un varón de 42 años intervenido en 2015 en nuestro hospital por dilatación de raíz aórtica y aorta ascendente junto con insuficiencia aórtica severa, insuficiencia mitral moderada y foramen oval permeable. Se realizó una resección del aneurisma de raíz y aorta ascendente e interposición de prótesis tubular Vascutek® Gelweave Valsalva™ n.° 28 con preservación valvular según la técnica de David, anuloplastia mitral con implante de anillo Carpentier-Edwards Physio (Edwards Lifesciences) n.° 30 y cierre de foramen oval permeable mediante sutura continua. En agosto del 2017 ingresó en su hospital de referencia por síndrome febril de origen urinario, que no respondió al tratamiento antibiótico convencional. Ante la posibilidad de endocarditis infecciosa, se obtuvieron hemocultivos que fueron positivos para Staphylococcus aureus meticilino-sensible. Se realizó un ecocardiograma, observándose una imagen en raíz aórtica compatible con absceso. Se optó por tratamiento conservador y revaluación. Dos semanas después, el ecocardiograma mostró un pseudoaneurisma a nivel del tracto de salida de ventrículo izquierdo. Se completó el estudio con una angio-TAC cardiaca que confirmó la presencia de un pseudoaneurisma con diámetros máximos de 35×30mm con comunicación por debajo de la válvula aórtica con el tracto de salida de ventrículo izquierdo, a la altura del seno coronariano derecho. Dicha comunicación presentaba un diámetro de 4mm y se encontraba aproximadamente a 6mm en dirección caudal del anillo aórtico ocupando parcialmente la aurícula derecha, en íntima relación con la válvula tricúspide; no se identificó extensión a la fibrosa mitroaórtica y se observó, además, que se encontraba fistulizado a la aurícula derecha (figs. 1 y 2).
El paciente fue trasladado a nuestro hospital donde fue intervenido. Considerando que el esternón no se encontraba en íntima relación con las estructuras cardiacas, ni con el pseudoaneurisma, se optó por abordar la cavidad torácica mediante reesternotomía media con sierra oscilante. Se llevó a cabo la canulación de aorta ascendente, ambas cavas y del seno coronario. Se estableció circulación extracorpórea y se enfrió al paciente hasta 28 grados. En la cirugía observamos un absceso originado en la base del seno no coronariano con rotura del velo aórtico que se continuaba hasta fistulizar en la aurícula derecha. Se llevaron a cabo el desbridamiento y la limpieza de las zonas afectadas por la infección y tras ello se realizó la reconstrucción del anillo aórtico con parche de pericardio heterólogo y sustitución valvular aórtica mediante prótesis mecánica Sorin Bicarbon™ n.° 21 desde la raíz aórtica, y cierre de fístula desde la aurícula derecha con sutura continua.
El resto de la estancia hospitalaria transcurrió sin incidencias. Los cultivos de las muestras quirúrgicas resultaron estériles. El paciente fue trasladado a su hospital de referencia para continuar tratamiento antibiótico por vía intravenosa a los 14 días postoperatorios, en buena situación clínica y hemodinámica, afebril y con las heridas en proceso de cicatrización. En la revisión postoperatoria a los 3meses de la intervención quirúrgica, el paciente se encontraba en clase funcional i/iv de la New York Heart Association y en el ecocardiograma de control se observó que la prótesis mecánica en posición aórtica era normofuncionante, no existía comunicación residual de la fístula, ni datos de endocarditis, y la prótesis tubular se encontraba bien expandida sin imágenes patológicas peritubulares.
Entre las posibles complicaciones derivadas de la presencia de un pseudoaneurisma cabe destacar la formación de fístulas a estructuras cardiacas adyacentes7. En el caso clínico presentado, nos encontramos con un absceso en la base del seno no coronariano, que se continuaba hasta fistulizar en la aurícula derecha. Los defectos que comunican el ventrículo izquierdo con la aurícula derecha son conocidos como tipo Gerbode, se ven con más frecuencia como una anomalía de origen congénito, o bien asociados con una endocarditis valvular aórtica. El tipo congénito más frecuente se origina en el septo membranoso interventricular y la comunicación entre el ventrículo izquierdo y la aurícula derecha se produce a través de un defecto del velo septal de la válvula tricúspide. En la forma adquirida en asociación con una endocarditis infecciosa, la comunicación se produce entre el ventrículo izquierdo y la aurícula derecha por encima de la valva septal de la válvula tricúspide, la cual permanece intacta, ya que normalmente se verá afectado por la infección la porción auriculoventricular del septo membranoso. Los defectos tipo Gerbode también han sido descritos asociados a un traumatismo, tras sustitución valvular aórtica, sustitución valvular mitral, reparación previa de un defecto septal auriculoventricular o cardiopatía isquémica8. Algunos de los pacientes con defectos del septo ventricular pueden desarrollar insuficiencia aórtica. Aunque muchos mecanismos pueden ser responsables, parece que el efecto Venturi es el factor predominante; se produce un aumento de velocidad a través del defecto, ocasionando el prolapso de los velos aórticos adyacentes. Para que la regurgitación aórtica sea explicada por este mecanismo es necesario que el defecto sea restrictivo9. En nuestro caso clínico, durante la intervención quirúrgica, se objetivó rotura del velo no coronariano como resultado de la extensión de la infección, lo que explica la insuficiencia ligera-moderada que presentaba en las pruebas diagnósticas preoperatorias; en este caso, el efecto Venturi no parece ser la causa de la regurgitación aórtica.
La intervención quirúrgica de un pseudoaneurisma debe planearse cuidadosamente. Entre los distintos aspectos cruciales que tenemos que tener en cuenta, encontramos: cómo acceder al pseudoaneurisma, estrategia de canulación y la necesidad de paro circulatorio hipotérmico10. Un escáner preoperatorio es necesario para delimitar la relación entre la aorta, el pseudoaneurisma, el corazón y el esternón5. En nuestro caso clínico, las imágenes de la TAC nos permitieron ver que tanto el corazón como el pseudoaneurisma se encontraban a una distancia prudencial de la tabla inferior del esternón, siendo el riesgo de rotura bajo, por ello se optó por realizar una reesternotomía usando la sierra oscilante, canulación central e hipotermia sistémica moderada.
La extensión perivalvular de una endocarditis infecciosa debe intervenirse precozmente, ya que puede progresar, como en nuestro caso, hasta graves complicaciones, como un pseudoaneurisma. La intervención quirúrgica es fundamental para evitar las posibles complicaciones fatales de esta anomalía y, en el caso de encontrarse asociada a una endocarditis infecciosa, erradicar la extensión de la infección.
Es posible que la incidencia de los pseudoaneurismas cardiacos se encuentre infraestimada, por ello en pacientes con factores de riesgo podría estar justificado realizar un cribado con técnicas de imagen.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.