Introducción. La prevención del cáncer de mama se realiza mediante el diagnóstico precoz detectando mamográficamente lesiones no palpables que deben ser valoradas para determinar la precocidad diagnóstica y el tipo de tratamiento.
Pacientes y método. Tras seleccionar a los pacientes con criterios mamográficos y citológicos se realizaron 160 biopsias (0,65% de 24.500 mamografías de detección) utilizando aguja-guía de Kopans y Homer, en general de forma ambulatoria, con sedación y anestesia local. Se empleó el diagnóstico histológico de cáncer como patrón-base de los datos estadísticos.
Resultados. El 46,87% de las lesiones biopsiadas fueron microcalcificaciones. La sensibilidad y la especificidad del sistema diagnóstico fue de 0,73 y 0,60, respectivamente. Se detectaron 84 cánceres (valor predictivo positivo: 52,5%; relación benigna/maligna de las biopsias: 0,9/1); 67 (79,76%) infiltrantes y 17 (20,24%) in situ, de los que 68 (80,94%) se encon traban en estadios 0 y I y 16 (19,96%) en estadio II. Fueron tratados con tumorectomía ampliada más axilectomía 50 pacientes (59,52%) y 12 (14,28%) con quimioterapia.
Conclusiones. El impacto del diagnóstico precoz de las lesiones de mama no palpables disminuye la necesidad de tratamientos oncológicos y permite la terapia conservadora, promoviendo la aceptación a la detección y mejorando la calidad de vida de la mujer.
Introduction. Early mammographic detection of nonpalpable breast lesions is essential for cancer prevention, facilitating early diagnosis and indicating the proper treatment.
Methods. Mammographic and cytologic screening led to the performance of guided needle biopsy according to Korans and Homer in 160 women (0.65% of 24,500 mammographies). The biopsies were generally carried out in the ambulatory setting under local sedation and anesthesia. The findings were compared with the results of the histological study for statistical analysis.
Results. Microcalcifications were encountered in 46.87% of the biopsies. The sensitivity and specificity of this diagnostic approach were 73% and 60%, respectively. Cancer was detected in 84 cases (positive predictive value: 52.5%; ratio of benign to malignant lesions: 0.9/1.0. There were 67 cases of infiltrating tumors (79.76%) and 17 (20.24%) of in situ lesions. Sixty-eight women (80.94%) presented stage 0 or stage I cancer and 16 (19.06%) had stage II lesions. Fifty patients (59.52%) underwent extensive tumor resection plus lymphadenectomy and 12 (14.28%) received chemotherapy.
Conclusions. The early diagnosis of nonpalpable breast lesions reduces the need for anticancer therapy, makes conservative treatment possible, promotes the acceptance of screening and improves the quality of life of the patients.
Introducción
El cáncer de mama presenta unas cifras de incidencia dependendientes de la edad, oscilando del 2,3 al 35/1.000 según consideremos mujeres de 30 u 80 años1. A partir de datos obtenidos de los registros de tumores se obtienen en nuestro país valores medios de incidencia del 4,2-6,7/1.000 para todas las edades por año, siendo la primera causa de muerte tumoral en la mujer y la primera causa absoluta de muerte en mujeres de 35 a 54 años. Una de cada 12-15 mujeres españolas tiene la probabilidad de desarrollar un cáncer de mama a lo largo de su vida. Pese a los avances terapéuticos conseguidos, no ha disminuido de manera signficativa la mortalidad. En el momento actual únicamente se dispone del diagnóstico precoz, mediante los programas de detección, para realizar una prevención secundaria2.
Con la difusión de la detección mamográfica se ha incrementado la detección de lesiones de mama no palpables y, como consecuencia, se han descrito una serie de signos radiológicos que han hecho surgir una nueva semiología3.
El término cáncer mínimo de mama, en general no palpable detectado en la detección, define el conjunto de tumores constituidos por tumores in situ y tumores infiltrantes menores de 0,5 cm, de diagnóstico exclusivamente radiológico. Las metástasis axilares, en estos casos, no sobrepasan el 5% de los casos y en el 90% de las pacientes la supervivencia supera los 10 años4. Estos hechos crean una situación a la que hay que adaptar la actividad médica; el cáncer de mama, aun siendo responsable de una elevada mortalidad, es curable si se realizan un diagnóstico precoz y un tratamiento correcto5.
Considerada la mamografía como test de detección, presenta una baja especificidad, que debe complementarse en muchos casos con el estudio citológico, no sólo en las lesiones de probable malignidad sino también en aquellas que presentan una baja probabilidad de riesgo. La técnica de punción-aspiración con aguja fina guiada por estereotaxia se ha descrito de utilidad para este fin6,7, e igualmente la punción dirigida mediante ecografía8.
Una vez realizada la adecuada selección de pacientes con lesiones de mama no palpables que deben ser intervenidas para confirmación histológica y tratamiento, la lesión debe marcarse previamente al acto quirúrgico para determinar su localización exacta y evitar sacrificar tejido mamario innecesario. De todos los métodos de localización (orientación mamográfica con coordenadas, marcador externo, aguja espinal, colorantes y arpones), hemos seleccionado la localización mediante aguja-guía arpón metálico, ya que en nuestra experiencia y en las referencias bibliográficas presenta mayores ventajas9-16.
Con la finalidad de valorar los aspectos diagnósticos y terapéuticos de las lesiones de mama no palpables, nos hemos planteado los siguientes objetivos: determinar las características de los cánceres detectados, calculando la proporción benignidad/malignidad y el valor predictivo positivo de las biopsias (VPP) y su evolución en el tiempo, fallos y complicaciones del procedimiento, analizar la sensibilidad y especificidad de los hallazgos mamográficos y de la citología, correlacionar los distintos tipos de lesiones mamográficas con los hallazgos histológicos y analizar el estadio TNM de los cánceres detectados y la correspondiente repercusión en las modalidades de tratamiento.
Pacientes y método
Pacientes. Mamografías. Biopsias
Iniciamos nuestro trabajo en 1992 simultáneamente con el programa poblacional de prevención de cáncer de mama de la Comunidad Valenciana, al ser el Hospital Dr. Peset centro de referencia de las pacientes que precisaban confirmación diagnóstica y tratamiento, procedentes de una de las cinco unidades piloto con las que se inicia el programa2.
De un total de 24.500 mamografías de detección (1992-1996) en doble proyección (craneocaudal y oblicua mediolateral), se seleccionaron 160 (0,65%) para biopsia de lesiones de mama no palpables según protocolo quirúrgico-radiopatológico consensuado. La edad media de las mujeres fue de 54,2 años (rango 45-65).
Los hallazgos mamográficos de las lesiones de mama no palpables se clasificaron en categorías descriptivas: microcalcificaciones, masa espiculada, nódulo de contorno bien definido, lesión estrellada, asimetría-alteración estructural y nódulo de contorno irregular. También se definieron las categorías diagnósticas de normal, benigna, probablemente benigna, probablemente maligna y maligna, indicativas de la probabilidad para cáncer. Todas las mamografías fueron diagnosticadas en un sistema de doble lectura radiológica14.
A 81 mujeres, previa a la biopsia quirúrgica con arpón se les practicó punción-aspiración con aguja fina dirigida con este reotaxia en 75 casos y en seis con ecografía, y los hallazgos citológicos se clasificaron en categorías diagnósticas: no valorable/no representativa (pocas células, artefactos o sangre), benigno, sospechoso de malignidad (atipia celular) y maligno.
Sistemas y métodos de radiolocalización
Se utilizaron agujas-guía tipo Kopans en "J" rígida, no extraíbles (n = 62), y agujas-guía tipo Homer (n = 98) en "J" flexible; esta última se puede extraer y reposicionar hasta conseguir la correcta situación en la lesión (fig. 1).
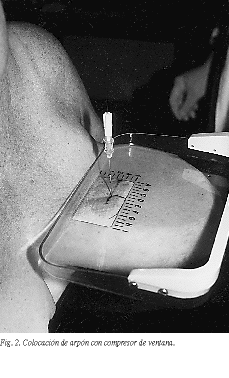
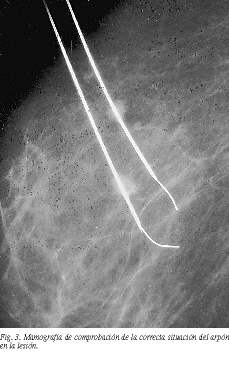
El método de colocación del arpón utilizado para ubicar el sistema de Kopans ha sido la punción estereotáxica, retirando la aguja una vez situado el arpón en la lesión. La punción con compresor de coordenadas se ha utilizado con el dispositivo de Homer y dejando la aguja sobre la guía (fig. 2). Siempre se realizó la mamografía de comprobación de la correcta situación del arpón en la lesión (fig. 3).
De las dos vías de punción posibles para la colocación de las agujas (anteroposterior y paralela a la pared torácica) hemos utilizado siempre la segunda, superior para los cuadrantes internos y externos superiores y lateral interna o externa para los cuadrantes inferiores interno y externo, respectivamente, buscando siempre la distancia más corta de la piel a la lesión.
Técnica quirúrgica
Previa sedación, la enferma es colocada en decúbito supino en la mesa operatoria y se procede a retirar los apósitos que fijan el arpón a la piel. Se prepara la superficie quirúrgica con solución de povidona yodada, aislando el campo operatorio con paños estériles y se realiza la anestesia local en el punto de abordaje.
Las vías de abordaje dependen de las características de la lesión, tamaño, localización y tipo de tratamiento quirúrgico elegido.
El abordaje por la base del arpón (fig. 4) consiste en seguir la guía desde su entrada a la piel mediante una incisión paralela a las líneas de Langer en el punto de entrada de la aguja, hasta su extremo distal, y proceder a la extirpación en cilindro del tejido alrededor de éste hasta la punta del arpón, asegurando la completa resección de la guía y de la lesión.
La disección se realiza con tijeras o bisturí de hoja, 1-2 cm alrededor del localizador y en la dirección de su trayecto, en forma de un cilindro y 1-2 cm lejos de su punta, calculando previamente la longitud introducida en el parénquima, ayudándonos de un separador tipo Farabeuf, extrayendo el cilindro íntegro formado por la aguja-guía y el tejido mamario resecado, sujetándolo progresivamente con dos pinzas tipo Allis conforme avanzamos en la disección y evitando de este modo tracciones y desplazamientos del localizador. Una variante de este acceso consiste en incidir en la piel en el punto más próximo a la lesión tras estimar la localización de ésta, realizando una disección más económica del tejido.
El abordaje periareolar se realiza mediante incisión circum areolar, con mejor resultado estético (fig. 5). La localización de la guía en este abordaje puede ser difícil. Tras la incisión de la piel solemos disecar el tejido mamario en el plano graso en dirección al orificio de entrada de la aguja-guía en la glándula, de modo similar a la que se realiza en la mastectomía subcutánea. Una vez se localiza la parte interna de la aguja-guía, se sujeta con una pinza tipo Allis y se procede a seccionar el tejido mamario 2 cm lejos de la punta, realizando una maniobra basculante del sistema desde su entrada en la piel, ayudándonos con un separador tipo Farabeuf, y se seccionan 2 cm de tejido mamario alrededor del localizador y en dirección de su salida de la piel.
Los cirujanos deben ser conscientes de que el localizador-guía puede desplazarse en las maniobras de tracción, sobre todo cuando queda anclado en una mama predominantemente grasa. El alambre es una guía y no un agente de tracción; por ello, la colocación del localizador debe realizarse de forma que la lesión quede 1-2 cm atravesada respecto a la punta del arpón, a lo largo del segmento engrosado (porción distal tejido mamario y punta del arpón-guía) para que cualquier tracción desplace el arpón hacia atrás, aproximándolo a la lesión en vez de alejarlo. El segmento engrosado actúa como indicador al cirujano, anticipando la distancia del arpón.
Después de extraer la pieza-biopsia y confirmada mediante radiografía de la pieza la extirpación correcta de la lesión, se oblitera el espacio muerto creado aproximando los márgenes del tejido mamario con puntos de sutura reabsorbibles tipo poliglicólico de 2/0. No solemos dejar drenaje aspirativo. Se cierra la piel con sutura intradérmica tipo polipropileno de 3/0. Una vez finalizada la intervención se coloca vendaje compresivo.
Todas las biopsias se han realizado en una sala quirúrgica para pacientes ambulatorios con sedación y anestesia local, excepto cuando la lesión es una masa espiculada o un nódulo irregular con citología positiva para células malignas, en cuyo caso utilizamos anestesia general con la finalidad de hacer estudio histológico peroperatorio y completar en el acto el tratamiento quirúrgico. Salvo en estas circunstancias, siempre hemos realizado estudio histológico diferido.
Radiografía de la pieza operatoria
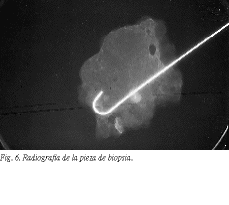
Una vez efectuada la resección quirúrgica del área en cuestión, se remite al servicio de radiología para confirmar mediante mamografía de la pieza la correcta extirpación de la lesión. Se coloca la pieza de biopsia entre dos hojas de plástico para efectuar una mamografía magnificada (fig. 6) y se comprueba la existencia de la lesión en ella. Si es necesario introducimos una aguja, para marcar más precisamente la lesión u otra área de interés. Se comunica al cirujano el resultado de la radiografía de la pieza y se remite acompañada de la radiografía de comprobación al servicio de anatomía patológica. Si se trata de un área dispersa se puede radiografiar el espécimen con una fina rejilla para señalar los cuadros de interés múltiple18.
La radiografía del espécimen resecado es obligatoria y de gran ayuda, pero se debe tener en cuenta que cuando se biopsian distorsiones tisulares u opacidades causantes de asimetría, en la radiografía de la pieza de exéresis puede aparentemente no discriminarse la lesión. Esto se debe a las alteraciones que produce en los tejidos la cirugía practicada. Para evitar esta interferencia de la cirugía practicada solemos resecar una zona amplia alejada 1-2 cm de los márgenes de la lesión y no transeccionar la lesión, preservando la pieza operatoria en su integridad, dejando en libertad al anatomopatólogo para la evaluación macroscópica y microscópica de la misma en condiciones plenas de poder localizar con muy pocos cortes la lesión en cuestión.
No se debe omitir la mamografía posterior de la mama operada. Aunque puede hacerse después de los 30 días de la operación, el lapso ideal se sitúa entre 6 meses y un año, pero si debe verificarse la presencia de remanente intraductal comedoniano por sospecha de microcalcificaciones residuales debe realizarse más precozmente. El objetivo es comprobar la ausencia de la lesión.
Anatomía patológica de la pieza operatoria
El patólogo, al recibir la pieza operatoria, que es obligatorio que esté referenciada espacialmente respecto a la mama (puntos de seda en áreas anterior y posterior, referencia de superficie areolar y axilar), puede elegir el plano de sección de la misma que más convenga, teniendo la seguridad de que el corte pase exactamente por la guía del alambre. Dado el pequeño tamaño de las lesiones no aconsejamos, en general, el análisis histológico peroperatorio con cortes de congelación, por la posibilidad de perder la lesión en los cortes iniciales, sobre todo las microcalcificaciones. En general, se ha utilizado el estudio histológico diferido de la lesión. Como técnicas de tinción se han empleado las habituales de hematoxilina-eosina e inmunohistioquímicas para determinación de receptores hormonales y oncogenes.
Análisis estadístico
Para obtener los datos referentes a los objetivos propuestos se construyó una base de datos informática por campos en cada paciente, con las variables cualitativas codificadas, comparando los códigos entre sí mediante operaciones de recuento. Se utilizó el diagnóstico histológico de cáncer como patrón para calcular los VPP de las biopsias y de los tipos morfológicos de lesión y la sensibilidad y especificidad de la mamografía y de la citología.
Resultados
En las 160 biopsias realizadas se detectaron 84 cánceres y 76 lesiones benignas con una tasa de detección respecto a la población estudiada de 3,4/1.000. El VPP de las biopsias fue del 52,5% y la relación benigna/maligna de 0,9/1. La localización más frecuente de los cánceres fue en el cuadrante superoexterno (n = 44) o central (n = 16) en ambas mamas.
La duración media del acto quirúrgico fue de 30 min (20-45), añadiendo el tiempo medio de la radiografía de la pieza incluido el traslado, que fue de 15 ± 5 min.
Se produjeron 4 (2,5%) complicaciones intra y posquirúrgicas (2 transecciones del arpón, un seroma y un hematoma) y se detectaron 4 (2,5%) fallos de biopsia, producidos por migración del localizador metálico en dos pacientes con mamas grasas y por traccionar y desplazar el localizador en el acto quirúrgico en otras dos pacientes. De los cuatro fallos de biopsia, en un caso se perdió la lesión (microcalcificaciones), no siendo evidente en la radiografía de la pieza ni en los controles post quirúrgicos. En otros dos, el seguimiento mamográfico a 3 años descartó malignidad (microcalcificaciones probablemente benignas), y en un caso se realizó una segunda biopsia detectando un carcinoma (masa espiculada). Las transecciones de la guía se produjeron con el sistema de Kopans. El dispositivo de Homer permitió una mejor accesibilidad por la vía areolar.
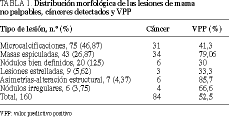
Las características radiológicas de las lesiones biopsiadas, los cánceres y VPP por tipos morfológicos se exponen en la tabla 1. La mayoría de las lesiones biopsiadas fueron microcalcificaciones y los VPP son dependientes de los distintos tipos morfológicos.
Se obtuvieron los valores de 0,89-0,47 y de 0,58-0,73 de sensibilidad y especificidad de la mamografía y citología, respectivamente. De las 81 citologías practicadas, siete fueron excluidas del análisis (8,6%) por resultado no valorable/no representativo.
La clasificación por tipos histológicos de los cánceres se describe en la tabla 2, siendo el carcinoma ductal infiltrante solo o asociado a carcinoma ductal in situ el tipo de neoplasia más frecuente. No se pudieron obtener datos del grado histológico de los cánceres debido a la falta de uniformidad de los informes anatomopatológicos al inicio del estudio. El tamaño histopatológico medio de los cánceres detectados fue de 11 mm.
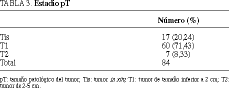
Respecto a la clasificación TNM, encontramos los valores de las tablas 3-5, con predominio de lesiones de pequeño tamaño y sin afectación axilar. Los 10 tumores con afectación axilar presentaron un tamaño medio superior a 14,5 mm y todos los casos de carcinoma no palpable estuvieron libres de metástasis a distancia.
Respecto al tratamiento quirúrgico de los cánceres, en 15 (17,8%) fue suficiente el primer acto quirúrgico de la biopsia (tumorectomía ampliada), no siendo necesario ampliar la resección mamaria, dado que los bordes de la pieza estaban libres de invasión tumoral. En un segundo tiempo se completó el tratamiento con la linfadenectomía axilar. En 69 de los 84 cánceres se tuvo que completar el tratamiento local ampliando la resección mamaria debido a que el resultado de la histología indicaba infiltración de los bordes de la resección. En total se realizó tumorectomía ampliada más linfadenectomia axilar en 50 casos (59,52%) y mastectomía radical modificada (MRM) en 34 (40,47%).
En la MRM se utilizó la técnica de Madden ampliada al tercer nivel de Berg y reconstrucción inmediata mediante prótesis expander tipo Becker en 3 casos a los que se había practicado MRM por la existencia de microcalcificaciones dispersas en toda la glándula, en pacientes con edad inferior a 50 años. La evolución de los porcentajes por años del tratamiento conservador respecto a la MRM en las lesions de mama no palpables pone de manifiesto un valor ascendente del 25% en el año 1993 al 53% en 1994 y del 70% en 1995.
Las líneas generales del tratamiento sistémico-adyuvante se subordinaron a la estadificación histológica del tumor y axila, no precisando ningún tipo de tratamiento adyuvante en 53 pacientes (tabla 6).
Discusión
La frecuencia global de las lesiones de mama no palpables depende de las características de la población estudiada; edad, estudios previos y de la cadena diagnóstica, mamógrafo, películas, técnica radiológica, reveladora, control de calidad y sistema de doble lectura. Las lesiones más frecuentes en nuestro estudio han sido las microcalcificaciones, con un VPP del 41,3%, inferior a la media global de todas las lesiones de mama no palpables, del 52,5%. Sin embargo, lesiones menos frecuentes, como la asimetría-alteración estructural (VPP: 85,7%), las masas espiculadas (VPP: 79,06%) y los nódulos de contorno irregular (VPP: 66,6%) presentan valores por encima de la media. Estas diferencias pueden afectar a los resultados globales; no obstante, el VPP del 52,5% es superior a la media del 25% de VPP de lesiones no palpables de mama recogida en la bibliografía19. La proporción de lesiones benignas/malignas en nuestro estudio es de 0,9/1, sustancialmente superior al objetivo descrito de 3/1 de los programas de detección17.
La mamografía presenta un alto valor de sensibilidad (0,89) y bajo de especificidad (0,47), por lo que es necesario complementar el diagnóstico con otra prueba de mayor especificidad. En el momento actual, la citología ofrece un valor de especificidad alto (0,73) y, por tanto, complementa a la mamografía. La citología con estereotaxia o ecodirigida nos ha sido de utilidad para seleccionar pacientes para biopsia sobre todo en aquellas lesiones probablemente benignas, que al presentar una citología positiva han sido biopsiadas. No se han utilizado biopsias percutáneas de cilindro en el grupo de pacientes de nuestro estudio.
Resulta evidente la precocidad diagnóstica que supone biopsiar cánceres no palpables, como se describe en los resultados de la mayoría de las lesiones de nuestra serie; de 84 cánceres, 81 se encontraban en estadios O, I y IIa, tres en estadio IIb, con supuesta evolución de buen pronóstico20, no existiendo en la actualidad ningún otro método o sistema de diagnóstico para realizar prevención secundaria en el cáncer de mama. Dicha precocidad diagnóstica posibilita, además, realizar tratamiento conservador sin disminución de la supervivencia21-24 evitando problemas psicosociales y promoviendo la participación de la mujer en los programas de detección al saber que con el diagnóstico precoz puede conseguir la curación y conservar su mama. En este sentido actuarían también las reconstrucciones mamarias posmastectomía (3 casos en nuestra serie).
La repercusión sobre la necesidad de tratamiento quimioterápico es evidente (sólo fue necesario en 12 casos [14,28%]), ya que el diagnóstico precoz ha posibilitado la detección de una mayoría de cánceres de pequeño tamaño y sin afectación axilar.
Por tanto, concluimos que la técnica de biopsia de las lesiones de mama no palpables con localizador metálico es un procedimiento que presenta baja morbilidad y alta efectividad en el diagnóstico y tratamiento de este tipo de lesiones, pudiendo realizarse con anestesia local y en régimen ambulatorio, para lo que es fundamental la buena colaboración del radiólogo, ciru jano y anatomopatólogo para la mejor calificación de los hallazgos.
El diagnóstico precoz mediante mamografía de detección de cánceres no palpables disminuye la necesidad de tratamientos oncológicos y permite la terapia conservadora de la mama beneficiando la calidad de vida de la mujer.