Introducción
La ciclooxigenasa (COX) es una enzima clave en la síntesis de las prostaglandinas, ya que cataliza la transformación del ácido araquidónico en prostaglandina H2, la cual es el sustrato a partir del que se sintetizan las prostaglandinas específicas de cada tipo celular1. Se han identificado 2 isoformas de la ciclooxigenasa: la ciclooxigenasa-1 (COX-1) y la ciclooxigenasa-2 (COX-2), que difieren sustancialmente en la regulación de su expresión y en sus funciones en la biología tisular. La COX-1 ("forma constitutiva") está presente en la mayor parte de los tejidos en condiciones normales. Se cree que contribuye a la producción de prostaglandinas, que tienen una importante función en el mantenimiento de la homeostasia y la integridad tisular. La COX-2 ("forma inducida") está ausente o muy poco expresada en la mayor parte de los tejidos, y se expresa en determinadas condiciones fisiopatológicas, como la inflamación y las situaciones de crecimiento tisular alterado2. Estudios realizados en líneas celulares y en modelos experimentales de cáncer colorrectal han aportado evidencias que indican que la COX-2 participa en las distintas fases de la oncogénesis, desde los estadios precoces de inducción tumoral hasta las fases más tardías de aparición de metástasis a distancia.
Con este estudio se pretende conocer el papel de la expresión de la COX-2 en la evolución postoperatoria de los pacientes con cáncer colorrectal. El objetivo es investigar la expresión de COX-2 en células tumorales de cáncer colorrectal humano y estudiar su valor de predicción de recurrencia tumoral y supervivencia.
Pacientes y método
Se ha estudiado de forma retrospectiva una serie de 105 pacientes con cáncer colorrectal esporádico intervenidos en el Servicio de Cirugía General del Hospital Universitario Médico-Quirúrgico de Jaén entre los años 1991 y 1997. Todos los pacientes recibieron un tratamiento quirúrgico con intención curativa siguiendo los criterios oncológicos de radicalidad. La cirugía fue electiva en 94 casos (89,5%), y 11 pacientes (10,5%) fueron intervenidos con carácter urgente. En el cáncer de colon se indicó quimioterapia postoperatoria en los tumores en estadio III. Los pacientes con cáncer de recto no recibieron tratamiento neoadyuvante. En este grupo se indicó quimioterapia y radioterapia postoperatoria en tumores N1,2 con cualquier T (estadio III) y tumores T4 N0 (estadio II).
Criterios de exclusión
Se excluyó de esta serie a los pacientes que presentaban en el momento del diagnóstico metástasis a distancia y los que tenían cánceres localmente avanzados en los que no fue posible realizar una exéresis radical del tumor. También se excluyó a 3 pacientes que presentaban cáncer de colon hereditario no asociado a poliposis.
Supervivencia. Intervalo libre de enfermedad
La supervivencia se estimó tomando como fecha inicio la del diagnóstico y como fecha final la de su última visita, que tuvo lugar entre los años 2000 y 2001, o bien la fecha de su fallecimiento. Como fecha de diagnóstico se ha tomado la del informe anatomopatológico preoperatorio o, en los casos intervenidos de urgencia, la fecha de la intervención quirúrgica. El intervalo libre de enfermedad se considera como el tiempo transcurrido entre el tratamiento quirúrgico y la aparición de recidiva.
Recogida de datos
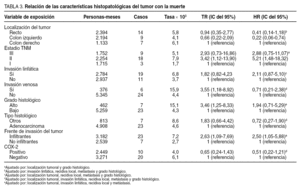
De cada uno de los casos se estudiaron las siguientes características: sexo, localización tumoral, estadio pTNM, tipo histológico, grado histológico, invasión venosa, invasión linfática y configuración del frente de invasión del tumor.
Inmunohistoquímica
Las muestras de tejido tumoral pertenecientes a los pacientes seleccionados proceden de los archivos del Servicio de Anatomía Patológica del Hospital Universitario Médico-Quirúrgico de Jaén. Las muestras se fijaron en formol tamponado al 10% y se incluyeron en parafina. Se realizaron secciones seriadas de 5 μ de espesor; la primera se utilizó para la tinción sistemática con hematoxilina-eosina y la segunda para técnicas inmunohistoquímicas con un sistema de inmunotinción automático (DAKO TechMate Horizon, Dinamarca). Para la demostración de la COX-2 se utilizó una dilución 1:25 del anticuerpo concentrado (clona H-62, Santa Cruz Biotechnology Inc., California) y la técnica de estreptavidina-biotina. Brevemente, tras deparafinar con xilol e hidratar en alcohol en una concentración decreciente, se realizó una recuperación antigénica en olla a presión llevando a ebullición el tampón citrato (pH 6,0) durante 3 min. Las secciones se incubaron en una solución de bloqueo de la peroxidasa, se lavaron en tampón de lavado y se incubaron durante 30 min con un anticuerpo secundario biotinilado, seguido de estreptavidina-peroxidasa durante 30 min. Entonces, la reacción se hizo visible incubando las preparaciones con diaminobencidina, seguida de hematoxilina para contrastar los núcleos. Como control positivo se utilizó una muestra positiva previamente comprobada (control externo) y los macrófagos en la lámina propia de cada muestra (control interno). El control negativo correspondió a muestras procesadas de la forma anteriormente descrita omitiendo la incubación con el anticuerpo primario.
Valoración de la inmunotinción para ciclooxigenasa-2
Se ha seguido el sistema de valoración propuesto por Masunaga et al3. La intensidad de la tinción se puntuó de 0 a 3: 0 = ausencia de tinción; 1 = tinción débil; 2 = tinción moderada y 3 = máxima tinción observada. El área de tinción fue puntuada de 0 a 4 según el porcentaje de células epiteliales que expresó COX-2, en relación con el área total del tumor: 0 (0%), 1 (1-25%), 2 (25-50%), 3 (50-75%) y 4 (75-100%). La expresión se consideró positiva cuando la suma de ambas puntuaciones fue > 2. Las muestras fueron evaluadas de manera independiente por 2 investigadores. En aquellos casos en los que la primera valoración fue discordante entre ambos, se hizo una segunda evaluación de las muestras de forma conjunta.
Análisis estadístico
Los datos se introdujeron en el programa EpiInfo 6.04. y se procesaron mediante el paquete Stata 7-SE (Collegue Station, Tejas, Estados Unidos). Se construyeron curvas de supervivencia según el procedimiento de Kaplan-Meier y en la comparación de curvas se utilizó la prueba de rangos logarítmicos. Posteriormente, se calcularon las tasas de incidencia de muerte para categorías específicas de factores de riesgo potenciales. Para ello se tuvo en cuenta el número de muertes dividido por el número de persona-años dentro de cada categoría. Se calculó la razón de tasas (RT) y, asimismo, se estimó su intervalo de confianza (IC) del 95%. Se elaboró un análisis estratificado y multivariable para identificar los factores de confusión. En el análisis multivariable se utilizó la regresión de Cox.
Resultados
Expresión de ciclooxigenasa-2
En la mayor parte de las preparaciones que expresaban COX-2, la tinción fue irregular en cuanto al área de expresión y heterogénea en cuanto a su intensidad. La inmunotinción para COX-2 se manifestó, predominantemente, en las células tumorales, aunque también se observó en células endoteliales, histiocitos y fibroblastos. La expresión de COX-2 en las células tumorales se consideró positiva en 38 casos (36,2%). La concordancia entre los 2 observadores en la primera lectura fue del 77%.
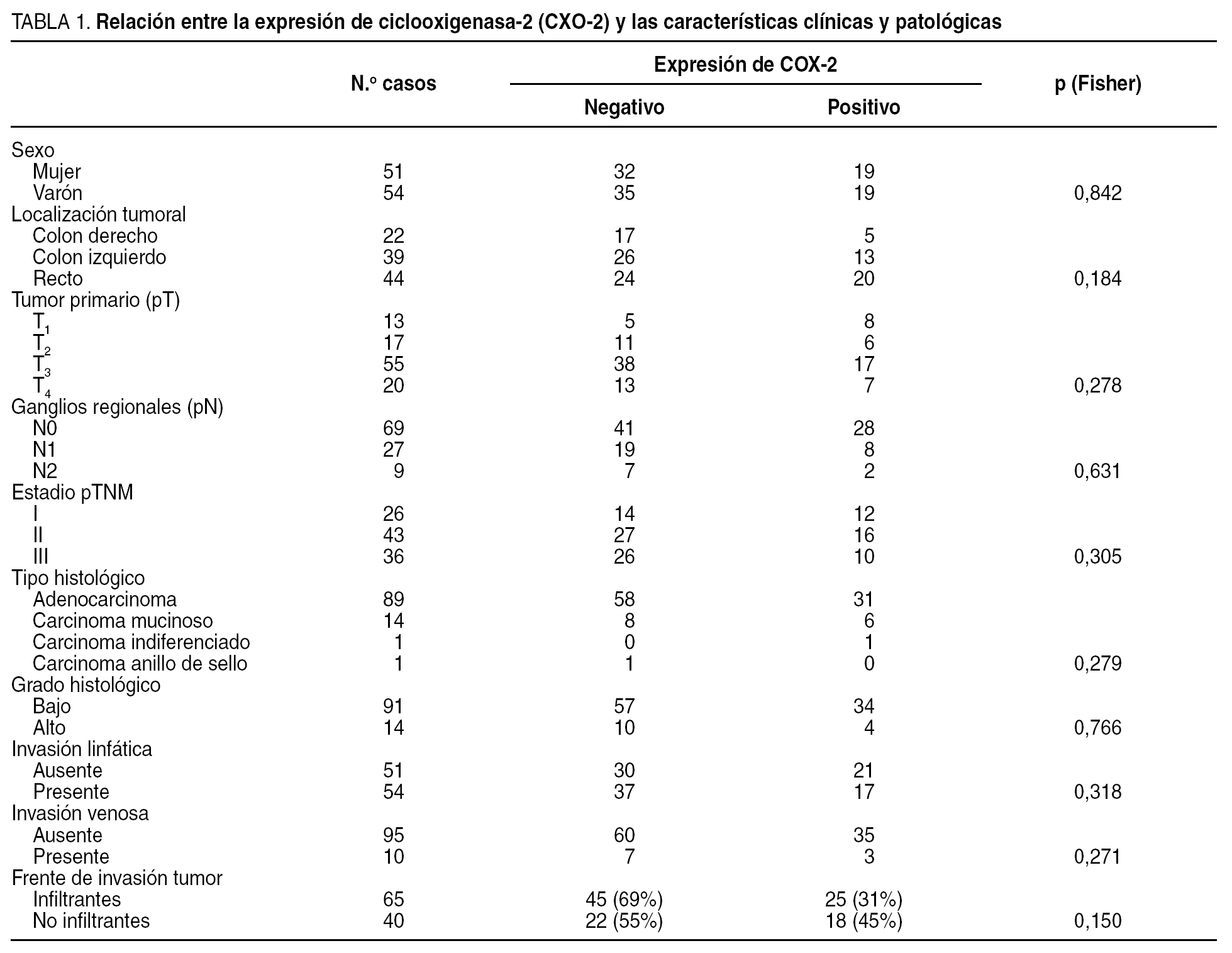
Relación de la expresión de ciclooxigenasa-2 con las características anatomoclínicas del tumor
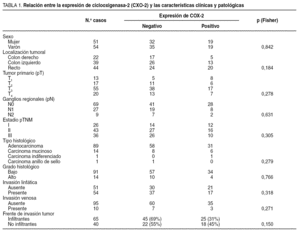
En la tabla 1 se muestra la asociación entre la expresión de la COX-2 y los factores clínicos, el estadio pTNM y las características histopatológicas del tumor. No hubo una relación estadísticamente significativa entre la expresión de COX-2, el sexo y la localización tumoral. Tampoco se encontró una asociación significativa entre la expresión de COX-2, el estadio tumoral y las características histopatológicas estudiadas.
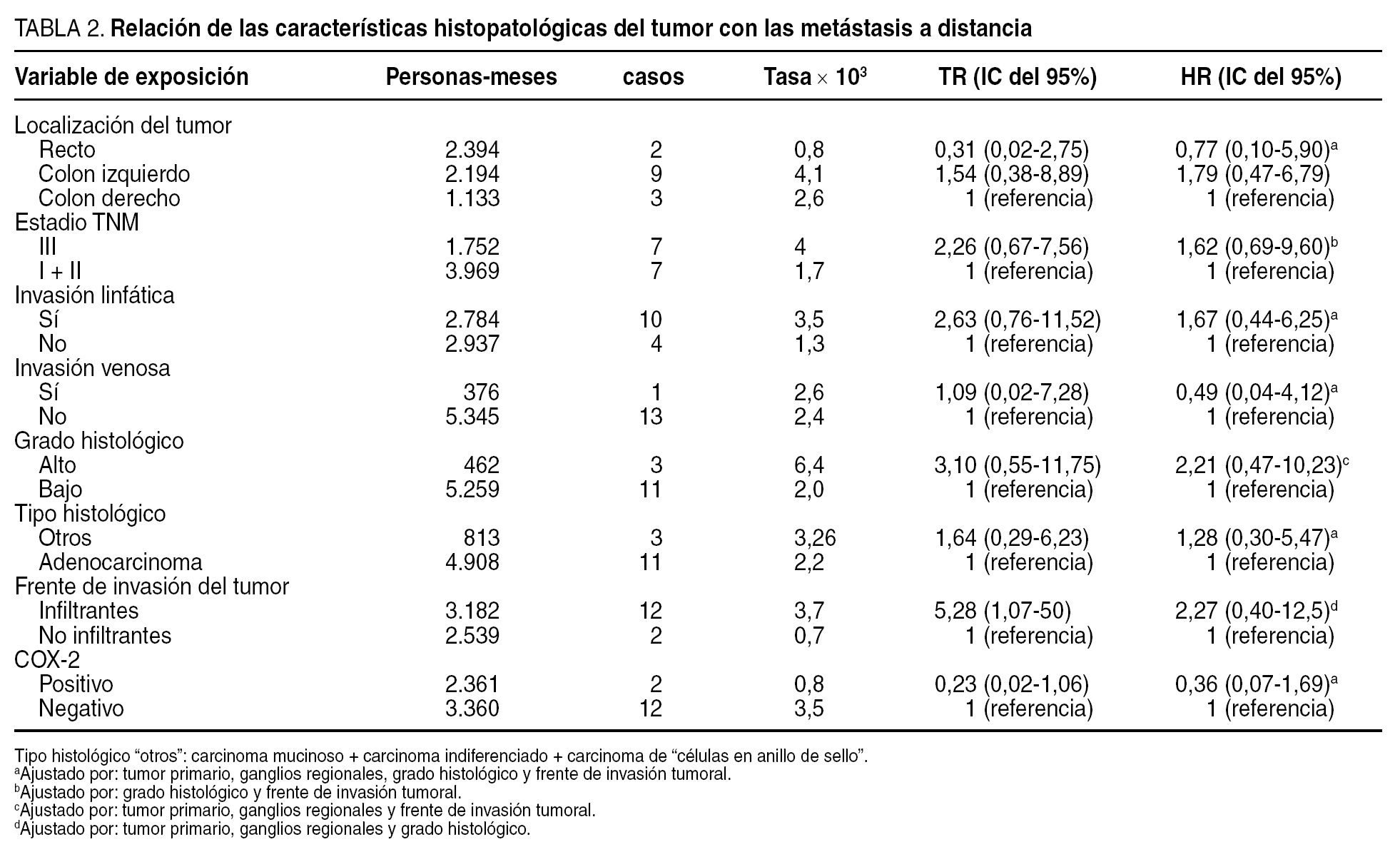
Relación de la expresión de ciclooxigenasa-2 con la recidiva tumoral
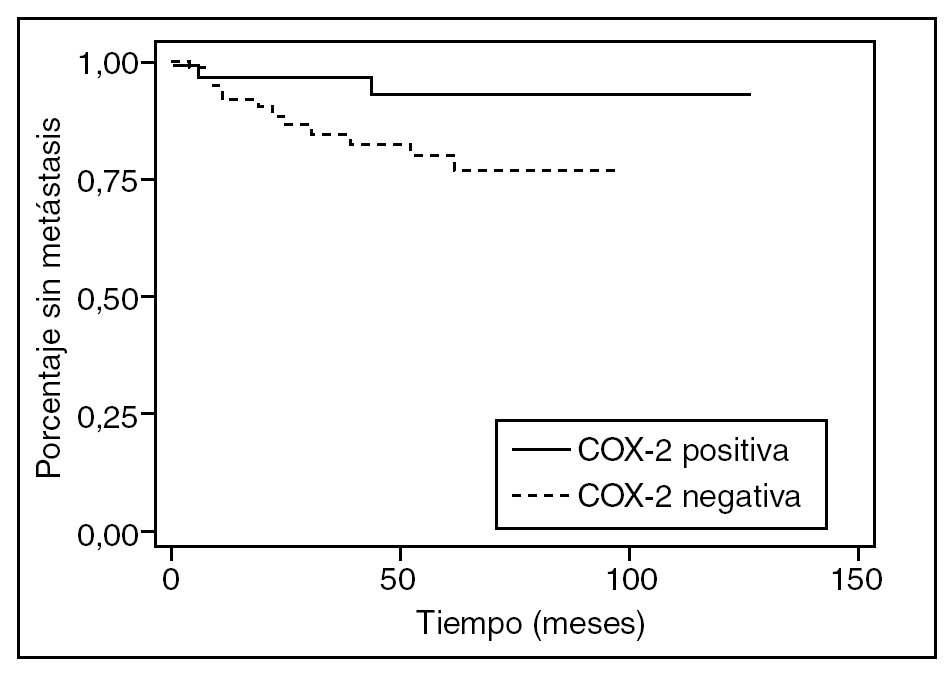
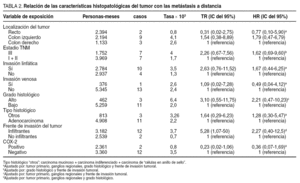
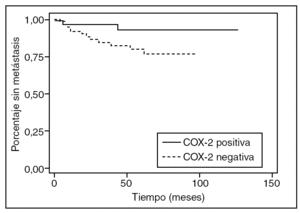
En 14 pacientes (13,3%) se diagnosticaron metástasis a distancia (hepáticas en 8 casos, pulmonares en 4 y en el sistema nervioso central en 2); 2 de ellos presentaban cáncer de recto (4,5% de los tumores de recto) y 12 de colon (20% de los tumores de colon). En el análisis multivariable, la expresión de COX-2 no se relacionó significativamente con las metástasis a distancia (harzard ratio [HR] = 0,36; IC del 95%, 0,07-1,69) (tabla 2). En el análisis de supervivencia no se observó asociación significativa entre la expresión de COX-2 y el tiempo transcurrido hasta la aparición de metástasis a distancia (p = 0,058) (fig. 1). En 17 pacientes (16%) se observó recidiva locorregional. En 12 casos la recidiva tuvo lugar en tumores de recto (el 29% de los tumores de recto) y 5 casos aparecieron en tumores de colon (el 8% de los tumores de colon).
Fig. 1. Curvas de tiempo hasta la aparición de metástasis a distancia, en función de la expresión de ciclooxigenasa-2 (COX-2); p = 0,058.
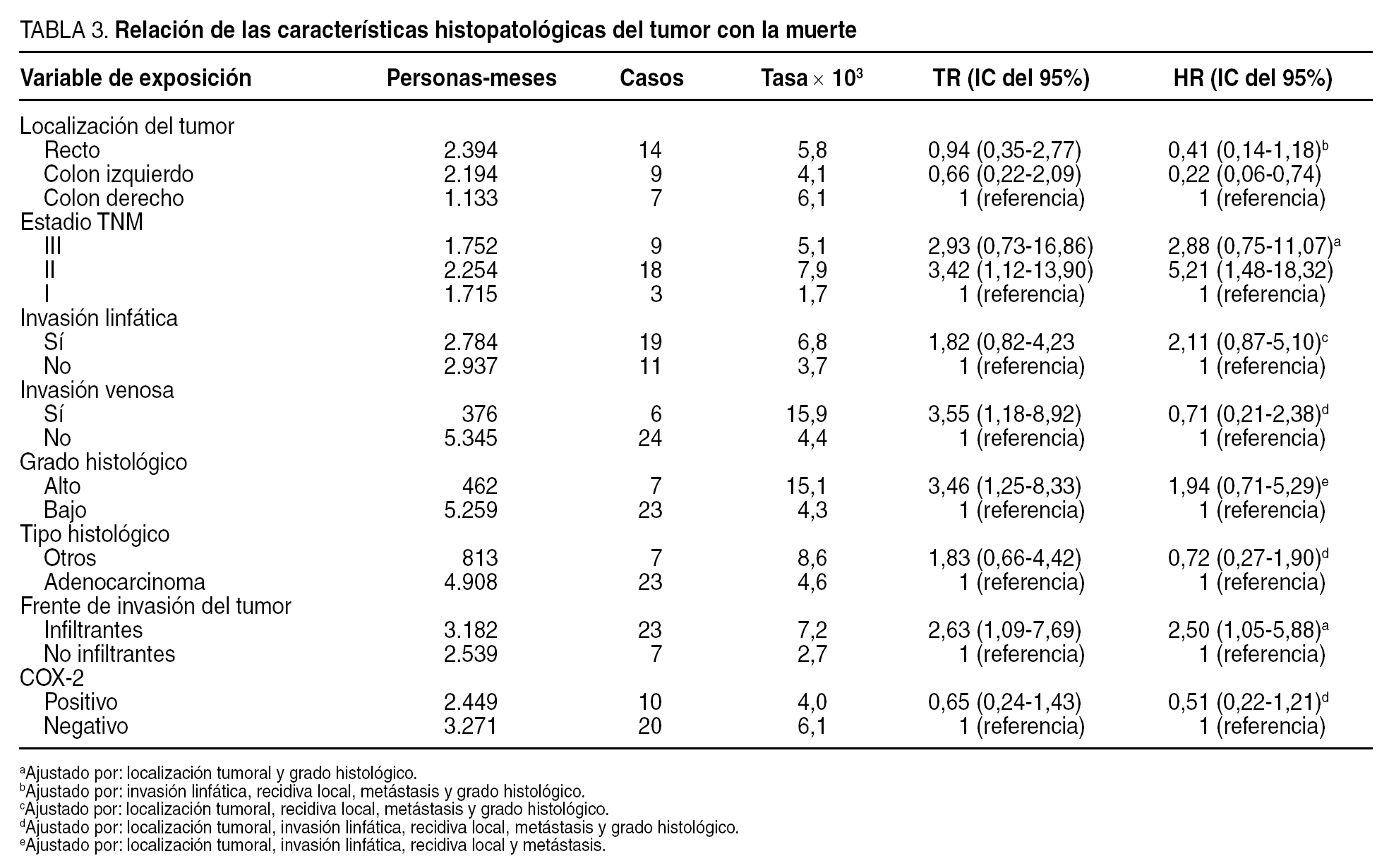
Relación de la expresión de ciclooxigenasa-2 con la supervivencia
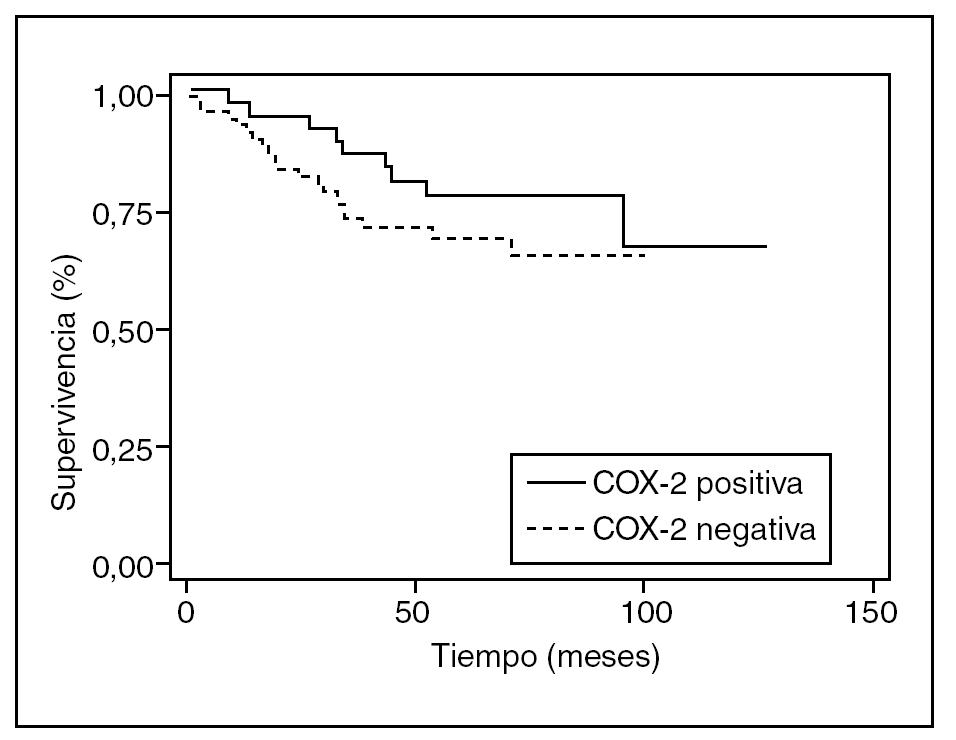
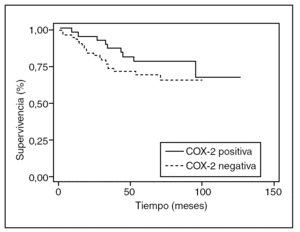
Durante el período de seguimiento fallecieron 30 pacientes (28,5%). La supervivencia media fue de 55 meses y la supervivencia global a los 5 y 10 años fue del 75 y del 60%, respectivamente. En el análisis multivariable, la expresión de COX-2 no se relacionó significativamente con la muerte (HR = 0,51; IC del 95%, 0,22-1,21) (tabla 3). En el análisis de supervivencia no se observó asociación significativa entre la expresión de COX-2 y el tiempo transcurrido hasta la muerte (p = 0,25) (fig. 2).
Fig. 2. Curvas de supervivencia según la expresión de ciclooxigenasa-2 (COX-2); p = 0,25.
Discusión
La participación de la COX-2 en la oncogénesis colónica está apoyada en los efectos observados con la administración de fármacos inhibidores selectivos de la COX-2 en modelos experimentales de cáncer colorrectal4. Sheng et al5 observaron que la administración de un inhibidor de la COX-2, simultáneamente a la implantación de células tumorales en ratas, redujo la formación del tumor en el 80-90% de los casos cuando las células implantadas expresaban COX-2. En este mismo modelo experimental, Tomozawa et al6 y Nagatsuka et al7 demostraron que el JTE-522, inhibidor selectivo de la COX-2, inhibió las metástasis a distancia en los cánceres que sobreexpresaban la COX-2. Otros estudios mostraron que se podían encontrar niveles elevados de prostaglandinas (PgE-2) en cánceres colorrectales8 y que el incremento de la síntesis de prostaglandinas se asocia con valores elevados de COX-2 en el 70-80% de los cánceres colorrectales. En este estudio, la expresión de COX-2 se consideró positiva en 38 casos (36%). Este porcentaje es inferior al que reflejan gran parte de los trabajos que estudian la expresión de la COX-2 en cáncer colorrectal, en los que se sitúa en torno al 70%, aunque hay importantes diferencias entre los distintos autores en el porcentaje de expresión positiva de la COX-2, que oscila entre el 25% de los casos estudiados en la serie de Konno et al9 y el 100% de las series de Sano et al10 y Tomozawa et al11. Creemos que esta disparidad de resultados guarda relación con el hecho de que no hay un método estándar para la determinación de la expresión/concentración de COX-2, sino que se emplean 3 técnicas distintas: inmunohistoquímica, determinación del ARNm de la COX-2 y determinación de proteína COX-2 mediante electroforesis. La inmunohistoquímica es el método más utilizado para valorar la expresión de COX-23,10-13, aunque algunos autores13,14 consideran que este método tiene menor sensibilidad que las otras técnicas y su carácter semicuantitativo hace difícil objetivar los resultados. Entre los autores que utilizan inmunohistoquímica como técnica de determinación de COX-2 no hay uniformidad en los métodos de lectura y los criterios de positividad. Tomozawa et al11 consideran 2 grados de expresión de COX-2 en función de la intensidad de la tinción. Por el contrario, Sheehan et al13 valoran únicamente la extensión de la tinción y consideran 4 grados de expresión según el área teñida. En el presente estudio se ha seguido el sistema de valoración descrito por Masunaga et al3. Este método de lectura, descrito en el apartado "Pacientes y método", se ha considerado el más idóneo, dadas las características de la tinción que hemos observado en las preparaciones. Otros autores como Yamauchi et al12 también han adoptado este método, aunque con distinta escala de puntuación.
En este estudio no se ha demostrado una asociación significativa entre la expresión de COX-2 y el estadio tumoral. Estos resultados se corresponden con los de Eberhart et al15, Dimberg et al16, Gustafson-Svärd et al17 y Hao et al18. Por el contrario, Masunaga et al3 y Sheehan et al13 coinciden en sus resultados al encontrar una relación estadísticamente significativa entre la expresión de la COX-2 y el estadio tumoral. Ambos autores encuentran que la expresión de COX-2 es mayor en los estadios más avanzados (estadios C y D de Dukes).
Otras características histopatológicas, cuya relación con la expresión de la COX-2 se han investigado en este estudio, fueron el tipo histológico, el grado histológico, la invasión venosa y linfática y el frente de invasión del tumor. Con ninguna de estas variables se encontró que hubiera asociación significativa. La relación de la COX-2 con el grado de diferenciación tumoral fue estudiada por Eberhart et al15, Gustafson et al17 y Hao et al18 sin encontrar asociación estadística. En contraposición, los trabajos de Masunaga et al3 pusieron de manifiesto que la expresión de COX-2 en los tumores moderadamente diferenciados y mal diferenciados fue significativamente mayor que en los tumores bien diferenciados.
Tomozawa et al11 y Sheehan y et al13 investigaron la relación entre la COX-2 y el tipo histológico y la invasión vascular. En ninguno de ellos se comprobó una relación estadísticamente significativa entre estas variables.
En el análisis univariable y multivariable, la expresión de COX-2 no se relacionó significativamente con las metástasis a distancia. En el análisis de supervivencia tampoco se observó una asociación significativa entre la expresión de COX-2 y el tiempo transcurrido hasta la aparición de metástasis a distancia. En la bibliografía consultada son pocos los estudios que se ocupan de valorar la expresión de la COX-2 como factor pronóstico de recidiva tumoral, y sus resultados no son coincidentes. Contrariamente a los resultados del presente estudio, Yamauchi et al12 y Tomozawa et al11 encuentran en el análisis multivariable que la expresión de COX-2 es un factor de riesgo independiente de metástasis hepáticas. Sin embargo, otros autores coinciden con nuestros resultados al no encontrar relación entre la expresión de COX-2 y la aparición de metástasis a distancia19,20.
En el análisis multivariable de este estudio, la expresión de COX-2 no se asoció significativamente con la muerte. Tampoco en el análisis de supervivencia se observó una relación con significación estadística entre la expresión de COX-2 y el tiempo transcurrido hasta la muerte. La misma conclusión se desprende de los estudios de Masunaga et al3, Öhd et al21 y Zhang et al22. Por el contrario, los estudios de Sheehan et al13 encuentran una asociación estadísticamente significativa entre la supervivencia de los pacientes y la expresión de la COX-2.
De acuerdo con las evidencias aportadas por los estudios experimentales se ha llegado a postular que la COX-2 favorece la aparición de metástasis a distancia y condiciona un peor pronóstico. Los resultados de los estudios clínicos consultados no parecen corroborar los resultados preliminares de los estudios en animales de experimentación y en líneas celulares de cáncer colorrectal.
Las diferencias en el diseño de los estudios, los criterios de selección de los pacientes y los métodos de evaluación de la expresión de COX-2 pueden estar en el origen de la disparidad de resultados que proporcionan los trabajos que analizan la expresión de la COX-2 en células epiteliales de cáncer colorrectal. Para que los resultados sean comparables se deben unificar el método de determinación y el sistema de evaluación de la expresión de COX-2. Hay consenso entre los autores al considerar que son necesarios estudios prospectivos, con series suficientemente numerosas y uniformes, para clarificar el papel de la COX-2 en el crecimiento tumoral, así como su relación con la supervivencia y la recidiva tumoral.