La cirugía es hoy el tratamiento más eficaz para el cáncer gástrico. Debido a los diferentes resultados quirúrgicos obtenidos entre los cirujanos japoneses y de los países occidentales, la técnica quirúrgica más apropiada sigue siendo motivo de controversia.
La técnica quirúrgica propuesta por la Japanese Research Society for Gastric Cancer (JRSGC) –gastrectomía con linfadenectomía tipo D2– no ha sido aceptada por la mayoría de los cirujanos occidentales debido a su morbilidad y mortalidad, como se ha confirmado en 2 estudios europeos, prospectivos y aleatorizados1,2. Si bien se ha criticado estos trabajos por su metodología, otras publicaciones internacionales3-7 demuestran que cirujanos experimentados pueden realizar la gastrectomía D2 con morbilidad y mortalidad no elevadas, incluso en pacientes mayores de 70 años8. En una publicación anterior de nuestro grupo comprobamos que tanto el tipo de gastrectomía como la linfadenectomía realizada no influían en la calidad de vida de los pacientes, por lo que podrían ser válidas en los pacientes con carcinoma gástrico9.
El objetivo del presente trabajo es analizar la morbilidad y la mortalidad relacionadas con la gastrectomía D2 en una serie de pacientes consecutivos intervenidos quirúrgicamente en la Unidad de Cirugía Esófago-Gástrica del Servicio de Cirugía General del Hospital Virgen del Camino (Pamplona), y comprobar si los resultados obtenidos pueden ser similares a los de centros con gran experiencia por el número de casos tratados.
Material y métodoTrabajo descriptivo y prospectivo en 126 pacientes consecutivos con diagnóstico de adenocarcinoma gástrico sin metástasis a distancia, a quienes se les practicó una gastrectomía con linfadenectomía D2 entre abril de 1998 y marzo de 2006.
Se excluyó del presente estudio a los pacientes sin confirmación anatomopatológica de adenocarcinoma, los casos con neoplasias sincrónicas y con tumores localizados en la unión esofagogástrica.
Se recogieron como antecedentes la enfermedad pulmonar obstructiva crónica (EPOC), la diabetes mellitus, la hipertensión arterial y el índice de masa corporal.
Técnica quirúrgicaLa extensión de la resección gástrica fue determinada por la localización anatómica del tumor, diámetro mayor, estadio tumoral y tipo histológico según la clasificación de Lauren. La gastrectomía subtotal distal se reservó para pacientes que presentaban tumores de menos de 3 cm de diámetro mayor, localizados en el antro distal, que correspondían al tipo intestinal de Lauren y que, al examen macroscópico, aparentemente no invadían la serosa gástrica. A los demás pacientes se les realizó gastrectomía total.
La resección se extendió a órganos vecinos cuando se sospechó que estaban invadidos por el tumor. Se realizó esplenectomía en los tumores proximales localmente avanzados con sospecha de invasión del bazo o con ganglios del hilio esplénico aparentemente invadidos. Se asoció pancreatectomía distal en los casos con sospecha de infiltración tumoral o de invasión metastásica de los ganglios de la cadena de la arteria esplénica.
Esta serie de intervenciones la realizó uno de los tres cirujanos de la Unidad de Cirugía Esófago-Gástrica.
La disección ganglionar se realizó siguiendo las recomendaciones de la JRSGC. Los ganglios extirpados corresponden a los de los niveles 1 y 2 incluido el grupo 1210. Al finalizar la intervención, un cirujano de la unidad, conjuntamente con el patólogo, identificó en fresco los grupos ganglionares según la JRSGC. Los ganglios linfáticos se aislaron mediante inspección y palpación. El estudio histológico fue convencional; se examinaron dos secciones teñidas con hematoxilina y eosina. No se realizaron técnicas de inmunohistoquímica de manera sistemática, tan sólo para confirmar si había micrometástasis o células tumorales aisladas.
La valoración del estadio se realizó de acuerdo a la clasificación TNM incluida en la quinta edición de la UICC y AJCC del año 199711. La definición de “tumor residual” utilizada fue la que recomienda la UICC, en la que la resección R0 se define como la ausencia de afección tumoral macroscópica o microscópica en el análisis de la pieza operatoria, y R1, como evidencia microscópica de tumor residual12.
La citología intraoperatoria del líquido peritoneal se realizó de forma sistemática en todos los casos a partir del año 1999. Tras la laparotomía se instilaban 500 ml de suero salino en la cavidad abdominal de los que se recogían 2 muestras de 50 ml.
En los pacientes sometidos a gastrectomía total se practicaba, antes de finalizar la intervención, una yeyunostomía con catéter para nutrición enteral.
Se registraron las complicaciones operatorias y postoperatorias, tanto las relacionadas directamente con la cirugía practicada como todas las que se manifestaron durante la hospitalización.
La mortalidad operatoria fue definida como la ocurrida dentro de los 30 días del postoperatorio o durante la hospitalización del paciente.
ResultadosLas características de los 126 pacientes se muestran en la tabla 1; 30 pacientes eran mayores de 75 años. El 52,4% de los pacientes presentaron un índice de masa corporal (IMC) superior a 25, es decir, estaban con sobrepeso.
TABLA 1. Características clinicopatológicas de la serie
La técnica quirúrgica más utilizada fue la gastrectomía total. La nutrición enteral se realizó exclusivamente en pacientes sometidos a gastrectomía total (en el 69,4%).
Estudio anatomopatológicoEl examen anatomopatológico de la pieza operatoria mostró infiltración de los bordes quirúrgicos en 11 (8,7%) pacientes; 6, del borde superior esofágico y 5, del duodenal. Los 6 casos con infiltración microscópica del borde superior eran tumores muy extensos (de 5 a 11 cm), localizados en el tercio superior gástrico, todos avanzados y de tipo difuso, y que no reunían los criterios topográficos de los tumores de la unión esofagogástrica después del estudio patológico. Se llevó a cabo una resección R0 en 99 (78,6%) pacientes. Se demostró infiltración de órganos en 11 casos (páncreas, 3; colon, 4; hígado, 1; bazo, 1; hiato esofágico, 1, y riñón, 1).
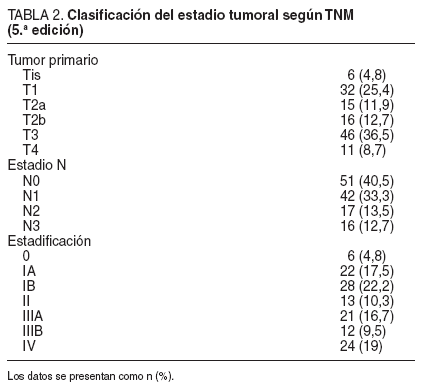
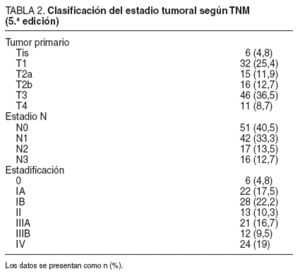
El grado de invasión tumoral de la pared gástrica y la extensión de la afección ganglionar se presentan en la tabla 2. La media ± desviación estándar (DE) de ganglios extirpados por cada caso fue de 32,8 ± 13,2, y según las recomendaciones de la escuela japonesa, en el primer nivel (grupos del 1 al 6) se extirpó una media de 24,7 ± 11,3 ganglios y en el segundo nivel (grupos del 7 al 12), una media de 8,2 ± 4,5 ganglios. En el examen anatomopatológico presentó metástasis un promedio de 5,44 ± 8,7 ganglios, con una media de 4,5 ± 7,4 en el primer nivel y 0,88 ± 2,1 en el segundo.
TABLA 2. Clasificación del estadio tumoral según TNM
La citología intraoperatoria del líquido peritoneal se realizó en 102 (81%) de los 126 casos, con resultado positivo en 6 (5,9%) de ellos.
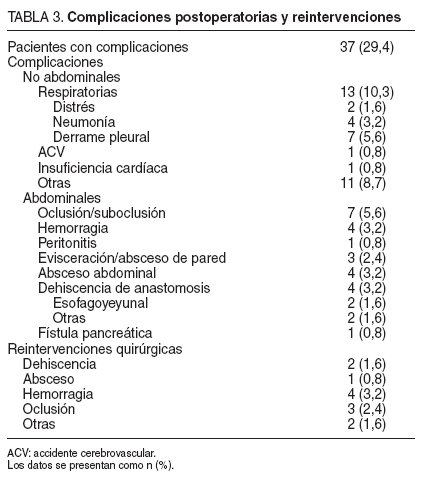
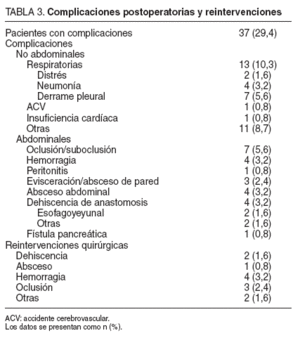
Morbididad y mortalidadSe presentaron complicaciones en 37 (29,4%) pacientes, y en algunos de ellos más de una complicación. Se realizaron 12 reintervenciones quirúrgicas, y todas correspondieron a pacientes sometidos a gastrectomía total. Las complicaciones postoperatorias y reintervenciones quirúrgicas se especifican en la tabla 3.
TABLA 3. Complicaciones postoperatorias y reintervenciones
Se realizó estudio radiográfico con contraste hidrosoluble al séptimo día postoperatorio de forma sistemática. No se demostró fuga anastomótica en los 4 casos de absceso abdominal. Uno de ellos precisó reintervención quirúrgica para su drenaje y los otros 3 se solucionaron con drenaje percutáneo. Un caso de peritonitis lo causó la filtración del catéter de yeyunostomía, y se comprobó en la reintervención.
De las 2 dehiscencias esofagoyeyunales, una de ellas precisó drenaje quirúrgico y la otra se trató de forma conservadora con drenaje percutáneo. La dehiscencia de anastomosis gastroyeyunal se resolvió con drenaje y tratamiento médico. La dehiscencia del muñón duodenal se reintervino con una buena evolución. El caso de la fístula pancreática se solucionó en una semana.
La mortalidad total de la serie fue de 2 (1,6%) casos a los que se les había realizado una gastrectomía total (mortalidad relacionada específicamente con la gastrectomía total del 2,1%). Uno de ellos era un paciente de 64 años con antecedentes de cardiopatía isquémica, bypasscoronario y EPOC severa; presentó un cuadro clínico de distrés respiratorio secundario a neumonía por el que falleció a los 30 días del postoperatorio, y sin evidencia de complicación intraabdominal. El segundo paciente, de 70 años con antecedentes de diabetes mellitus y EPOC, presentó un shock postransfusional a los 24 días del postoperatorio. En la necropsia no se encontró complicación intraabdominal. Ninguno de los 2 pacientes había presentado dehiscencias de las anastomosis (mortalidad de la dehiscencia esofagoyeyunal del 0%).
DiscusiónLos datos de los pacientes de nuestra serie son semejantes a los presentados en otras publicaciones en cuanto a edad, sexo2,13-15 y factores de riesgo asociados8,16.El conjunto de todos estos factores hizo que más del 60% de los pacientes de la serie tuviesen una valoración del riesgo ASA III y IV, mientras que otros autores describen estos grupos de riesgo en un 40 y un 4% de los casos, respectivamente17. Más de la mitad de ellos tenían sobre-peso en el momento de la intervención quirúrgica.
Debido al tamaño promedio de los tumores, así como a la frecuente localización de éstos en los tercios medio y proximal del estómago, a la mayor parte de los pacientes se les realizó una gastrectomía total, de acuerdo con nuestras preferencias en el tratamiento quirúrgico del cáncer gástrico avanzado. En la misma línea que otros trabajos, como los del German Gastric Carcinoma Study, hemos realizado gastrectomía subtotal a los pacientes con tumores localizados en el antro gástrico, pequeños, que no invaden la serosa, y del tipo intestinal de Lauren. En todos los demás casos se practicó gastrectomía total4. Por contra, otras publicaciones no detectan un claro beneficio de la gastrectomía total frente a la subtotal por lo que preconizan la utilización de esta última5,13. Consideramos que las series no son comparables, ya que en dichas publicaciones la mayor parte de los tumores se encontraban localizados en el antro gástrico y en una proporción similar el tamaño tumoral era menor de 5 cm de diámetro mayor.
La resección de órganos vecinos como parte obligada de la linfadenectomía D2 es muy controvertida y ya en los trabajos prospectivos y aleatorizados europeos de Países Bajos y Reino Unido, en los que se comparaba la linfadenectomía D1 con la D2, las elevadas morbilidad y mortalidad se las atribuyó en parte a la resección de la cola del páncreas y del bazo1,2,18. Bastantes autores recomiendan evitar la resección de estos órganos, entre ellos Csendes et al19 que, en un estudio prospectivo y aleatorizado que comparaba resultados de gastrectomía total con o sin esplenectomía, concluyeron que la esplenectomía no es necesaria en los estadios tempranos de la enfermedad, ya que realizarla de forma sistemática aumentaría las complicaciones sépticas postoperatorias sin aumentar la sobrevida de los pacientes. Kitamura et al20 también recomendaron no realizar la pancreatoesplenectomía de forma sistemática durante la gastrectomía total, ya que, en su experiencia, no proporcionaba una mejoría en la supervivencia. Anteriormente, el German Gastric Carcinoma Study Group también concluyó que la esplenectomía no aumentaba la supervivencia de los pacientes16. Hoy día, la maniobra de preservación pancreática de Maruyama ha sido aceptada por la mayoría de los autores21. Por otra parte, existe un consenso general que acepta la extirpación tanto del bazo como de la porción distal del páncreas cuando hay sospecha de invasión tu-moral directa o de afección ganglionar macroscópica en los grupos 10 y 11 con el fin de obtener una resección R018,22,23. En nuestra serie la resección de algún órgano vecino se debió exclusivamente a la sospecha de invasión tumoral; en el caso de las resecciones pancreáticas y esplénicas, además de dicha causa, a la proximidad tu-moral o aparente afección ganglionar en los grupos ganglionares 10 y 11. De los 22 casos en los que se realizó esplenectomía, 20 correspondían a tumores localizados en el tercio superior y medio gástrico (16 eran T3/T4 y 4 eran tumores muy próximos al hilio esplénico y con sospecha de infiltración); los otros 2 eran cánceres de muñón gástrico. En el estudio patológico se encontraron ganglios invadidos en el hilio esplénico en 8 casos. Los 9 casos en que se realizó pancreatectomía eran tumores T3/T4 y con sospecha macroscópica de infiltración tumoral que se confirmó en 3 pacientes. En los demás casos, se realizó una linfadenectomía D2 con preservación tanto del bazo como de la cola del páncreas. El promedio de ganglios extirpados por cada caso, 32,8, es similar al obtenido por otros grupos6,13,19,24 y, a su vez, superior al mínimo de ganglios recomendado por Siewert et al25 para estas intervenciones quirúrgicas y al número de ganglios aconsejado por la última clasificación TNM de la AJCC para poder realizar una valoración correcta del estadio de la enfermedad.
La morbilidad general en nuestra serie fue del 29,4%, cifra que creemos muy aceptable ya que es inferior a la publicada en otras series1,2,26,27, aunque se puede mejorarla para alcanzar valores como los comunicados por otros grupos en donde la morbilidad general puede llegar a valores por debajo del 12%5,6,13. Es de reseñar que, en nuestra serie, hemos incluido todo tipo de complicaciones presentadas por los enfermos, lo que refleja la morbilidad real de la intervención.
En concordancia con los hallazgos de otros autores, entre las complicaciones no abdominales, las respiratorias fueron las más frecuentes2,4,6,8,15,17.
Entre las complicaciones abdominales, las fugas de las anastomosis se presentan en varias series en porcentajes que van del 2,1 a más del 8%2,4,6,8,13,19,25. La incidencia total de dehiscencias diagnosticadas en nuestra serie, del 3,2%, la consideramos baja, ya que incluye todas las dehiscencias en las anastomosis realizadas, no solamente las de la anastomosis esofagoyeyunal. Es difícil aventurar las razones que expliquen esta incidencia, pero creemos que tiene que desempeñar un papel importante la realización de una técnica muy cuidadosa, así como la participación siempre del mismo equipo de cirujanos especializados en estas intervenciones. La mayor parte de las publicaciones revisadas no especifican en detalle el dato de la incidencia de fugas de la anastomosis esofagoyeyunal, que en nuestra serie se presentó en un 1,6% de los casos, semejante al de las publicaciones que sí lo especifican5,15.
La frecuencia de abscesos intraabdominales varía también en la literatura revisada, aunque la mayoría tiene una incidencia parecida a la nuestra, y en alguna serie llegan hasta casi un 15%3,4,6,8,28,29. Los 4 abscesos abdominales tenían estudio radiográfico digestivo negativo para dehiscencia y fueron tratados con drenaje (3 percutáneo y 1 quirúrgico). La evolución fue favorable en los 4 casos, por lo que no es posible asegurar tajantemente la etiología de los abscesos.
Los cuadros de obstrucción intestinal en el período postoperatorio de los pacientes sometidos a gastrectomía D2 no es un dato comentado con frecuencia por otros autores; en aquellos que lo hacen la frecuencia es algo menor a la nuestra, aunque normalmente no engloban los cuadros de íleo intestinal como nosotros5,6,13.De nuestros 7 casos, en 3 se trató de oclusiones mecánicas por adherencias que precisaron reintervención quirúrgica para su solución. Los otros 4 eran cuadros clínicos de íleo intestinal tratados con medidas conservadoras y resueltos satisfactoriamente.
La hemorragia postoperatoria se presenta, en general, con una frecuencia muy parecida a la de nuestra serie2-4,8. En los 4 casos de hemorragia se realizó reintervención quirúrgica; en 2 de ellos la causa eran vasos sangrantes a nivel del meso y del retroperitoneo, respectivamente; el tercer caso era una hemorragia a nivel de la anastomosis esofagoyeyunal, y el cuarto, una hemorragia de la pared abdominal. En todos se realizó hemostasia y evolucionaron favorablemente.
Del análisis de las complicaciones postoperatorias en nuestra casuística se desprende que la morbilidad general tras gastrectomía y linfadenectomía D2 puede ser baja, incluso cuando se trata de un grupo de pacientes con factores de riesgo asociados (porcentaje elevado con ASA III y IV, así como sobrepeso). No podemos atribuir nuestros resultados a una razón concreta y exclusiva. Creemos que deben desempeñar un papel destacado diversas circunstancias, que los mismos cirujanos realizaran siempre estas intervenciones, una técnica muy cuidadosa, el establecimiento de un protocolo de prevención de complicaciones respiratorias, el diagnóstico y el tratamiento precoces con radiología intervencionista de los abscesos y colecciones intraabdominales, y la alimentación enteral precoz en el postoperatorio. La mayoría de las series publicadas demuestran cifras algo más elevadas de morbilidad1,2,26. Creemos, además, que debería existir un consenso para definir las complicaciones como relacionadas o no con la cirugía y poder hacer los estudios comparables, así como evaluar cada grupo sus resultados en relación con otros con mayor casuística.
Del total de pacientes de la serie, un 9,5% tuvo complicaciones que hicieron necesaria una segunda intervención quirúrgica, cifras semejantes a las reportadas por autores como Roukos y Csendes, aunque superior a la de otros autores3,6,8,19.
De las 12 reintervenciones, 4 corresponden a las hemorragias postoperatorias previamente comentadas, al igual que las 3 oclusiones intestinales mecánicas. Dos casos eran colecciones intraabdominales que se trató con drenaje quirúrgico y que evolucionaron favorablemente. Otra causa de reintervención fue una peritonitis por filtración del catéter de yeyunostomía y se solucionó con la recolocación adecuada de la sonda. Por último, 2 pacientes presentaron evisceración en el postoperatorio inmediato que requirió cierre de la pared abdominal. Todas las reintervenciones correspondieron a pacientes que se habían sometido a gastrectomía total.
Nuestro criterio es la vigilancia estrecha de la evolución postoperatoria de estos pacientes y la utilización generosa de los medios auxiliares de diagnóstico en caso de sospecha de posibles complicaciones (ecografía y tomografía computarizada). Si hay sospecha o evidencia de colección intraabdominal somos partidarios del drenaje percutáneo por parte de radiología intervencionista. En todo caso, indicamos la reintervención precoz en caso de drenaje inadecuado o evolución desfavorable.
La mortalidad general de nuestra serie fue del 1,6%, con una mortalidad relacionada con la gastrectomía total del 2,1%, y no hubo mortalidad en la gastrectomía subtotal lo que nos aproxima a series quirúrgicas de centros especializados3-6,23,29. También es de destacar el hecho de que la causa directa de la muerte de nuestros 2 pacientes no haya sido por la técnica quirúrgica realizada.
En conclusión, los resultados de morbilidad y mortalidad de esta serie son similares a los publicados por los grupos con mayor experiencia en este tipo de intervenciones. Todo ello indica, a nuestro juicio, la importancia de la realización de esta operación por cirujanos dedicados preferentemente a la patología esofágica y gástrica.
Correspondencia: Dr. A. Díaz de Liaño. Pintor Maeztu, 2, 8.° C. 31008 Pamplona. Navarra. España. Correo electrónico: adiazdea@cfnavarra.es
Manuscrito recibido el 26-4-2007 y aceptado el 5-9-2007.