Introducción. Motivados por conocer la situación actual del tratamiento del cáncer colorrectal en los hospitales de la Comunidad Valenciana, y por encargo de la Sociedad Valenciana de Cirugía, se elaboró una encuesta dirigida a todos los Servicios de Cirugía General y Aparato Digestivo de estos centros, cuyo resultado exponemos.
Material y método. Se realizó un análisis retrospectivo mediante encuesta, y se obtuvieron los datos desde el año 1997 hacia atrás, agrupándolos por años naturales. La encuesta abordó siete apartados del tratamiento del cáncer colorrectal (diagnóstico, cirugía programada, cirugía de urgencias, terapéutica adyuvante, enfermedad avanzada, seguimiento y anatomía patológica), y se estudiaron tanto parámetros de estructura como de proceso, así como los resultados de los mismos.
Resultados. Se remitieron un total de 20 cuestionarios obteniéndose 17 respuestas (85%). Sólo 2 hospitales (11,7%) disponen de ecografía endorrectal. Ninguno realiza por sistema enema de doble contraste. Únicamente en 3 hospitales (17,64%), el cáncer rectal es tratado por un grupo determinado de cirujanos. Cinco hospitales (29,4%) realizan con asiduidad el lavado colónico intraoperatorio en la cirugía del cáncer obstructivo. Siete centros (41,1%) llevan a cabo algún tipo de terapéutica adyuvante preoperatoria en el cáncer rectal, siendo la cifra total de recidivas locales del 11,58% a los 2 años de seguimiento. No existe ningún protocolo establecido de seguimiento postoperatorio de estos pacientes en 3 hospitales (17,64%). El número medio de ganglios aislados por pieza quirúrgica es de nueve, y sólo 2 centros (11,7%) reflejan en sus informes anatomopatológicos la afectación del margen circunferencial.
Conclusiones. De los resultados obtenidos en esta encuesta y su posterior comparación con la bibliografía concluimos: a) en el aspecto diagnóstico, se debe mejorar el porcentaje de colonoscopias completas; los enemas opacos, cuando se realicen, deberían llevarse a cabo sistemáticamente mediante la técnica de doble contraste; sería aconsejable implantar la ecografía endorrectal como exploración de rutina para la correcta estadificación del cáncer rectal con el fin de realizar una correcta selección de los pacientes ca
Introducción
El presente trabajo es el resultado de una encuesta elaborada por el Grupo de Trabajo sobre Cáncer Colorrectal de la Sociedad Valenciana de Cirugía (SVC) que fue remitida a todos los Servicios de Cirugía de los hospitales públicos de la Comunidad Valenciana.
El Grupo de Trabajo sobre Cáncer Colorrectal de la SVC está constituido por profesionales, mayoritariamente cirujanos, pero también oncólogos, patólogos y radioterapeutas con especial dedicación en su centro de trabajo a esta enfermedad. La SVC creó una guía de práctica clínica con el objeto de abordar el tratamiento del cáncer colorrectal desde un punto de vista multidisciplinario, tarea que se completó en la primavera de 1998 con la publicación de dicha guía1.
Antes de difundirla, y para conocer la situación actual del tratamiento del cáncer colorrectal en los hospitales de la Comunidad Valenciana, se elaboró una encuesta dirigida a todos los jefes de los servicios de cirugía general y aparato digestivo de estos centros.
Material y método
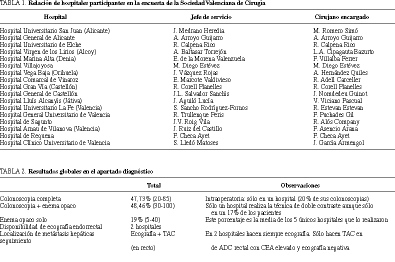
En marzo de 1998 se remitieron un total de 20 cuestionarios, dándose un plazo de 3 meses para su contestación. Se obtuvieron 17 respuestas (85%) (12 tras la primera llamada y cinco tras una segunda). Los servicios que han colaborado en esta encuesta se recogen en la tabla 1.
La metodología aplicada fue de análisis retrospectivo mediante una encuesta sobre 45 ítems con modelo de respuesta abierta. Los datos debían obtenerse desde el año 1997 hacia atrás, siendo agrupados por años naturales. La encuesta abordó 7 apartados del tratamiento del cáncer colorrectal, estudiando tanto parámetros de estructura como de proceso, así como los resultados de los mismos.
1. Diagnóstico: criterios de utilización y disponibilidad de técnicas diagnósticas, como colonoscopia, enema opaco, ecografía abdominal, ecografía endorrectal, TAC y RNM.
2. Cirugía programada: cirujanos que operan esta enfermedad, tiempo entre diagnóstico y cirugía, existencia de estomaterapeuta, marcaje previo de colostomía, preparación de colon, profilaxis antibiótica, profilaxis tromboembólica, cantidad anual de cánceres colorrectales intervenidos quirúrgicamente y localización de los mismos, porcentaje de resecciones curativas, porcentaje de amputaciones abdominoperineales y resecciones anteriores en cáncer rectal, mortalidad operatoria, infección de herida, filtración anastomótica clínicamente manifiesta tras una resección anterior y tras otras resecciones, recidiva local a los 2 años en cáncer de colon y de recto.
3. Cirugía de urgencias: promedio anual de cánceres colorrectales obstructivos y perforados operados, promedio anual de intervenciones de Hartmann practicadas en cirugía de cáncer colorrectal y porcentaje de éstas que se reconstruyen con posterioridad, promedio anual de resecciones con anastomosis primarias y tipo de técnica que se utiliza, así como mortalidad operatoria.
4. Terapéutica adyuvante: criterios de utilización de quimioterapia y radioterapia en cáncer cólico y rectal.
5. Enfermedad avanzada: papel de la cirugía y de la quimioterapia, y uso de quimioterapia intraarterial.
6. Seguimiento: protocolo de seguimiento.
7. Anatomía patológica: media de ganglios aislados, clasificación utilizada y especificación del grado de diferenciación.
Resultados
En el aspecto diagnóstico, llama la atención que sólo 2 hospitales (11,7%) disponían de ecografía endorrectal. Ninguno realizaba por sistema enema con la técnica de doble contraste. El resto de criterios de utilización y disponibilidad de técnicas diagnósticas se recogen en la tabla 2.
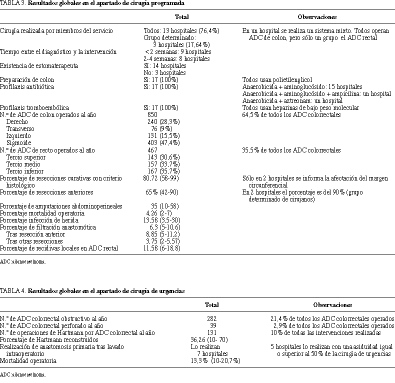
En 3 hospitales (17,64%), el cáncer rectal era tratado por un grupo determinado de cirujanos. Los resultados de los demás parámetros evaluados en cirugía programada se resumen en la tabla 3. En este mismo sentido, se evaluó la cirugía de urgencias, cuyos valores se exponen en la tabla 4; llama la atención que sólo 5 hospitales (29,4%) realizaran con asiduidad el lavado colónico intraoperatorio en la cirugía del cáncer obstructivo.
Los criterios de utilización de terapéutica adyuvante, tan to en el cáncer de colon como en el de recto, se resumen en la tabla 5. Se realizó algún tratamiento preoperatorio de este tipo únicamente en 7 hospitales (41,1%), siendo la cifra global de recidivas locales del 11,58%.
En el apartado de anatomía patológica, así como en el seguimiento, los resultados se esquematizan en la tabla 6. No existía protocolo de seguimiento postoperatorio establecido en 3 hospitales (17,64%). El número medio de ganglios aislados por pieza quirúrgica fue de nueve y sólo 2 centros (11,7%) reflejaban en sus informes anatomopatológicos la afectación del margen circunferencial.
Por último, en la tabla 7 se resumen las indicaciones de la cirugía y la quimioterapia en la enfermedad avanzada.
Discusión
Aspectos diagnósticos
El estudio completo del colon y del recto puede obtenerse mediante colonoscopia completa o bien rectosigmoidoscopia rígida o flexible y enema opaco realizado preferentemente con la técnica del doble contraste. Aunque para la exclusión de lesiones sincrónicas el estudio de Barillari2 evidencia que la colonoscopia es más precisa que el enema opaco, ambas pruebas pueden variar de forma cualitativa, por lo que la elección de una de ellas dependerá tanto de los medios disponibles como de la experiencia del médico que realice la prueba.
Según los datos de la bibliografía, se debe conseguir una colonoscopia completa hasta el ciego en el 90% de los casos, con un porcentaje de perforación del 0,1%3. Sin embargo, el estudio de Trent y Wales4 demostró un porcentaje de colonoscopias completas en menos del 50% de los casos. Nuestro trabajo demuestra un porcentaje total de colonoscopias completas similar, si bien hay que puntualizar que en la inmensa mayoría de hospitales esta cifra se sitúa aproximadamente en el 70%, pero el valor total estuvo sesgado por 2 centros que alcanzaron menos de un 20% de colonoscopias completas. También hay que señalar, en sentido negativo, el hecho de que no se haya generalizado en nuestro medio el uso sistemático de enema opaco de doble contraste en el estudio de esta enfermedad, pues sólo hubo un hospital que lo practicase y únicamente en un 17% de sus pacientes.
Con anterioridad a la cirugía electiva se recomienda descartar la existencia de metástasis hepáticas mediante un estudio con TAC o ultrasonidos, así como de metástasis pulmonares con una radiografía de tórax5, ya que los pacientes con metástasis a distancia y una neoplasia localmente resecable se beneficiarían de la resección de la lesión primaria6. También algún paciente con buen estado general y con lesión en el hígado puede ser un candidato potencial para resección hepática o quimioterapia intraarterial. La mayoría de los centros encuestados realiza estudio de extensión mediante ecografía en el cáncer de colon y de TAC en el cáncer rectal, ya que la misma exploración sirve no sólo para visualizar el hígado, sino la extensión local del tumor.
En el caso de tumores rectales palpables situados en los dos tercios distales del recto, se debe evaluar el grado de fijación de los mismos inicialmente mediante exploración física con el fin de evitar cirugía sin garantías de radicalidad, e identificar a aquellos pacientes que pueden beneficiarse de radioterapia preoperatoria. Asimismo, tanto si existen dudas respecto a su grado de fijación como si la evaluación de la extensión locorregional de los tumores rectales puede modificar el esquema terapéutico, se recomienda la evaluación de los mismos mediante TAC pélvica, RNM o ecografía endorrectal7, exploración esta última de la que actualmente sólo disponen dos de los hospitales estudiados.
El intervalo de tiempo entre el diagnóstico y el tratamiento del cáncer colorrectal debe ser el menor posible. Aunque no se puede recomendar un tiempo de espera máximo de seguridad, los resultados de diversos ensayos clínicos de detección indican que la supervivencia es mejor cuando la enfermedad se trata en estadios precoces de su desarrollo8. Los estudios de Trent, Wales y Wessex4 revelaron un tiempo medio de espera de 26 y 27 días, respectivamente, con unas medianas de 20 y 18 días y rangos que oscilaron entre 0 y 400 días. Según estos datos se recomienda que el tiempo medio de espera desde que se realiza el diagnóstico hasta que se interviene el cáncer colorrectal no sea superior a 4 semanas, hecho que se dio en todos los centros encuestados.
Cirugía programada
Existe una gran variabilidad en cuanto a procedimientos, actuaciones y grado de experiencia de unos cirujanos a otros9. Estudios en los que se comparan resecciones efectuadas por cirujanos con especial interés en coloproctología y otros sin interés en la misma, no han conseguido demostrar diferencias estadísticas significativas en cuanto a longitud de segmento resecado, escisión de órganos vecinos afectados o número de ganglios extirpados, aunque todos estos parámetros siempre fueron más favorables en los pacientes intervenidos por aquellos cirujanos con interés en la coloproctología10. Sin embargo, en los últimos años han ido apareciendo estudios en los que sí parece existir diferencias estadísticamente significativas en lo que respecta a la recidiva local y la supervivencia a los 5 años tras resección anterior baja11,12. Por tanto, a pesar de que no hay datos fiables en la relación causa-efecto respecto al número de casos tratados por un cirujano, debe tenerse presente que un análisis de resultados sólo puede ser razonable si analizamos también un número apreciable de pacientes. En este sentido, sólo en tres de los hospitales encuestados esta enfermedad era intervenida quirúrgicamente por un grupo determinado de cirujanos. Es interesante la propuesta mixta que se realiza en uno de los centros, consistente en que sólo el cáncer rectal, que depende más del cirujano que el colónico, sea tratado por un grupo con especial interés en esta cirugía. Esta alternativa podría ser aplicada en servicios en los que, debido al escaso número de cirujanos, no sea posible crear una unidad estrictamente dedicada a la cirugía colorrectal.
De los estudios actuales se desprende que si el paciente es candidato a la realización de un estoma se le deben explicar de modo cuidadoso las causas del mismo y sus consecuencias. Con suficiente antelación a la cirugía, deberá ser visitado por un estomaterapeuta para su preparación, tanto física (localización del estoma para ubicarlo en el lugar más idóneo) como psicológica13. Sólo 3 hospitales de nuestro estudio no disponían de este especialista. Es evidente que cuando no sea posible la visita del estomaterapeuta, como puede suceder en situaciones de urgencia, el lugar del estoma será marcado por el propio cirujano.
La mayoría de los cirujanos considera que la preparación intestinal es fundamental para reducir la incidencia de complicaciones sépticas y fallos de sutura14. Sin embargo, existen numerosos estudios que no han demostrado un beneficio en pacientes sometidos a cirugía de colon izquierdo o recto, sobre todo actualmente, en la era de potentes antibióticos sistémicos15. Por ello, no pueden ofrecerse recomendaciones definitivas en este sentido, pero la opinión de la mayoría aboga todavía por la preparación intestinal mecánica.
El riesgo de trombosis venosa profunda (TVP) y de embolismo pulmonar (EP) están aumentados en los enfermos sometidos a cirugía de cáncer colorrectal. Se ha demostrado que los porcentajes de TVP, EP y muerte por EP pueden reducirse de forma significativa en pacientes quirúrgicos con la aplicación de heparina subcutánea16. Las heparinas de bajo peso molecular (HBPM) tienen una eficacia similar a la heparina estándar, si bien las complicaciones relacionadas con la hemorragia parecen ser menores17. Todos los hospitales de nuestro estudio utilizaban HBPM en la profilaxis tromboembólica.
El papel de la profilaxis antibiótica en la prevención de complicaciones infecciosas tras la cirugía está muy bien establecido. Se recomienda la administración preoperatoria intravenosa de antibióticos en la cirugía colorrectal18. Varios antibióticos y combinaciones de los mismos han demostrado ser efectivos. Así, como sucede en la mayoría de centros encuestados, la pauta más habitual suele ser la utilización de un anaerobicida (metronidazol, clindamicina) junto con un aminoglucósido (gentamicina, tobramicina) o una cefalosporina. También se han utilizado la amoxicilina-ácido clavulánico19, anaerobicida más aztreonam, etc. Una buena combinación podría ser una cefalosporina y metronidazol, ya que existen evidencias de que una sola dosis administrada durante la inducción anestésica es igual de eficaz en la prevención de la infección de la herida como la pauta de 3 dosis20. Con la moderna profilaxis antibiótica, el índice de infección de herida operatoria (evidenciada por la presencia de pus) en cirugía electiva deberá ser menor del 10%20, teniéndose en cuenta que se ha llegado a publicar un porcentaje de hasta el 2%21. En este sentido, nuestros porcentajes se han situado en un 13,58%, claramente superiores a los recomendados.
La cirugía es la base fundamental en el tratamiento del cáncer colorrectal y se considera curativa cuando el cirujano es capaz de extirpar toda la enfermedad macroscópica seguido de la comprobación histológica de ausencia de tumor en los márgenes de la pieza, tanto laterales como en los extremos22. En caso de duda sobre la existencia de tumor residual deberá biopsiarse la zona sospechosa5. El porcentaje de resecciones curativas varía de un cirujano a otro. Se debe tender a conseguir un índice global de resecciones curativas del 60%, aunque éste dependerá en parte del estadio tumoral en que se presenten los pacientes23. En centros más especializados se han descrito mejores resultados con cifras de resecciones curativas, que pueden llegar hasta casi el 80%24. Estos porcentajes tan elevados podrían atribuirse a una alta especialización y experiencia de los cirujanos, aunque no puede descartarse que obedezcan a una selección cuidadosa de pacientes remitidos desde otros centros a estas unidades de referencia. En nuestro estudio, el porcentaje de resecciones curativas fue del 80,72%. Este halagador resultado debe ser matizado, ya que sólo 2 hospitales informaron sobre la afectación de los márgenes laterales y, como es sabido, la presencia de tumor en esos márgenes de la pieza se asocia hasta con un 85% de recidivas25.
Mientras en el cáncer de colon la mayoría de las recidivas locales se presentan junto con enfermedad diseminada26, en el cáncer rectal se presentan casi siempre solas, lo que supone que la técnica quirúrgica es decisiva y hasta cierto punto los resultados dependen del cirujano, existiendo una gran variabilidad también es este tema, ya que los índices de recidiva son del 0-21%27. La diseminación del tumor en el mesorrecto y la cantidad de resección mesorrectal se han involucrado recientemente como factores pronósticos en el cáncer de recto28, recomendándose la escisión del mesorrecto hasta unos 5 cm por debajo del margen distal del cáncer rectal en los tumores de tercio superior, mientras que en los de tercio medio e inferior la escisión completa del mesorrecto debería ser la norma.
La tendencia a evitar la amputación abdominoperineal (AAP) en beneficio de la resección anterior hizo pensar que podría gravar las tasas de recidiva local, pero numerosas series no han encontrado diferencias entre estas intervenciones9,29-31. Aunque la proporción ideal entre resección anterior y amputación abdominoperineal no se puede determinar, se recomienda que el porcentaje de tumores rectales tratados por AAP sea inferior al 40%. Siempre que pueda conseguirse un margen distal al tumor sano de 2 cm, los factores locales lo permitan (anchura de pelvis, obesidad, tamaño tumoral, grado de continencia) y la neoplasia sea bien o moderadamente diferenciada, se recomienda una resección anterior. En este sentido, el 65% de resecciones anteriores de nuestro estudio es un resultado bastante bueno, destacando las cifras del 90% obtenidas por 2 hospitales en los que existen unidades de cirugía colorrectal.
Las dehiscencias de sutura son mucho más frecuentes en las resecciones del recto que en las del colon, constituyendo una importante causa de morbimortalidad, y varían en frecuencia de unos cirujanos a otros entre el 3 y el 15%32. Desde este punto de vista, nuestras cifras pueden considerarse muy aceptables. Está fuera de toda discusión que con el advenimiento de las suturas mecánicas la realización de las anastomosis rectales bajas es mucho más sencilla. Este hecho, junto con el cambio tan espectacular de las recomendaciones para un margen distal de seguridad en la resección del cáncer rectal, ha permitido aumentar el número de intervenciones con preservación esfinteriana. Desafortunadamente, las anastomosis ultrabajas tienen un índice importante de dehiscencias, aun cuando un mismo cirujano tenga cifras aceptables en otros tipos de resección24.
Cirugía de urgencias
El cáncer colorrectal se presenta con frecuencia como una urgencia, y cuando esto ocurre se asocia con una mortalidad elevada. En el estudio Trent y Wales4, el 20% de todas las operaciones fueron de urgencias y la mortalidad operatoria fue del 19,9% en comparación con el 5,1% para las operaciones electivas. La presentación como urgencia más frecuente del cáncer colorrectal es la obstrucción, suponiendo en el estudio Trent y Wales4 una frecuencia del 16% de todas las formas de presentación del cáncer colorrectal. La hemorragia y la perforación son mucho menos frecuentes. Estas cifras son bastante similares a las obtenidas por nosotros en cuanto a porcentaje de intervenciones, aunque ligeramente superiores en la mortalidad.
El tipo de cirugía indicado en la obstrucción del intestino grueso es controvertido, aunque pueden darse unas normas de tipo general. Para las lesiones del lado izquierdo, el uso de una simple colostomía disfuncionante generalmente no es admitido, salvo en circunstancias extremas en las que el paciente se considera muy debilitado para un procedimiento más extenso. Por contra, se aconseja resecar el cáncer obstructivo, finalizando la intervención según la técnica de Hartmann o, cuando las condiciones son favorables, confeccionando una anastomosis primaria. Si se elige esta última alternativa deberá realizarse una resección con lavado colónico intraoperatorio o una colectomía subtotal con anastomosis ileorrectal. Un estudio aleatorizado reciente indicó que ambos procedimientos son equivalentes, aunque el hábito intestinal a largo plazo es mejor con el lavado intraoperatorio33. En nuestro medio continúa optándose por las resecciones tipo Hartmann, de las cuales se reconstruyen un total del 36,26%, en detrimento de las anastomosis primarias con lavado intraoperatorio, que sólo se han realizado en 5 de los hospitales encuestados, con una asiduidad igual o superior al 50% de los pacientes operados por obstrucción de colon izquierdo.
Las técnicas intervencionistas radiológicas o endoscópicas (prótesis metálicas expandibles) pueden contemplarse como alternativa a la cirugía de urgencia del cáncer obstructivo en casos seleccionados34. La experiencia en nuestro medio con este tipo de técnicas ha sido anecdótica.
Terapéutica adyuvante
Hoy día existen evidencias obtenidas a través de estudios controlados aleatorizados de que los pacientes con cáncer co lorrectal operable se benefician de la quimioterapia adyuvante.
Salvo por la inclusión de radioterapia (pre o postoperatoria), las orientaciones de quimioterapia adyuvante en el cáncer de colon son extrapolables al cáncer de recto. Así, desde 1990, el Instituto Nacional de la Salud de los EE.UU. recomienda la administración de quimioterapia adyuvante postoperatoria a los pacientes con cáncer de colon en estadios B2 de alto riesgo (CEA preoperatorio superior a 5 ng/ml, obstrucción o perforación intestinal, adherencia o invasión de órganos adyacentes, histología poco diferenciada, coloide, de células en anillo de sello o aneuploidía celular) y C, así como la asociación de quimioterapia y radioterapia en todos los pacientes con cáncer de recto en estadios B2 y C35. El tratamiento debe iniciarse entre las 4 y las 6 semanas después de la cirugía. Hasta el momento, ningún estudio ha demostrado un efecto convincente en estadios A o B1 y, por tanto, no pueden realizarse recomendaciones definitivas en estos pacientes. Esta actitud coincide con la mayoría de los hospitales encuestados.
Los índices de recidiva local tras la cirugía curativa sola pueden llegar hasta el 32%34, pero la cifra media de las series publicadas se sitúa alrededor del 14%36. No obstante, pueden conseguirse mejores resultados y una reciente revisión independiente del trabajo de Heald reveló una recidiva local del 5% para cánceres rectales en estadios B y C de Dukes a los 5 años tras resección clínicamente curativa37. Por contra, las tasas de recurrencia local para la cirugía curativa sola en los ensayos más satisfactorios de radioterapia osciló desde 16 hasta el 30%38,39, e incluso en los grupos de tratamiento radioterápico adyuvante el índice osciló entre el 9 y el 15%39.
Aunque los resultados de Heald pueden deberse a un alto grado de preparación técnica, podrían explicarse, al menos en parte, por un cuidadoso patrón de selección de pacientes. No obstante, plantean la posibilidad de que la radioterapia pueda tener algún efecto "barrera" para la cirugía inadecuada, y el hecho de que algunos de los estudios hayan demostrado una disminución significativa en la recidiva local con la radioterapia en la cirugía curativa podría explicarse como una mala interpretación de los hallazgos operatorios. Así pues, los resultados de Heald sugerirían que, prestando una cuidadosa atención a los detalles técnicos, de la intervención podrían conseguirse verdaderas resecciones localmente curativas en un alto porcentaje de pacientes y, por tanto, la radioterapia sería superflua.
Las recidivas locales suelen provocar sufrimiento al paciente debido a dolor, hemorragia u obstrucción, por lo que se acepta generalmente que el control local pélvico es un objetivo principal en el tratamiento adyuvante35. Las ventajas de la radioterapia preoperatoria son: a) disminución del riesgo de diseminación del tumor viable durante la cirugía; b) protección del intestino delgado, debido a que en condiciones normales es un órgano móvil y es menos probable que permanezca dentro del campo de irradiación pélvica; c) menor volumen irradiado, no requiriéndose la inclusión del periné, y d) mejor oxigenación del lecho tumoral previa a la cirugía, al no existir alteración del flujo sanguíneo regional.
Se van acumulando pruebas de que la radioterapia preoperatoria en el cáncer rectal puede producir una reducción significativa en la recurrencia local con un pequeño impacto en la supervivencia40. En la actualidad no parece haber ventajas entre un curso largo, de 5 semanas (45 Gy, 1,8 Gy/día) frente a un curso más corto de una semana (25 Gy, 5 Gy/día) si bien no hay ningún ensayo que compare estos dos esquemas. Aunque no se ha estudiado de forma específica, el aumento de la mortalidad cardiovascular en algunos ensayos de radioterapia sugeriría la necesidad de una adecuada terapéutica antitrombótica en estos pacientes.
En definitiva, se debería considerar la radioterapia preoperatoria en el tratamiento del cáncer rectal en estadios T3-4. Para tumores operables sería preferible la pauta corta (25 Gy en una semana e intervenir al paciente a la semana de finalizar la radioterapia). En el caso de tumores fijos, los datos actuales apoyarían una pauta más larga (45 Gy en 5 semanas) seguido de un intento de resección quirúrgica41. En tumores rectales en estadios T1-2 podría ser razonable omitir la radioterapia siempre que se pueda conseguir una resección histológicamente curativa. En caso de que presenten márgenes afectados o estadio patológico T3-4 y/o N+ deberá considerarse la radioterapia postoperatoria1. En nuestro estudio, ningún hospital utilizó radioterapia preoperatoria de ciclo corto en el cáncer rectal operable, 2 centros usaron radioterapia preoperatoria de ciclo largo en tumores T3, T4 y ganglios positivos (N+), y 2 hospitales más en estadio T4 solo. Dos hospitales utilizaron radioquimioterapia preoperatoria en tumores T4 o N+ y otro la usó en tumores T3 y T4. Los demás centros utilizaron la radioquimioterapia clásica postoperatoria en estadios II de riesgo y esta dio III, así como en pacientes cuyas piezas quirúrgicas presentaban márgenes afectados tras resección realizada inicialmente con intención curativa.
Las evidencias actuales sugieren que, con el uso de técnicas quirúrgicas óptimas y la radioterapia preoperatoria para los tumores fijos o dudosos, puede conseguirse una recidiva local global inferior al 10% a los 5 años. Nuestras recidivas locales son del 11,58%, pero a los 2 años de seguimiento.
Enfermedad avanzada
La supervivencia a los 3 años de los pacientes con recidiva locorregional de cáncer colorrectal es de alrededor del 10%42. Aunque la radioterapia y la quimioterapia pueden ofrecer una paliación útil, también tienen efectos secundarios tóxicos, y no existen estudios aleatorios que demuestren una mejoría en la calidad de vida ni en la supervivencia43. Existen algunas pruebas de que la resección de la recidiva local puede mejorar la supervivencia44, pero esto no ha podido comprobarse en un ensayo aleatorizado.
La enfermedad primaria irresecable es más frecuente en el recto y se asocia con muy mal pronóstico. Aunque algunos autores recomiendan una resección paliativa6 siempre que sea posible, no está probado que ésta mejore la supervivencia29. La radioterapia es útil para aliviar el dolor pélvico, pero tiene complicaciones45. En el paciente con un cáncer rectal obstructivo irresecable, una colostomía disfuncionante puede proporcionar una paliación adecuada, pero no mejorará el tenesmo, la hemorragia o la expulsión de moco. La ablación transanal del tumor mediante láser, electrocoagulación o técnicas de resección puede proporcionar una mejor paliación y debería considerarse en estos casos41.
El hígado, seguido del pulmón, son las localizaciones más frecuentes del cáncer colorrectal metastásico. La mediana de supervivencia de estos pacientes es inferior a un año y el principal factor pronóstico es el estado general. En la mayoría de ocasiones, el tratamiento sistémico es la única opción terapéutica, aunque en un reducido número de casos puede ser factible la extirpación quirúrgica de las metástasis, indicada en todos los centros consultados y realizada en cinco de ellos, o la quimioterapia hepática intraarterial46, que sólo fue practicada por uno de los hospitales encuestados. Con una selección adecuada, la hepatectomía por cáncer colorrectal metastásico puede asociarse con una supervivencia a 5 años de alrededor del 33%47. La hipótesis de que esta conducta prolonga la vida no se ha probado en estudios aleatorizados, pero el seguimiento a largo plazo de estos pacientes ha demostrado que son raras las recidivas después de un intervalo libre de enfermedad de 3 años48. Es importante apuntar que los buenos resultados de este tipo de operaciones dependen de una baja mortalidad operatoria, por lo que sólo debería intentarse cuando ésta se puede conseguir.
En resumen, el principal objetivo del tratamiento de la enfermedad avanzada debería ser una paliación efectiva, con una calidad de vida lo más óptima posible, debiendo administrarse quimioterapia y/o radioterapia paliativas a los pacientes afectados de enfermedad localmente avanzada o metastásica que conserven un buen estado general, como ocurrió en los pacientes de nuestro trabajo, pues ya se han publicado estudios aleatorizados en los que se ha demostrado beneficio en la supervivencia49,50.
Mortalidad operatoria
La mortalidad para las operaciones por cáncer colorrectal varía según si la intervención es electiva o de urgencia, así como si es curativa o paliativa. Incluso, también existe una variación considerable entre los distintos cirujanos en el caso de resecciones curativas, con una mortalidad a los 30 días que oscila entre el 0 y el 20%29. El estudio Trent y Wales4 reveló una mortalidad operatoria del 19,9% para la cirugía de urgencia y del 5,1% para la cirugía electiva. Incluso los centros especializados publican cifras de alrededor del 4% para las resecciones electivas, aunque éstas puede llegar a descender en algunos casos hasta el 1,5%21. En resumen, debe tenderse a que la mortalidad operatoria por cáncer colorrectal sea menor del 20% en cirugía de urgencias y del 5% en cirugía electiva1, valores que cumplieron sobradamente los distintos centros participantes en nuestro estudio.
Seguimiento
Tras una intervención con intención curativa existen una serie de razones que aparentemente justificarían un seguimiento1: a) detección de enfermedad recurrente (locorregional o a distancia) en fase presintomática, de forma que sea posible una nueva actuación quirúrgica curativa; b) detección y tratamiento de tumores metacrónicos en fases iniciales; c) apoyo psicológico del paciente y tratamiento de los efectos colaterales derivados de la propia intervención quirúrgica y de los tratamientos adyuvantes aplicados, y d) comprobar la radicalidad del tratamiento quirúrgico y facilitar un control de los resultados.
La falta de uniformidad de criterios a la hora de establecer unas normas de vigilancia sobre los pacientes operados por cáncer colorrectal ha motivado la realización de múltiples trabajos encaminados a averiguar qué exploraciones permitirían una mayor rentabilidad diagnóstica. Parece ser que todos los cirujanos controlan a sus pacientes después de la operación, pero de manera muy variable. El estudio Trent y Walles4 reveló que la frecuencia de seguimiento variaba desde una sola visita hasta un seguimiento de por vida y que, además, las exploraciones complementarias realizadas diferían sustancialmente de unos cirujanos a otros, ya que sólo unos pocos empleaban una estrategia de vigilancia comparable. Estas diferencias se presentan de igual modo en otras escuelas quirúrgicas, ya que la Sociedad Americana de Cirujanos Colorrectales se hace eco de una controversia similar en este sentido51. Trece de los hospitales participantes en nuestro estudio tenían un protocolo de seguimiento uniforme por parte de todos los cirujanos. En definitiva, en ausencia de estudios aleatorizados, los argumentos más persuasivos para un seguimiento rutinario son el soporte psicológico al paciente y el control de los resultados1.
Anatomía patológica
Es de vital importancia contar con un informe anatomopatológico preciso y detallado para poder realizar una estimación pronóstica y planificar un posterior tratamiento.
Desgraciadamente, se ha demostrado una gran variabilidad en la calidad de los informes anatomopatológicos, lo que tiene unas implicaciones muy importantes a la hora de interpretar las diferencias en cuanto a resultados en las distintas áreas de salud. Por esta razon, este aspecto debe solucionarse con urgencia.
Es fundamental saber si un tumor se ha resecado por completo y lo avanzado que estaba en esos momentos, ya que ambos parámetros afectarán a un tratamiento posterior. Deberemos prestar especial atención a dos parámetros: a) afectación de los márgenes de escisión (incluidos los "donuts" en los procedimientos de sutura automática) y, para los cánceres rectales situados por debajo de la reflexión peritoneal, el plano de resección circunferencial (lateral, radial). Respecto a este último punto, los tumores situados a menos de 1 mm del margen de resección se considerarán incompletamente resecados52, y b) el número de ganglios linfáticos examinados, el número de ganglios que contengan metástasis y si el ganglio apical está afectado. También se recomienda que los "depósitos" tumorales extramurales que midan menos de 3 mm de diámetro sean considerados como nódulos linfáticos metastásicos, independientemente de si se acompañan de tejido linfático identificable53. En este sentido, se han publicado en la bibliografía técnicas que pretenden aumentar el número de ganglios aislados en el espécimen con el objeto de no infraestadificar los distintos tumores54. Lamentablemente, el número medio de ganglios aislados en nuestro estudio fue de nueve, menor de lo de seable.
Por último, respecto a la estadificación del tumor, únicamente en 5 hospitales del estudio se utilizaba la clasificación de Dukes, en otros cuatro coexistían esta clasificación con el TNM, y en 8 empleaban la clasificación TNM. Analizando la bibliografía, observamos que existe una tendencia a realizar la clasificación de acuerdo con esta última.
Conclusiones
Desglosando las conclusiones de nuestro estudio diremos que:
1. En el aspecto diagnóstico deberíamos tratar de mejorar el porcentaje de colonoscopias completas. Los enemas opacos deberían realizarse por sistema mediante la técnica de doble contraste y, por último, es aconsejable implantar la ecografía endorrectal como exploración de rutina para la correcta estadificación del cáncer rectal, con el fin de realizar una correcta selección de pacientes candidatos a terapéutica adyuvante preoperatoria.
2. De la revisión de la bibliografía se desprende que la radioterapia preoperatoria puede disminuir el número de recidivas locales en el cáncer de recto, con un papel discutido sobre la supervivencia. Se necesitan, pues, estudios prospectivos para valorar qué régimen terapéutico adyuvante preoperatorio es el más adecuado.
3. Dado que la cirugía del cáncer rectal depende del cirujano, creemos que debería realizarse por personal especialmente entrenado.
4. Respecto a la cirugía de urgencias, y con la finalidad de evitar intervenciones ulteriores, consideramos que, en la obstrucción intestinal y si las condiciones del paciente lo permiten, debería tratarse de aumentar el porcentaje de resecciones con anastomosis primaria entrenando al equipo quirúrgico en la realización del lavado intraoperatorio.
5. En el apartado de seguimiento postoperatorio, es recomendable que los hospitales dispongan de protocolos homogéneos con la finalidad de uniformizar el control de estos pacientes, además de prestarles un apoyo psicológico y servir de auditoría de sus resultados.
6. Para valorar de manera correcta si una resección ha sido realmente curativa, se recomienda que en los informes anatomopatológicos se especifique el margen circunferencial; así mismo se debe intensificar el aislamiento de ganglios linfáticos a fin de evitar una infraestadificación tumoral.