Introducción
En los últimos años se ha investigado con gran interés el valor pronóstico sobre la evolución postoperatoria de los factores biológicos en adenocarcinomas colorrectales. El objetivo es identificar a subgrupos de pacientes con riesgo diferente de recidiva y fallecimiento; además, también se cree que estos factores biológicos pueden ayudar a predecir la respuesta a la quimioterapia1 . Entre todos los potenciales marcadores predictivos, el gen p53 ha sido uno de los más ampliamente estudiados2,3 .Se detectan alteraciones de p53 hasta en el 60% de los adenocarcinomas de colon y recto4 . En condiciones normales, la proteína codificada por este gen, la proteína p53, es un factor de transcripción que desarrolla un papel muy importante en la regulación del ciclo celular y en la muerte celular programada o apoptosis. Cuando existe una mutación del gen se produce una proteína estructural-mente anormal, no funcionante, que se acumula en la célula y es fácilmente detectable por inmunohistoquímica.
Diversas publicaciones afirman que la determinación de la proteína p53 ofrece información sobre el pronóstico en pacientes con cáncer colorrectal5-8 . Parece que la acumulación intracelular de dicha proteína (sobreexpresión) se asocia con una evolución postoperatoria desfavorable. Sin embargo, también se han publicado estudios con resultados contrapuestos9-11 , por lo que, por desgracia, no hay acuerdo sobre la utilidad clínica de este marcador. Se ha insistido en la necesidad de desarrollar nuevas investigaciones y analizar la relación entre la proteína p53 y los factores predictivos clinicopatológicos reconocidos3 .
En el presente estudio hemos querido determinar el valor pronóstico de la proteína p53 como indicador de riesgo de recidiva en cada estadio tumoral. Hasta ahora, se ha admitido que p53 tiene un peso predictivo constante e igual en todos los estadios. No obstante, es fácil deducir que los resultados obtenidos en pacientes con tumores iniciales no necesariamente tienen el mismo significado que los obtenidos en pacientes con metástasis diseminadas. Además, habitualmente en los estudios se ha incluido a grupos heterogéneos de pacientes, con enfermos de todos los estadios tumorales, lo que es útil como trabajo inicial, pero para definir la utilidad clínica de un marcador es más apropiado trabajar con grupos tu-morales específicos y homogéneos. La inclusión de representantes de todos los estadios tumorales diluye el poder estadístico del estudio y puede ser un factor de confusión.
Material y método
Pacientes
Análisis de 407 pacientes consecutivos, reclutados de forma prospectiva y diagnosticados de adenocarcinoma de colon y recto entre enero de 1994 y diciembre de 2001 en nuestro hospital. A todos ellos se les realizó una resección quirúrgica del tumor. Posteriormente, se excluyó a 82 pacientes con adenocarcinoma de recto que recibieron radioquimioterapia adyuvante preoperatoria, 5 pacientes con poliposis familiar, 17 pacientes que fallecieron por complicaciones postoperatorias, 7 perdidos durante el seguimiento y 8 en los que no se pudo realizar correctamente el análisis inmunohistoquímico; por ello, el grupo final de estudio incluye a 288 pacientes. De acuerdo con los hallazgos quirúrgicos e histológicos, 42 pacientes (14,6%) se encontraban en estadio 1-2N0M0 (estadio I), 144 (50%) en estadio T3-4N0M0 (estadio II) y 102 (35,4%) T2-4M0 (estadio III) de la clasificación TNM (tabla 1).
En el momento de la intervención los datos de cada paciente fueron recogidos y almacenados en una base de datos computarizada (dBA-SE III plus). Los datos demográficos, las variables clínicas, el tratamiento, la anatomía patológica, la inmunohistoquímica y el seguimiento fueron recogidos de forma prospectiva y almacenados como parte de un estudio de factores pronósticos12 . El seguimiento postoperatorio se realizó de acuerdo con un programa descrito previamente.
El tiempo medio de seguimiento de toda la cohorte fue de 30 meses, con límites entre 4 y 90 meses. Durante este período se detectó recidiva tumoral en 87 pacientes, en 25 de ellos locorregional aislada y en 77 metástasis y/o recidiva local. La supervivencia libre de enfermedad en toda la serie fue del 88% a los 12 meses, el 74% a los 24 meses, el 68% a los 36 meses y el 60% a los 5 años.
Se administró quimioterapia adyuvante postoperatoria basada en 5-fluorouracilo por vía intravenosa y levamisol por vía oral. Recibieron este tratamiento 89 pacientes. Se administró quimioterapia adyuvante postoperatoria a 38 pacientes con tumores en estadio III (menores de 75 años, con buen estado general y sin enfermedad grave asociada) y a 51 pacientes con tumores en estadio II de alto riesgo (tumores obstructivos, con invasión de órganos vecinos o con perforación).
Se determinó la concentración preoperatoria de CEA en suero mediante enzimoinmunoanálisis con kits comerciales (ES-300; Boehringer Mannheim). El valor límite de normalidad fue 5 ng/ml.
Anatomía patológica
El estudio histopatológico se realizó en muestras representativas de los tumores extirpados, fijadas en formol tamponado y embebidas en parafina. Las preparaciones se tiñeron con hematoxilina y eosina. De cada tumor se analizaron, al menos, 5 preparaciones. Las variables analizadas fueron: tipo histológico, grado de diferenciación, penetración tumoral en la pared colorrectal, invasión de ganglios linfáticos, infiltración linfoplasmocitaria peritumoral, infiltración venosa intramural.
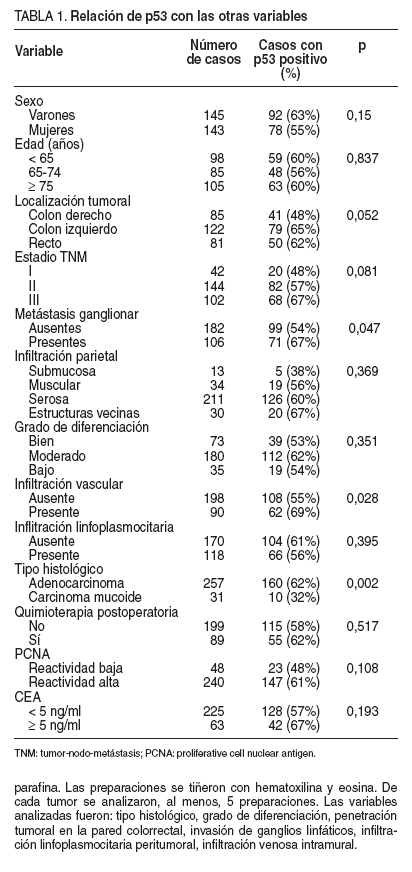
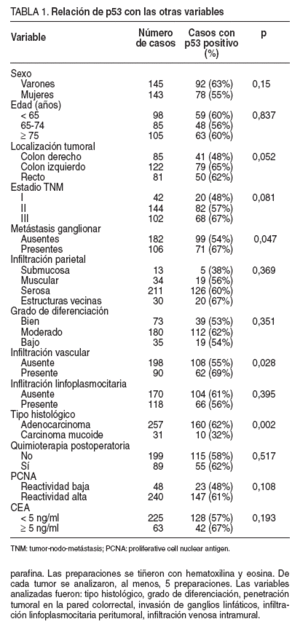
TABLA 1. Relación de p53 con las otras variables
Inmunohistoquímica
Se determinaron las proteínas p53 y PCNA (proliferative cell nuclear antigen) de forma prospectiva. Para la tinción de la proteína p53 se utilizó el anticuerpo monoclonal DO7 (Dakopatts, Golstrup, Dinamarca). La tinción se diluyó a 1:50 y se aplicó a temperatura ambiente durante 60 min. Posteriormente, se aplicó un horno microondas como sistema recuperador de antígeno. Para la tinción inmunohistoquímica se empleó un equipo comercial de avidina-biotina fosfatasa alcalina (UltraprobeTM ) (Biomeda, California, Estados Unidos). Se empleó un colorante FastRed TT (Sigma, Deisenhofen, Alemania) para detectar la actividad del anticuerpo. Se utilizaron preparaciones de cáncer de colon con reactividad conocida como controles positivos. Únicamente se consideraron positivas (sobreexpresión) las muestras con tinción de p53 en el núcleo de, al menos, el 10% de las células tumorales.
Para la determinación de PCNA se empleó la misma técnica, con los siguientes tiempos de incubación: 30 min a temperatura ambiente para el anticuerpo anti-PCNA (PC10) (dilución 1:20) (Dakopatts, Golstrup, Dinamarca) y 45 min para el complejo avidina-biotina. Las preparaciones se clasificaron en 2 grupos, según el número de núcleos de células tu-moral teñidos: índice de PCNA bajo (10-50%) y PCNA elevado (> 50%).
Análisis estadístico
El trabajo fue diseñado como estudio de cohortes. El objetivo principal fue la aparición de recidiva del tumor colorrectal. Además, se recogieron, separadamente, los datos de recidiva locorregional y metástasis. Se calculó la supervivencia libre de recidiva desde la fecha de la intervención hasta la detección de la recidiva o la última visita.
La asociación entre p53 y las otras variables se calculó mediante la prueba de la χ2 de Pearson. La curva de supervivencia libre de recidiva se calculó mediante el método de Kaplan-Meier, y para las comparaciones se empleó el test de rangos logarítmicos. El valor predictivo de cada variable sobre la aparición de recurrencia del tumor se analizó mediante análisis de regresión de Cox. Se calcularon las hazard ratio s, ajustadas y crudas, y los intervalos de confianza (IC) del 95% de cada variable, como indicadores del riesgo relativo. El análisis se aplicó en toda la cohorte de pacientes y, posteriormente, fue repetido en cada estadio tumoral TNM por separado.
Resultados
Se detectó sobreexpresión de la proteína p53 en el núcleo de las células tumorales en 170 pacientes (59%). La frecuencia entre los casos que pertenecían al estadio TNM tumoral I (20 pacientes, el 48%) fue menor que entre los casos en estadio II (82 pacientes, el 57%) y que entre aquellos en estadio III (68 pacientes, el 67%), pero las diferencias no alcanzaron significación estadística (p = 0,081). La sobreexpresión de p53 fue significativamente más frecuente en los tumores localizados en el colon izquierdo-recto, en los casos con presencia de metástasis linfáticas, en los tumores que presentaban infiltración vascular y en las neoplasias de tipo histológico no mucinoso (tabla 1).
Estadio I
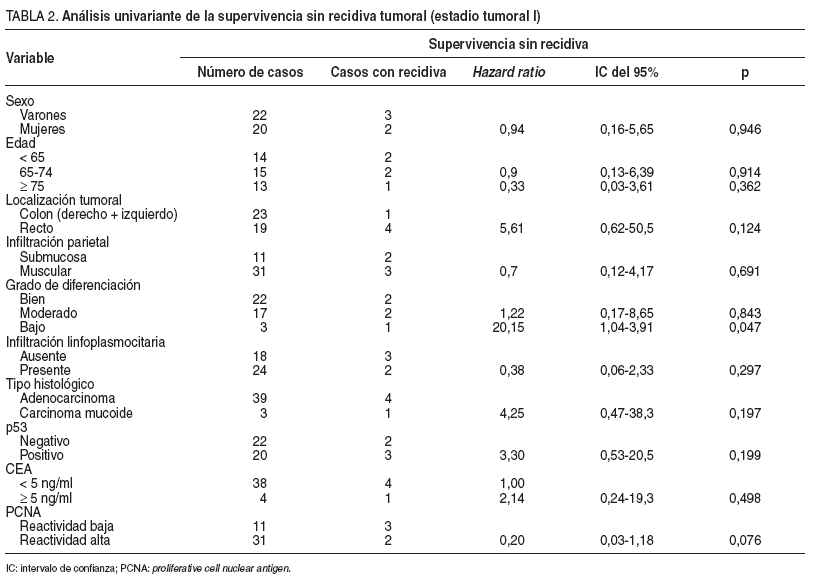
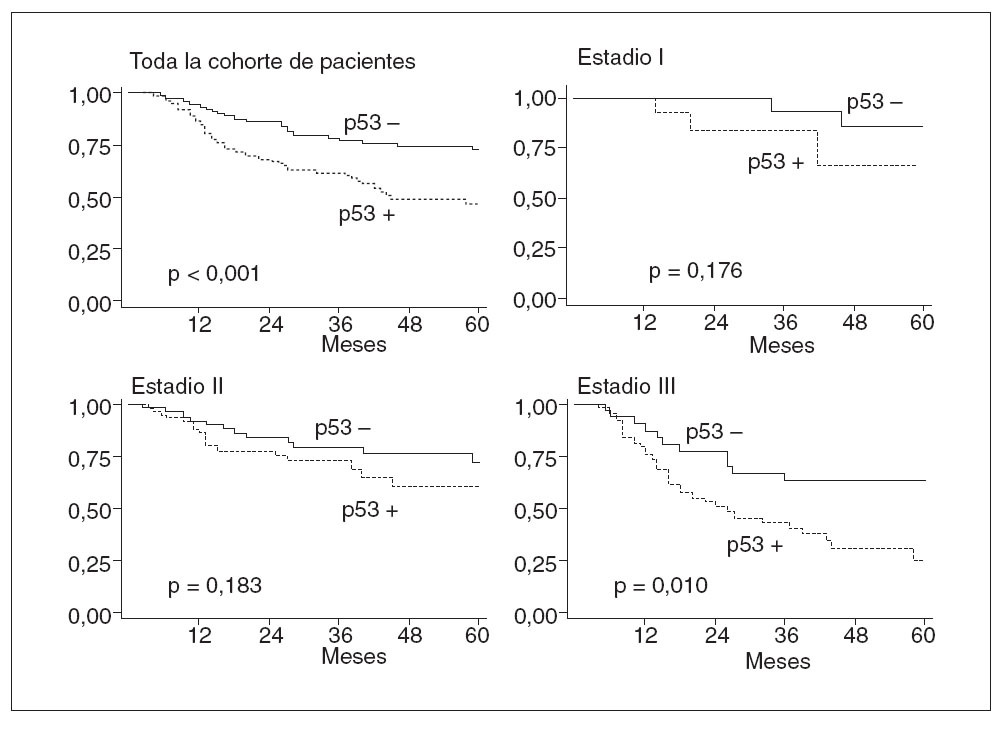
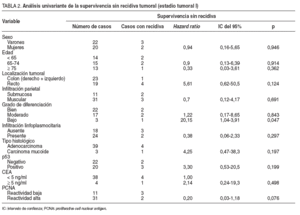
En 5 pacientes se detectó recidiva del tumor: 2 casos con tumores p53 negativos (9%), y 3 con p53 positivos (15%). La supervivencia sin recidiva a los 60 meses de seguimiento fue del 90% en los tumores con p53 negativo y del 70% en aquellos con p53 positivo (p = 0,18) (fig. 1). Ninguno de los factores pronósticos estudiados se asoció de forma significativa, en el análisis univariante, con una mayor frecuencia de recidiva tumoral, posiblemente debido al escaso número de recidivas observadas; por ello, en este grupo no se desarrolló un modelo multivariante para el análisis de factores de riesgo (tabla 2).
Estadio II
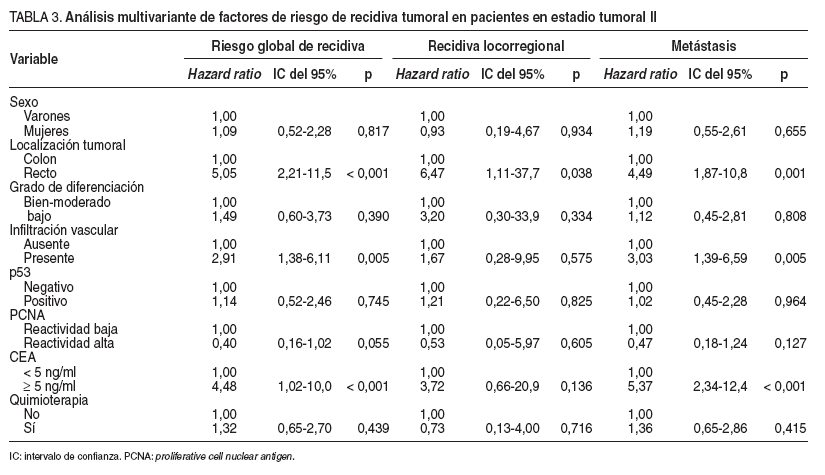
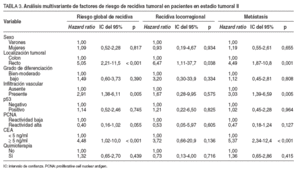
En 34 pacientes se detectó recidiva del tumor: 13 casos con tumores p53 negativos (20,9%) y 21 con p53 positivos (25,6%). La supervivencia sin recidiva a los 60 meses de seguimiento fue del 73% en los tumores con p53 negativo y del 60% en aquellos con p53 positivo (tabla 4). Posteriormente, se repitió el análisis separando a los pacientes según el tipo de recidiva. En este caso la presencia de infiltración vascular ( hazard ratio = 2,91; IC del 95%, 1,38-6,11) y CEA sérico elevado ( hazard ratio = 4,48; IC del 95%, 1,02-10). La presencia de inmunorreactividad de PCNA elevada se asoció con mayor supervivencia libre de recidiva y casi alcanzó el nivel de significación estadística como factor pronóstico protector ( hazard ratio = 0,40; IC del 95%, 0,16-1,02).
Fig. 1. Supervivencia libre de enfermedad en el conjunto de la serie y en cada uno de los estadios tumorales, según el estado de la tinción de p53.
TABLA 2. Análisis univariante de la supervivencia sin recidiva tumoral (estadio tumoral I)
TABLA 3. Análisis multivariante de factores de riesgo de recidiva tumoral en pacientes en estadio tumoral II
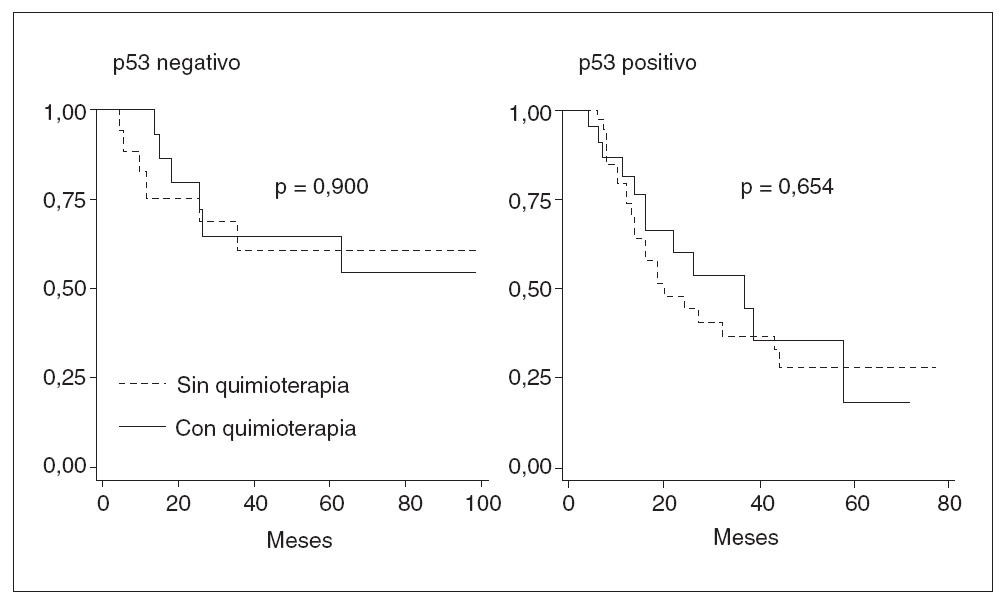
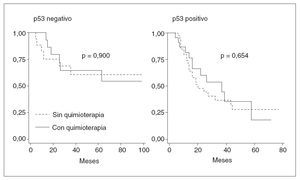
Fig. 2. Supervivencia libre de en fermedad en pacientes en estadio III, según el estado de la tinción de p53 y el tratamiento de quimioterapia operatoria. adyuvante post-operatoria.
Estadio III
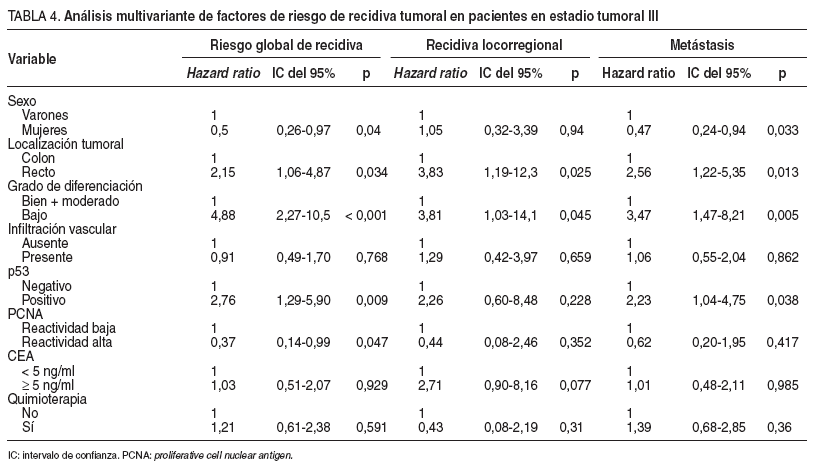
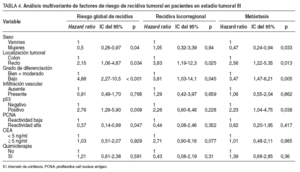
Se detectó recidiva del tumor en 48 pacientes: 12 casos eran tumores p53 negativos (35,3%), y 36, p53 positivos (52,9%). La supervivencia sin recidiva a los 60 meses de seguimiento fue del 60% en los tumores con p53 negativo y del 26% en aquellos con p53 positivo (p = 0,010) (fig. 1). En el análisis multivariante, p53 se mostró como un factor pronóstico independiente asociado a un riesgo elevado de recidiva. Según este análisis, pacientes con tumores p53 positivos presentaron un riesgo de recidivar 2,76 veces superior que aquellos con tumores p53 negativos (IC del 95%, 1,29-5,9) (p = 0,009) (tabla 4). El bajo grado de diferenciación también se comportó como un factor pronóstico asociado con un riesgo elevado de recidiva. Ser mujer y presentar un PCNA elevado se comportaron como factores pronósticos protectores (tabla 4). Posteriormente, se repitió el análisis separando a los pacientes según el tipo de recidiva. En este caso la presencia de inmunorreactividad de p53 demostró poseer un valor pronóstico como indicador de riesgo elevado de recidiva en forma de metástasis durante el seguimiento postoperatorio ( hazard ratio = 2,23; IC del 95%, 1,04-4,75); no alcanzó significación estadística el valor como factor pronóstico de recidiva locorregional (tabla 4).
TABLA 4. Análisis multivariante de factores de riesgo de recidiva tumoral en pacientes en estadio tumoral III
Se analizó el efecto combinado de p53 y quimioterapia postoperatoria adyuvante en pacientes en estadio III. En pacientes con tumores p53 positivos, la supervivencia sin recidiva tumoral fue del 23% entre los tratados con quimioterapia y del 28% entre los no tratados (p = 0,654). En pacientes con tumores p53 negativos, la supervivencia sin recidiva tumoral fue del 54% entre los tratados con quimioterapia y del 60% entre los no tratados (p = 0,90) (fig. 2). El tratamiento con quimioterapia, tanto en el grupo con tumores p53 negativos como en el de tumores p53 positivos, no modificó significativamente el riesgo de recidiva tumoral.
Discusión
Los resultados de nuestro estudio confirman que la re-actividad inmunohistoquímica de la proteína p53 en adenocarcinomas colorrectales, sometidos a resección quirúrgica, guarda relación con la evolución postoperatoria. Los tumores que tienen sobreexpresión de dicha proteína desarrollan con mayor frecuencia recidiva y tienen menor supervivencia sin recurrencia a los 5 años de seguimiento. Observamos que todos los grupos de tumores (estadios I, II y III) tienden a seguir ese comportamiento. La aportación de nuestro estudio ha sido comprobar que la asociación entre la expresión de p53 y la evolución postoperatoria únicamente posee significación estadística en los tumores en estadio tumoral III. Con los datos obtenidos se puede decir que el valor predictivo de p53 no es constante, sino que varía en función del estadio tumoral, de forma que solamente posee valor como factor pronóstico indicativo de riesgo elevado de desarrollar recidiva postoperatoria en tumores en estadio III.
Según el modelo multivariante desarrollado, en el grupo de pacientes con tumores en estadio III, el riesgo de recidiva fue 2,76 veces más elevado cuando se detectó sobreexpresión de p53. Además, al analizar el valor pronóstico de p53 en relación con la localización de la recidiva, comprobamos que p53 posee valor pronóstico como indicador de riesgo de recidiva en forma de metástasis, pero no alcanza significación estadística como factor pronóstico de recidiva locorregional. Parece que los tumores que poseen sobre expresión de la proteína p53 tienen una elevada capacidad de desarrollar metástasis a distancia.
Se conoce bien la frecuencia de sobreexpresión de la proteína p53 en el cáncer colorrectal, así como la frecuencia en cada estadio tumoral13,14 . También, en un elevado número publicaciones se ha analizado la relación entre sobreexpresión de la proteína y la evolución postoperatoria (supervivencia/recidiva). En un menor número de estudios se ha analizado el valor pronóstico de la sobreexpresión de p53 como indicador de riesgo de recidi-va/fallecimiento, teniendo en cuenta la influencia de los factores pronósticos coincidentes y siguiendo un método estadístico multivariante15,16 . Habitualmente se ha incluido a grupos heterogéneos de pacientes, con enfermos de todos los estadios tumorales17 . Según nuestros datos, en pocos estudios se ha detallado el valor pronóstico que proporciona la determinación de p53 en cada estadio tu-moral. Sí se conocen, en cambio, trabajos desarrollados sobre series monográficas de pacientes en estadio II o 5,6,8,10,16-18 . Los resultados de estas últimas publicaciones ya apuntan la existencia de diferencias entre estadios. Los datos de nuestro estudio confirman y amplían esa información.
Creemos que el hecho de que la asociación entre la expresión de p53 y la evolución postoperatoria posea significación estadística únicamente en el estadio tumoral III está en relación con las diferencias biológicas existentes entre los tumores en estadio II y III. Estos últimos poseen un mayor número de aberraciones genéticas y en ellos se detectan con mayor frecuencia alteraciones en los genes relacionados con el desarrollo tumoral y la formación de metástasis (oncogenes, genes reparadores, genes supresores, factores de crecimiento, moléculas de adhesión celular, factores de angiogénesis, metástasis, enzimas de la matriz extracelular)1,19 . Los tumores en estadio III ya han adquirido alteraciones genéticas que les permiten invadir estructuras vecinas y metastatizar en ganglios linfáticos. En estos tumores la sobreexpresión de p53 es un marcador indicativo de elevada capacidad desarrollar metástasis hematógenas, de forma que esta sobreexpresión se comporta como un marcador del deterioro genético.
Parece existir acuerdo en que la presencia de mutaciones en el gen p53 se asocia a un curso evolutivo postoperatorio negativo20-22 . Dadas las dificultades, logísticas y técnicas, que entraña el estudio del gen (extracción de ADN, secuenciación del ADN, reacción en cadena de la polimerasa [PCR]), muchos investigadores han optado por determinar, mediante inmunohistoquímica, la proteína p53, asumiendo que la acumulación de dicha proteína (sobreexpresión) tiene el mismo significado que la mutación del gen. Sin embargo, no existe una opinión clara sobre el valor de la detección inmunohistoquímica de la proteína p533,4 . Se sabe que mutación y sobreexpresión inmunohistoquímica concuerdan en el 60% de los casos. También puede existir sobreexpresión causada por otros factores, como infecciones virales, alteración de proteínas relacionadas con la regulación de p53 (proteína mdm-2) o exposición a tóxicos genéticos2-4 . La mutación del gen p53 y la acumulación de la proteína pueden representar fenómenos intracelulares diferentes. Creemos que los datos aportados en nuestro estudio pueden contribuir a definir el papel de la determinación de proteína p53. Desde un punto de vista práctico, la controversia tiene poco sentido, ya que la sobreexpresión de ésta refleja el grado de agresividad tumoral y se asocia a un patrón clínico desfavorable, con independencia de la alteración biológica que represente5-8,19,23 .
Además de p53, analizamos otros factores pronósticos coincidentes, entre los que destacan los resultados obtenidos por la localización tumoral y la inmunorreactividad de la proteína PCNA. Ambos factores demostraron tener un peso estadístico significativo como marcadores predictivos independientes en el análisis multivariante. Se trata de factores que aportan información sobre el pronóstico tanto en tumores en estadio II como en tumores en estadio III.
La localización del tumor es un factor pronóstico ampliamente reconocido. Se sabe que la frecuencia de recidiva es superior en los tumores de recto que en los tumores de colon. En nuestro estudio el peso estadístico de este factor fue superior en los tumores en estadio II que en aquellos en estadio III. Creemos que este hallazgo no es clínicamente significativo: hay que tener en cuenta que en el estudio no se han incluido los tumores de recto sometidos a radioterapia preoperatoria, supuestamente son los casos que poseen mayor riesgo de recidiva.
La proteína PCNA es una proteína accesoria de la ADN polimerasa. Esta proteína es sintetizada por las células durante la fase de actividad de replicación del ADN. Se detecta únicamente en las células que se encuentran en las fases G1 y S del ciclo de división celular. La detección inmunohistoquímica del PCNA es un método simple y útil para cuantificar la proporción de células tumorales que se encuentran en fase de división y para cuantificar el grado de proliferación celular de un tumor24,25 . Decidimos incluir el PCNA en este estudio como un factor pronóstico complementario para ayudar a caracterizar el comportamiento de cada tumor y para ayudar a delimitar el valor predictivo de p53. En principio, parece lógico pensar que cuanto mayor sea el grado de actividad proliferativa, mayor será la agresividad clínica de un tumor. No hay acuerdo unánime sobre el valor de este marcador en los carcinomas colorrectales. Aunque se ha publicado que los tumores con elevada reactividad PCNA muestran un comportamiento más agresivo, también hay observaciones contradictorias24-27 . Según nuestros datos la presencia de inmunorreactividad del PCNA elevada se asoció con mayor supervivencia libre de recidiva y se comportó como factor pronóstico protector. Los tumores con reactividad elevada del PCNA presentaron menor riesgo de recidiva, tanto en estadio II (hazard ratio = 0,40; IC del 95%, 0,16-1,02) como en estadio III (hazard r atio = 0,37; IC del 95%, 0,14-0,99). No sabemos cuál es la razón de estos hallazgos; podría ser que los tumores con bajo índice de PCNA y, por tanto, con bajo índice de proliferación, respondieran en menor medida a los tratamientos adyuvantes postoperatorios con quimioterapia o radioterapia26 . Con los datos disponibles no podemos justificar esta hipótesis, y parece interesante estudiar en el futuro esta posibilidad.
En estudios preclínicos se ha observado que la actuación de los agentes que se utilizan habitualmente en el tratamiento del cáncer (fármacos quimioterápicos, radiaciones ionizantes) se basa en la inducción de apoptosis y muerte celular mediada por la activación de la proteína p53 normal28,29 . Por ello, es de gran interés explorar la relación entre la mutación de p53 y respuesta a la quimioterapia adyuvante postoperatoria2,4 . En varios estudios se afirma que dicha respuesta es menor en pacientes con tumores portadores de mutación en el gen p53 5,6,16,26 , aunque este hallazgo no ha sido plenamente confirma-9,10,31,32 . Hipotéticamente, se podría identificar a los pacientes con tumores quimiosensibles y la quimioterapia se podría seleccionar en función de las características genéticas del tumor. Las indicaciones actuales de terapia adyuvante están basadas en criterios histopatológicos (pacientes con adenopatías metastásicas y pacientes en estadios II con factores de riesgo). En nuestro estudio no observamos que el estado de la proteína p53 desarrolle alguna influencia sobre el efecto de la quimioterapia adyuvante postoperatoria. La sobreexpresión inmunohistoquímica de p53 no fue un factor útil para predecir la respuesta a la quimioterapia adyuvante en pacientes en estadio III. Nuestro trabajo no había sido diseñado para este objetivo, por lo que los resultados no permiten obtener conclusiones. Además, el tratamiento no fue administrado aleatoriamente y el número de pacientes tratados con quimioterapia era reducido. A pesar de estas limitaciones, creemos que nuestros resultados pueden ser orientativos. Por el momento, no se dispone de evidencia clínica suficiente para poder atribuir al estado del gen p53 un valor orientador para conocer la quimiosensibilidad del tumor.
Con los datos disponibles podemos concluir que la proteína p53 no posee el mismo valor como factor pronóstico en todos los estadios tumorales. Esta proteína únicamente posee valor predictivo indicativo de riesgo elevado de recidiva en el grupo de pacientes con tumores en estadio III.
Correspondencia: Dr. M. Díez . Cirugía General. Hospital Príncipe de Asturias. Alcalá de Henares. 28805 Madrid. España. Correo electrónico: mdiez.hupa@salud.madrid.org
Manuscrito recibido el 1-7-2004 y aceptado el 8-10-2004.