Introducción
La aterosclerosis humana es un proceso multifactorial en el que están implicados factores genéticos y ambientales1, y cuyo desarrollo acontece progresivamente en lugares específicos del entramado vascular. La búsqueda de los diversos factores implicados y el prolongado período de desarrollo requieren el auxilio de modelos animales que simulen, con mayor o menor éxito, el proceso humano y que ayuden a entenderlo. Hace ahora casi un siglo que científicos rusos2 pusieron en marcha este enfoque experimental al inducir aterosclerosis en conejos. En el largo camino de experimentación recorrido, se han utilizado diferentes modelos animales y ha quedado bien establecida la conexión del metabolismo lipídico y la aterogénesis así como parte de sus mecanismos moleculares implicados; ello ha sido útil también para la especie humana. En muchos casos, el camino se ha realizado en sentido contrario; ante procesos de escasa incidencia en humanos, se precisaba encontrar un modelo animal para verificar una hipótesis o la eficacia de un tratamiento (sirva como ilustración el caso de la hipercolesterolemia familiar y el hallazgo del conejo Watanabe). La elaboración intelectual de la patogenia de la arteriosclerosis se ha ido perfilando a lo largo de este siglo y cada modelo ha aportado algunas de las claves necesarias para entender el fascinante, complejo y dinámico cuadro de la aterosclerosis, que amenaza con tener tintes propios en cada localización donde se presente3.
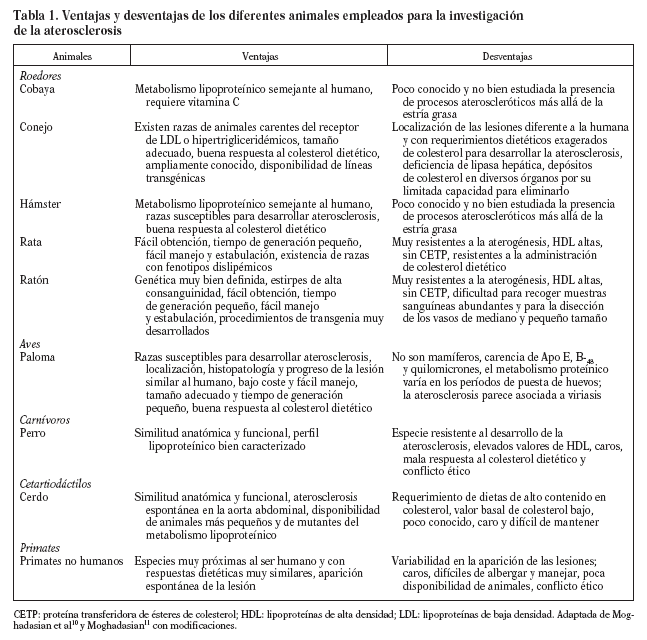
El empleo de modelos animales para el estudio de la arteriosclerosis posee, como cualquier faceta de la actividad humana, ventajas e inconvenientes. Ningún modelo reproduce exactamente la situación humana, si es que existe una única situación humana de arteriosclerosis. Cada día se hace más patente que la enfermedad no es igual en los varones que en las mujeres y que, a su vez, hay cientos de variaciones polimórficas que afectan a los genes más directamente implicados en el desarrollo de la arteriosclerosis cuyas consecuencias anatomopatológicas no conocemos. Hechas estas consideraciones, que nos sitúan en un plano de humildad científica con respecto al conocimiento de la arteriosclerosis humana, se ha de reconocer que el punto cumbre de la arteriosclerosis, es decir, la rotura de la placa y la formación del trombo, lo presentan muy pocos modelos animales, e incluso los que lo sufren, se encuentran filogenéticamente alejados de la especie humana. Este panorama no es razón suficiente para abandonar un enfoque tan repetidamente probado como parecen sugerir los autores de una reciente revisión4 al preguntarse: "Can animal models be regarded as a help?The answer is a qualified maybe". Nuestra postura se basa en que cada modelo proporciona una información valiosa y que se requieren varios para concluir que esos resultados tengan relevancia para la especie humana. Si los resultados se confirman en distintos modelos que están separados filogenéticamente, la extrapolación será tanto más válida (tabla 1). Este criterio ha sido ampliamente usado a la hora de iniciar las fases clínicas de nuevos fármacos y, a juzgar por nuestro arsenal terapéutico, no parece que haya funcionado mal.
En términos generales, la experimentación animal posee una serie de ventajas: en primer lugar, es posible elegir las especies y las subespecies más adecuadas para la experimentación, utilizando un número de animales suficientemente grande como para efectuar un análisis estadístico y completar los estudios en un corto período. Una segunda razón es la posibilidad de controlar las variables experimentales y valorar cada una de ellas de forma independiente del resto de los factores, seleccionando animales sanos o con anormalidades genéticas de características bien contrastadas en los que se pueden combinar factores de riesgo y enfermedades concurrentes. Por otro lado, el uso de animales es la única vía para desarrollar nuevos métodos de diagnóstico y tratamiento, tanto preventivos como reparadores, antes de aplicarlos a la especie humana5. Por último, esta utilización de modelos animales permite trabajar en las condiciones ideales en cuanto a la posibilidad de elección de especie, tiempo y método de estudio, y facilita igualmente analizar el efecto de diferentes planteamientos experimentales en el animal, tanto vivo como muerto, así como la obtención de todo tipo de muestras6-8.
En la selección de animales para el estudio de la aterosclerosis, hay que tener en cuenta varios criterios, propuestos por Vesselinovitch9, cuya validez sigue vigente, aunque adaptada a los nuevos factores de riesgo10,11. Estos criterios son:
1. Disponibilidad y coste de adquisición de los animales.
2. Facilidad de mantenimiento y manipulación.
3. Existencia de razas genéticamente puras.
4. Anatomía, fisiología y bioquímica similares a las de la especie humana.
5. Aparición de la enfermedad de forma espontánea o inducida por diversos agentes.
6. Desarrollo de lesiones con relativa facilidad.
Manipulación nutricional que favorezca el desarrollo de placas avanzadas.
Tiempo relativamente corto de desarrollo de lesiones graves.
7. Tamaño adecuado de las lesiones para facilitar la recogida y el análisis de las muestras.
8. Desarrollo del proceso similar al de la arteriosclerosis humana:
Lipoproteínas séricas y metabolismo de lípidos.
Patogenia de la lesión dependiente de hipercolesterolemia, hipertensión, hiperhomocisteinemia, inflamación, estrés oxidativo, etc.
Topografía de la aparición de la lesión.
Similitud de los componentes de la lesión.
Desarrollo de complicaciones clínicas tales como calcificación, isquemia, infarto de miocardio, trombosis y gangrena, aneurismas, etc.
El propósito de esta revisión es resumir los conocimientos que existen sobre características del metabolismo lipoproteico y el desarrollo de la arteriosclerosis en algunos modelos animales presentes en la naturaleza.
Roedores
Cobaya
Cavia porcellus, además de requerir el aporte de vitamina C, presenta importantes rasgos del metabolismo lipoproteico que lo asemejan al de los humanos. Así, la mayoría de su colesterol plasmático se transporta en las lipoproteínas de baja densidad (LDL), ya que posee la proteína transferidora de ésteres de colesterol (CETP); no sintetiza apolipoproteína (Apo) B-48 en el hígado, debido a una disminuida capacidad para editar el ARNm de la Apo B; la biosíntesis y el catabolismo hepáticos del colesterol son moderados, y las hembras presentan valores más elevados de colesterol ligado a lipoproteínas de alta densidad (cHDL) que los machos. En respuesta a la ovariectomía, las hembras manifiestan un perfil lipoproteico similar al de las mujeres menopáusicas y su respuesta a otro tipo de intervenciones es similar a la encontrada en sujetos de la especie humana. Con la administración de dietas hipercolesterolemiantes durante 3 meses, los cobayas desarrollan lesiones aórticas que disminuyen con la administración de ácido ascórbico. Las lesiones se caracterizan por la presencia de estría grasa y resultan más acusadas en los machos que en las hembras. Una detallada descripción de este modelo se encuentra en la revisión publicada por Fernández12.
Conejo
Desde que Anitschkow13 hace 90 años demostrase la acumulación de colesterol en la aorta del conejo, esta especie ha sido ampliamente usada para el estudio de la arteriosclerosis, por el rápido desarrollo de las lesiones aórticas y el relativo bajo coste de su mantenimiento. Una excelente revisión del potencial de este modelo se puede encontrar en el trabajo de Brousseau y Hoeg14.
El conejo posee rasgos del metabolismo lipoproteico compartidos con el hombre. Así, el hígado no produce Apo B-4815, las lipoproteínas que contienen Apo B son similares en su composición a las humanas y posee la CETP16. En cambio, se diferencia en la ausencia de la Apo A-II y en la baja actividad de la lipasa hepática17.
La mayoría de los estudios publicados analizan los efectos del colesterol en las dietas y, resumiendo, su aporte en éstas varía entre un 0,5 y un 4% del peso, con un período de administración de entre 8 y 16 semanas. Con estos protocolos experimentales se observa un elevado valor de colesterol plasmático (> 1.000 mg/dl) transportado en LDL y, principalmente, en ß-lipoproteínas de muy baja densidad (VLDL) (70 al 80% del total del colesterol), lipoproteínas secretadas por un hígado incapaz de eliminar el exceso de colesterol ingerido18-22. La elevada hipercolesterolemia se traduce en presencia de lesiones aórticas en el estadio de estría grasa. Así, con aportes de colesterol superiores al 1% del peso de la ingesta, se inducen fundamentalmente lesiones con abundantes células espumosas23-25 y en este fenómeno parece influir la edad del conejo utilizado, más pronunciado en individuos jóvenes26. En cambio, con aportes de colesterol comprendidos entre el 0,125 y el 0,5% durante 6 u 8 meses se observa una progresión de la estría grasa a la lesión ateromatosa, tal como se evidencia por la presencia de mayor número de células musculares lisas, depósitos de colesterol y áreas necróticas en la aorta y los vasos epicárdicos27-33, un fenómeno que no ocurre en los vasos intramiocárdicos34. Estos datos indican que en este modelo animal, la duración del ensayo y el aporte dietético de colesterol pueden modular el desarrollo de los estadios de la arteriosclerosis hacia un patrón más similar al humano en las lesiones aórticas, pero no en los vasos intramiocárdicos.
También la localización de las lesiones parece influida por el aporte de colesterol. Un aporte inferior al 0,15% induce su aparición en la aorta torácica superior, en tanto que aportes superiores a esta cifra producen una presencia generalizada de placas a lo largo de la íntima aórtica35,36.
Existen razas de conejos, como la Watanabe (WHHL) y la St. Thomas'Hospital, que presentan alteraciones del metabolismo lipoproteico y que hacen más interesante este animal. La primera de ellas presenta un fenotipo de hipercolesterolemia familiar, ya que presenta un defecto en el gen del receptor LDL, y los animales homocigotos alcanzan cifras de colesterolemia de 400 a 800 mg/dl37, mientras que la segunda manifiesta un fenotipo de hiperlipemia combinada familiar38.
Entre los conejos Watanabe se han seleccionado, a su vez, estirpes con mayores valores de colesterol ligado a LDL (cLDL) y con desarrollo de placas ateromatosas en las coronarias39. Con una estrategia de cruces selectivos, se ha obtenido incluso una variante de los anteriores que presenta infarto de miocardio40. En estos animales, una estenosis de las coronarias por depósitos en el espacio subendotelial induce la aparición del infarto miocárdico por mecanismos independientes de la cantidad de colesterol, puesto que sus valores no son diferentes de los hallados en los Watanabe originales. Los infartos reproducen el patrón de presentación subendocárdico observado en los humanos, ya que varias arterias están afectadas. Para explicar el fenómeno, los autores describen un patrón de placa ateromatosa inestable con la presencia de una delgada capa fibrosa y acumulación de macrófagos en su superficie que podrían potenciar su rotura. Este modelo permite el estudio de infarto de miocardio a pesar de que no se ha observado la rotura de placas ni la trombosis intravascular que caracterizan el síndrome coronario humano.
Hámster
El hámster sirio dorado (Mesocricetus auratus) presenta rasgos comunes con los humanos, en cuanto a su metabolismo lipoproteico: el hígado únicamente produce Apo B-10041, la mayor parte del colesterol plasmático se transporta en LDL,
las hembras presentan valores más elevados de cHDL42 y posee una capacidad hepática de metabolización del colesterol similar43. Con la ingesta de una dieta enriquecida con grasa poliinsaturada se reduce su colesterol plasmático en HDL y se induce la expresión del receptor SR-BI44-46. A pesar de estas similitudes, es un animal con una baja actividad de la CETP, aproximadamente un 15% de la presente en humanos47.
La administración de una dieta suplementada con grasa saturada y colesterol durante 4 semanas induce hipercolesterolemia y aterosclerosis, con presencia de estrías grasas en la aorta torácica, y se observa una menor susceptibilidad en las hembras que en los machos. El proceso se acentúa cuando se induce una diabetes experimental junto con la administración de la dieta grasa48-50. En este modelo se ha demostrado la regresión parcial de lesión en el estadio de estría grasa mediante el tratamiento con lovastatina o suministrando dietas de bajo contenido en colesterol y grasa51. Existen igualmente estirpes diferentes de este animal que no responden de la misma forma a la administración de dietas ricas en grasa y colesterol. Así, tras 12 semanas con esta alimentación, la variedad CR presentó valores más bajos de colesterol total en plasma, pero más depósito en la aorta que la estirpe F1B52. Todos estos hallazgos experimentales están revalidando este modelo y actualmente se utiliza ampliamente para verificar la influencia de diversos agentes con potencial aplicación humana o para establecer los mecanismos de acción de otros agentes ya conocidos53,54.
Rata
Las ratas son animales comunes de laboratorio que han servido como modelo en un gran número de estudios sobre lipoproteínas y arteriosclerosis. La rata tiene varias ventajas como animal de experimentación, que van desde la economía en su mantenimiento hasta una buena supervivencia tras complicados procesos quirúrgicos. Además, por su tamaño, requiere pequeñas cantidades tanto de alimento como de los agentes que se ensayan. Los estudios realizados en esta especie incluyen investigaciones sobre la cinética de las lipoproteínas (Lp) plasmáticas, la síntesis de colesterol, y las interacciones de las Lp y los tromboxanos o los péptidos endoteliales sobre el tono vascular.
La rata tiene, no obstante, algunas características distintas a los humanos que limitan su uso para ciertos estudios de la aterosclerosis y metabolismo lipoproteico. Está clasificada como un mamífero HDL, porque, a diferencia del hombre, en su plasma predominan estas lipoproteínas55. Además, la CETP, que desempeña un papel importante en los perfiles lipoproteicos humanos, está ausente en la rata. También, carece de Apo (a) y, por tanto, de Lp(a) y de Apo D. Otra característica de este animal es que la metabolización del colesterol a ácidos biliares se ve incrementada por el aumento del consumo de colesterol en la dieta, mientras que en otras especies experimentales y en humanos este incremento compensatorio de la eliminación del colesterol no se produce. Precisamente, se considera que este proceso es el principal responsable de su resistencia para experimentar hipercolesterolemia, lo que indica que entre la rata y el hombre hay diferencias sustanciales en el metabolismo lipoproteico y en la regulación de las lipoproteínas plasmáticas56.
La rata es muy resistente al desarrollo de aterosclerosis y, al igual que el ratón y el perro, presenta lesiones vasculares en la íntima y en la media sólo tras el consumo de una dieta rica en colesterol junto con la administración de tiouracilo y ácido cólico57.
Entre las distintas razas de ratas existentes, la RICO manifiesta un fenotipo hipercolesterolémico, debido a un aumento de la síntesis de VLDL y quilomicrones, además de un descenso de su catabolismo58. Por su parte, la rata obesa Zucker presenta una mutación del receptor de leptina que expresa un fenotipo de dislipemia y de resistencia a la insulina, por lo que es un modelo animal del síndrome metabólico59. Ambos modelos se han empleado para la inducción de hipercolesterolemia y el ensayo de agentes hipolipemiantes58,60. Otras razas, como DOCA ySHR90-92, son modelos de hipertensión e igualmente se han utilizado para verificar la influencia de diversos agentes de ensayo61.
Ratón
El ratón es un animal ampliamente utilizado en investigación, ya que se reproduce con facilidad, tiene un tiempo de generación corto y se dispone de razas puras, muchas de las cuales poseen interesantes fenotipos heredables. Además, ocupa poco espacio y tiene un bajo coste de mantenimiento. Sin embargo, el ratón es un animal altamente resistente a la aterosclerosis62.
En su metabolismo lipoproteico se asemeja a la rata, ya que produce Apo B-48 en el hígado, al editar el ARNm de la Apo B15; además, carece de proteína transferidora de ésteres de colesterol63, de Apo (a) y por tanto de Lp(a) y de Apo D, y es un animal HDL55. Los estudios iniciales sobre las contribuciones genéticas a la enfermedad aterosclerótica se realizaron con ratones C57BL/6J, ya que sólo esta raza desarrolló procesos aterogénicos inducidos por una dieta enriquecida en grasa saturada y colesterol junto con ácido cólico64,65. Con esta dieta, los ratones mostraban unos valores de colesterol 4 o 5 veces mayores que los presentes en los alimentados con una dieta estándar baja en lípidos, y la mayoría de este incremento se hallaba en las fracciones que no correspondían a las HDL. Por desgracia, este modelo no permite una representación exacta de la enfermedad humana, ya que es necesaria una dieta fuertemente enriquecida en
colesterol en comparación con la humana y con un constituyente hepatotóxico, el ácido cólico. Esta valoración inicial de este modelo ha cambiado
radicalmente por la posibilidad de llevar a cabo manipulaciones genéticas mediante tecnología transgénica y selección de genes. Dos excelentes revisiones en castellano de los modelos surgidos mediante este avance tecnológico se han publicado en esta Revista66,67.
Aves
Paloma
Con su dieta cotidiana, este animal presenta un valor de colesterol plasmático elevado (300 mg/dl), que se transporta fundamentalmente en las HDL (hasta un 70%), y que aumenta hasta 2.000 mg/dl cuando es alimentado con dietas enriquecidas con colesterol al 0,5% y sebo bovino al 10%. En este último caso, aumentan las lipoproteínas ß-VLDL y LDL. Sin embargo, estos animales no poseen las Apo E ni B-4868.
Existen razas como la Show Racer (SR) que son resistentes al desarrollo de aterosclerosis incluso con la administración de dietas de alto contenido en colesterol69, y otras, como la White Carneau (WC), que la desarrollan espontáneamente con una dieta rica en grano. La susceptibilidad al desarrollo de la arteriosclerosis de este último animal parece atribuible tanto a defectos hereditarios en la capacidad de los macrófagos para exportar el colesterol70-72, como en los transportadores intestinales, localizados fundamentalmente en la porción proximal del intestino delgado, e implicados en la eliminación fecal de esta molécula73.
Las lesiones observadas en la paloma WC se localizan en las regiones torácica y abdominal de la aorta, en el tronco braquiocefálico y en las arterias ilíacas, carótidas, renales y coronarias; además, son muy similares tanto morfológica como ultraestructuralmente a las humanas. Así, se pueden presentar células espumosas, depósitos de colesterol y acumulación de matriz extracelular. En el caso de las placas avanzadas se observan focos calcificados y neovascularización, y estas placas pueden llegar a ulcerarse y formar trombos con el consiguiente desarrollo de infarto de miocardio69,74,75 en un cuadro muy semejante al humano. Todo indica que la paloma puede ser un buen modelo para el estudio de la arteriosclerosis.
Carnívoros
Perro
En este caso, también se trata de un animal con baja actividad de proteína transferidora de ésteres de colesterol, aproximadamente un 15% de la presente en humanos47, y resistente al desarrollo de aterosclerosis e incluso a la dislipemia moderada cuando se alimenta con dietas suplementadas con colesterol y grasa. Es necesario hacerlos hipotiroideos para elevar su colesterolemia. Aun en estas circunstancias, y en presencia de hipercolesterolemia, no todos los animales desarrollan la enfermedad76. En otros trabajos se ha demostrado que se requiere que las dietas enriquecidas en grasa y colesterol sean deficientes en ácidos grasos esenciales para inducir el proceso aterosclerótico. Así, empleando una dieta con un 5% en peso de colesterol y un 16% de aceite de coco hidrogenado, junto con falta de aporte de ácidos grasos esenciales, después de un año de utilización se observa un aumento del 800% de la colesterolemia y el desarrollo de lesiones en la aorta abdominal, las ramas ilíacas y la arteria coronaria.Si en vez de aceite de coco se emplea el de cártamo, rico en ácido linolénico, no se consigue el efecto mencionado77,78.
Cetartiodáctilos
Cerdo
Este animal posee una serie de rasgos interesantes comparables con los de la especie humana: es omnívoro, presenta hábitos sedentarios y propensión a la obesidad, y muchos de sus órganos son de un tamaño similar79. A finales de los años ochenta, el cerdo empezó a ser considerado un buen modelo para el estudio del metabolismo lipoproteico y de la arterosclerosis. En este sentido, el cerdo posee una distribución lipoproteínica similar a la encontrada en humanos, ya que transporta del 50 al 60% del colesterol en partículas LDL80-83, aunque presenta características propias que lo diferencian del hombre, como carecer de la CETP84 y de la Apo A-II85. Las características de su Apo A-IV, similar a la humana en un 75,6% y con una fuerte afinidad por las HDL, indican igualmente que este modelo animal se asemeja a la especie humana más que otras especies86. Al igual que el hombre, cuando es alimentado con una dieta rica en grasa saturada (15-20%) y colesterol (1-2%), su colesterol plasmático se incrementa entre un 500 y un 800%, y a la vez desarrolla complejas lesiones arterioscleróticas6,80,82,87-95. Asimismo, una inducción de diabetes experimental conlleva hipertrigliceridemia y una aceleración del proceso arteriosclerótico96.
Los cerdos poseen un sistema cardiovascular muy similar al humano en el número de latidos y, por tanto, en el flujo sanguíneo97, y su circulación coronaria, de igual modo, presenta muy pocas arterias colaterales92. Otro aspecto destacado es la reactividad farmacológica, análoga en ambas especies98. Los cambios experimentados en la circulación coronaria en estos modelos de coronariopatías se asemejan a los descritos en pacientes humanos97,99. Incluso la variedad de cerdo blanco Belga presenta muerte súbita cuando es sometido a estrés100.
Existen variedades naturales de cerdos con fenotipos interesantes para el campo de la arteriosclerosis: uno de ellos es el que presenta como característica principal una Apo B-100 alterada, que provoca la enfermedad denominada disbetalipoproteinemia familiar (FDB)101. En humanos, esta deficiencia parece deberse únicamente al cambio de un aminoácido de la Apo B-100102,103. Esta mutación provoca una unión deficiente entre las LDL y su receptor, deficiencia similar a la que presentan los pacientes que sufren hipercolesterolemia familiar, cuyo defecto se encuentra en el receptor de LDL. En ambos casos, el catabolismo mediado por el receptor se ve disminuido y produce hipercolesterolemia debida al aumento de LDL.
Actualmente, el modelo animal que más se asemeja a la disbetalipoproteinemia familiar humana es una raza de cerdos con hipercolesterolemia inherente a las LDL (IHLC). Las LDL de estos cerdos son más grandes y menos pesadas que las de los controles, ya que están enriquecidas en ésteres de colesterol y, a su vez, presentan un menor catabolismo cuando se inyectan a cerdos controles104. Por otra parte, la lesión desarrollada de forma espontánea por este animal, al año de edad, presenta focos principales en arterias coronarias, ilíacas y femorales. A los 2 años, aparecen lesiones estenósicas complicadas con capas fibrosas, núcleos necróticos, acumulación de colesterol, depósitos de calcio y neovascularizaciones en las principales arterias coronarias. A los 3 años, se hallan lesiones complejas con nueva vascularización en la íntima de las arterias, hemorragias y rotura de la placa105. Sin embargo, parece que la IHLC no es un modelo perfecto para estudiar la disbetalipoproteinemia familiar humane, ya que al secuenciar el ADN de la región de unión de la Apo B-100 del cerdo no se detectó ninguna mutación exclusiva de este alelo, y estos cerdos tienen una actividad normal del receptor de LDL.
En resumen, el cerdo es un buen modelo para el estudio de los efectos del colesterol de la dieta y otros lípidos sobre la biología de las arterias coronarias, el estudio de las complicaciones isquémicas coronarias y su diagnóstico, y los mecanismos involucrados en la restenosis tras la angioplastia, junto con los agentes que pueden interferir con la restenosis o prevenirla100. Asimismo, debido a las similitudes anatómicas y fisiológicas y en su reactividad farmacológica, el cerdo es un animal especialmente recomendado para el desarrollo de nuevos procedimientos terapéuticos y quirúrgicos94,106. En su contra, hay que mencionar que el coste de su mantenimiento y estabulación resultan prohibitivos para muchos laboratorios.
Primates
Primates no humanos
Los primates no humanos presentan una gran proximidad filogenética con la especie humana, lo que se refleja, a título de ejemplo, en que las Apo A-IV y C-III del macaco y del hombre son semejantes en un 87% de sus aminoácidos, y para la Apo A-II la semejanza alcanza hasta el 94%107,108. Debido a esta alta similitud genética entre ambas especies, presentan una considerable similitud fisiológica y comparten, por tanto, la susceptibilidad a las mismas enfermedades. Si bien el grupo de los primates no humanos es muy diverso, desde el punto de vista del metabolismo lipoproteico podemos diferenciar 2 grandes grupos: los que transportan el colesterol plasmático mayoritariamente en las HDL (género Cebus)109 y los que lo hacen en las LDL (género Macaca)110. Esta diferencia asociada a la actividad de la CETP111 no se corresponde exactamente con los subórdenes taxonómicos de platirrinos y catarrinos, y podría contribuir a explicar las respuestas a las diferentes dietas. En este sentido, en el mono verde africano y en el Cebus de cara blanca se ha demostrado que el tipo de grasa de la dieta regula la expresión de la Apo A-I, principal constituyente de las HDL, al aumentar la expresión de su ARNm con el aporte de grasa saturada y disminuir con la ingesta de grasa poliinsaturada112,113. Sin embargo, el macaco desarrolla más hipercolesterolemia y menor inducción de la expresión del gen de la Apo A-I que el mono verde africano en respuesta a una dieta rica en grasa saturada y colesterol114. Igualmente, el macaco con dietas de alto contenido en ácidos grasos poliinsaturados presenta un descenso de las HDL, debido fundamentalmente a un elevado catabolismo de estas partículas115. Esta especie es extraordinariamente sensible a la ingesta de colesterol dietético comparado con la humana, y sus concentraciones de colesterol plasmático se llegan a elevar hasta 20 veces en algunos estudios116.
Con dietas de alto contenido en colesterol, primates como los chimpancés, los monos araña, el aullador, el Rhesus, los babuinos y los macacos desarrollan una forma de arteriosclerosis muy similar a la humana117-119. Según el grado y la gravedad de las lesiones arterioscleróticas, los monos se clasifican en hipo e hiperrespondedores119-122; por otra parte, la localización de estas lesiones es muy variable, según la especie estudiada. Así, los machos Rhesus123 desarrollan las lesiones en la bifurcación de la rama descendente anterior y ramas circunflejas de las arterias coronarias, en tanto que en los cébidos aquéllas aparecen en la bifurcación carotídea y en la coronaria120. El macaco únicamente desarrolla lesiones en la coronaria y no en la aorta124, mientras que la situación contraria se observa en el mono verde africano, con preferencia hacia la aorta abdominal120. Todavía más, aun en una misma especie existe mucha variabilidad por la concurrencia de otros factores; en este sentido, macacos con deficiencia del receptor de LDL presentan lesiones en la aorta y en menor extensión en las coronarias125, y en el caso del mono verde africano, otros autores describen un patrón más difuso de presentación que el referido anteriormente126.
De todos los primates no humanos, el macaco es el modelo que mejor representa la progresión de la arteriosclerosishumana en respuesta a la dieta y
la posibilidad de su regresión y, por ende, el más empleado127-130. Sus lesiones inflamatorias y concéntricas son particularmente resistentes a la regresión131. Así, un suplemento de vitaminas (ácido fólico,vitamina B12 y vitamina B6) capaz de prevenir la hiperhomocisteinemia tuvo poco efecto sobre la vasodilatación dependiente del endotelio y el engrosamiento de la íntima de las arterias carotideas o ilíacas132. Este último está asociado a la presencia de radicales O2 y valores elevados de NAD(P)H oxidasa, que disminuyen a medida que mejora la función endotelial133. En la regresión dietética también se observa un aumento de la actividad anticoagulante en respuesta a la trombina en estos animales134.
Los macacos también presentan una respuesta a la angioplastia muy similar a la humana en cuanto a la extensión de la pared arterial afectada, la rotura de la placa, la rotura de la media o deslaminación, y la formación de pequeños trombos en la superficie luminar dañada. En etapas posteriores, se produce igualmente una disminución del calibre de la luz por contracción del vaso e hiperplasia de la neoíntima. En algunos casos en los que se observa un aumento del calibre vascular, éste se debe a un aumento del diámetro del vaso por un proceso de remodelado135.
Para el estudio de la regresión también se han empleado otros primates. En este sentido, Rhesus sometidos a un consumo de dietas hipercolesterolémicas ricas en grasa saturada y colesterol durante 5 años desarrollan un cuadro de lesiones excéntricas en la íntima de la aorta y las carótidas que experimenta regresión cuando posteriormente se les alimenta con dietas desprovistas de dichos componentes durante, al menos, 1,5 años. En cambio, la regresión de la lesión coronaria requiere de un período más prolongado130,136.
En resumen, la respuesta dietética similar a la humana hace que los primates no humanos sean unos excelentes modelos para el estudio de la aterosclerosis. En cambio, la variabilidad en el desarrollo de la lesión, el elevado coste y la limitada disponibilidad de animales, unida al hecho de que alguno de ellos sea especie protegida, los riesgos de su manejo y la existencia de problemas éticos limitan su uso en el estudio de la aterosclerosis137.
Conclusión
A tenor de la exposición precedente, es evidente que se dispone de unas herramientas de trabajo poderosísimas, con un siglo de experiencia, que permiten tanto el estudio de la implicación de diferentes componentes ambientales en la patogenia de la arterioesclerosis, como el desarrollo de procedimientos más seguros y efectivos, y menos invasivos de tratamiento. Bien es verdad que cuanto mayor es el conocimiento que se posee de los distintos modelos animales, más evidente parece que no existe uno ideal que responda satisfactoriamente a todos los problemas planteados. Siempre habrá diferencias con la enfermedad humana, por lo que al elegir el modelo animal hay que tener en cuenta el aspecto concreto que se va a estudiar7,8,10. Por ello, como no existe un modelo ideal, se han de utilizar varios antes de extrapolar los resultados de cualquier potencial tratamiento que estabilice la placa o que induzca su regresión, y su aplicación al paciente humano ha de confirmarse en voluntarios humanos4. A pesar de estas limitaciones, las ventajas para seleccionar nuevos procedimientos diagnósticos y tratamientos, así como para generar nuevos conocimientos sobre componentes de las placas que, a su vez, generen nuevos diagnósticos y terapias, hacen que la utilización de modelos animales sea imprescindible en la investigación en el campo de la patología cardiovascular. El conocimiento de los modelos espontáneos de la naturaleza no se ha agotado y, de hecho, puede proporcionar excelentes resultados cuando se complementa con la transgenia. La aplicación de la modificación genética en el conejo y en la rata es una realidad que está reforzando el conocimiento en el campo cardiovascular obtenido en el ratón por medio de esta tecnología14. A esta tendencia se pueden añadir manipulaciones transgénicas en el cerdo y los primates que, aunque más costosas, son igualmente viables.
Perspectivas de futuro
El mejor conocimiento de las particularidades de los diferentes animales, unido al previsible conocimiento del genoma de muchas de las especies mencionadas, nos llevará en un corto período al análisis genómico comparado, que permitirá predecir el alcance fisiopatológico de muchas variaciones génicas. Un enfoque de este tipo ya está produciendo resultados en este momento, por comparación de los genomas de ratón y humano138. A su vez, las estrategias genómicas, mediante el desarrollo de chips, permitirán conocer las respuestas tisulares específicas a las más variadas situaciones ambientales3,139. La información obtenida con ambos enfoques supondrá un avalancha de conocimientos de tal magnitud que su encauzamiento para establecer las categorías o patrones de expresión exigirá nuevos desarrollos informáticos para que su manejo sea ágil y, sobre todo, para que sean más asequibles a los profesionales. De esta forma, se podrán proporcionar respuestas a interrogantes fundamentales, como la susceptibilidad individual al desarrollo de la arteriosclerosis y su localización en el árbol arterial en un determinado entorno genético-ambiental y la regresión de las lesiones establecidas.