La diabetes mellitus tipo 1 es una de las enfermedades crónicas más frecuente en la población juvenil, con una incidencia anual en nuestro país de 10,7 casos nuevos por 100.000 habitantes1. El impacto de las complicaciones microvasculares en la morbimortalidad y en la calidad de vida de los pacientes con diabetes tipo 1 está bien establecido, especialmente la retinopatía y la neuropatía2. Sin embargo, las complicaciones macrovasculares, y de forma específica la enfermedad cardíaca coronaria y la arteriopatía periférica, preferentemente se han evaluado en la diabetes mellitus tipo 2.
Los grandes estudios de intervención en pacientes con diabetes tipo 1, como el Diabetes Clinical Complications Trial (DCCT), han demostrado el beneficio de la intensificación del tratamiento con insulina en la aparición de las complicaciones microangiopáticas2, sin evidenciar diferencias significativas en la tasa de enfermedad macrovascular después de un seguimiento medio de 6,5 años, muy probablemente debido a su baja incidencia en el grupo de adultos jóvenes, que se estima inferior al 1% anual3. Al igual que en la diabetes tipo 24, hay el convencimiento general que la repercusión del control glucémico intensivo en la diabetes tipo 1 sobre la enfermedad macrovascular es menor que sobre la microangiopatía2. Así pues, está ampliamente difundido que el principal objetivo terapéutico en la diabetes tipo 1 es el óptimo control metabólico para reducir la incidencia de microangiopatía. En muchas ocasiones, para conseguirlo se requieren dosis suprafisiológicas de insulina, con el consiguiente incremento de peso y riesgo de hipoglucemias. Si a este hecho añadimos el aumento en la supervivencia global y en la prevalencia de hipertensión arterial y dislipemia, nos hallamos ante un grupo de pacientes afectados de diabetes tipo 1 con muchas de las características del tipo 2 (hiperinsulinismo, sobrepeso, hipertensión arterial y dislipemia) y, por tanto, no es de extrañar que el aumento de la enfermedad cardiovascular en este grupo de pacientes represente ya la primera causa de muerte en la edad adulta5.
A continuación se analizan los principales determinantes del aumento del riesgo cardiovascular en la diabetes tipo 1 y sus implicaciones clínicas con el objeto de conseguir una mejoría sustancial de su salud cardiovascular.
Breve reseña histórica de la diabetes tipo 1La primera referencia histórica de los síntomas atribuibles a la diabetes data del año 1550 a. C. en el papiro de Ebers, en el que se atribuía la poliuria al Dios Imhotep. Posteriormente, Arateo en el año 150 d. C. hace referencia a la diabetes como una "afección maravillosa que consiste en la fusión de la carne y las extremidades en la orina" en la que "el paciente vive poco tiempo cuando la enfermedad está totalmente establecida, ya que la fusión es rápida y la muerte sucede pronto", por clínica progresiva de insulinopenia que conduce a un cuadro de cetoacidosis. No fue hasta enero de 1922 cuando se utilizó por primera vez insulina extraída de páncreas canino para corregir la acidosis metabólica, en un paciente llamado Leonard Thompson, de 14 años, en el Toronto General Hospital de Canadá. A partir de ese momento la morbimortalidad por descompensaciones agudas comenzaron a disminuir de forma progresiva, y en 1923, Joslin describió como, después de 1 año de tratamiento con insulina, 46 de los 48 niños diagnosticados en ese período continuaban con vida6. Fue entonces cuando las complicaciones crónicas de la diabetes empezaron a adquirir relevancia clínica por sus repercusiones en la calidad de vida y la mortalidad.
Complicaciones microvascularesEn población española con diabetes tipo 1, a los 10 años del diagnóstico la prevalencia de retinopatía es del 7,6%, la de microalbuminuria del 10,4% y la de polineuropatía del 4,3%7. La diabetes mellitus es la principal causa de ceguera y de hemodiálisis en la población adulta. Desde el inicio del tratamiento con insulina hasta la década de los noventa, estas complicaciones, en especial la nefropatía, constituían la principal causa de muerte8.
Como se ha apuntado con anterioridad, el estudio DCCT, publicado en el año 1993, demostró que el tratamiento intensivo con insulina reducía la incidencia de retinopatía en un 50% y la de nefropatía en un 34%2, tras lo que se generalizó la terapia con múltiples dosis de insulina en la diabetes tipo 1.
Complicaciones macrovascularesDiferentes estudios han probado que la ateromatosis coronaria es más difusa y extensa en la diabetes tipo 1 que en la población no diabética9–11, tal como ha corroborado el estudio Oslo mediante ultrasonografía intracoronaria12. Asimismo, hay que resaltar que las alteraciones en la estructura y función vascular tienen lugar en etapas muy tempranas del curso evolutivo de la diabetes tipo 113–16.
La enfermedad cardiovascular es la responsable de la mayor parte del incremento de mortalidad en los pacientes con diabetes tipo 1 y su primera causa de muerte a partir de los 30 años. Entre los 60 y los 84 años, el 56% de las muertes en los varones y el 65% en las mujeres con diabetes tipo 1 se deben a episodios cardiovasculares5. Las causas del aumento progresivo de la enfermedad macrovascular respecto a la microvascular en los últimos años son diversas, y entre éstas cabe citar una menor incidencia de la última tras el tratamiento intensivo con insulina, una mayor supervivencia global en este grupo de pacientes y un aumento de factores de riesgo como la hipertensión arterial y la dislipemia. Sin embargo, y aunque el riesgo relativo de enfermedad cardiovascular es algo mayor en los pacientes con diabetes tipo 1 tras ajustar por la edad17, cabe preguntarse si hay factores de riesgo específicos en la diabetes tipo 1. En primer lugar, la presencia de nefropatía emerge con claridad como predictor principal de riesgo cardiovascular, tal y como se ha reconocido durante muchos años18,19 y se ha confirmado repetidamente20,21. Sin embargo, y excluyendo la nefropatía, las tasas de enfermedad cardíaca coronaria siguen siendo excesivamente elevadas19. En este apartado de factores específicos de la diabetes tipo 1 relacionados con la enfermedad coronaria, hay que citar la neuropatía autonómica22–24, aunque las alteraciones del sistema nervioso autónomo en la diabetes tipo 1 se asocian de forma consistente con la enfermedad renal25. Este hecho podría explicar el elevado riesgo de mortalidad asociado con la neuropatía autonómica26,27, como destacaron por primera vez en un artículo seminal, Ewing et al23.
Hasta la fecha, los estudios acerca del control glucémico y el riesgo cardiovascular han obtenido resultados dispares. Así, en el Pittsburg Epidemiology of Diabetes Study28, la incidencia anual de enfermedad cardíaca coronaria a los 10 años de seguimiento fue del 1,8% en los varones y del 1,7% en las mujeres, demostrando que la duración de la diabetes, la presencia de hipertensión arterial, el recuento leucocitario como marcador de inflamación, el colesterol unido a lipoproteínas de alta densidad (cHDL), el colesterol no HDL y el consumo de cigarrillos eran los predictores independientes de un primer episodio cardiovascular. En este estudio, el grado de control metabólico, medido mediante la hemoglobina glucosilada, no resultó ser un factor predictor en el análisis univariado ni en el multivariado, aunque cabe destacar que la hemoglobina glucosilada era superior al 10% en ambos grupos, lejos de los objetivos terapéuticos recomendados en la actualidad. A pesar de que la hiperglucemia per se sólo mostró una débil asociación con los episodios coronarios, de acuerdo con los datos de los estudios Pittsburg Epidemiology of Diabetes Complications y del Wisconsin Epidemiologic Study of Diabetic Retinopathy, la glucemia fue un potente predictor de enfermedad arterial periférica29, amputaciones30 e ictus31.
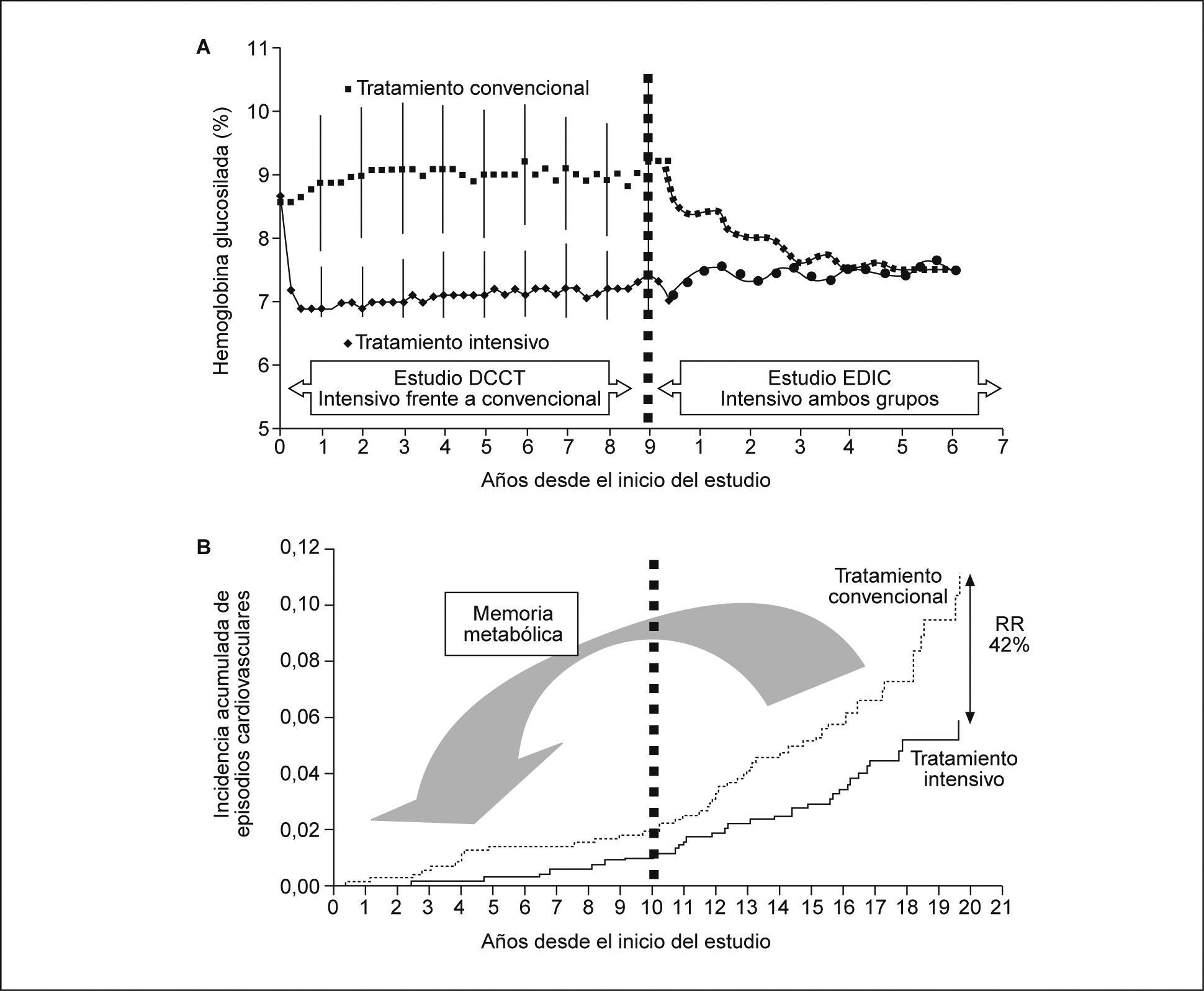
Más recientemente se han divulgado los resultados del estudio DCCT/EDIC3, continuación del DCCT que demostró los beneficios del control glucémico en cuanto a la microangiopatía, sin obtener diferencias significativas en cuanto a macroangiopatía. A la vista de estos resultados, los pacientes con diabetes tipo 1 pasaron a recibir tratamiento intensivo con múltiples dosis de insulina y en la segunda parte del estudio DCCT, conocido como Epidemiology of Diabetes Interventions and Complications Study (EDIC Study)3, se analizó la influencia del control metabólico intensivo en las complicaciones macrovasculares, con un seguimiento medio de 17 años (fig. 1). La prevalencia de cualquier episodio cardiovascular fue de 0,38 por paciente y año en el grupo que recibió tratamiento intensivo los primeros años respecto a 0,80 por paciente y año en el grupo de tratamiento convencional durante el DCCT, lo que representó una reducción de riesgo del 42%. La reducción del riesgo de infarto de miocardio no mortal, ictus o muerte fue del 57%. El fenómeno por el cual el mal control glucémico durante un período aumenta la incidencia de macroangiopatía, pese a una optimización metabólica posterior, se ha denominado "memoria metabólica" (fig. 1). Aunque los mecanismos fisiopatológicos de este fenómeno están por esclarecer, puede ser relevante el hecho de que en el grupo que recibió inicialmente tratamiento convencional había mayor prevalencia de microalbuminuria. En cualquier caso, el análisis multivariado demostró un descenso de riesgo cardiovascular del 20% al reducir la cifra de hemoglobina glucosilada un 10% respecto al valor inicial. Con anterioridad, en este mismo grupo de pacientes se había objetivado una menor calcificación de las arterias coronarias en el grupo intensivo a los 8 años de finalizado el DCCT. El análisis multivariado demostró una asociación entre la severidad de la calcificación de las arterias coronarias y el índice cintura/cadera, el consumo de cigarrillos, la hipertensión arterial, la hipercolesterolemia y la hemoglobina glucosilada, tanto durante el DCCT como durante el EDIC32. De forma similar, cuando se valoró la presencia de aterosclerosis extracoronaria subclínica, se documentó una menor progresión del grosor íntima-media carotídeo en el grupo de tratamiento intensivo33. Un reciente metaanálisis que incluía 1.800 pacientes con diabetes tipo 1 y 4.472 con diabetes tipo 2 reveló un una reducción de los episodios macrovasculares, con un mejor control glucémico en ambos casos. Además, sugiere una mayor reducción del riesgo vascular en la diabetes tipo 1 y una menor reducción del riesgo en la diabetes tipo 2 con la optimización del control metabólico34.
Principales resultados del Diabetes Control and Complications Trial2/Epidemiology of Diabetes Interventions and Complications Study3 (DCCT/EDIC)
Panel A valores medios de hemoglobina glucosilada del grupo de tratamiento insulínico intensivo y del grupo de tratamiento convencional, durante el período del ensayo clínico DCCT (parte izquierda de la gráfica), y después de finalizar el ensayo (parte derecha), cuando ambos grupos fueron tratados con insulinoterapia intensiva, estudio EDIC. Las diferencias en el grado de control sólo se observaron durante el período del ensayo clínico DCCT. Durante la fase de 10 años de seguimiento, estudio EDIC, ambos grupos tuvieron similares valores de hemoglobina glucosilada.
Panel B: incidencia acumulada de episodios cardiovasculares en función del brazo de tratamiento insulínico: intensivo frente a convencional, recibido durante el período del estudio DCCT. A pesar de que ambos grupos pasaron a seguir tratamiento intensivo durante los últimos 10 años del estudio, y de que no tenían valores medios distintos de hemoglobina glucosilada, en el grupo inicialmente tratado con insulinoterapia intensiva se observó una reducción de riesgo de episodios cardiovasculares del 42%, sugiriendo la existencia de una ‘memoria metabólica“.
RR riesgo relativo.
En los pacientes con diabetes mellitus tipo 2 se ha demostrado una clara relación entre la resistencia a la insulina, el síndrome metabólico y la enfermedad cardiovascular35,36. Aunque la diabetes tipo 1 obedece a la destrucción inmunológica de la célula beta-pancreática, la resistencia a la insulina puede presentarse también en la diabetes mellitus tipo 1, lo que se conoce como "diabetes doble". Este concepto se acuñó por primera vez en 1991 por Teupe y Bergis37 en un grupo de sujetos con diabetes tipo 1, hijos de diabéticos tipo 2, con mayor peso, mayores requerimientos de insulina y peor control metabólico que otro grupo sin antecedentes familiares de diabetes tipo 2. En el Pittsburg Epidemiology of Diabetes Complications la tasa estimada de disposición de glucosa, un método para estimar el grado de sensibilidad a la insulina en los pacientes con diabetes tipo 1, basado en parámetros clínicos, que muestra una buena correlación con la determinada mediante el pinzamiento euglucémico hiperinsulinémico38, fue, junto con la nefropatía, un excelente predictor de episodios coronarios graves28.
En la población americana, la prevalencia de síndrome metabólico en los pacientes con diabetes mellitus tipo 1 oscila entre el 21% según la definición de la Organización Mundial de la Salud, el 12% según los criterios del Panel III del National Cholesterol Education Program (NCEP), y el 8% según los de la International Diabetes Federation (IDF)39. Otros estudios realizados en Europa en pacientes con diabetes tipo 1, como el FinnDiane Study40, revelan una prevalencia de síndrome metabólico según el NCEP del 38% en varones y del 40% en mujeres. Se han referido datos similares en el área mediterránea, donde la prevalencia de síndrome metabólico según criterios del NCEP es del 24,5% en varones y del 43,2% en mujeres con diabetes tipo 1, estadísticas que contrastan con el 58,8 y el 80,8%, respectivamente, descritos en los pacientes con diabetes tipo 241.
En el marco del estudio DCCT2, el aumento ponderal medio en el grupo de múltiples dosis de insulina fue de 14kg, e incluso mayor en los pacientes hijos de diabéticos tipo 22, como consecuencia de los mayores aportes de insulina por unidad de peso. A pesar de ello, es de destacar que al finalizar el estudio el 94% de los 730 pacientes incluidos en el grupo de tratamiento convencional intensificó el tratamiento con insulina.
Si bien en los años de seguimiento del estudio DCCT se confirmó una menor incidencia de complicaciones microvasculares en los pacientes con diabetes tipo 1 al intensificar el tratamiento con insulina, es de subrayar que la prevalencia de síndrome metabólico según los criterios de la IDF aumentó en ambos grupos, pero de manera mucho más marcada en el grupo de tratamiento intensivo, siendo a los 9 años del 45% en este grupo y del 27% en el de tratamiento convencional42. Además, el aumento ponderal en los pacientes con tratamiento intensivo se asoció con un aumento de la adiposidad visceral43, y tuvo un impacto negativo en el perfil lipídico, la presión arterial44 y los parámetros de inflamación45. Sin embargo, no debemos olvidar que la estrategia terapéutica intensiva en el DCCT/EDIC se acompañó de una importante y significativa reducción del riesgo cardiovascular y que, no sólo la presencia de síndrome metabólico al inicio del estudio DCCT no se relacionó con el desarrollo de complicaciones micro y macrovasculares durante el estudio sino el grupo de pacientes que desarrolló el síndrome metabólico durante el seguimiento del estudio presentó una menor probabilidad de presentar complicaciones microvasculares y cardiovasculares a largo plazo3,46.
Por otra parte, la presencia de síndrome metabólico según los criterios de la IDF39 es un factor de riesgo independiente para la enfermedad cardiovascular (razón de riesgo, 2,05; p = 0,03), después de ajustar por la edad al diagnóstico, la duración de la diabetes, la hemoglobina glucosilada y el colesterol unido a lipoproteínas de baja densidad (cLDL). Muy recientemente, en el marco del estudio EDC, la adiposidad de asoció positivamente con la presencia de enfermedad cardíaca coronaria, pero en cambio la relación con la severidad de ésta fue inversa o inexistente47.
Nuevos factores de riesgo cardiovascular y diabetes tipo 1Desde la última década, la aterosclerosis se considera una enfermedad inflamatoria48, y varios de los reconocidos factores emergentes de riesgo vascular pueden desempeñar un importante papel en la aterogénesis que acontece en la diabetes tipo 1. En este contexto, es obligado mencionar que la modificación oxidativa de las partículas LDL y la subsiguiente respuesta inmune, puede ser uno de estos nuevos factores, habiéndose descrito una asociación entre el título de anticuerpos frente a las LDL oxidadas y la enfermedad cardíaca coronaria en la diabetes tipo 149. Los inmunocomplejos circulantes resultantes pueden inducir la formación de células espumosas y la disfunción endotelial50 mediante la activación de los macrófagos y las células endoteliales, y contrarrestando la acción fisiológica del óxido nítrico, con la consiguiente citotoxicidad vascular48,51. Se conoce bien que la capacidad de adhesión de los monocitos juega un importante papel en el inicio de la aterogénesis48,52, por lo que, en este contexto, la selectina E constituye un potente factor predictor independiente de enfermedad cardíaca coronaria en la diabetes tipo 153.
Aunque es fácil comprender la imposibilidad de analizar de forma extensa e integrada el papel de los cada vez más numerosos marcadores de inflamación en el desarrollo de la enfermedad cardiovascular de la diabetes tipo 154, cabe indicar que en el estudio Eurodiab la proteína C reactiva, la interleucina (IL) 6 y el factor de necrosis tumoral alfa fueron significativamente diferentes al clasificar a los pacientes según la presencia o ausencia de enfermedad cardíaca coronaria, después de ajustar por la edad, sexo, hemoglobina glucosilada, duración de la diabetes y presión arterial sistólica55. Asimismo, el receptor soluble IL-2, un marcador de las células T activadas, se ha asociado con la progresión de la enfermedad cardíaca coronaria en la diabetes tipo 156. Adicionalmente, en la diabetes tipo 1 se ha descrito un aumento de la expresión del ligando CD40 y una regulación al alta del ligando soluble CD40, mecanismos implicados con la activación de las células endoteliales y captación de los monocitos57,58.
La adiponectina, una de las proteínas circulantes más abundantes en el plasma59, que se acumula preferentemente en el espacio subintimal de la pared vascular cuando hay una agresión del endotelio, ha despertado un especial interés al demostrarse que tiene propiedades antiaterogénicas y antiinflamatorias60. Sin embargo, los estudios en la diabetes tipo 1 son limitados y confusos pues, a pesar del aumento de la incidencia de la enfermedad cardiovascular, se han encontrado concentraciones de adiponectina excesivamente altas comparado con la diabetes tipo 2 o con la situación de tolerancia normal a la glucosa61–63. Dado que la insulina está implicada en la regulación de la expresión de la adiponectina64, los valores relativamente elevados de insulinemia en la diabetes tipo 1 deben desempeñar un papel. Asimismo, la elevada prevalencia de macroalbuminuria en las cohortes examinadas de diabetes tipo 1 podrían explicar, al menos en parte, la hiperadiponectinemia hallada, tal como se ha descrito en la insuficiencia renal65–67. A pesar de todo, se ha descrito un riesgo de enfermedad cardíaca coronaria un 64% inferior por cada unidad de desviación estándar (6,3μg/ml) de incremento en los pacientes con diabetes tipo 1 del estudio EDC67, después de ajustar por los factores de riesgo clásicos, incluyendo la excreción urinaria de albúmina. Las investigaciones del Coronary Artery Calcification in Type 1 Diabetes (CACTI) han detallado también que las concentraciones más bajas de adiponectina se asocian de forma independiente con una mayor progresión del contenido de calcio intracoronario en la diabetes tipo 168.
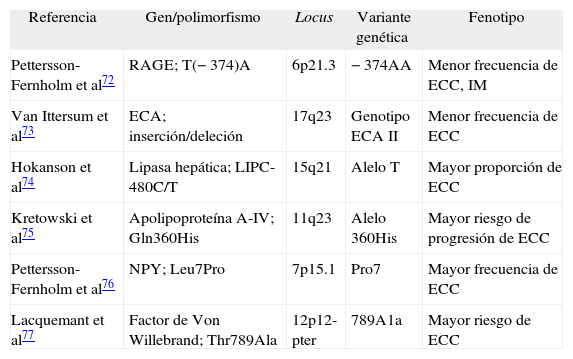
Genética, riesgo cardiovascular y diabetes tipo 1La aterosclerosis es una enfermedad multifactorial cuya expresión fenotípica es fruto de una compleja interacción entre los factores genéticos y los ambientales. En este sentido, diferentes estudios han remarcado el efecto de la historia familiar en el riesgo cardiovascular en general y en la diabetes tipo 169–71. Sin embargo, escasos estudios se han centrado en el análisis de la predisposición genética a la enfermedad cardíaca coronaria en la diabetes tipo 172–77 (tabla 1).
Estudios de asociación de genes candidatos para la enfermedad cardíaca coronaria en la diabetes mellitus tipo 1
| Referencia | Gen/polimorfismo | Locus | Variante genética | Fenotipo |
| Pettersson-Fernholm et al72 | RAGE; T(−374)A | 6p21.3 | −374AA | Menor frecuencia de ECC, IM |
| Van Ittersum et al73 | ECA; inserción/deleción | 17q23 | Genotipo ECA II | Menor frecuencia de ECC |
| Hokanson et al74 | Lipasa hepática; LIPC-480C/T | 15q21 | Alelo T | Mayor proporción de ECC |
| Kretowski et al75 | Apolipoproteína A-IV; Gln360His | 11q23 | Alelo 360His | Mayor riesgo de progresión de ECC |
| Pettersson-Fernholm et al76 | NPY; Leu7Pro | 7p15.1 | Pro7 | Mayor frecuencia de ECC |
| Lacquemant et al77 | Factor de Von Willebrand; Thr789Ala | 12p12-pter | 789A1a | Mayor riesgo de ECC |
ECA: enzima de conversión de la angiotensina; ECC: enfermedad cardíaca coronaria; IM: infarto de miocardio; NPY: neuropéptido Y; RAGE: receptor de los productos avanzados del final de la glucación.
Las últimas investigaciones se han encaminado a la genética de la adiponectina, basándose en las crecientes evidencias que apuntan que las variantes genéticas del gen AMP1 (11391G/-11377G haplotipo T45G, G276T) determinan, en gran parte, las concentraciones de adiponectina y se asocian con el riesgo cardiovascular en la diabetes tipo 2, en los sujetos control no diabéticos78–80 y en la diabetes tipo 1 con nefropatía81.
ConclusionesEn las líneas precedentes ha quedado patente que la diabetes tipo 1 presenta un riesgo cardiovascular elevado, que es evidente en los sujetos jóvenes. Debajo de este riesgo cardiovascular elevado subyace la presencia de diferentes factores de riesgo modificables, como los clásicos cardiovasculares u otros más específicos de la diabetes tipo 1 como la nefropatía82. La relación entre la glucemia y los episodios clínicos es multifactorial y compleja. Desafortunadamente, los estudios clínicos de intervención en la diabetes tipo 1 para la prevención cardiovascular se limitan al DCCT/EDIC, que demostró el gran beneficio del control glucémico intensivo.
Por otra parte, los pacientes con diabetes tipo 1 presentan varios factores de riesgo cardiovascular a edades tempranas, y muchos de ellos requieren intervenciones terapéuticas a partir de los 25 años de edad83. En la actualidad, muchos de los pacientes afectados de diabetes mellitus tipo 1 presentan como mínimo 2 de las características principales del síndrome metabólico, el sobrepeso y las alteraciones del metabolismo hidrocarbonado. En cualquier caso, más allá de la importancia cardiovascular del síndrome metabólico en los pacientes con diabetes mellitus tipo 1, es de destacar que este grupo de pacientes presenta, cada vez más, características comunes a los afectados de diabetes mellitus tipo 2, y que, por tanto, como ha quedado demostrado en éstos84,85, se debería realizar un abordaje intensivo sobre todos los factores de riesgo cardiovascular para reducir las complicaciones macrovasculares, que en este momento representan la primera causa de mortalidad a partir de los 30 años en este grupo de pacientes.