Las diferencias entre sexos en la incidencia de enfermedad cardiovascular se han asociado con un diferente perfil lipídico en hombres y mujeres, relacionado con cambios en las hormonas sexuales a lo largo de la vida. La pubertad es el periodo del desarrollo en el que empieza a manifestarse la influencia de estas hormonas sobre el perfil lipídico. Por ello, en nuestro estudio, hemos analizado la relación de los niveles de testosterona, estradiol y sex hormone binding globulin (SHBG, ‘globulina transportadora de hormonas sexuales’) con los cambios en las variables antropométricas y lipídicas que tienen lugar en la pubertad.
MétodosLa población de nuestro estudio la constituyen 370 escolares sanos (175 varones y 195 mujeres) de edades comprendidas entre 12–15 años. Los niveles plasmáticos de lípidos se determinaron mediante métodos estandarizados. Los niveles de testosterona y estradiol fueron determinados mediante radioimmunoensayo y los niveles de SHBG mediante ensayo immunoradiométrico.
ResultadosEn niños, importantes aumentos del peso y la altura a lo largo del periodo puberal se acompañaron de un aumento significativo de la testosterona y un descenso de la SHBG. El cHDL fue significativamente más bajo en varones de 15 años que en los más jóvenes y la apo A-I disminuyó progresivamente en función de la edad. En niñas, no se observaron diferencias significativas. En niños, el cHDL y la apo A-I correlacionaron negativamente con la testosterona y positivamente con la SHBG. La correlación entre apo A-I y SHBG continuó significativa (p<0,001) después de ajustar por el IMC.
ConclusionesEl importante descenso de los niveles de cHDL y apo A-I observado durante la pubertad en los varones de nuestro estudio se relaciona no solo con el aumento de los niveles de testosterona, sino también con la bajada de los niveles de SHBG, apoyando el papel de la SHBG en dicho descenso.
Sex-related differences in the prevalence of coronary heart disease have been associated to different lipid profiles in men and women, related to changes in sex hormones throughout life. Puberty is a period of development in which the influence of sex hormones on the lipid profile is starting to take place. Thus, we aimed to analyze the relationship between sex hormones (testosterone, oestradiol and SHBG (sex hormone binding globulin)) and changes in anthropometric variables and plasma lipid levels during puberty.
MethodsOur population-based sample included 370 healthy pubertal children (175 males and 195 females), ranging from 12–15 years old. Plasma lipid levels were measured by standarized methods. Testosterone and oestradiol levels were determined by RIA and SHBG levels were determined by IRMA.
ResultsIn boys, significant increases in weight and height across the period were accompanied by an increase in testosterone and a decrease in SHBG levels. HDL-cholesterol levels were significantly lower in 15-year-old than in younger boys and apo A-I levels steeply decreased across the studied age groups. No significant changes were observed in girls. In boys, HDL-cholesterol and apo A-I levels correlated negatively with testosterone and positively with SHBG. Apo A-I levels remained significantly (p<0.001) correlated to SHBG after adjusting for BMI.
ConclusionsThe significant decrease in HDL-cholesterol and apo A-I levels observed during puberty in boys in our study seemed to be related to both testosterone and SHBG levels, supporting the role of SHBG on this decrease of HDL-cholesterol levels occurring during puberty in boys.
La aterosclerosis es un proceso que se desarrolla en las primeras décadas de la vida, evolucionando de forma asintomática y, en general, sin expresión clínica hasta la edad adulta. Estudios utilizando ecografía intravascular han detectado lesiones ateroscleróticas en las arterias coronarias del 17% de los individuos menores de 20 años estudiados1, evidenciando el comienzo de esta enfermedad a edades muy tempranas. Además, la presencia en la edad infantil de factores de riesgo de aterosclerosis se relaciona con la aparición de la ECV en la edad adulta2–4. Sin embargo, la instauración de factores de riesgo cardiovascular y alteraciones metabólicas varía en función del sexo, atribuyéndose a la modulación hormonal las diferencias en dicha instauración que condicionarán las discrepancias entre sexos en el futuro desarrollo de la ECV.
Así, diferencias en niveles de lípidos plasmáticos parecen relacionarse con la distinta prevalencia de la ECV observada entre hombres y mujeres a lo largo de la vida5, de modo que el efecto de las hormonas sexuales y su acción regulatoria en el metabolismo de los lípidos han sido ampliamente investigados, observándose una asociación entre los niveles hormonales y variaciones en los niveles de lípidos de acuerdo a la edad y al sexo6–9.
En este sentido, la pubertad es un momento de importantes cambios antropométricos, hormonales y lipídicos relacionados con el proceso de maduración sexual10. Los estudios que han analizado la relación entre niveles hormonales en el periodo puberal y las medidas antropométricas y de composición corporal se han centrado en niños obesos11–13 o exclusivamente en niñas14–16, de modo que los datos sobre los cambios en niveles de hormonas sexuales y variables antropométricas en la pubertad temprana en niños sanos son escasos. Por su parte, los estudios que han analizado la relación de los cambios en los niveles hormonales con las variaciones en los niveles plasmáticos de lípidos que tienen lugar durante la pubertad17, han observado que la distinta tendencia en la evolución de los niveles de cHDL de acuerdo al sexo se relaciona con el aumento de los niveles de testosterona en niños18,19. Sin embargo, todos los estudios se han centrado en los niveles totales de hormonas sexuales y el papel de la globulina transportadora de hormonas sexuales (SHBG) no ha sido evaluado previamente en niños puberales sanos. La SHBG modula la disponibilidad biológica libre activa de testosterona y estradiol20–22, y su papel regulador podría ser crucial en la relación entre los niveles de hormonas y la modificación del perfil lipídico que tiene lugar durante la pubertad.
Por ello, dentro del Estudio Cuatro Provincias nos propusimos determinar los niveles de estradiol, testosterona y SHBG en niños españoles de edad puberal y analizar la relación entre dichos niveles hormonales y los cambios en las variables antropométricas y en los niveles de lípidos plasmáticos de acuerdo al sexo y a la edad en una muestra representativa de niños españoles sanos de 12–15 de edad.
Material y métodosDiseño y sujetos de estudioSe trata de un estudio transversal en el que se han analizado variables antropométricas, perfil lipídico y niveles hormonales en 370 niños sanos de edad puberal (12–15 años de edad), integrantes del segundo corte del Estudio Cuatro Provincias en Madrid. La selección de los niños en el primer corte se realizó mediante muestreo aleatorio, por conglomerados de los centros escolares, estratificados por sexo y nivel socioeconómico (titularidad pública y privada de los colegios). El protocolo de estudio cumple las normas de Helsinki y la legislación española sobre investigación clínica en humanos, y ha sido aprobado por el comité ético de investigación clínica de la Fundación Jiménez Díaz en Madrid. Todos los padres debieron firmar un consentimiento informado para la inclusión de sus hijos en el estudio.
Recogida de informaciónUna vez obtenidos los consentimientos informados correspondientes a los niños seleccionados para participar en el estudio se procedió a la extracción de muestras de sangre y a la recogida de información para cada niño en cada uno de los colegios que participaron en el estudio. Se excluyeron los niños que, según comunicado de los padres, padecían alteraciones metabólicas, endocrinas, hepáticas o renales. La información fue recogida siempre por el mismo equipo de campo, ayudados por un médico y 2 ATS responsables de la extracción de sangre.
Variables antropométricasLas medidas se realizaron con los niños vestidos con ropa ligera y sin zapatos. La talla se midió hasta el último milímetro utilizando tallímetros extensibles portátiles (modelo Ka We 4444Seca). El peso se midió hasta el último 0,1kg con una balanza electrónica digital homologada (modelo Seca 812). A partir de estas medidas se calculó el IMC (peso en kg/talla2 en m2).
Determinaciones bioquímicasLas muestras de sangre se obtuvieron por venopunción después de las medidas físicas, en ayunas de una noche. Se recogieron 10ml de sangre en tubo Vacutainer conteniendo EDTA-Na2, como antioxidante y anticoagulante. Los tubos se mantuvieron en hielo hasta que fueron centrifugados (20min a 3000rpm y 4°C) para separar sus fracciones, que posteriormente fueron congeladas a −70°C para su envío en hielo seco al laboratorio central para análisis.
Perfil lipídicoEn el plasma obtenido se valoran por métodos enzimáticos colesterol y TG (Menarini Diagnostics) en un autoanalizador RA-1000. El cHDL se determinó después de la precipitación de las lipoproteínas que contienen apo B con ácido fosfowolfrámico y Mg (Boehringer Mannheim). El cLDL se calculó según la formula de Friedewald. Las concentraciones de apo A-I y apo B en plasma se cuantificaron por immunonefelometria (Array System, Beckman Instruments). La testosterona y el estradiol se determinaron mediante radioimmunoensayo, usando kits comerciales (DSL-4000 Active® Testosterone and DSL-43100 Active® Estradiol, respectivamente; Diagnostic Systems Laboratories, Inc., Webster, Texas, EE.UU). La SHBG se midió utilizando un ensayo immunoradiométrico (DSL-7400 Active® SHBG; DSL, Inc., Webster, Texas, EE.UU.).
Análisis estadísticoTodos los análisis se han realizado con el programa SPSS v 9.0 (SPSS Inc, Chicago, IL). Las diferencias en las variables del estudio según edad se han evaluado mediante ANOVA, y el pertinente análisis Post Hoc: Tukey o Tamhane's T2 según las varianzas fueran o no iguales. Las correlaciones entre los niveles de hormonas y las variables antropométricas y lípidicas se han determinado mediante coeficientes de correlación de Spearman.
ResultadosLa población del estudio incluye 370 escolares sanos (175 varones y 195 mujeres) de edades comprendidas entre 12–15 años. La edad media fue similar en ambos sexos, 13,6±1,1 en niños y 13,7±0,9 en niñas.
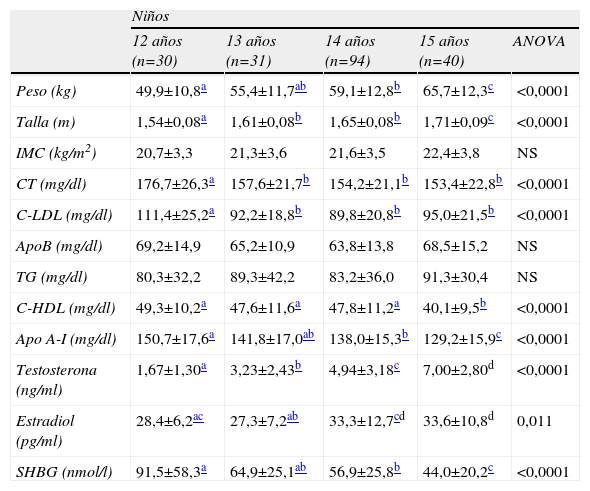
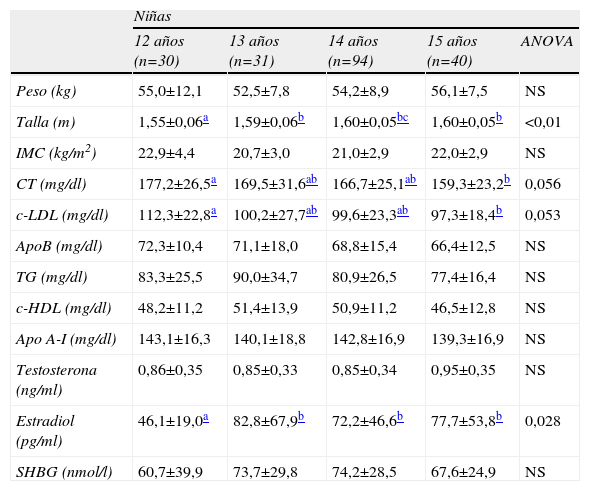
Las variables antropométricas (peso, talla e IMC), el perfil lipídico y los niveles de hormonas según la edad en niños y niñas se muestran en las tablas 1 y 2 respectivamente. El peso aumenta gradualmente al aumentar la edad en niños pero no en niñas. El peso de los niños se incrementa en más de 15kg a lo largo del periodo de edad estudiado, desde una media de 49,9±10,8kg a los 12 años hasta una media de 65,7±12,3 a los 15. En las niñas de 12 años el peso medio es de 55,0±12,1kg y no se modifica significativamente en los otros grupos de edad. La altura también aumenta gradual y significativamente al estudiar niños de 12–15 años. En las niñas, la altura es significativamente más elevada en el grupo de 13 que en el grupo de 12 pero no presenta diferencias significativas entre los 13–15 años. No se observan diferencias significativas en las medias del IMC entre grupos.
Datos antropométricos, perfil lipídico y niveles hormonales (media±DE) según edad en niños
| Niños | |||||
| 12 años (n=30) | 13 años (n=31) | 14 años (n=94) | 15 años (n=40) | ANOVA | |
| Peso (kg) | 49,9±10,8a | 55,4±11,7ab | 59,1±12,8b | 65,7±12,3c | <0,0001 |
| Talla (m) | 1,54±0,08a | 1,61±0,08b | 1,65±0,08b | 1,71±0,09c | <0,0001 |
| IMC (kg/m2) | 20,7±3,3 | 21,3±3,6 | 21,6±3,5 | 22,4±3,8 | NS |
| CT (mg/dl) | 176,7±26,3a | 157,6±21,7b | 154,2±21,1b | 153,4±22,8b | <0,0001 |
| C-LDL (mg/dl) | 111,4±25,2a | 92,2±18,8b | 89,8±20,8b | 95,0±21,5b | <0,0001 |
| ApoB (mg/dl) | 69,2±14,9 | 65,2±10,9 | 63,8±13,8 | 68,5±15,2 | NS |
| TG (mg/dl) | 80,3±32,2 | 89,3±42,2 | 83,2±36,0 | 91,3±30,4 | NS |
| C-HDL (mg/dl) | 49,3±10,2a | 47,6±11,6a | 47,8±11,2a | 40,1±9,5b | <0,0001 |
| Apo A-I (mg/dl) | 150,7±17,6a | 141,8±17,0ab | 138,0±15,3b | 129,2±15,9c | <0,0001 |
| Testosterona (ng/ml) | 1,67±1,30a | 3,23±2,43b | 4,94±3,18c | 7,00±2,80d | <0,0001 |
| Estradiol (pg/ml) | 28,4±6,2ac | 27,3±7,2ab | 33,3±12,7cd | 33,6±10,8d | 0,011 |
| SHBG (nmol/l) | 91,5±58,3a | 64,9±25,1ab | 56,9±25,8b | 44,0±20,2c | <0,0001 |
Datos antropométricos, perfil lipídico y niveles hormonales (media±DE) según edad en niñas
| Niñas | |||||
| 12 años (n=30) | 13 años (n=31) | 14 años (n=94) | 15 años (n=40) | ANOVA | |
| Peso (kg) | 55,0±12,1 | 52,5±7,8 | 54,2±8,9 | 56,1±7,5 | NS |
| Talla (m) | 1,55±0,06a | 1,59±0,06b | 1,60±0,05bc | 1,60±0,05b | <0,01 |
| IMC (kg/m2) | 22,9±4,4 | 20,7±3,0 | 21,0±2,9 | 22,0±2,9 | NS |
| CT (mg/dl) | 177,2±26,5a | 169,5±31,6ab | 166,7±25,1ab | 159,3±23,2b | 0,056 |
| c-LDL (mg/dl) | 112,3±22,8a | 100,2±27,7ab | 99,6±23,3ab | 97,3±18,4b | 0,053 |
| ApoB (mg/dl) | 72,3±10,4 | 71,1±18,0 | 68,8±15,4 | 66,4±12,5 | NS |
| TG (mg/dl) | 83,3±25,5 | 90,0±34,7 | 80,9±26,5 | 77,4±16,4 | NS |
| c-HDL (mg/dl) | 48,2±11,2 | 51,4±13,9 | 50,9±11,2 | 46,5±12,8 | NS |
| Apo A-I (mg/dl) | 143,1±16,3 | 140,1±18,8 | 142,8±16,9 | 139,3±16,9 | NS |
| Testosterona (ng/ml) | 0,86±0,35 | 0,85±0,33 | 0,85±0,34 | 0,95±0,35 | NS |
| Estradiol (pg/ml) | 46,1±19,0a | 82,8±67,9b | 72,2±46,6b | 77,7±53,8b | 0,028 |
| SHBG (nmol/l) | 60,7±39,9 | 73,7±29,8 | 74,2±28,5 | 67,6±24,9 | NS |
Los niveles de colesterol total (CT) y cLDL fueron significativamente más altos en los varones de 12 años que en el resto de los grupos de edad. Los niveles de cHDL disminuyeron progresivamente de acuerdo al grupo de edad considerado, de modo que fueron significativamente más bajos en niños de 15 que en niños más jóvenes. Los niveles de apo A-I en niños fueron significativa y progresivamente más bajos al aumentar la edad del grupo considerado (tabla 1). Respecto a las variaciones del perfil lipídico en las niñas, únicamente se han observado diferencias significativas entre los niveles plasmáticos de CT y cLDL a los 12 y dichos niveles a los 15 años (tabla 2). En niños, los niveles medios de testosterona fueron de 4,56±3,26ng/ml y en niñas los niveles de estradiol de 71,2±50,5pg/ml. Los niveles de SHBG fueron significativamente más bajos en niños (61,6±37,3nmol/l) que en niñas (70,8±30,0nmol/l). En niños, los niveles de testosterona aumentaron gradual y significativamente al aumentar la edad del grupo considerado, de modo que existen diferencias significativas entre todos los grupos de edad. Por el contrario, los niveles de SHBG disminuyeron de forma gradual y significativa entre los grupos de 12–15 años (tabla 1). En niñas, los niveles de estradiol son más altos a los 13 años que a los 12, pero no se modifican significativamente entre los 13, 14 y 15. Los niveles de SHBG no mostraron diferencias significativas entre grupos (tabla 2).
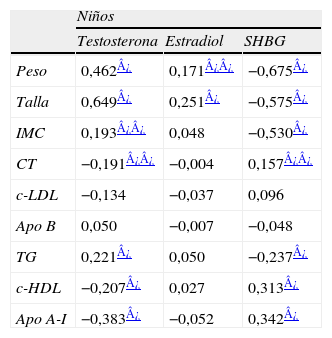
En las tablas 3 y 4 se muestran los coeficientes de correlación de Spearman para las correlaciones entre los niveles de hormonas y las variables antropométricas y lipídicas en niños y niñas respectivamente. Se observó una importante correlación positiva de la testosterona con el peso, la talla y el IMC en niños (tabla 3) y con el peso y el IMC en niñas (tabla 4). La SHBG presentó importantes correlaciones negativas con el peso, la talla y el IMC en niños (tabla 3) y con el peso y el IMC en niñas (tabla 4).
Análisis de correlación de Spearman entre los niveles de hormonas y las variables antropométricas y el perfil lipídico en niños
Análisis de correlación de Spearman entre los niveles de hormonas y las variables antropométricas y el perfil lipídico en niñas
El peso y el IMC correlacionan de forma negativa con los niveles de cHDL y apo A-I en ambos sexos y positivamente con los niveles de TG en niños (datos no mostrados).
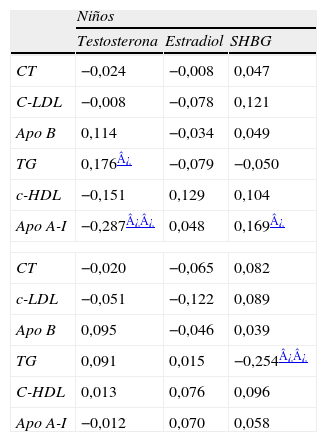
En niños, después de ajustar por IMC, los niveles de testosterona [que correlacionaban de forma significativa y negativa con el CT, el cHDL y la apo A-I, y positiva con los TG en análisis de correlación bivariada (tabla 3)] continuaron correlacionando significativamente con la apo A-I y con los TG (tabla 5). En análisis bivariado, la SHBG se asoció positivamente con el CT, el cHDL y la apo A-I y negativamente con los TG en niños (tabla 3). En niñas, correlacionó positivamente con el cHDL y negativamente con los TG (tabla 4). Después de ajustar por IMC, la SHBG continúo correlacionando positivamente con los niveles de apo A-I en niños y negativamente con los niveles de TG en niñas (tabla 5).
Análisis de correlación parcial entre los niveles de hormonas y el perfil lipídico ajustando por IMC
| Niños | |||
| Testosterona | Estradiol | SHBG | |
| CT | −0,024 | −0,008 | 0,047 |
| C-LDL | −0,008 | −0,078 | 0,121 |
| Apo B | 0,114 | −0,034 | 0,049 |
| TG | 0,176¿ | −0,079 | −0,050 |
| c-HDL | −0,151 | 0,129 | 0,104 |
| Apo A-I | −0,287¿¿ | 0,048 | 0,169¿ |
| CT | −0,020 | −0,065 | 0,082 |
| c-LDL | −0,051 | −0,122 | 0,089 |
| Apo B | 0,095 | −0,046 | 0,039 |
| TG | 0,091 | 0,015 | −0,254¿¿ |
| C-HDL | 0,013 | 0,076 | 0,096 |
| Apo A-I | −0,012 | 0,070 | 0,058 |
Los resultados de los análisis de regresión múltiple (Stepwise), que incluyeron como variables predictoras estradiol, testosterona y SHBG, mostraron que la SHBG era la única variable significativa a la hora de explicar variaciones en los niveles de cHDL, contribuyendo a explicar el 10% de la variación del cHDL en niños y el 3,2% en niñas, después de ajustar por IMC. En niños, la testosterona y la SHBG explicaban el 16,2% de la variación de los niveles plasmáticos de apo A-I. Así mismo, la SHBG contribuía a explicar el 5,4% y el 4,6% de la variabilidad en los niveles de TG en niños y niñas respectivamente.
DiscusiónEl desarrollo puberal, en el que los esteroides sexuales juegan un papel fundamental, supone un evidente cambio en todas las esferas (antropométrica, hormonal, y lipídica)10, configurando, además de otras cosas, los diferentes factores de riesgo cardiovascular en ambos sexos.
En nuestro estudio en niños puberales entre 12–15 años de edad, hemos observado unos niveles de testosterona y unos valores de peso y talla progresivamente más altos al incrementarse la edad considerada en varones. En niñas, sin embargo, los niveles de estradiol y la altura son diferentes entre los 12–13 años, pero son similares en el resto de los grupos de edad. Al analizar la relación entre las variables antropométricas y los niveles de hormonas sexuales, hemos observado una importante correlación entre los niveles de testosterona y el peso y la talla en niños, pero una correlación más débil entre el estradiol y las variables antropométricas en niñas. En este sentido, es importante reflexionar sobre el momento del desarrollo en que se encuentran estos niños. Se ha descrito un patrón de crecimiento distinto en niños y niñas, de modo que el pico de crecimiento tiene lugar en niñas antes que en niños23, ocurriendo a los 11,5 años en niñas españolas (justo antes del periodo estudiado) y a los 13,5 en niños (dentro del periodo estudiado). Los varones de nuestro estudio están en pleno cambio ponderal y hormonal; en el periodo estudiado ganan 15kg de peso y el aumento de la testosterona es muy evidente. En el caso de las niñas, el hecho de que el peso prácticamente no se modifique puede ser debido a que a los 12 años ya ha tenido el pico de crecimiento, los niveles de estradiol permanecen estables entre los 13–15 años y, por tanto, las modificaciones asociadas al estradiol son menos evidentes.
Durante la pubertad también se producen importantes cambios en los niveles de lípidos24,25. Nosotros hemos observado niveles progresivamente más bajos de cHDL y apo A-I al aumentar la edad considerada en varones, pero no en niñas, tal y como se ha descrito previamente en población española26 y en otras poblaciones27–29. Claramente estamos asistiendo a la instauración de un factor de riesgo cardiovascular tan decisivo como es una concentración disminuida de cHDL, que va a ser característica a partir de este momento del varón, y que contribuirá a que sufra cardiopatía isquémica una década antes que la mujer.
El importante descenso de los niveles de cHDL en niños ha sido asociado con el incremento de los niveles de testosterona durante la pubertad18,19,30. En nuestro estudio el incremento de los niveles medios de testosterona en niños, efectivamente, va paralelo a niveles de cHDL y apo A-I progresivamente más bajos a partir de los 12 años, y los niveles de testosterona correlacionan de forma significativa e inversa con dichos niveles, observándose una correlación de la testosterona más fuerte con los niveles de apo A-I que con los de cHDL. De acuerdo a estudios previos30, la relación entre testosterona y niveles de cHDL en los niños puede estar relacionada con el efecto de la testosterona sobre la apo A-I más que con la cantidad de colesterol asociada con estas proteínas.
La progresiva disminución de cHDL y apo A-I observada en los niños pero no en las niñas, también fue acompañada de una disminución paralela en los niveles de SHBG en los niños, y de la ausencia de cambios en las niñas. Pero, como hemos comentado, estos niños estaban en un momento de importantes cambios a nivel global, afectando al crecimiento y a los niveles hormonales, y un aumento considerable de su peso corporal, acompaña a los cambios progresivos de las concentraciones de testosterona (aumento) y SHBG (disminución) con la edad31. En nuestra población, los niveles de SHBG correlacionan inversamente con el peso y el IMC tanto en niños como en niñas. Sin embargo, después de ajustar por el IMC, la correlación de la SHBG con la apo A-I en niños y con los TG en niñas sigue siendo importante y la SHBG aparece como la única variable explicativa de las variaciones de los niveles de cHDL en ambos sexos.
No hemos encontrado estudios que hayan analizado la relación de los niveles de SHBG con el cambio en los niveles de cHDL que se produce durante este periodo puberal. En adultos, la mayoría de los estudios transversales han observado que la SHBG es un importante factor determinante de los niveles de cHDL y TG, y que las asociaciones entre estas variables y SHBG son mucho más fuertes que sus asociaciones con las propias hormonas sexuales9. La SHBG se ha asociado positivamente con el cHDL y negativamente con los TG tanto en hombres8,9,32–34 como en mujeres33,35,36, aunque un estudio reciente realizado en población japonesa ha descrito esta asociación en mujeres pero no en hombres37, lo que sugiere que la asociación puede depender de la población estudiada. Otros estudios transversales mostraron que a pesar de que la SHBG correlaciona positivamente con los niveles de cHDL, el ajuste por peso debilita esta asociación38.
En resumen, en nuestra población puberal, observamos importantes modificaciones de las variables antropométricas, los niveles de lípidos y los niveles hormonales en varones, en los que está teniendo lugar un crecimiento activo. Hemos observado que en estos niños, además de existir una correlación negativa entre los niveles de c-HDL y Apo A-I y los niveles de testosterona, existe una importante correlación positiva entre dichos niveles y los niveles de SHBG, de modo que la correlación entre Apo A-I y SHBG persiste incluso después de ajustar por IMC, sugiriendo que la SHBG puede jugar un papel importante en el descenso de los niveles de cHDL que tiene lugar durante la pubertad en niños.
Financiaci´onEste trabajo ha sido parcialmente subvencionado por la beca concedida por la FEA/SEA para la Investigación Clínico-Epidemiológica en el año 2005, en el XVIII Congreso Nacional de la Sociedad Española de Arteriosclerosis, celebrado en La Coruña.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Mercedes Benavente, José L del Barrio, Rafael Rubio, Enrique Viturro, Stefanie Schoppen, Pía Riestra, Alicia García-Anguita (Laboratorio de Lípidos, Fundación Jiménez Díaz, Universidad Autónoma de Madrid).
Miguel A Lasunción, Henar Ortega (Servicio de Bioquímica-Investigación, Hospital Ramón y Cajal, Universidad de Alcalá).
José M. Martín Moreno, Lydia Gorgojo (Universidad de Valencia).
Miguel A. Royo (Instituto de Salud Carlos III, Madrid).
Angel Gil (Universidad Rey Juan Carlos, Madrid).
Fernando Rodríguez Artalejo (Universidad Autónoma de Madrid).
Ovidio Fernández (Hospital Cristal Piñol, Orense).
Alipio Mangas y Alfonso Macías (Universidad de Cádiz).
Jacinto Fernández Pardo (Hospital General Universitario, Murcia), Alberto Torres (Universidad de Murcia).