La valoración del riesgo vascular en pacientes asintomáticos y la respuesta a la intervención terapéutica es uno de los mayores objetivos para la prevención de eventos cardiovasculares. Nuestro objetivo fue evaluar si una nueva proteína descrita de la superfamilia del factor de necrosis tumoral, TWEAK, se secreta diferencialmente por la pared vascular sana en comparación con la lesión aterosclerótica humana, y si las concentraciones plasmáticas de esta proteína pueden servir como biomarcador de aterosclerosis.
Material y métodosMediante técnica de radioinmunoanálisis analizamos el sobrenadante procedente del cultivo de placas carotídeas y de arterias sanas humanas. Además, analizamos la concentración plasmática de TWEAK soluble (sTWEAK) en pacientes con aterosclerosis carotídea (n=30), pacientes que presentaban disfunción endotelial (n=200) y sujetos asintomáticos (n=106), y se compararon con sujetos sanos (n=83).
Resultados y conclusiónLos niveles de sTWEAK se encontraban disminuidos en el sobrenadante procedente de placas carotídeas comparadas con arterias sanas. Posteriormente, el análisis de la concentración plasmática de sTWEAK mostró que sujetos con estenosis carotídea tenían niveles reducidos en comparación con sujetos sanos. Además, los niveles plasmáticos de sTWEAK se encontraron disminuidos en sujetos asintomáticos en los cuales se midió el espesor íntima-media (un índice de aterosclerosis subclínica) y en sujetos en los cuales se había medido su función endotelial. Estos resultados sugieren que sTWEAK puede ser un nuevo marcador potencial de aterosclerosis subclínica.
Assessment of vascular risk in asymptomatic patients and the response to medical therapy is a major challenge for prevention of cardiovascular events. Our aim was to investigate if a novel protein of TNF superfamliy, TWEAK, is differentially released by healthy versus atherosclerotic arterial walls. Moreover, we have analysed whether soluble TWEAK (sTWEAK), which could be found in plasma and serve as biomarker of atherosclerosis.
Material and methodsSupernatants obtained from cultured human carotid plaques and healthy arteries were analysed by ELISA. In addition, sTWEAK plasma levels were measured in subjects with carotid atherosclerosis (N=30), patients with endothelial dysfunction (N=200) and asymptomatic patients (N=106) and compared with healthy subjects (N=28).
Results and conclusionsTWEAK concentrations were decreased in supernatants from carotid atherosclerotic plaques compared with healthy arteries. Furthermore, measurement of sTWEAK in plasma showed a reduced concentration in subjects with carotid stenosis compared with healthy subjects. Moreover, sTWEAK concentrations were diminished in asymptomatic subjects in whom intima-media thickness was measured and in subjects with endothelial dysfunction.
These results suggest that sTWEAK could be a potential biomarker of atherosclerosis.
La rotura de la placa aterosclerótica da lugar a diferentes complicaciones cardiovasculares, como el infarto de miocardio o el ictus, los cuales representan la primera causa de muerte en los países occidentales1. La aterogénesis es un proceso complicado caracterizado por el depósito de lípidos en el interior de la pared vascular seguido de una respuesta inflamatoria crónica. Esto da lugar a un remodelado vascular en el cual se encuentran implicados el reclutamiento de células inflamatorias, la proliferación de células del músculo liso, la fibrosis y la neovascularización2. Nuestra hipótesis es que la placa de ateroma propensa a la rotura puede secretar un perfil proteico particular, reflejando directamente los eventos finales que preceden a la rotura, como la proteólisis o la muerte celular. Los niveles de diferentes moléculas inflamatorias se han encontrado aumentados en sujetos con elevado riesgo de desarrollar un evento coronario agudo3,4. Muchos de los biomarcadores que existen actualmente fueron descritos analizando proteínas en el plasma relacionadas con el proceso inflamatorio asociado a la aterosclerosis (p. ej.: proteína C reactiva, ligando de CD40)5.
En este contexto, recientemente TWEAK se ha descrito como un ligando perteneciente a la superfamilia del factor de necrosis tumoral (TNF)6. TWEAK se expresa como una proteína transmembrana tipo II que se puede procesar proteolíticamente para generar su forma soluble7. En la actualidad se desconoce si la forma unida a la membrana plasmática es biológicamente activa, aunque la forma soluble sí da lugar a diferentes respuestas biológicas en células en cultivo, como aumento de la expresión de proteínas quimioatractantes (MCP-1 e IL-88) y MMP-99, o aumento de la activación de factores de transcripción, como NF-kB10, una proteína clave en la regulación de la expresión de genes proinflamatorios. En este sentido, cabe destacar que hemos observado que TWEAK recombinante es capaz de inducir la secreción de MCP-1 en células humanas del músculo liso de la aorta en cultivo11.
Nuestro objetivo ha sido analizar si la forma soluble de TWEAK (sTWEAK) se secreta diferencialmente por placas carotídeas en comparación con arterias sanas. Además, hemos analizado si las concentraciones plasmáticas de sTWEAK pueden variar en sujetos con afectación vascular en comparación con sujetos sanos para conocer si sTWEAK puede ser un nuevo biomarcador de daño vascular.
Materiales y métodosPacientesPacientes con estenosis carotídeaSe incluyeron en el estudio treinta pacientes (estenosis >70%; 22 hombres y 8 mujeres; edad: 62±9 años; el 86%, hipertensos; el 39%, diabéticos; el 54%, hiperlipidémicos) que iban a ser sometidos a endarterectomía carotídea en la Fundación Jiménez Díaz, previo consentimiento informado en todos los casos. El día de la intervención quirúrgica se recogió plasma y muestras de endarterectomía carotídea. Además, como grupo control se incluyeron 28 voluntarios sanos pareados por edad (59±8) y sexo (21 hombres y 7 mujeres). Los estudios fueron aprobados por el comité ético del hospital siguiendo las guías institucionales.
Pacientes asintomáticosLa población de individuos asintomáticos constó de 106 individuos con edades comprendidas entre los 25–78 años de edad. En todos los casos, los pacientes no presentaron enfermedad coronaria o de patologías vasculares periféricas en su historia clínica. Se utilizó también, como criterio de exclusión, la existencia de alteraciones en la función renal, arteritis, desórdenes del tejido conectivo, alcoholismo o el uso de agentes antiinflamatorios no esteroideos en las dos semanas previas a la entrada en el estudio. Se tomó la presión arterial en el antebrazo derecho con ayuda de un esfigmógrafo.
El comité ético aprobó el estudio que fue efectuado siguiendo la Declaración de Helsinki y todos los participantes dieron su consentimiento informado. Todos los sujetos fueron sometidos a una ultrasonografía carotídea para determinar la relación íntima-media (IMT), como se describió previamente12,13. Dos sonógrafos examinaron a todos los sujetos, sin conocimiento de la información clínica.
Pacientes con disfunción endotelialSe incluyeron 200 pacientes con una edad media de 47±11 años a los cuales se les midió la función endotelial. La vasodilatación dependiente del endotelio se midió en la arteria braquial usando un ultrasonógrafo de alta resolución (ATL 5.000 ultrasound system) de 12mHz. El brazo de los sujetos analizados se inmovilizó en posición extendida. Las imágenes del diámetro de la arteria braquial se grabaron en video para el consiguiente análisis ciego. Se infló un torniquete neumático a 200mmHg y después de 5min se desinfló. Trascurridos 60s se midió el flujo. Transcurridos 15min se repitió el análisis. El máximo diámetro de dilatación se calculó como la media de 3 diámetros medidos consecutivamente. La función endotelial se calculó como el porcentaje de cambio entre el diámetro basal y el obtenido tras la prueba. El comité ético aprobó el estudio que fue efectuado siguiendo la Declaración de Helsinki y todos los participantes dieron su consentimiento informado.
Muestras procedentes de remanentes quirúrgicos para cultivo tisularEn colaboración con un grupo de investigación del U698 INSERM (Cardiovascular Remodeling, CHU X-Bichat de París, Francia), se recopilaron muestras residuales procedentes tanto de endarterectomías carotídeas como de arterias mamarias de operaciones de by-pass.
Las placas y los tejidos controles se cortaron e incubaron en medio RPMI libre de proteínas durante 24h. El medio condicionado se recogió y centrifugó y la concentración proteica se determinó mediante el método de Bradford. La secreción atribuida a la necrosis del tejido durante la incubación se determinó mediante la concentración de LDH en el medio condicionado y fue inferior al 10%14.
Técnica de radioinmunoanálisisSe tomaron muestras de sangre venosa de los distintos sujetos. Las muestras de plasma completo fueron almacenadas a −80°C hasta la realización del ensayo. La concentración de sTWEAK fue determinada con 100μl de plasma por duplicado mediante un kit comercial (Bender MedSystems, Viena,Austria). Cada ensayo fue calibrado usando una curva estándar con concentraciones conocidas de TWEAK recombinante. La mínima concentración detectable de TWEAK fue de 10pg/ml. Los coeficientes de variación intraensayo e interensayo fueron del 6,2 y el 8,3%, respectivamente.
Análisis estadísticoLos análisis estadísticos se realizaron mediante el software SPSS para Windows versión 11.0. Los resultados se expresan como la media±desviación estándar o error estándar de la media. Los datos de los ELISA de TWEAK fueron analizados mediante el test U de Mann-Whitney y se expresaron como la mediana y los percentiles 25 y 75. La significación estadística a un nivel del 95% se estableció mediante el empleo de ANOVA y el test t de Student.
ResultadosLa secreción sTWEAK disminuye en sobrenadantes de placas carotídeas en cultivo.
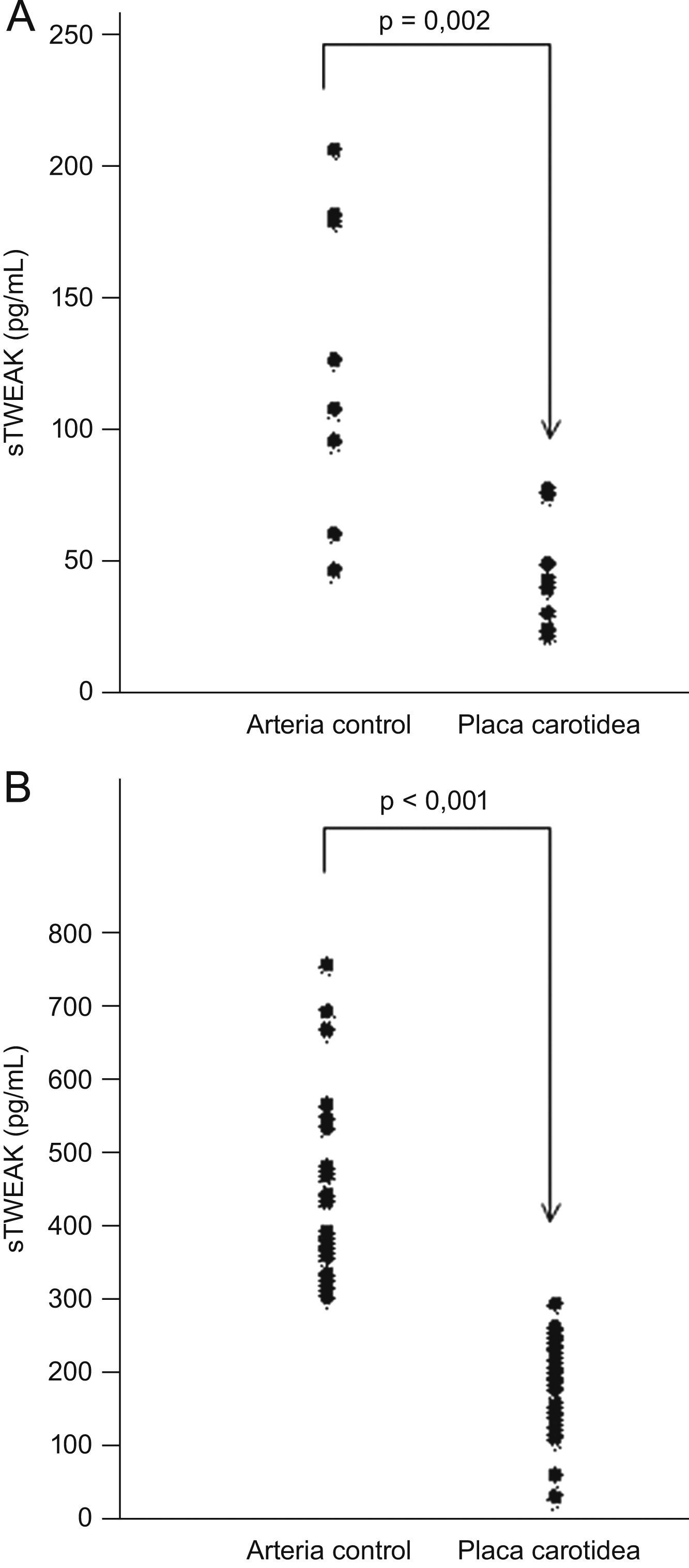
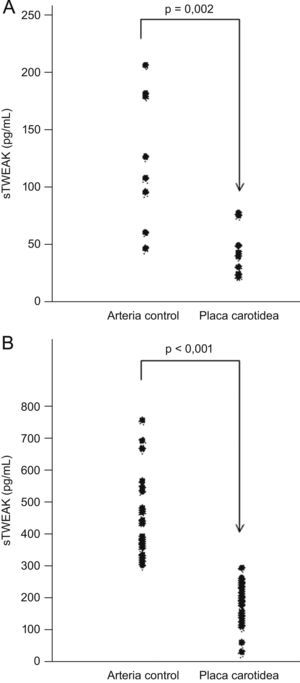
Se realizó la cuantificación de sTWEAK mediante ELISA en medios condicionados procedentes de sobrenadantes de placas carotídeas (n=7) y arterias controles (n=7). Como se observa en la figura 1, las placas ateroscleróticas secretan niveles significativamente inferiores de sTWEAK en comparación con las arterias controles (43,6 [27,8–67,2] vs. 116,9 [96,2–179,5] pg/μg de proteína, respectivamente; p=0,002).
Secreción de TWEAK soluble (sTWEAK) por placas carotídeas y niveles plasmáticos en sujetos con aterosclerosis. A) Técnica de radioinmunoanálisis de sTWEAK en medios condicionados procedentes de arterias mamarias y placas carotídeas (la concentración de sTWEAK se normalizó con la concentración total de proteínas). B) Niveles plasmáticos de sTWEAK en pacientes con aterosclerosis carotídea (n=30) y en sujetos controles (n=28).
Para verificar nuestra hipótesis de que los niveles plasmáticos reflejan la secreción de la pared arterial, se utilizaron muestras de plasma de pacientes con aterosclerosis carotídea (n=30) y de individuos sanos (n=28), pareados por edad y sexo. Se observó que la concentración de sTWEAK en plasma era menor en individuos con aterosclerosis carotídea que en individuos sanos (202,6 vs. 393,24pg/ml, respectivamente; p<0,001) (fig. 1B). Los niveles circulantes de sTWEAK no se vieron afectados por el sexo ni por la edad.
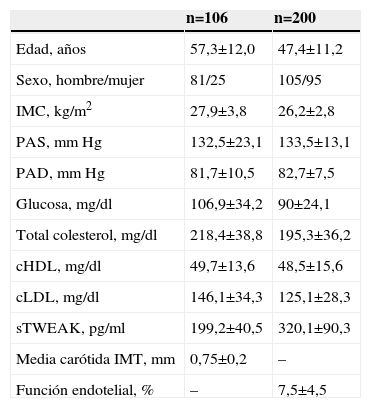
Para validar si sTWEAK puede ser un nuevo biomarcador plasmático de aterosclerosis utilizamos muestras de pacientes en los cuales se habían medido dos marcadores subrogados de aterosclerosis, como son la función endotelial y el IMT. Las características de los sujetos analizados se muestran en la tabla 1.
Características basales de la población estudiada
| n=106 | n=200 | |
| Edad, años | 57,3±12,0 | 47,4±11,2 |
| Sexo, hombre/mujer | 81/25 | 105/95 |
| IMC, kg/m2 | 27,9±3,8 | 26,2±2,8 |
| PAS, mmHg | 132,5±23,1 | 133,5±13,1 |
| PAD, mmHg | 81,7±10,5 | 82,7±7,5 |
| Glucosa, mg/dl | 106,9±34,2 | 90±24,1 |
| Total colesterol, mg/dl | 218,4±38,8 | 195,3±36,2 |
| cHDL, mg/dl | 49,7±13,6 | 48,5±15,6 |
| cLDL, mg/dl | 146,1±34,3 | 125,1±28,3 |
| sTWEAK, pg/ml | 199,2±40,5 | 320,1±90,3 |
| Media carótida IMT, mm | 0,75±0,2 | – |
| Función endotelial, % | – | 7,5±4,5 |
Los valores se expresan como media±DE, número de sujetos y media±SEM (#).
cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; DE: desviación estándar; IMC: índice de masa corporal; IMT: espesor íntima-media; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SEM: error estándar de la media; sTWEAK: TWEAK soluble.
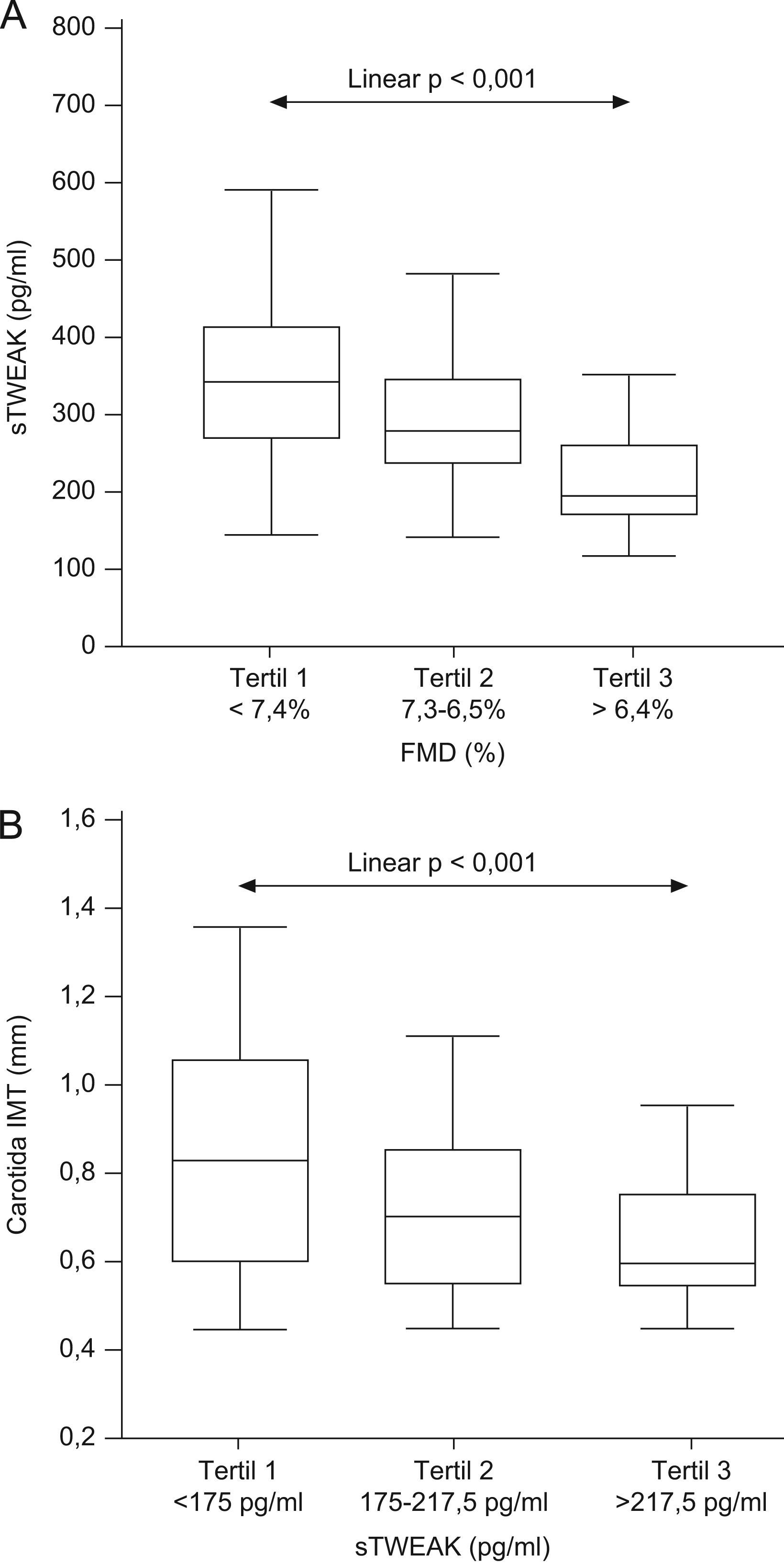
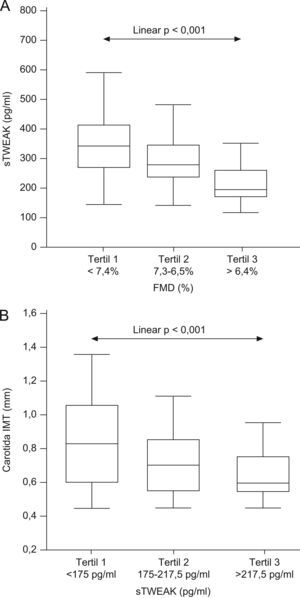
Como muestra la figura 2A, el análisis de la función endotelial y los niveles de sTWEAK en 200 sujetos mostró que cuando se consideraron los tertiles de la FMD se observó una tendencia lineal entre el aumento en la disminución de la función endotelial y el descenso de los niveles de sTWEAK (p<0,001). Mediante análisis multivariable, en el cual se incluyeron parámetros que pueden estar afectando a la función endotelial (edad, sexo, colesterol total, presión arterial, índice HOMA y concentración de proteína C reactiva), observamos que las concentraciones de sTWEAK se asociaron independientemente con la función endotelial (β=0,134; p=0,01).
Niveles plasmáticos de TWEAK soluble (sTWEAK) en los diferentes sujetos analizados. A) Box-plot que muestra la función endotelial en relación con los tertiles de sTWEAK en sujetos asintomáticos. Las cajas representan los percentiles 25 y 75; la línea dentro de la caja representa la mediana. Las barras de error marcan los percentiles 10 y 90. B) Box-plot que muestra el espesor íntima/media en relación con los tertiles de sTWEAK en sujetos asintomáticos. Las cajas representan los percentiles 25 y 75; la línea dentro de la caja representa la mediana. Las barras de error marcan los percentiles 10 y 90.
Para confirmar estos resultados, utilizamos muestras de plasma procedentes de 106 individuos aparentemente sanos, de los que se conocía el IMT, y que no presentaban en su historia clínica casos de enfermedad coronaria o de patología vascular. Cuando se consideraron los tertiles de sTWEAK, se observó una tendencia lineal entre el descenso de sTWEAK y el IMT (p<0,001) (fig. 2B).
Para analizar la posible interferencia en la relación entre el IMT y los niveles de sTWEAK de los factores de riesgo habitualmente empleados en clínica, y de los marcadores de inflamación típicos, se realizó un análisis de regresión múltiple, que permite eliminar el efecto de dichas covariables en la relación entre las dos variables de interés, IMT y sTWEAK. Tras realizar la corrección con dichos factores se observó una asociación independiente significativa entre la relación entre IMT y la concentración plasmática de sTWEAK (β=0,183; p=0,01).
DiscusiónEn este trabajo hemos analizado la concentración de sTWEAK, un nuevo miembro de la superfamilia del TNF, en el secretoma procedente de placas ateroscleróticas carotídeas y se comparó con muestras procedentes de arterias mamarias control. Aunque el uso de arterias carótidas sanas para comparar con carótidas patológicas sería deseable, no fue posible obtener este tipo de muestras. Por este motivo se usaron arterias mamarias como tejido control. Hemos observado cómo sTWEAK se secreta en menor medida por placas carotídeas que en arterias sanas. Además, la misma tendencia se observó al analizar los niveles circulantes de sTWEAK en pacientes con estenosis carotídea comparada con sujetos sanos. Recientemente se ha descrito que TWEAK se expresa en las placas ateroscleróticas humanas9. Sin embargo, en este estudio no se comparó con la expresión de esta proteína en tejido sano. En este sentido, cabe destacar que previamente hemos demostrado que TWEAK se expresa intensamente en arterias mamarias sanas y que su expresión es mayor en comparación con placas11, datos en concordancia con los obtenidos del medio condicionado. Además, TWEAK se expresa en diferentes órganos no patológicos y células, incluidas las células del músculo liso vascular7. También hemos observado cómo los niveles de sTWEAK están disminuidos en pacientes con aterosclerosis carotídea en comparación con sujetos sanos, indicando que la concentración plasmática de sTWEAK podría estar reflejando la secreción por la pared arterial. Además, sTWEAK se asoció a la función endotelial. Como es conocido, la enfermedad cardiovascular se asocia a un endotelio disfuncionante, el cual va a permitir el paso descontrolado de moléculas y células al interior de la pared vascular. El proceso por el cual sTWEAK se relaciona con la función endotelial es desconocido actualmente, pero podría estar relacionado con la expresión de esta proteína en las células endoteliales. Así, la expresión y secreción de otros miembros de la superfamilia del TNF, como el ligando de Fas, se encuentran disminuidas en el endotelio disfuncionante15.
La medida del engrosamiento de la pared de la carótida se considera un índice de aterosclerosis. En diferentes estudios se ha demostrado el valor predictivo del incremento del IMT en el desarrollo de eventos cardiovasculares16. En nuestro estudio hemos observado una correlación negativa entre los niveles de sTWEAK y el IMT en sujetos asintomáticos, indicando que bajos niveles de esta proteína podrían ser un potencial índice de aterosclerosis. En el mismo contexto, la expresión de otros miembros de la superfamilia del TNF se ve afectada en sujetos con alto riesgo cardiovascular.
Aunque estos resultados podrían parecer contradictorios, ya que TWEAK ha sido relacionado con la respuesta inflamatoria, recientemente se ha descrito que, en condiciones normales, TWEAK debe estar implicado en mecanismos de defensa frente al desarrollo de una excesiva respuesta inflamatoria17. Además, también se ha descrito que bajo condiciones proinflamatorias la expresión de TWEAK es disminuida18, lo cual está en concordancia con la observación de que TWEAK se expresa y se secreta en menor cantidad por las lesiones ateroscleróticas. Además, como hemos comentado anteriormente, mientras el ligando de Fas puede participar activamente en el desarrollo de la lesión aterosclerótica19, la concentración plasmática del ligando de Fas soluble está disminuida en pacientes con hiperlipidemia familiar combinada, en sujetos con aterosclerosis carotídea20 o en sujetos con alto riesgo cardiovascular21.
Finalmente, es importante tener en cuenta que TWEAK puede estar relacionada con diferentes situaciones patológicas, como cáncer22 o enfermedades inmunes23 y, por lo tanto, el estudio de las concentraciones plasmáticas de sTWEAK en diferentes patologías podría proporcionar una importante información acerca de la especificidad de sTWEAK como marcador de aterosclerosis subclínica.
En conclusión, hemos observado que sTWEAK se secreta en menor cantidad por arterias sanas con respecto a placas ateroscleróticas. Además, la concentración plasmática de sTWEAK fue menor en sujetos con aterosclerosis carotídea en comparación con sujetos sanos. Finalmente, sTWEAK se correlaciona negativamente en sujetos en los cuales el espesor íntima/media o la función endotelial se había medido, indicando que esta proteína puede ser un nuevo biomarcador de aterosclerosis subclínica.
FinanciaciónEste trabajo ha sido financiado por el Fondo de Investigaciones Sanitarias (CP04/00060; PI021047), Ministerio de Ciencia e Inovación (SAF 2007/60896) y por una beca FEA de la Sociedad Española de Arteriosclerosis (SEA), 2005, para Investigación Básica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha recibido una Nominación Especial en el XIX Congreso Nacional SEA (Santander, 2006).