Existe una asociación entre el síndrome metabólico (SM) y el lupus eritematoso sistémico (LES). Los ratones hembra New-Zealand Black-White de primera generación (BWF1) constituyen un modelo de LES humano y presentan características del SM. Hemos estudiado en este modelo la evolución temporal del SM y marcadores de LES, y su relación con la proporción de células T reguladoras (Tregs).
MétodosTreinta y dos ratones hembra New-Zealand White (control) y 32 ratones hembra BWF1 (grupo LES) se estudiaron durante 28 semanas, determinando el consumo de dieta y el peso corporal. Los animales se sacrificaron a las 8, 16, 24 y 36 semanas de vida, determinando: el peso de tejido adiposo visceral, la proporción de células CD4+, CD4+CD25+ y Tregs en linfocitos esplénicos, concentraciones plasmáticas y hepáticas de triglicéridos, concentraciones plasmáticas de glucosa, insulina, leptina, anticuerpos anti-dsDNA y creatinina.
ResultadosLos ratones LES presentaron, hasta las 16 semanas de vida, signos de alteraciones metabólicas, como hiperfagia, hiperleptinemia y un peso superior a los ratones control, asociado al incremento en la masa de tejido adiposo visceral, así como una mayor proporción de células Treg. A partir de las 16–24 semanas de vida, se produjo un cambio drástico, con un incremento en los niveles plasmáticos de anticuerpos anti-dsDNA, que coincidió con la desaparición de las manifestaciones de SM.
ConclusionesLa presencia de resistencia a la leptina en las primeras semanas de vida explicaría no solo la mayor ingesta de alimento presentada por los ratones LES, sino también la mayor proporción de células Tregs.
There is an association between metabolic syndrome (MS) and systemic lupus erythematosus (SLE). Female New-Zealand Black-White first generation (BWF1) mouse is an established model of human SLE, also showing MS characteristics. We studied in this model the temporal evolution of MS and SLE markers, and their relationship with the proportion of regulatory T cells (Tregs).
Methods32 female mice New-Zealand White (control) and 32 female mice BWF1 (SLE group) were studied during 28 weeks, determining solid food consumption and body weight. At week 8, 16, 24 and 32, animals were sacrificed, to determine: the weight of visceral adipose tissue, the proportion of CD4+, CD4+CD25+ and Tregs cells in splenic lymphocytes, the liver and plasma triglyceride concentrations, and the plasma concentrations of glucose, insulin, leptin, anti-dsDNA antibodies, and creatinin.
ResultsSLE mice showed, until the age of 16 weeks, signs of metabolic alterations such as hyperphagia, hyperleptinaemia, and an increased body weight, related to a high amount of visceral adipose tissue, as well as an increased proportion of Tregs cells. From the week 16 on, a drastic change ensued, with an increase in the plasma concentration of anti-dsDNA antibodies, matching the disappearance of MS signs.
ConclusionThe presence of leptin resistance during the first few weeks of life could explain not only the high consumption of solid diet presented by SLE mice, but also the increase in the proportion of Tregs cells.
A partir de la segunda mitad del pasado siglo se ha producido un crecimiento sostenido de la prevalencia en la población mundial de dos patologías aparentemente no relacionadas, el síndrome metabólico (SM) y las enfermedades autoinmunes, especialmente en las sociedades adaptadas al tipo de vida occidental o «Western»1–5. Esta situación ha coincidido con cambios drásticos en el estilo de vida, que han consistido en la adopción de forma masiva de un estilo de vida sedentario asociado al consumo de dietas hipercalóricas, con un balance energético positivo en la mayoría de la población6,7.
Dichos cambios en el estilo de vida constituyen de forma clara un factor de riesgo que predispone a la aparición de enfermedades metabólicas (obesidad, resistencia a la insulina, SM, etc.) y sus manifestaciones cardiovasculares7,8. Sin embargo, si exceptuamos el incremento en la concentración de polucionantes químicos en el medio ambiente de nuestras áreas urbanas, no se conoce hasta el momento un factor o factores de riesgo asociados al incremento de prevalencia de las enfermedades autoinmunes.
El SM y la obesidad abdominal se asocian a un conjunto de alteraciones metabólicas (como la intolerancia a la glucosa, la dislipemia y la hipertensión), que, conjuntamente, se traducen en un marcado incremento en el riesgo de padecer una enfermedad cardiovascular4,9,10. Mientras que en los últimos 25 años la prevalencia de los denominados factores de riesgo cardiovascular tradicionales (tabaquismo, dislipemia, etc.) ha disminuido de forma gradual, la prevalencia de obesidad, SM y diabetes mellitus se ha incrementado dramáticamente5.
El lupus eritematoso sistémico (LES) es una de las enfermedades autoinmunes más heterogéneas y que afecta a multitud de órganos, presentando una altísima prevalencia en Italia, España, Martinica y en la población afrocaribeña del Reino Unido1. El LES progresa a través de cuatro fases: 1. presencia de autoanticuerpos contra una gran variedad de autoantígenos de naturaleza ubicua; 2. deposición de los autoanticuerpos y de complejos inmunes en los tejidos; 3. desarrollo de inflamación tisular y, finalmente, 4. daño tisular y fibrosis. Existe una marcada predominancia del sexo femenino en el LES, con relaciones mujer/hombre entre 9:1 y 13:1.
Los pacientes con LES presentan una probabilidad de padecer un suceso cardiovascular significativo de cinco a seis veces superior a la población general11,12. Comparando las relaciones de sucesos cardiovasculares en el Framingham Offspring Study, se detectó un riesgo más de 50 veces superior de padecer un infarto de miocardio en pacientes con LES de una cohorte de Pittsburgh con edades comprendidas entre los 35 y los 44 años13. Estudios epidemiológicos señalan una posible asociación entre el SM y el LES, e indican que factores de riesgo aterosclerótico tradicionales, asociados en el SM, como la hipertensión, la resistencia a la insulina, la esteatosis hepática, la diabetes mellitus y la obesidad, juegan un papel determinante en el desarrollo de aterosclerosis prematura en los pacientes con LES14,15. Aunque existe evidencia epidemilógica que relaciona la obesidad con un incremento en el riesgo de padecer enfermedades autoinmunes16, se desconoce, por el momento, si existen vías moleculares comunes entre ambas patologías.
El ratón New Zealand Black (NZB) se caracteriza por presentar síntomas moderados de LES. La progenie (F1) de primera generación del cruce entre ratones NZB y ratones no autoinmunes New Zealand White (NZW), denominada BWF1, manifiesta una aparición temprana y una elevada incidencia de LES. En esta cepa, el LES murino presenta numerosas características similares a la enfermedad humana, incluyendo un origen genético complejo, una mayor incidencia en hembras, aparición de glomerulonefritis por inmunocomplejos y presencia de anticuerpos antinucleares17. En un artículo seminal publicado por Ryan et al en 200618, se demuestra que los ratones BWF1, al igual que en humanos y en asociación con la manifestación de la nefritis por LES, presentan características típicas del SM, como hipertensión, obesidad visceral, resistencia a la insulina, esteatosis hepática e hiperleptinemia.
La leptina es una hormona adipocitaria cuya concentración sérica es proporcional a la masa grasa corporal. La leptina presenta múltiples efectos en el control de la ingestión de alimentos y en la homeostasis energética, así como en la regulación de la respuesta inmune. Las concentraciones de leptina, tanto plasmática como en los focos inflamatorios, se encuentran anormalmente reducidas en los procesos infecciosos, mientras que la situación contraria, concentraciones anormalmente elevadas, aparece en los procesos autoinmunes19. Desde hace tiempo se conocen los efectos de la leptina en la promoción de las respuestas inmunes por células T cooperadoras de tipo 1 (Th1) y de inmunidad celular. Recientemente se ha descrito que la leptina reduce la proliferación de las células T reguladoras (Tregs)20–22. Las células Tregs que aparecen en condiciones fisiológicas (o células T que expresan CD4, CD25 y FoxP3 –Tregs CD4+CD25+FoxP3+-) mantienen de forma activa la autotolerancia inmunológica, de forma que su déficit o disfunción puede acarrear la aparición de enfermedad autoinmune23. Por lo tanto, los efectos inmunológicos descritos para la leptina pueden promover la aparición de patologías autoinmunes, incluyendo el LES23 y la aterosclerosis24.
En el presente estudio se realiza un seguimiento temporal, durante 28 semanas, de la evolución de parámetros relacionados con el síndrome metabólico (concentraciones plasmáticas y hepáticas de triglicéridos, concentraciones plasmáticas de glucosa, insulina y leptina, etc.), así como de marcadores de LES (concentraciones plasmáticas de anticuerpos ant-DNA, creatinina, etc.), y su posible correlación con la proporción de células Tregs, en un modelo murino de LES, el ratón New Zealand BWF1 hembra.
Material y métodosAnimales y diseño experimentalPara este estudio, se utilizaron ratones hembra BWF1, propensos al lupus eritematoso sistémico (LES), y ratones hembra progenitores New Zealand White (W), que no desarrollan LES de forma evidente, como control. Los animales se mantuvieron, cuatro por jaula, en las condiciones habituales, con comida y agua ad libitum, en las instalaciones del estabulario de la Facultad de Farmacia de Barcelona, desde las cuatro a las 36 semanas de vida. Semanalmente se determinaron el consumo de dieta y el peso corporal. Grupos de 8 animales LES y W se sacrificaron a las 8, 16, 24 y 36 semanas de vida. Estos puntos temporales corresponden, según Alperovich et al25 a: ausencia de ninguna manifestación clínica de LES (8 semanas), aparición de anticuerpos anti dsDNA en plasma (16 semanas), inicio de las alteraciones funcionales renales (24 semanas) y aparición de lesión renal manifiesta, asociada al LES y detectable de forma histológica (36 semanas). En el momento del sacrificio, se obtuvieron muestras de sangre y bazo para las valoraciones correspondientes.
Todo el proceso se realizó de acuerdo con la guía establecida por el Comité de Bioética de la Universitat de Barcelona, según se indica en la Ley (5/1995) (21 julio) de la Generalitat de Catalunya.
Análisis de parámetros plasmáticosLos valores plasmáticos de triglicéridos, glucosa y creatinina se midieron mediante el ensayo colorimétrico de SPINREACT (Sant Esteve d'en Bas, Girona, España) (referencia 1001312, 1001192, K-4001, respectivamente). Los NEFA se determinaron mediante el ensayo colorimétrico de WAKO Chemicals GMBH (Neuss, Alemania). Los niveles de leptina y insulina se determinaron con el kit RL-83K RIA y RI-13K RIA, respectivamente, ambos de Linco Research (Missouri, Estados Unidos). La valoración de los anticuerpos anti-ds-DNA se realizó mediante un kit de Elisa de Alpha Diagnostic Internacional, referencia 5110 (Madrid, España).
Valoración de proteinuriaA partir de muestras de orina de los animales se determinaron los niveles de proteinuria mediante las tiras reactivas del kit AlbustixR de los laboratorios Bayer.
Aislamiento de linfocitosPara el aislamiento de los linfocitos se lavóel bazo con PBS-FBS10% con antibiótico al 1% en el momento de la extracción. Tras disgregar el tejido usando una malla estéril de 40 mesh con PBS-FBS10%, se recogió el filtrado en un tubo nuevo y se centrifugó a 538×g 10min a 4°C. Se descartó el sobrenadante. Para evitar posibles interferencias de los eritrocitos en la citometría se sometió el sedimento celular a choque osmótico, resuspendiendo el pellet con 1ml de PBS1X y añadiendo a continuación 8ml de agua destilada y se agitó por inversión 3 veces. Con el objetivo de restaurar la tonicidad se añadió 1ml de PBS10X, se agitó por inversión 5 veces y se centrifugó a 538×g durante 10min a 4°C. El sedimento celular se resuspendió con PBS-FBS10% y se procedió al recuento celular.
Marcaje de linfocitos para citometría de flujo500.000 células/tubo se repartieron en tubos FACS con 1ml de PBS- FBS 2%-NaN3 1% frío y se resuspendieron mediante agitación manual suave. Se centrifugaron a 538×g 5min a 4°C, descartándose el sobrenadante por decantación. Se añadieron 10μl de cada uno de los anticuerpos unidos a fluorocromo previamente diluidos (anti-CD4 ratón conjugado con PE, anti-CD25 ratón conjugado con FITC y el anticuerpo usado como control negativo anti-CD7 humano de eBiosciences [París, Francia]). Se agitó la mezcla enérgicamente y se incubó a 4°C durante 20min. Tras un lavado con 1ml de PBS frío, se centrifugó y descartó el sobrenadante. Con la finalidad de permeabilizar las células se añadió 1ml de solución fijadora/permeabilizadora 1X (eBioscience Ref. 00-5521 [París, Francia]) y se incubó a 4°C 30min. Tras lavar con 1ml de solución permeabilizadora 1X se añadieron 15μl del anticuerpo anti-foxp3 ratón/rata conjugado con APC (diluido previamente con solución permeabilizadora). Se incubó la mezcla un mínimo de 30min a 4°C. Se realizaron 2 lavados adicionales con la misma solución permeabilizadora 1X y se fijaron las células con 500μl de solución fijadora de p-formaldehído (0,5%) (P-formaldehído 2,5g, NaCl 4,2g y agua destilada c.s.p 500ml). Finalmente, se resuspendieron con la ayuda de un vórtex. Se mantuvieron las muestras a 4°C bajo condiciones de total oscuridad hasta su lectura en citómetro de flujo. Todas las incubaciones realizadas durante el experimento se realizaron protegiendo las muestras de la luz. Para este estudio se incluyeron también controles positivos de cada uno de los anticuerpos marcados con fluorocromo.
β-oxidación de los ácidos grasosLa actividad hepática de β-oxidación de ácidos grasos se determinó según el método descrito previamente26, utilizando 30μg de sobrenadante postnuclear de hígado de ratón como muestra.
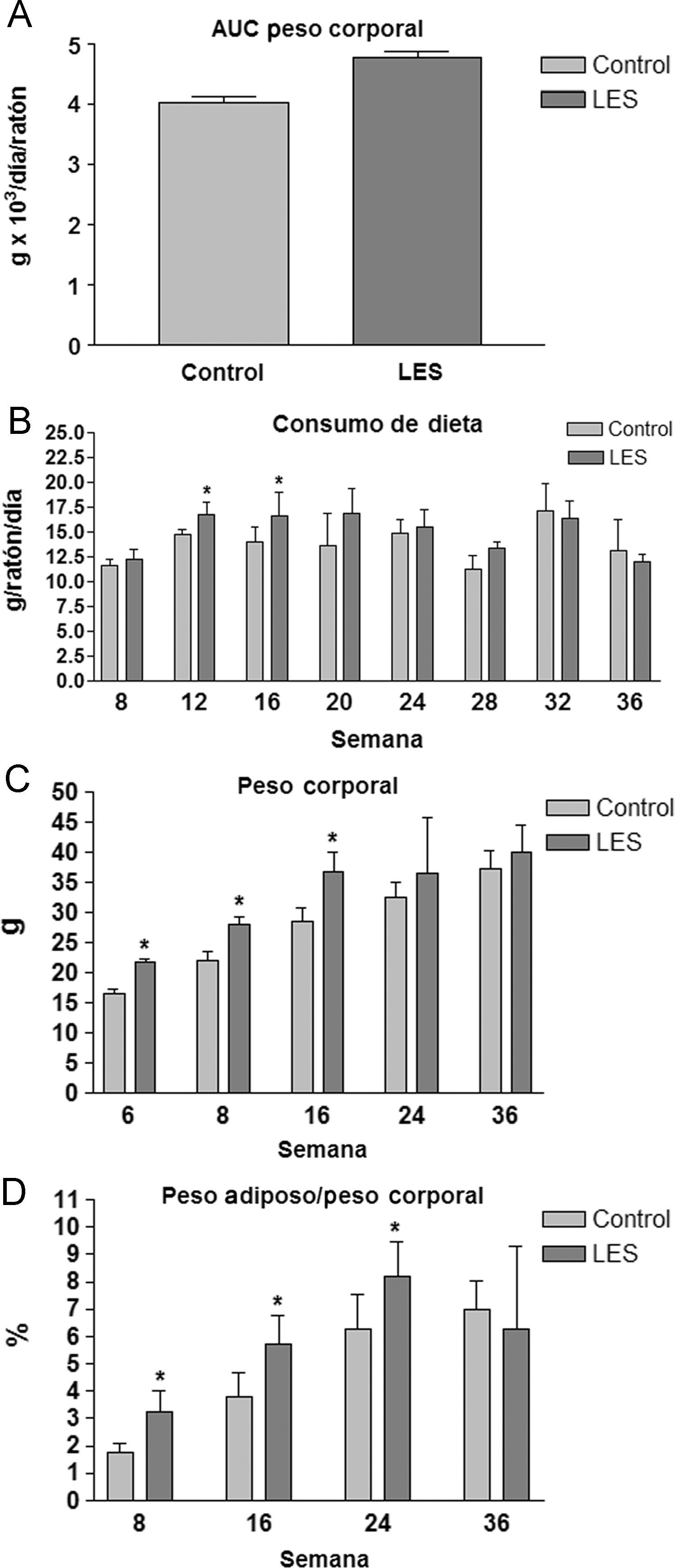
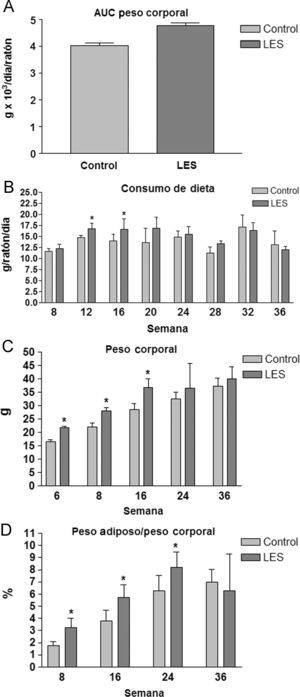
ResultadosParámetros organométricosTanto los ratones hembra NZW control, como los ratones hembra BWF1 (LES) presentaron un aspecto saludable durante el estudio, sin que se produjera ninguna muerte inesperada o fuera necesario eutanizar a ninguno de los animales. Los ratones LES presentaron un peso corporal superior (18%, fig. 1A) y una ingesta de dieta sólida similar respecto a los ratones control, excepto en el período comprendido entre el inicio del estudio y la semana 16, en el que, de promedio, ingirieron un 18% más (fig. 1B) de dieta sólida. Igualmente, durante este período fue más manifiesta la diferencia de peso entre los ratones LES y control (fig. 1C). La relación entre el peso del tejido adiposo visceral y el peso corporal fue superior en los ratones LES, aunque disminuyó de forma progresiva a lo largo del período de estudio, desde un 83% de incremento a las 8 semanas, hasta un 17% de incremento a las 24 semanas, sin que se apreciara ninguna diferencia en dicho parámetro a las 36 semanas de estudio (fig. 1D).
Área bajo la curva del peso corporal (A) y valores de consumo de dieta (B), peso corporal (C) y porcentaje de tejido adiposo visceral respecto al peso corporal (D) durante las semanas de estudio para los ratones control y con lupus eritematoso sistémico (LES). Los datos se expresan como media±ds para una n=8, como mínimo.
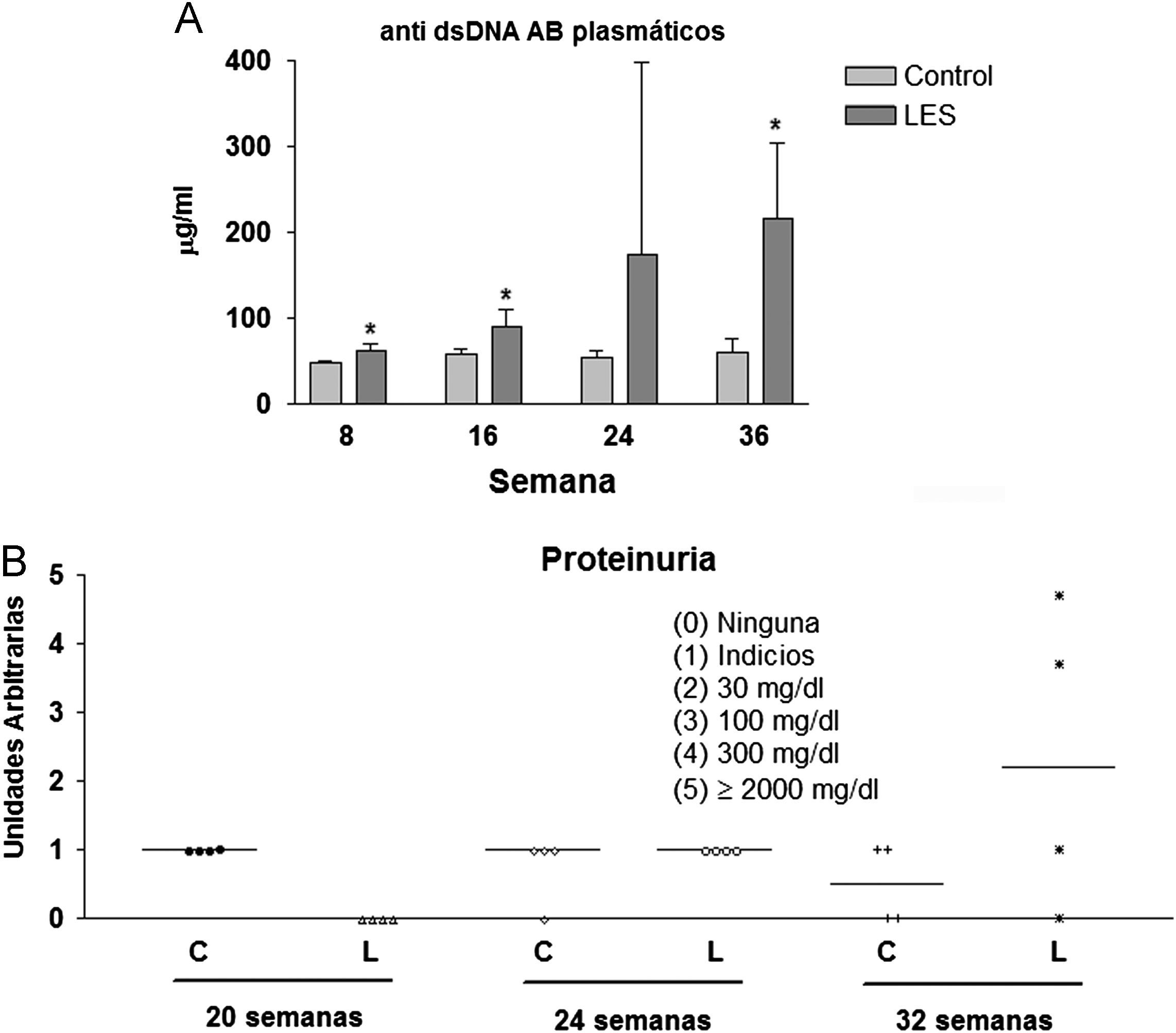
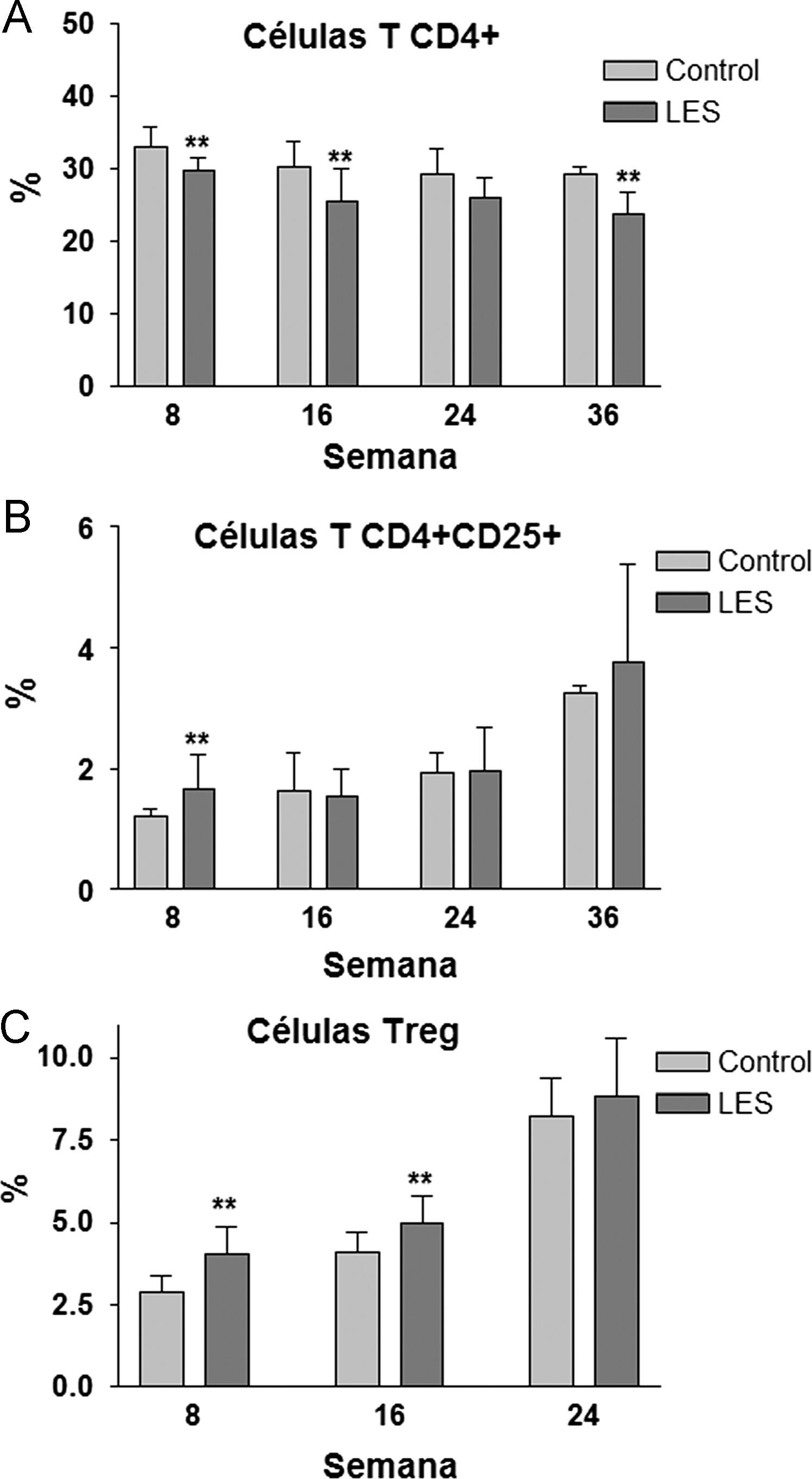
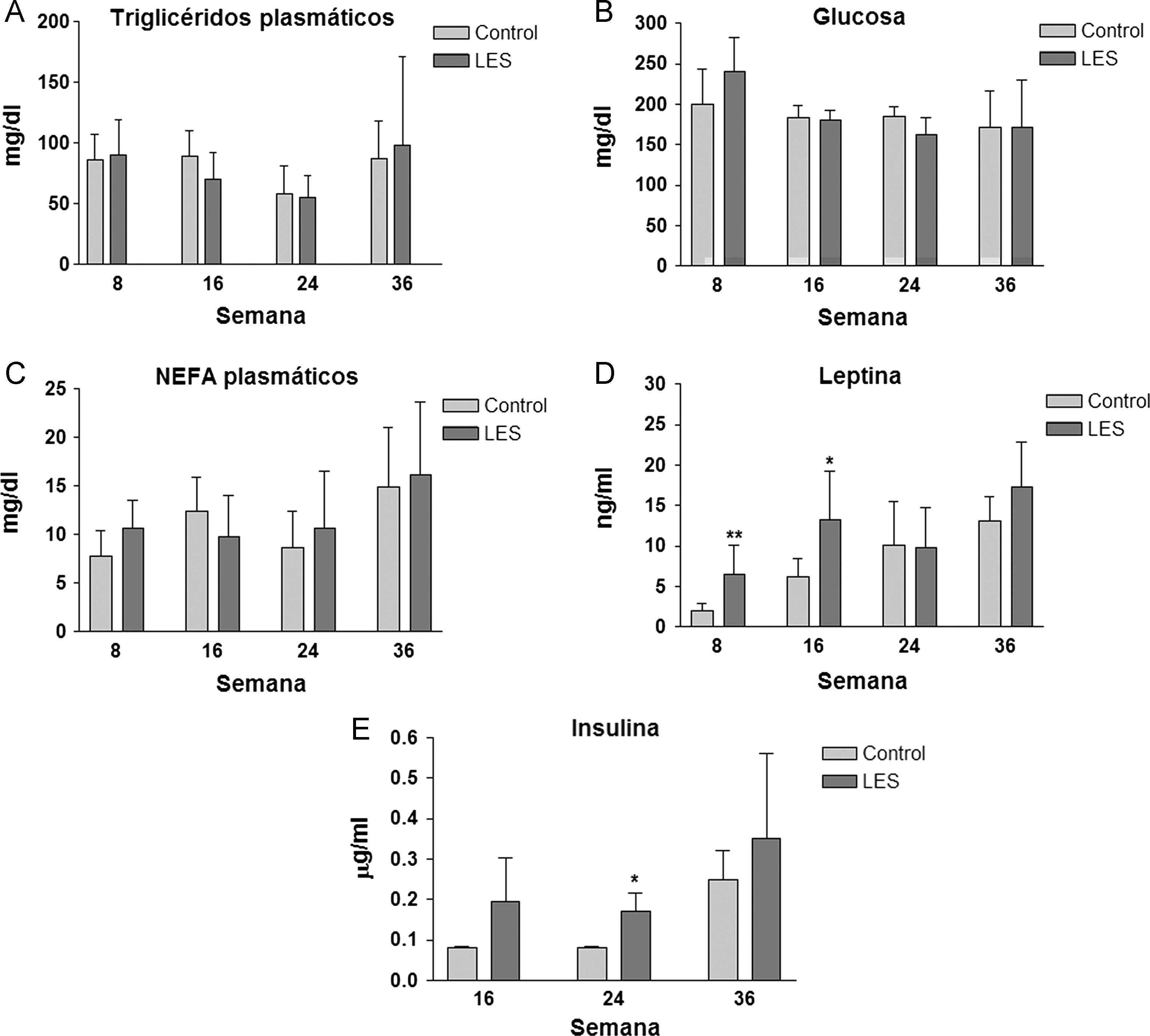
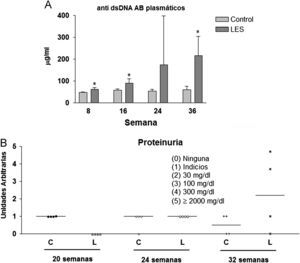
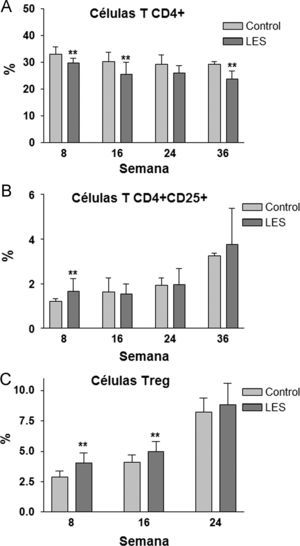
Aunque las concentraciones plasmáticas de creatinina no se modificaron significativamente a lo largo del estudio (datos no mostrados), sí que se incrementó de forma progresiva la presencia de anticuerpos anti-dsDNA en la sangre de los ratones LES, pasando desde un incremento del 30% en la semana 8, a más de 3,5 veces el valor presentado por los ratones control a las 36 semanas de estudio (fig. 2A). La proteinuria a las 24h se evaluó en los tres últimos meses previos al sacrificio de los animales, presentando claros signos de proteinuria los ratones LES a las 32 semanas de vida (fig. 2B). Los ratones LES presentaron durante todo el estudio, una reducción de entre el 10 y el 19% en el porcentaje de células T CD4+ en linfocitos esplénicos (fig. 3A). Por el contrario, el porcentaje de células T CD4+CD25+ solo se vio modificado a las 8 semanas de edad, con un incremento del 40% en los ratones LES (fig. 3B). Igualmente, el porcentaje de células Treg (CD4+CD25+FoxP3) se vio incrementado en los ratones LES a las 8 (40%) y 16 (21%) semanas de vida (fig. 3C).
(A) Concentraciones plasmáticas de anticuerpos anti-dsDNA en ratones control y con lupus eritematoso sistémico (LES), expresadas como media±ds para una n=8 en las diferentes semanas de estudio. (B) Valores individuales de proteinuria en 24h presentada por ratones control (C) y con lupus eritematoso sistémico (L) a las correspondientes semanas de estudio.
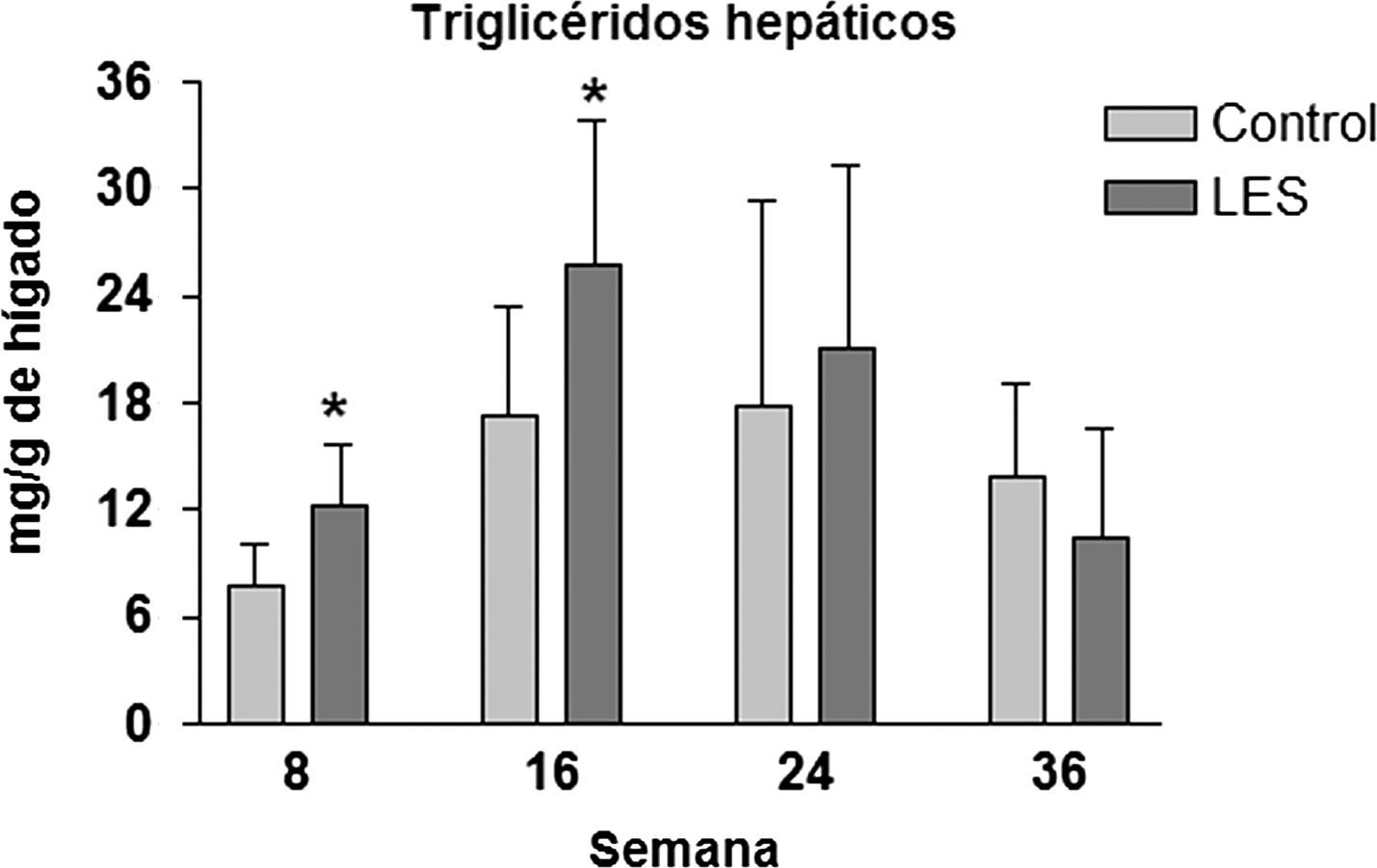
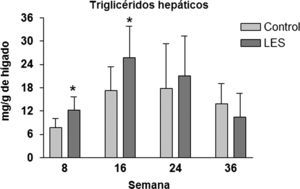
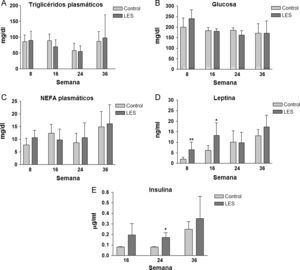
Los ratones LES presentaron esteatosis hepática hasta las 16 semanas de vida (×1,5 respecto a los ratones control), igualándose posteriormente los valores de triglicéridos hepáticos a los presentados por los ratones control (fig. 4). La esteatosis hepática no se acompañó de ninguna modificación en la actividad de β-oxidación de ácidos grasos (datos no mostrados). Del conjunto de parámetros plasmáticos evaluados, triglicéridos, glucosa, ácidos grasos libres, leptina e insulina, únicamente estas dos hormonas vieron modificadas sus concentraciones a lo largo del estudio. En concreto, los ratones LES presentaron hiperleptinemia a las 8 (×3,1) y 16 (×2,1) semanas de vida (fig. 5D), respecto a los ratones control, mostrando igualmente los ratones LES una tendencia a la hiperinsulinemia que solo fue significativa a las 24 semanas de vida (×2,1) (fig. 5E).
Los ratones LES presentaron, hasta aproximadamente la mitad de tiempo estudiado (16 semanas de vida), claros signos de alteraciones metabólicas, como hiperfagia, hiperleptinemia, y un peso superior a los ratones control, probablemente asociado al incremento paralelo en la masa de tejido adiposo visceral. Durante este período de tiempo, los niveles de anticuerpos anti-dsDNA se mantuvieron moderadamente elevados. Durante el período comprendido entre las 16 y las 24 semanas de vida, se produjo un cambio drástico, con un marcado incremento en los niveles plasmáticos de anticuerpos anti-dsDNA, que coincidió con la práctica desaparición de la totalidad de signos relacionados con alteraciones metabólicas.
En un estudio similar, realizado también en ratones BWF1, Alperovich et al25 indican una supervivencia a las 36 semanas de vida del 69%, presentando una elevación consistente de los anticuerpos anti-dsDNA en plasma a partir de las 20 semanas de vida y de la proteinuria a partir de las 28 semanas. Desconocemos la razón subyacente a la diferente evolución de la gravedad de la nefropatía entre este estudio y el nuestro, en el que la supervivencia fue del 100% a las 36 semanas de vida, apareciendo anticuerpos anti-dsDNA elevados en plasma y proteinuria a partir de las 24 y las 32 semanas de vida, respectivamente. En cualquier caso, el deterioro progresivo del estado de salud de los ratones LES en la segunda parte del estudio podría ser la causa de la desaparición de todas las alteraciones metabólicas detectadas al inicio del mismo, como el incremento en el consumo de dieta, en tejido adiposo visceral o en leptina plasmática. Igualmente, parece evidente que en este modelo, el ratón BWF1, las alteraciones metabólicas preceden temporalmente a las manifestaciones clínicas de LES.
Ya se ha indicado previamente que la leptina reduce la proliferación de las células Tregs, promoviendo la aparición de patologías autoinmunes, como el propio LES23 o la arteriosclerosis24; así, por ejemplo, Taleb et al27 han demostrado recientemente que un déficit de señalización de la leptina promueve la respuesta inmune mediada por células Tregs y previene la aparición de arteriosclerosis en un modelo murino. Por ello, resulta aparentemente contradictorio que, en nuestro estudio, coincidan temporalmente la hiperleptinemia plasmática y una mayor proporción de células Tregs esplenocíticas cuando, según la información conocida, la hiperleptinemia tendría que asociarse a una reducción en las células Tregs. No parece probable un error en la determinación citométrica de las células Tregs, dado que recientemente, Scanglione et al28, utilizando el mismo modelo animal de LES, también han detectado un incremento en la proporción de células Tregs circulantes.
Al igual que sucede con la vía de señalización de la insulina, se ha detectado la presencia de resistencia a la leptina, tanto en humanos como en modelos experimentales en roedores29. El fenómeno de resistencia a la leptina se produce tanto a nivel del sistema nervioso central, como a nivel de tejidos periféricos, como el hígado30. Aunque en el estudio de Ryan et al18 la hiperleptinemia presentada por los ratones BWF1 no se asociaba a resistencia a la leptina a nivel central, los datos presentados no están en contradicción con la existencia de resistencia a la leptina a nivel de tejidos periféricos y, entre ellos, los linfocitos T. Asumiendo esta posibilidad, la resistencia a los efectos de la leptina explicarían no solo la mayor ingesta de alimento presentada por los ratones LES, sino también la mayor proporción de células Tregs. En este sentido, las alteraciones metabólicas no solo precederían la manifestación de la sintomatología clínica del LES, sino que retardarían o enlentecerían su aparición. Variaciones en el grado de resistencia a la leptina entre distintas cepas de ratones BWF1 explicarían las diferencias en la evolución temporal de las manifestaciones clínicas de LES.
FinanciaciónEste trabajo ha sido realizado gracias a la ayuda económica proporcionada por la FPCNL (Fundació Privada Catalana de Nutrició i Lípids), el proyecto CENIT-GENIUSPHARMA y una Beca para Investigación Básica de la Sociedad Española de Arteriosclerosis (SEA), convocatoria 2009.
Contribución de autoríaE. Baroso, L. Vila y N. Roglans contribuyeron a la obtención de los resultados experimentales del presente estudio. El diseño del mismo, la interpretación de los resultados y la redacción de este manuscrito fueron realizados por J.C. Laguna. N. Roglans contribuyó a la revisión del presente manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.