La hipertensión portal se caracteriza por un aumento de la presión venosa portal como resultado de la obstrucción del flujo sanguíneo portal. Una de las consecuencias de dicha obstrucción es el desarrollo de circulación colateral, la cual deriva una parte importante del flujo portal a la circulación sistémica. Entre las diferentes complicaciones que se asocian a la hipertensión portal en la rata destaca la esteatosis hepática, que a su vez se asocia a diferentes factores de riesgo como la obesidad, la diabetes, la hipercolesterolemia y la hipertrigliceridemia. Diversos mecanismos como la resistencia a la insulina, la liberación de citoquinas y el estrés oxidativo participan en el desarrollo de esta patología. El modelo experimental de hipertensión portal en la rata por triple ligadura parcial de la vena porta permite estudiar las complicaciones que se producen tanto a corto plazo o agudas, como a largo plazo o crónicas. La mayoría de las alteraciones esplácnicas y sistémicas que se producen en este modelo experimental son de naturaleza inflamatoria, y por esta razón el estudio de los mecanismos fisiopatológicos implicados tiene gran interés para la investigación de nuevas terapias antiinflamatorias.
Portal hypertension (PH) is characterised by increase in portal venous pressure by obstruction of portal flow. As a consequence of PH, a collateral circulation is developed, which shifts an important part of portal flow to the systemic circulation. Furthermore, hepatic steatosis is another feature of PH in the rat, which is also, associated which different risk factors such as, obesity, diabetes, hypercholesterolemia and hypertrygliceridemia. Several mechanisms such as insulin resistance, cytokine production and oxidative stress participate in the development of this clinical pathology. An experimental model of pre-hepatic portal hypertension by triple partial portal vein ligation enables complications produced both short-term or acute and long-term or chronic outcome to be studied. Most of the splanchnic and systemic alterations produced in this experimental model are of an inflammatory nature, and for this reason the study of the physiological mechanisms involved are of great interest to the research of new anti-inflammatory therapies.
La hipertensión portal (HP) es una complicación frecuente y grave de la cirrosis, e incluye síntomas como las varices esofágico-gástricas, la encefalopatía hepática, la ascitis y el síndrome hepatorrenal1.
La HP se define como un incremento de la presión sanguínea portal y se mide mediante el gradiente de presión venosa hepática o por la diferencia de presión entre la vena porta y la vena cava inferior1,2.
Para el estudio experimental de la HP, el modelo empleado con más frecuencia consiste en la ligadura parcial de la vena porta (LVP) en la rata3,4, ya que dicho modelo produce el menor grado de insuficiencia hepática o de lesión hepática. Así, este modelo permite un estudio más selectivo de las alteraciones relacionadas exclusivamente con la HP4,5.
Tanto en ratas con HP prehepática como en los pacientes cirróticos, el aumento de la resistencia en la vascularización hepática es el episodio primario que causa la HP(backward hypothesis), la cual se agrava posteriormente por el aumento del flujo portal secundario a la circulación hiperdinámica esplácnica2,6–9.
Entre las alteraciones esplácnicas y sistémicas relacionadas con la HP destaca la circulación hiperdinámica. Esta circulación hiperactiva ha sido atribuida principalmente a dos mecanismos: el aumento de factores vasodilatadores circulantes y la disminución de la respuesta a los vasoconstrictores7–10. Los factores vasodilatadores implicados incluyen el óxido nítrico (NO), el monóxido de carbono (CO), el factor de necrosis tumoral alfa (TNF-α), el glucagón, la prostaciclina (PGI2), el factor hiperpolarizante derivado del endotelio, los endocanabinoides, la adrenomedulina y el sulfuro de hidrógeno (H2S)9,10. A su vez, la hiporreactividad a los vasoconstrictores endógenos (norepinefrina, angiotensina II [AT-II], endotelina, vasopresina) o exógenos (alfa-agonistas) refleja la reducción de la respuesta vasoconstrictora, que contribuye a la vasodilatación9,10.
En contraste con la hiperactividad de la circulación esplácnica y sistémica, la circulación hepática es hipoactiva, con una reducida vasodilatación y un incremento del tono vascular10,11. La consecuencia de este desequilibrio vasorregulador es el desarrollo de HP12.
Desequilibrio vascular relacionado con la inflamación en la hipertensión portalLa LVP en la rata es el modelo experimental más frecuentemente utilizado para el estudio a corto plazo de la fisiopatología de la HP prehepática3,4. Una simple constricción de la vena porta es inmediatamente seguida de un incremento en la resistencia y presión portal, así como de una disminución de la entrada de flujo venoso portal3,6. A los cuatro días de la LVP se produce el desarrollo parcial de colaterales portosistémicas y, después de dos semanas de evolución, la mayor parte (95%) del flujo sanguíneo portal aumentado es desviada del hígado por una extensa red de vasos colaterales6. En este momento, la resistencia al flujo portal disminuye hasta valores control y el flujo sanguíneo esplácnico, secundario a una disminución de la resistencia esplácnica arteriolar, aumenta, contribuyendo todo ello a un incremento de la presión portal13.
Por lo tanto, hasta la actualidad la HP prehepática en la rata había sido siempre considerada como un deterioro hemodinámico con alteraciones mucho más homogéneas de las que se habían descrito en la HP humana, en particular respecto de su limitada variación del grado de HP, del desarrollo de colaterales portosistémicas y de la atrofia hepática14. Sin embargo, esta uniformidad evolutiva no ha podido ser verificada por nuestros estudios previos, en los cuales, utilizando una técnica modificada de estenosis calibrada de la vena porta en la rata, tanto el grado de atrofia hepática como la esplenomegalia y la circulación colateral portosistémica que se desarrollaban eran muy variables5.
En esta técnica modificada, la resistencia inicial al flujo sanguíneo portal fue aumentada alargando la longitud del tracto portal estenosado al realizar tres ligaduras parciales equidistantes15. Ya que se ha sugerido que el incremento inicial de la presión portal producida por la estenosis de la vena porta en la rata podría tener un efecto permanente en la evolución de la HP16, el incremento en la resistencia inicial producido por la triple ligadura parcial de la vena porta (TLVP) respecto de la ligadura parcial simple podría tener un efecto negativo en esta evolución y, de este modo, incrementar la intensidad de las complicaciones15.
La variabilidad del modelo experimental de HP por TLVP no se ha observado solo en su evolución a corto plazo (14-28 días), que es el aspecto más estudiado, sino que también se ha comprobado en estadios evolutivos crónicos (de 6 a 14 meses)17. Una de las razones por las que el modelo experimental de HP prehepática presenta una evolución tan variable podría basarse en su naturaleza inflamatoria5,17.
Se ha propuesto que la vasodilatación esplácnica y sistémica serían el episodio inicial que conduce al síndrome hiperdinámico o síndrome vasodilatador progresivo9. En particular, el fallo multiorgánico en la insuficiencia hepática crónica es, en gran parte, atribuible a este síndrome9,10. Sin embargo, el fallo multiorgánico o síndrome de disfunción multiorgánica (MODS) representa la complicación final de una enfermedad grave, después de un estado de síndrome de respuesta inflamatoria sistémica (SIRS). Además, la transición del estado de SIRS a MODS no tiene un límite claro, quizá porque estas dos entidades representan un continuum18,19. Por consiguiente, la dilatación hiperdinámica de las circulaciones esplácnica y sistémica con alteraciones microcirculatorias asociadas, propias de la HP prehepática en la rata, sería el mecanismo inicial que conduce al desarrollo de una respuesta inflamatoria esplácnica y sistémica leve5. Según esta hipótesis, una complicación adicional, como la insuficiencia hepática (p.ej., cirrosis), podría inducir un aumento de la respuesta inflamatoria sistémica y esplácnica con el desarrollo de complicaciones más graves, como son la disfunción multiorgánica y el posterior fallo multiorgánico (MOF)5,17.
La hipótesis inflamatoria acerca de la etiopatogenia inflamatoria de la HP puede permitir especular que la TLVP en la rata, ya que potencia la intensidad de las complicaciones respecto de la LVP simple, también aumentaría el grado de la respuesta inflamatoria esplácnica y sistémica.
Evolución inflamatoria aguda o a corto plazo en ratas con hipertensión portal prehepáticaLos diferentes mecanismos que contribuyen al desarrollo de la HP prehepática en la rata permiten atribuir diferentes fases evolutivas a esta enfermedad6,13.
En la fase evolutiva precoz (de 2 a 6 semanas) la HP se asocia a una circulación sistémica y esplácnica hiperdinámica13. La circulación hiperdinámica también podría favorecer el mantenimiento de la respuesta inflamatoria que ha sido propuesta como una de las características de este modelo experimental5,20,21.
En esta fase evolutiva precoz podría considerarse que las alteraciones esplácnicas predominan respecto de las sistémicas. Primero, el incremento patológico de la presión portal que comporta la circulación esplácnica hiperdinámica podría favorecer la alteración de los flujos sanguíneos venoso y arterial, produciéndose un incremento circunferencial perpendicular a la pared del vaso mediado por la presión y las fuerzas de cizallamiento tangenciales a la pared vascular y que son secundarias, a su vez, a un flujo no laminar22. Este flujo alterado asociado con fuerzas mecánicas patológicas ejerce profundos efectos sobre la biología de la pared vascular, en particular sobre el endotelio, y podría estimular la producción de especies reactivas del oxígeno (ERO), con estrés oxidativo vascular, así como el proceso inflamatorio23. El incremento en la producción de ERO por las células vasculares causado por estas fuerzas mecánicas patológicas ha sido implicado en la activación del factor de transcripción nuclear (NF)-κB, MAP-quinasas y metaloproteinasas de la matriz extracelular (MMP), así como en la oxidación de las lipoproteínas de baja densidad (LDL, low density lipoproteins), en las alteraciones de la respuesta vasomotora y finalmente en la angiogénesis23–25.
En segundo lugar, tanto el incremento de la velocidad del flujo sanguíneo como la apertura de los shunts arteriovenosos inducidos por la circulación hiperdinámica esplácnica disminuirían la disponibilidad tisular de oxígeno en la mucosa intestinal. Esta alteración induciría hipoxia tisular y, consecuentemente la cronicidad de la respuesta inflamatoria5,17.
Por último, la activación del sistema renina-angiotensina-aldosterona y la hiperactividad del sistema nervioso simpático son características de la HP. A su vez, tanto el incremento de la frecuencia y del gasto cardiaco, como la retención de sodio y agua, también caracterizan a la HP26,27. Los niveles elevados de AT-II en plasma inducen, mediante la secreción de aldosterona (entre otros factores), la retención de agua y de sodio27. Se ha demostrado que estos cambios en el transporte iónico se asocian con todos los tipos de enfermedades inflamatorias28. En la HP estos cambios en el transporte de iones con retención de sodio y agua favorecerían la existencia de una volemia excesiva en los lechos vasculares con mayor vasodilatación, como ocurre en el sistema venoso esplácnico. Este mecanismo podría inducir una derivación de sangre hacia el sistema venoso esplácnico en detrimento de la circulación sanguínea sistémica29.
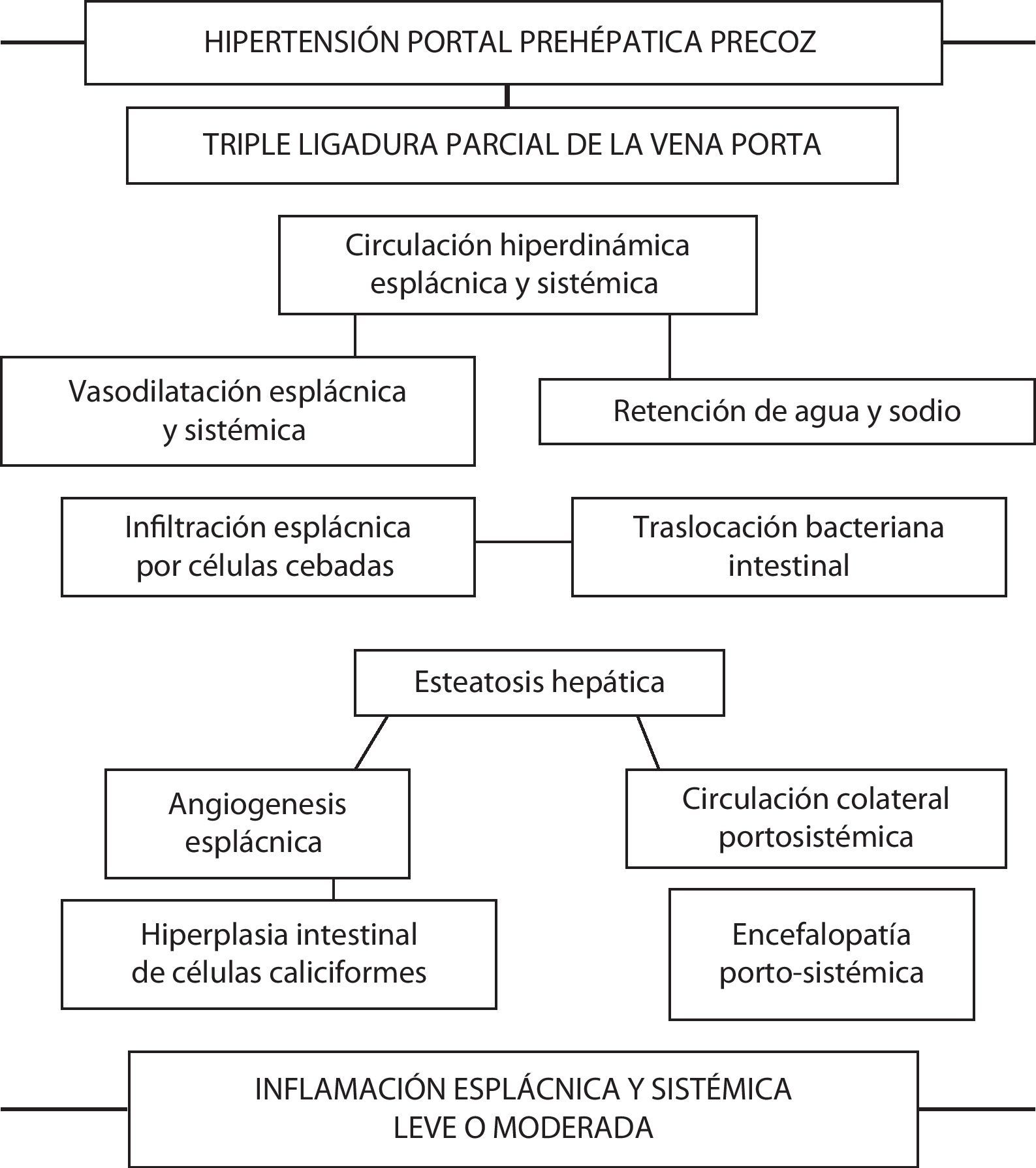
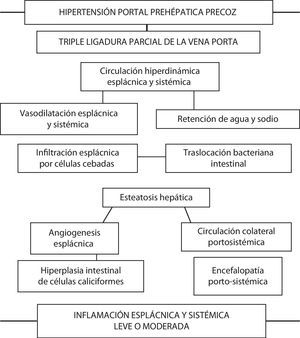
Las ratas con HP presentan un incremento de la infiltración de células cebadas en el duodeno, en el yeyuno, en el íleon y en los ganglios linfáticos mesentéricos superiores a las seis semanas de evolución30–32. Únicamente las células cebadas tienen la capacidad de almacenar TNF-α presintetizado y por ello pueden liberar este mediador espontáneamente tras ser activadas33. Por lo tanto, el excesivo número de células cebadas presentes en el intestino delgado y en los ganglios linfáticos mesentéricos de ratas con TLVP podría ser secundario a su capacidad para liberar el TNF-α que tienen almacenado cuando actúa un estímulo apropiado. Se ha propuesto que el TNF-α causa vasodilatación a través de la prostaglandina I2 (PGI2) y de NO33. Si esto es así, la liberación del TNF-α almacenado tras la activación de las células cebadas podría estar involucrada en el desarrollo de la circulación hiperdinámica esplácnica34 (fig. 1).
Relación de las complicaciones secundarias a la producción de hipertensión portal prehepática en la rata. A corto plazo los animales presentan alteraciones cardiovasculares e inmunológicas esplácnicas y sistémicas que, a su vez, inducen remodelación hepática (esteatosis) e intestinal (angiogénesis e hiperplasia de células caliciformes). En conjunto, estas alteraciones integrarían una respuesta inflamatoria moderada, tanto esplácnica como sistémica.
La HP es uno de los factores que determinan la translocación bacteriana intestinal hacia los ganglios linfáticos mesentéricos. Se ha descrito la existencia de una mínima incidencia de translocación bacteriana intestinal en ratas con una ligadura parcial de la vena porta, si bien siempre que se asocie con algún factor desencadenante, como por ejemplo el shock hemorrágico35. Por el contrario, en ratas con TLVP al mes de evolución postoperatoria aumenta significativamente la incidencia de translocación bacteriana a los ganglios linfáticos mesentéricos36. Además, se ha observado un trastorno de la microflora bacteriana del intestino con un incremento de las enterobacterias y de las bacterias anaerobias y una disminución de Enterococci y de bacterias ácido-lácticas. Esta disbacteriosis es otro factor importante que explica la translocación bacteriana intestinal a los ganglios linfáticos mesentéricos inducida por la TLVP en la rata36.
En este mismo periodo de la evolución post-TLVP se ha demostrado la existencia de una respuesta inflamatoria hepática, con producción de mediadores inflamatorios, como TNF-α, IL-1β y NO. Esta respuesta proinflamatoria que se produce en el hígado, y que podría inducir efectos perjudiciales, es contrarrestada y equilibrada con la liberación de citoquinas antiinflamatorias, especialmente con la producción intestinal de IL-1020,21. Las citoquinas IL-1β y TNF-α destacan sobre todo como factores inmunológicos con gran capacidad para la producción de esteatosis hepática, una afección que forma parte de la denominada hepatopatía grasa no-alcohólica (NAFLD, non-alcoholic fatty liver disease), la cual ha sido demostrada tanto a corto plazo y largo plazo en ratas con TLVP37,38.
En la HP prehepática la esteatosis hepática, con acumulación de triglicéridos y colesterol, se asocia con el desarrollo de megamitocondrias en los hepatocitos39. Diversos hechos sugieren un papel importante de la disfunción mitocondrial en la esteatosis hepática40. En el hígado graso también se produce estrés oxidativo con formación de ERO41. La abundante formación de ERO puede oxidar los lípidos insaturados de los depósitos de grasa y causar peroxidación lipídica. Tanto los productos de la peroxidación lipídica como los mediadores inflamatorios como TNF-α, pueden dañar la mitocondria, atacando e inactivando los componentes de la cadena respiratoria40–42. A su vez, la producción de ERO y la peroxidación lipídica pueden ocasionar alteraciones en la estructura de la mitocondria38–40 y producir la necrosis o la apoptosis de los hepatocitos43.
Las citoquinas pro-inflamatorias, particularmente TNF-α, inducen la hiperactividad de la iNOS y, consecuentemente, el incremento de la síntesis de NO hepático. A su vez, la reacción de las ERO con NO produce peroxinitritos, y estos radicales libres de nitrógeno pueden unirse a proteínas de la cadena respiratoria mitocondrial, lo cual resulta en su deterioro funcional con inhibición de la fosforilación oxidativa y, por lo tanto, de la producción de ATP44.
Las ratas con TLVP precoz presentan alteraciones intestinales que podrían incluirse en el término «enteropatía hipertensiva portal». Este tipo de enteropatía se caracteriza por cambios vasculares y epiteliales de etiología supuestamente inflamatoria5,17. En ratas con hipertensión portal a las seis semanas del postoperatorio se ha demostrado un aumento del calibre y del número de vasos sanguíneos en la submucosa duodenal que, curiosamente, se correlacionaba con la infiltración intestinal por células cebadas30. Por lo tanto, la vasodilatación y la angiogénesis, que son los factores responsables de las alteraciones estructurales vasculares propias de la enteropatía hipertensiva portal45, pueden ser atribuidas, entre otras causas, a los efectos fisiopatológicos producidos por la liberación excesiva de mediadores por parte de las células cebadas30–32. La hiperemia esplácnica, el aumento de vascularización esplácnica y el desarrollo de circulación colateral portosistémica en las ratas con hipertensión portal son en parte procesos angiogénicos dependientes del factor de crecimiento endotelial vascular (VEGF)46. La producción y la liberación de factores angiogénicos (VEGF) y de factores de crecimiento por las células cebadas47 podría tener un papel importante en la modulación de la angiogénesis esplácnica17.
Nuestro grupo también ha descrito previamente en la enteropatía hipertensiva portal crónica experimental la existencia de remodelación epitelial intestinal consistente en la hiperplasia de las células caliciformes48. La hiperplasia de las células caliciformes con la hipersecreción de mucina son alteraciones características de la remodelación epitelial que ocurre en el tracto respiratorio en procesos inflamatorios crónicos, como el asma y la enfermedad pulmonar obstructiva crónica49,50. El moco secretado por las células caliciformes en la luz intestinal constituye un componente de la defensa de la mucosa, por lo que en la enteropatía hipertensiva portal esta hipersecreción podría estar mediada, entre otros factores, por las células cebadas51 (fig. 1).
Recientemente se ha destacado la importancia que posee la inflamación en la modulación de la patogénesis molecular de la encefalopatía hepática (EH)52. Sin embargo, la inflamación podría no solo modular la gravedad de la EH, sino que incluso podría ser el mecanismo fisiopatológico que induce su desarrollo53.
La HP prehepática precoz en la rata cursa con alteraciones inflamatorias, mediadas por diversas quimioquinas, en el eje esplácnico-cerebral. Las ratas con TLVP presentan un aumento de CXCR4/SDF-1α en el hipocampo y en el cerebelo, asociado con un incremento de CX3CR1/fractalkina en el íleon y en los ganglios linfáticos mesentéricos54. El aumento de CXCR4/SDF-1α en el hipocampo podría estar relacionado con su papel fundamental en la neovascularización, la reparación neuronal y los mecanismos de remodelación. A su vez, el incremento de CX3CR1 en el íleon podría inducir la migración de los monocitos, lo cual contribuiría al desarrollo de inflamación intestinal54. Puesto que fractalkina estimula la angiogénesis activando las vías de señalización Raf-1/MEK/ERK y PI3K/AKT/eNOS/NO a través de su unión al receptor CXC3CR1 acoplado a proteína G55, la interacción entre fractalkina y CX3CR1 podría contribuir a la patogenia vascular de la enteropatía hipertensiva portal. La fractalkina también puede actuar como un factor quimioatrayente de células cebadas56, explicándose así el incremento de la infiltración de células cebadas que ocurre en los ganglios linfáticos mesentéricos de ratas con TLVP en un periodo evolutivo precoz31,32.
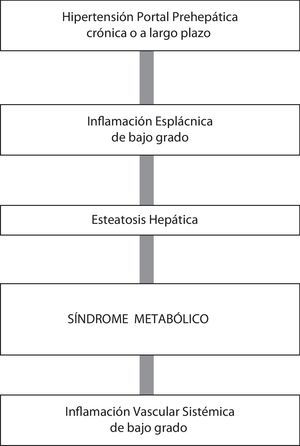
Evolución crónica o a largo plazo en ratas con hipertensión portal prehepáticaEl modelo de HP prehepática experimental en la rata es normalmente estudiado en periodos evolutivos precoces, pero podría ser más interesante el estudio de fases evolutivas crónicas (de 6 a 22 meses), ya que los mecanismos implicados en su producción, así como en sus complicaciones, podrían ser más parecidos a los que existen en las hepatopatías crónicas en el ser humano, que dependen, entre otros factores, de la cronicidad de la HP57–59.
Las ratas con TLVP crónica (6 meses) presentan un amplio rango de peso corporal, hepático, esplénico y testicular, así como diferentes tipos de circulación colateral portosistémica. No obstante, el desarrollo de la circulación colateral esplenorrenal y paraesofágica es constante y se asocia con un incremento del peso hepático60. A su vez, en esta fase evolutiva crónica el incremento de la presión portal es moderado37,39.
En ratas con TLVP, tras 15 meses de evolución persiste la producción de mediadores antiinflamatorios hepáticos e intestinales, como la IL-10, la hemooxigenasa (HO) y el monóxido de carbono (CO), pero en esta fase evolutiva crónica también se producen mediadores pro-inflamatorios como el TNF-α y el NO21 en el intestino.
En el hígado predominan la activación de la HO, así como el incremento en la síntesis de CO, que además de tener efectos vasodilatadores y antiapoptóticos61 son moléculas antiinflamatorias62. Varios factores fisicoquímicos pueden estar aumentados durante la HP crónica, incluyéndose tanto las fuerzas de cizallamiento, la hipoxia y el NO, así como los agentes proinflamatorios endotoxina y citoquinas que pueden inducir HO-1, la isoforma inducible de la HO63. La activación de la HO-1 hepática en las ratas con TLVP crónica puede ser beneficiosa al producir una mejora de la defensa antioxidante61 y aumentar la liberación del mediador vasodilatador CO, que puede contribuir a modular el flujo sanguíneo hepático21.
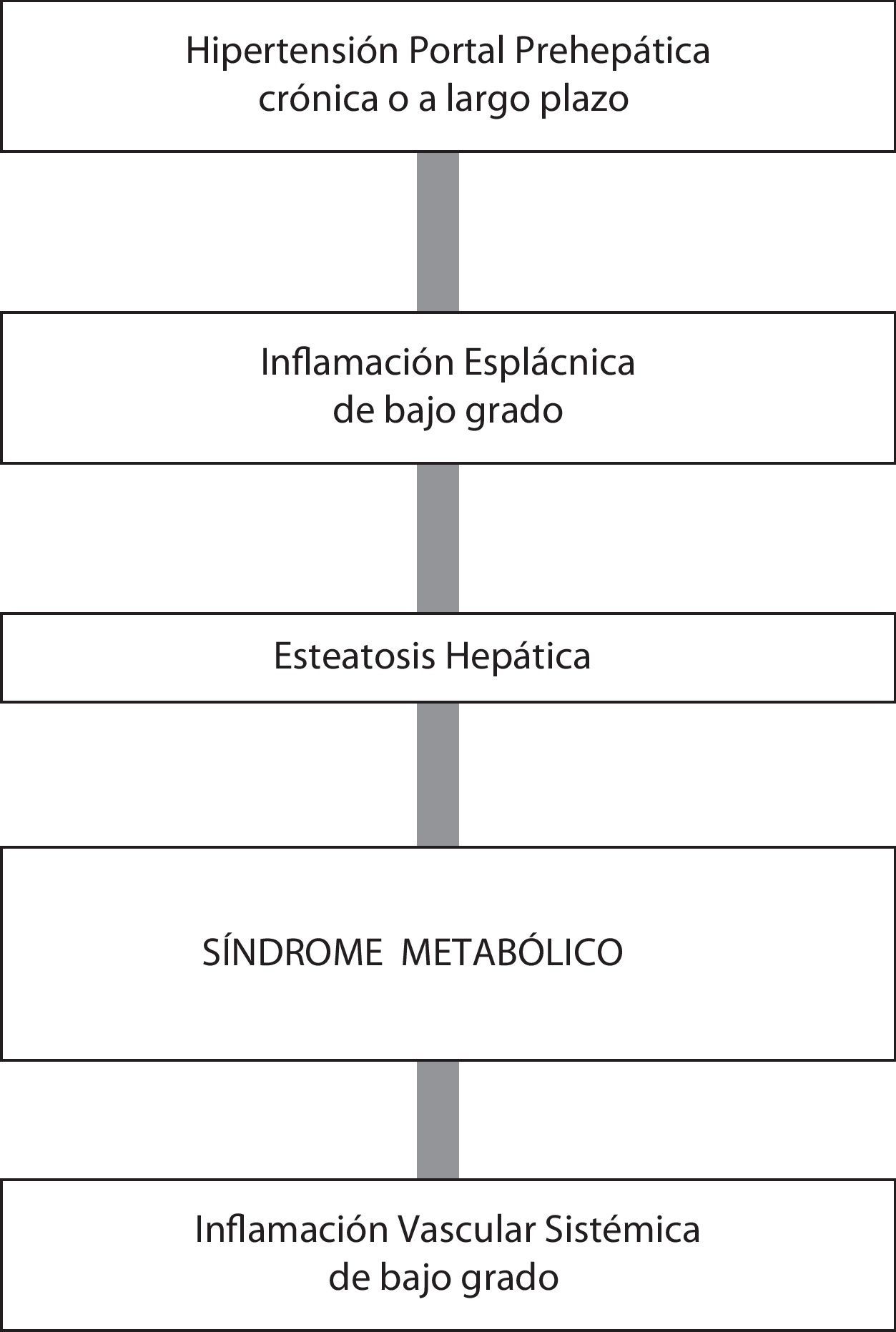
En ratas con HP tras un año de evolución se produce infiltración de grasa en el hígado. Esta acumulación de grasa en los hepatocitos es progresiva desde un estadio evolutivo precoz de HP (1 mes) a uno tardío o crónico (1 año), y por lo tanto la persistencia de mecanismos etiopatogénicos secundarios a HP podría ser considerada37. La esteatosis hepática podría ser la causa de la hepatomegalia que ha sido descrita en la evolución de la HP prehepática en la rata64. En este caso, la ligadura parcial de la vena porta no solo sería suficiente para obtener un modelo experimental de HP sino también un modelo de esteatosis hepática37 (fig. 2).
Por otra parte, en este estado evolutivo crónico de la HP prehepática experimental, el incremento de depósitos lipídicos ectópicos (triglicéridos y colesterol) está asociado con una disminución de la síntesis de fosfolípidos, que podría empeorar la sensibilidad del hígado a ser dañado39. El exceso de triglicéridos y de colesterol hepáticos produce esteatosis y también suministra sustratos para la peroxidación lipídica40,42. Además, la acumulación de colesterol y la disminución de fosfolípidos han sido asociadas con el síndrome metabólico65.
Recientemente se ha demostrado, en el ser humano, que el aumento del contenido intrahepático de triglicéridos es un buen marcador de las alteraciones metabólicas asociadas con obesidad66. Así, la lipólisis de los triglicéridos intrahepáticos aumentaría la tasa de secreción de triglicéridosVLDL (very low density lipoprotein), que estaría directamente involucrada en la patogénesis de la dislipidemia, asociada con la hepatopatía grasa no-alcohólica (NAFLD, non-alcoholic fatty liver disease)66.
En las ratas con TLVP crónica (2 años), el incremento del contenido hepático de triglicéridos y de colesterol está asociado con un aumento de los niveles de lipoproteínas de baja densidad (LDL) y de la proteína de unión a lipopolisacáridos (LBP, lipopolisacharide-binding protein) en suero67. Se ha propuesto que en las ratas con HP crónica y con inflamación crónica leve o subclínica, el cambio inapropiado de un metabolismo protagonizado por hidratos de carbono a un metabolismo predominantemente lipídico induciría un desequilibrio energético corporal y finalmente una esteatosis hepática, así como algunas de las manifestaciones descritas en la clínica del síndrome metabólico5,67. En este supuesto, la participación de las células hepáticas en el procesamiento de la glucosa y de los lípidos, que a su vez se asocia a su papel clave en los mecanismos de activación de los receptores nucleares reguladores de la actividad metabólica, tendría al hígado como órgano primordial para explicar la fisiopatología del síndrome metabólico68.
La asociación entre la esteatosis hepática y el síndrome metabólico con la inflamación está bien documentada69,70. Los niveles hepáticos elevados de TNF-α y de IL-1β se asocian con resistencia a la insulina, dislipidemia y disfunción endotelial68,69, pudiendo inducir al desarrollo de esteatosis hepática y síndrome metabólico, características de la HP prehepática crónica experimental21 (fig. 2).
El desarrollo de una inflamación leve o moderada en la HP, probablemente de origen esplácnico, podría ser el vínculo fisiopatológico entre el síndrome metabólico, la esteatosis hepática y la patología vascular sistémica5. Se ha sugerido que entre los potenciales mediadores de esta respuesta inflamatoria esplácnica secundaria a HP prehepática destacarían los mastocitos31,32,60.
La disregulación inflamatoria vascular en la circulación esplácnica podría promover asimismo vasodilatación arterial con reducida resistencia vascular periférica y circulación hiperdinámica, una respuesta característica de la HP crónica71. Por este mecanismo, los lípidos que se encuentran en la circulación sistémica alcanzarían el sistema venoso portal a través de la circulación esplácnica hiperdinámica, y así llegarían al hígado incrementando la esteatosis hepática. Por lo tanto, se podría concluir que la inflamación esplácnica leve o moderada secundaria a HP sería necesaria para poder relacionar la circulación hiperdinámica sistémica y esplácnica con el metabolismo dislipidémico70.
Inflamación vascular leve o moderada en la hipertensión portal crónicaLas células endoteliales tienen un papel importante en situaciones tanto fisiológicas como patológicas. El endotelio forma una capa simple de células, aunque el volumen total de las células endoteliales del cuerpo humano es comparable al del hígado, lo que a su vez explica la importancia fundamental que posee en ambas situaciones72. En respuesta a diversos factores, tanto autacoides circulantes, citoquinas y hormonas como estímulos físicos y químicos (cambios de presión, fuerzas de cizallamiento y pH), las células endoteliales sintetizan y liberan diversos factores que modulan el tono vascular, la permeabilidad, la hemostasia, la respuesta inflamatoria y la angiogénesis72,73. Las células endoteliales también pueden comunicarse directamente con las células musculares lisas subyacentes mediante uniones mioendoteliales, permitiendo así no solo la propagación de estímulos eléctricos, sino también la transferencia de iones y de pequeñas moléculas como son el calcio y los nucleótidos cíclicos72.
El término «disfunción endotelial» fue acuñado a mediados de los ochenta, cuando Furchgott y Zawadzki demostraron que las células endoteliales requerían de la presencia de acetilcolina para poder relajar el músculo liso vascular subyacente74. Desde entonces, el término «disfunción endotelial» ha sido asociado con múltiples patologías vasculares, incluidas la hipertensión, la aterosclerosis, la patología coronaria, la diabetes, la obesidad, la hipercolesterolemia, la inflamación72,73 y, por último, la hipertensión portal y la cirrosis10 (fig. 3).
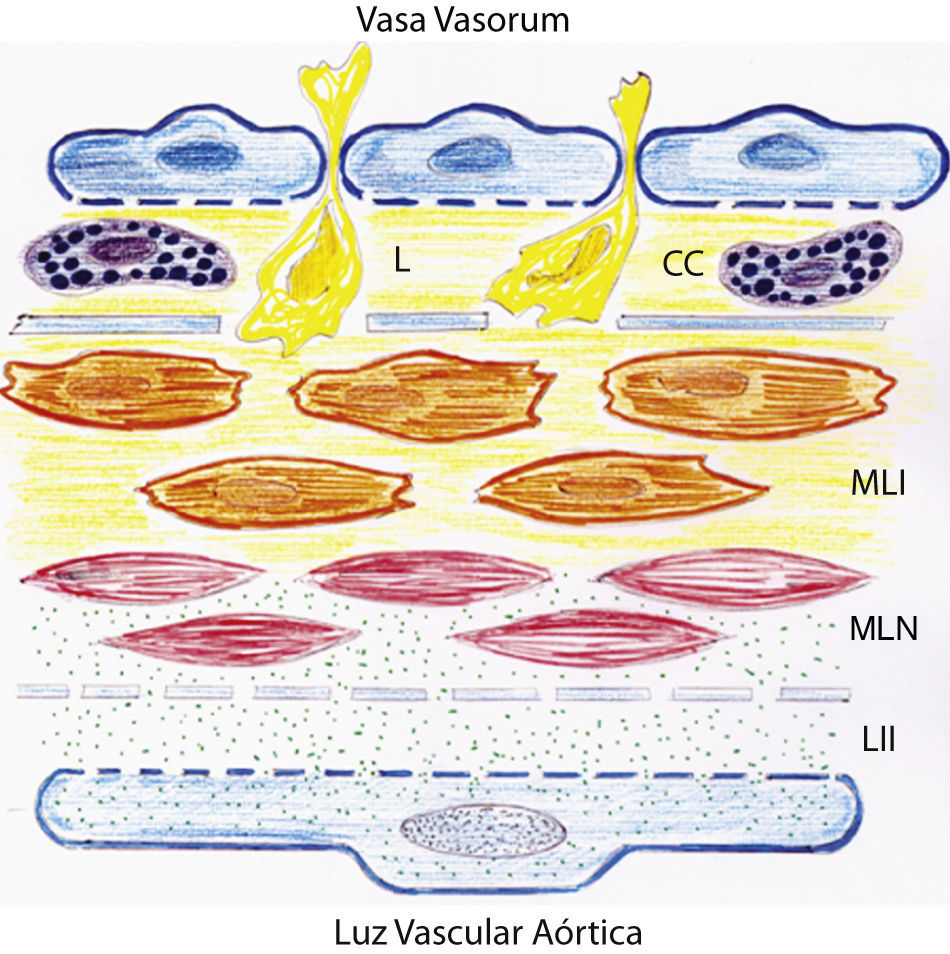
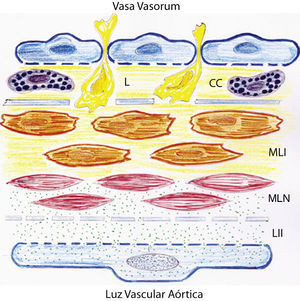
Dibujo representativo de las alteraciones inflamatorias de la pared de la aorta abdominal en ratas con hipertensión portal prehepática crónica. Estas alteraciones se pueden producir por dos mecanismos fundamentales que implican respectivamente el endotelio aórtico, con lesión de la íntima, y los vasa vasorum, con afectación de las capas adventicia y media. CC: células cebadas; L: leucocitos; LII: lesión inflamatoria de la íntima; MLI: células musculares lisas lesionadas por un mecanismo inflamatorio; MLN: células musculares lisas normales.
La disfunción endotelial está considerada como una alteración precoz en la HP2,10. Sin embargo, la disfunción endotelial vascular en la HP está considerada como una enfermedad heterogénea con distintos mecanismos y grados fisiopatológicos, dependiendo principalmente de su localización: hepática2,10,75, mesentérica66,76,77 o sistémica10,77.
La disfunción endotelial sistémica ha sido ampliamente estudiada en la hipertensión portal aguda en ratas77–81, pero los estudios en periodos de evolución tardíos o crónicos son escasos82. Además, los estudios se han hecho generalmente en vasos sistémicos centrales como la aorta, pero sin diferenciar entre las localizaciones torácica y abdominal, aunque anatomofisiológicamente poseen características diferentes.
La valoración de los niveles de NO vascular en las células endoteliales y en la circulación sanguínea es indicativa de disfunción endotelial2,9–11. Asimismo, el estrés oxidativo desempeña un papel central en la fisiopatología vascular83. En el aparato cardiovascular los sistemas enzimáticos más relevantes productores de ERO son la NAD(P)H oxidasa y la xantina oxidasa mitocondrial, y en ciertas condiciones, la óxido nítrico oxidasa83,84. Existen numerosos ejemplos de la activación de estas enzimas en gran variedad de estados, incluyendo la hipertensión, la diabetes y la aterosclerosis83,84. Diversas evidencias demuestran una interacción entre el estrés oxidativo y la regulación del tono vascular mediante sustancias como la AT-II y la endotelina184. En la disfunción endotelial se han demostrado interacciones entre las LDL y su modificación oxidativa a LDL oxidadas (LDLox) y el sistema renina-angiotensina83. También la AT-II es bien conocida como activadora de la vía de la NADPH oxidasa por el receptor AT1, y muchos de los efectos fisiopatológicos de la AT-II son atribuidos, al menos en parte, a la producción de estrés oxidativo mediante este mecanismo85,86.
El incremento en la actividad de la NAD(P)H oxidasa en la aorta abdominal de ratas con TLVP crónica, con la consecuente producción de ERO, causa estrés oxidativo con producción de disfunción endotelial. Los niveles aumentados de LDL en plasma pueden ser oxidados mediante ERO a LDLox en ratas con hipertensión portal. Ya que las LDLox han sido descritas como un potente inductor de aniones superóxido, su producción sería una causa adicional de estrés oxidativo83.
Cada vez más evidencias reafirman la participación de la NAD(P)H oxidasa y el sistema redox en la regulación de la función endotelial y en la modulación del tono vascular72,83. En las células del músculo liso vascular de la aorta, las subunidades Nox1 y Nox4 de la NAD(P)H oxidasa son responsables de la generación de ERO87. También Nox1 juega un papel crítico en la formación de la neoíntima mediante la migración de células de músculo liso, proliferación y producción de matriz extracelular88.
En la producción de estrés oxidativo en la aorta de ratas con hipertensión portal, la activación del sistema nervioso simpático (SNS) y del sistema renina-angiotensina-aldosterona (SRAA) a través de sus respectivos mediadores, como catecolaminas y AT-II9,12, debe ser considerado como un estímulo importante87. Además, el incremento de la actividad del SNS está relacionado con la resistencia a la insulina86, y ambos están fuertemente asociados con la esteatosis hepática89. A su vez, la activación de la AT-II estimula la producción de mineralocorticoides. Particularmente, la aldosterona incrementa la retención de sodio y el volumen plasmático, y por esta razón es reconocida como un factor etiopatogénico de la hipertensión portal y el síndrome hepatorrenal90.
Se ha propuesto que las enfermedades mediadas por estrés oxidativo se producen cuando existe un desequilibrio entre la actividad pro- y anti-oxidativa73. En este caso, se consideraría que el estrés oxidativo en la aorta abdominal es inducido por una disminución en su capacidad antioxidante, a pesar de que la actividad superóxido dismutasa esté aumentada. Sin embargo, este aumento en la actividad superóxido dismutasa podría favorecer la respuesta antioxidante inducida en ratas con TLVP por la hipercolesterolemia y/o lipopolisacáridos (LPS) evitando así más graves complicaciones. Así, se ha demostrado que en ratones hipercolesterolémicos, repetidas infecciones por Escherichia coli inducen una respuesta endógena antioxidante que sirve para modular la inflamación vascular en enfermedades cardiovasculares91.
El incremento en la actividad de la óxido nítrico sintasa endotelial (eNOS) es la contribución más importante a la producción de NO vascular en la aorta abdominal en las ratas con hipertensión portal crónica. Las ERO reaccionan con el NO produciendo peróxido nítrico y disminuyendo así su biodisponibilidad92. Además, en la vía de señalización convencional de NO el NO induce la S-nitrosilación de proteínas que regulan la biología de la célula endotelial93.
La aortopatía hipertensiva portal podría considerarse una enfermedad inflamatoria de la pared arterial. Así, compartiría mecanismos patogénicos con otras aortopatías inflamatorias, como la arteriosclerosis94–100. Los rasgos clave de esta aortopatía inflamatoria crónica en la HP prehepática experimental podrían ser el estrés oxidativo, el desequilibrio entre citoquinas proinflamatorias y antiinflamatorias, así como su remodelación. Como es aceptado en la aterosclerosis101, tanto la lesión de la íntima causada por la disfunción endotelial aórtica, como la patología de los vasa vasorum, representarían vías fisiopatológicas causantes de inflamación aórtica relacionada con la HP. Los vasa vasorum llegan a la adventicia y a las capas superiores de la media de la pared arterial. Por ello, su disfunción endotelial podría ser el origen del proceso inflamatorio en otras capas de la pared aórtica, que podrían complementar así el producido en la túnica íntima (fig. 3).
En resumen, el modelo experimental de hipertensión portal en la rata por TLVP permite estudiar las complicaciones que se producen tanto a corto plazo o agudas, como a largo plazo o crónicas. La mayoría de las alteraciones esplácnicas y sistémicas que se producen en este modelo experimental son de naturaleza inflamatoria, y por esta razón el estudio de los mecanismos fisiopatológicos implicados tiene gran interés para la investigación de nuevas terapias antiinflamatorias (fig. 4). En particular, destacan las alteraciones inflamatorias cardiovasculares que a largo plazo serían similares a las que se producen en la clínica humana, en procesos como por ejemplo la arteriosclerosis. Futuros estudios son necesarios para establecer los mecanismos etiopatogénicos que integrarían las alteraciones esplácnicas secundarias a la hipertensión portal y la vasculopatía inflamatoria arterial sistémica que se produce a largo plazo en este modelo experimental.
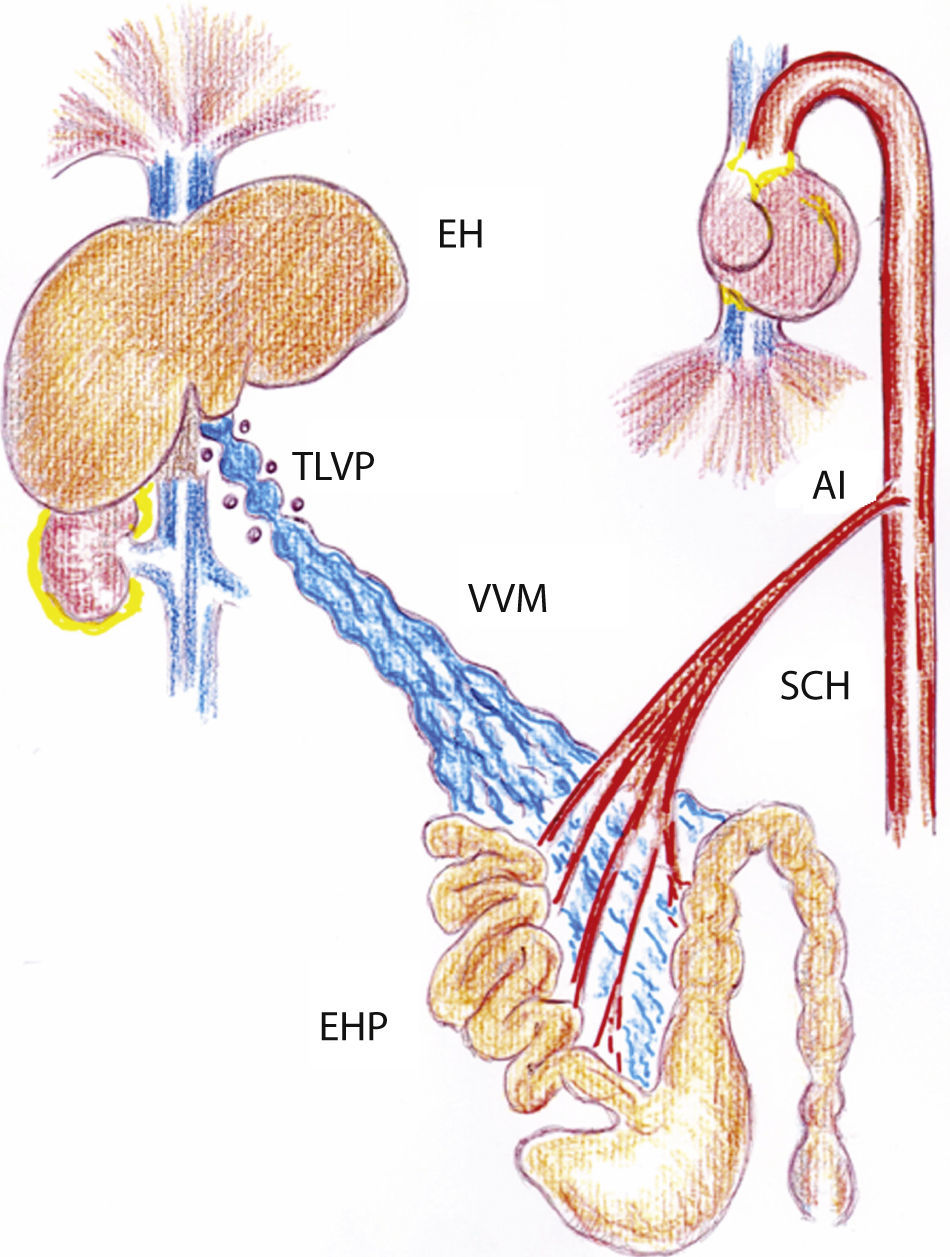
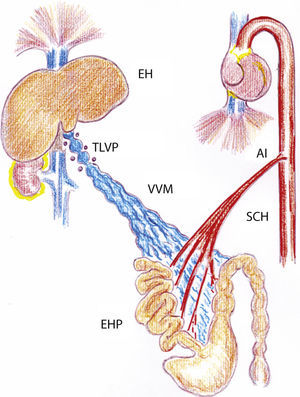
Dibujo representativo de las alteraciones inflamatorias esplácnicas y sistémicas en ratas con hipertensión portal prehepática crónica. AI: aortopatía inflamatoria; EH: esteatosis hepática; EHP: enteropatía hipertensiva portal; SCH: síndrome circulatorio hiperdinámico esplácnico y sistémico; TLVP: triple ligadura parcial de la vena porta; VVM: vasculopatía venosa mesentérica.
Los autores declaran no tener ningún conflicto de intereses.
Fundación Mutua Madrileña, Investigación Médica (AP5966-2009)