Nuevos avances en el tratamiento del infarto agudo de miocardio involucran inéditas vías de señalización y progenie celular. En este sentido, la regeneración es una herramienta novedosa que contribuiría al remodelado ventricular fisiológico postinfarto. Más específicamente, la reexpresión del factor de transcripción WT1 en la pared miocárdica por isquemia e infarto se relacionaría con la invasión de células con la capacidad de regeneración. Este mecanismo parece no resultar suficiente para restituir completamente las células musculares y vasos perdidos. De especial interés, la presencia de la proteína de respuesta a golpe de calor 70 (Hsp70) y su interacción con el receptor de vitamina D modularían positivamente la expresión de WT1. En este contexto, se propone que la activación de los receptores de vitamina D asociados a Hsp70 podría favorecer el remodelado cardiaco fisiológico y reducir la progresión a insuficiencia cardiaca.
New advances in the treatment of acute myocardial infarction involve novel signaling pathways and cellular progeny. In this sense, regeneration is a novel tool that would contribute to post-infarction physiological ventricular remodeling. More specifically, re-expression of the WT1 transcription factor in the myocardial wall by ischemia and infarction would be related to the invasion of cells with the capacity for regeneration. This mechanism seems not to be sufficient to restore muscle cells and lost vessels entirely. Of particular interest, the presence of the heat-shock response protein 70 (Hsp70) and its interaction with the vitamin D receptor would modulate the expression of WT1 positively. In this context, it is proposed that the activation of vitamin D receptors associated with Hsp70 could favor physiological cardiac remodeling and reduce the progression to heart failure.
La enfermedad coronaria fue y continúa siendo un verdadero flagelo para la humanidad. Esto es debido a que la muerte celular miocárdica por el déficit de irrigación conlleva la muerte en edad temprana o la aparición de un síndrome de insuficiencia cardiaca asociado a la caída de la fuerza de contracción o al remodelado cardiaco patológico. De interés epidemiológico existe una estrecha relación entre la creciente demanda social actual a la que se ve sometido el hombre y la mayor predisposición a desarrollar enfermedad. Los pacientes que presenten enfermedad coronaria con el tiempo sufrirán las consecuencias propias de los eventos coronarios tales como la insuficiencia cardiaca y/o las arritmias. Dicho estado los condicionará con distintos grados de discapacidad en los años siguientes. La enfermedad cardiovascular (ECV) es la causa principal de mortalidad a nivel mundial. Durante el 2013 causó más de 17,3 millones de muertes, de las cuales 7,4 millones se debieron a cardiopatía coronaria y 6,7 millones a los accidentes cerebrovasculares (ACV)1. Con estos datos se proyecta una cifra que aumentará a más de 23,6 millones para el 2030. Específicamente sobre los valores del 2013 se calcula —a nivel mundial— que las ECV causaron 16 millones de fallecimientos y condujeron a la pérdida de 293 millones de años de vida ajustados según la discapacidad, lo que representa cerca del 31% de todos los fallecimientos. Las últimas estadísticas obtenidas revelan que la cardiopatía isquémica causa una de cada 7 muertes en los Estados Unidos, matando a más de 360.000 personas al año, y que junto con el ACV sigue siendo la causa principal de muerte2.
Remodelamiento cardiaco postinfarto de miocardioEl infarto agudo de miocardio (IAM) condiciona un riesgo de muerte que oscila entre el 6,5 y 8,5%3. Además, se destaca el hecho de que la mortalidad llega al 8,8% para los IAM con elevación del segmento ST (IAMCEST) y al 5,1% para los IAM sin elevación del segmento ST (IAMSEST)4. Aquí la evolución y el tamaño del daño miocárdico permiten asociar este evento a insuficiencia cardiaca. La incidencia de insuficiencia cardiaca en el IAM resulta muy alta, sin embargo, ningún estudio refleja la magnitud real del problema debido a la dificultad del registro y la evolución de infartos no hospitalizados. En estos casos el pronóstico a 10 años para los pacientes con insuficiencia cardiaca es pobre y la supervivencia alcanza solo al 10% cuando se asocia a cardiopatía isquémica e insuficiencia cardiaca5.
En la evolución hacia la insuficiencia cardiaca el proceso de remodelado ventricular postinfarto se determina por un aumento del tamaño ventricular, y donde las alteraciones genéticas, estructurales y bioquímicas condicionarán el deterioro de la capacidad funcional del corazón a largo plazo y consecuentemente la aparición del síndrome de insuficiencia cardiaca progresiva, un cuadro sindromático de mal pronóstico5.
Por expansión del infarto se entiende el afinamiento de la pared en la región infartada y la dilatación de la cavidad ventricular. Dicha expansión determina cambios en la forma del corazón, pasando a una morfología más redondeada y esférica. Al respecto se conoce que el aumento del estrés parietal estimularía la replicación de los sarcómeros con preferencia por los ubicados en serie. En razón de la interacción de factores como el aumento de la tensión parietal y la inflamación, entre los más destacados, se producirá un aumento en la relación del radio de la cavidad/espesor de la pared, lo que caracteriza a la hipertrofia ventricular excéntrica propia de la etapa crónica6.
No obstante la prevalencia conceptual de que el remodelado ventricular está asociado a cambios en la conformación y el tamaño cardiaco que resultan como consecuencia del deterioro progresivo de la función ventricular, no se cuenta, sin embargo, con acabada información determinante y completa sobre los mecanismos responsables puestos en juego. Tal afirmación se ve respaldada por los hallazgos de recientes estudios que incluyen factores clásicos y otros inéditos como el déficit energético, los cambios en el tránsito de calcio, las alteraciones en la vía adrenérgica, los cambios en proteínas contráctiles, la apoptosis, la inflamación, el estrés oxidativo, las alteraciones de las metaloproteasas7, la regulación de la expresión de genes organogénicos como WT1 (factor Wilms’ tumor-1), los niveles de vitamina D y las proteínas de respuesta a golpe de calor como la de peso molecular 70 (Hsp70)8-10.
De particular interés, estos factores pueden modularse mediante la utilización de fármacos como los inhibidores de la enzima de conversión de angiotensina (IECA), los bloqueantes de los receptores AT1 (ARAII), betabloqueantes y estatinas, comprobados en efectividad a la hora de disminuir el grado de remodelado y mejorar el pronóstico a largo plazo11,12.
Con especial atención sobre la actividad inflamatoria que se genera en el marco del IAM, la misma afecta el remodelado y la normal evolución de la cicatriz. En este sentido, se ha demostrado que un aumento de la proteína C reactiva (CRP) post-IAM predice rotura cardiaca y la aparición de aneurisma ventricular en la evolución, así como un aumento de la incidencia de muerte cardiaca durante el año de producido el evento13.
La inflamación en respuesta a necrosis miocárdica es una reacción fisiológica que prepara la curación de tejidos a través de la fibrosis (mecanismo fisiológico-alostático), pero puede volverse excesiva en presencia de factores añadidos como el estrés mecánico, la autoinmunidad, los antecedentes genéticos, la activación neurohumoral, el estrés oxidativo y el envejecimiento (sobrecarga alostática)7, lo que finalmente conducirá a una remodelación patológica. Consecuentemente, el daño miocárdico y el remodelado cardiaco requieren que la estructura dañada y los cambios posteriores se asocien a un determinado tamaño y con una respuesta inflamatoria significativa6. Así, el tamaño del infarto debería superar del 16 al 20% del área miocárdica del ventrículo izquierdo para desarrollar remodelamiento. De interés, Armstrong estudió a un grupo importante de pacientes con claras evidencias de remodelado y pudo caracterizarlos en dos subgrupos, uno mayoritario con infarto de miocardio anterior dilatado (61%) y otro (33%) con infarto inferior14.
La respuesta inflamatoria acompañante determinará —junto con los trastornos en la mecánica (tamaño del infarto, estrés de la pared)— el cambio en la conformación y estructura del corazón, con la consiguiente alteración y remodelamiento patológico.
Nuevos horizontes sobre remodelado cardiaco patológico asociados al factor de transcripción WT1 y factores relacionadosEl gen wt1 codifica una proteína de unión al ADN que funciona como activador o represor transcripcional de más de 20 genes diferentes por unión a sus promotores. Se ubica en el cromosoma humano 11p13 y tiene un tamaño de 345kb. Por su parte, el ARNm de wt1 tiene tres sitios de traducción que dan como resultado tres isoformas proteicas de WT1 con diferentes pesos moleculares: 62-64kDa, 52-54kDa y 36-38kDa. La proteína mayoritaria es la isoforma de 52-54kDa. Su actividad o función está controlada por fosforilación de la proteína quinasa A (PKA), que permite la translocación de WT1 desde el núcleo al citosol celular. Este proceso interfiere con las actividades transcripcionales de WT1. Actividades que resultan claves durante el desarrollo y mantenimiento de corazón, riñón, mesotelio y gónadas15.
Específicamente en lo que se refiere al desarrollo del corazón, el pericardio proporciona células progenitoras cardiogénicas que junto con el epicardio y el miocardio dirigen la especificación del linaje coordinando tanto el crecimiento del miocardio como la formación de los vasos coronarios. El pericardio adulto tiene la función de proporcionar una superficie lisa para el movimiento cardiaco. Por otro lado, en condiciones patológicas se producen alteraciones en esta mecanística, y en los últimos tiempos comienza a ser profundizado su estudio. Específicamente, recientes hallazgos destacan sobre nuevas funciones relacionadas con la isquemia y lesión cardiaca. La primera evidencia de implicación epicárdica en la regeneración cardiaca ha emergido de estudios en vertebrados inferiores.
El tubo cardiaco embrionario está formado por la fusión de los campos cardiacos que dan lugar al ventrículo izquierdo y partes de las aurículas. Las células progenitoras del órgano proepicárdico migran para formar la envoltura epicárdica y contribuir a la vasculatura coronaria al moverse desde la superficie hacia el endocardio. Este evento se encuentra perfectamente modulado por la expresión de WT1, que luego del desarrollo permanece quiescente. La expresión epicárdica de WT1 disminuye después del nacimiento y permanece en niveles bajos durante el resto de la vida adulta. En detalle, la expresión endotelial de WT1 en el corazón adulto es baja y se observa principalmente en algunos capilares y venas cardiacas16. Al respecto, el silenciamiento de WT1 en células endoteliales condicionó una reducción significativa en la formación de vasos cardiacos y redes de vasos adecuados17. Esto refuerza la importancia de la presencia de WT1 y el papel esencial que cumple en las células endoteliales cardiacas.
De central relevancia para la presente revisión, muy recientemente se ha observado que en la isquemia y necrosis cardiaca se produce una sobreexpresión de WT1 que activaría células quiescentes con la capacidad de diferenciarse en cardiomiocitos y células vasculares8,16. Esta sobreexpresión —temporal, de baja potencia y duración— resulta suficiente para producir una invasión desde la superficie hacia la zona de la lesión de la pared cardiaca por IAM. Esto permitiría restituir los tejidos dañados y formar nuevos vasos. Sin embargo, no logra compensar completamente el deterioro producido18.
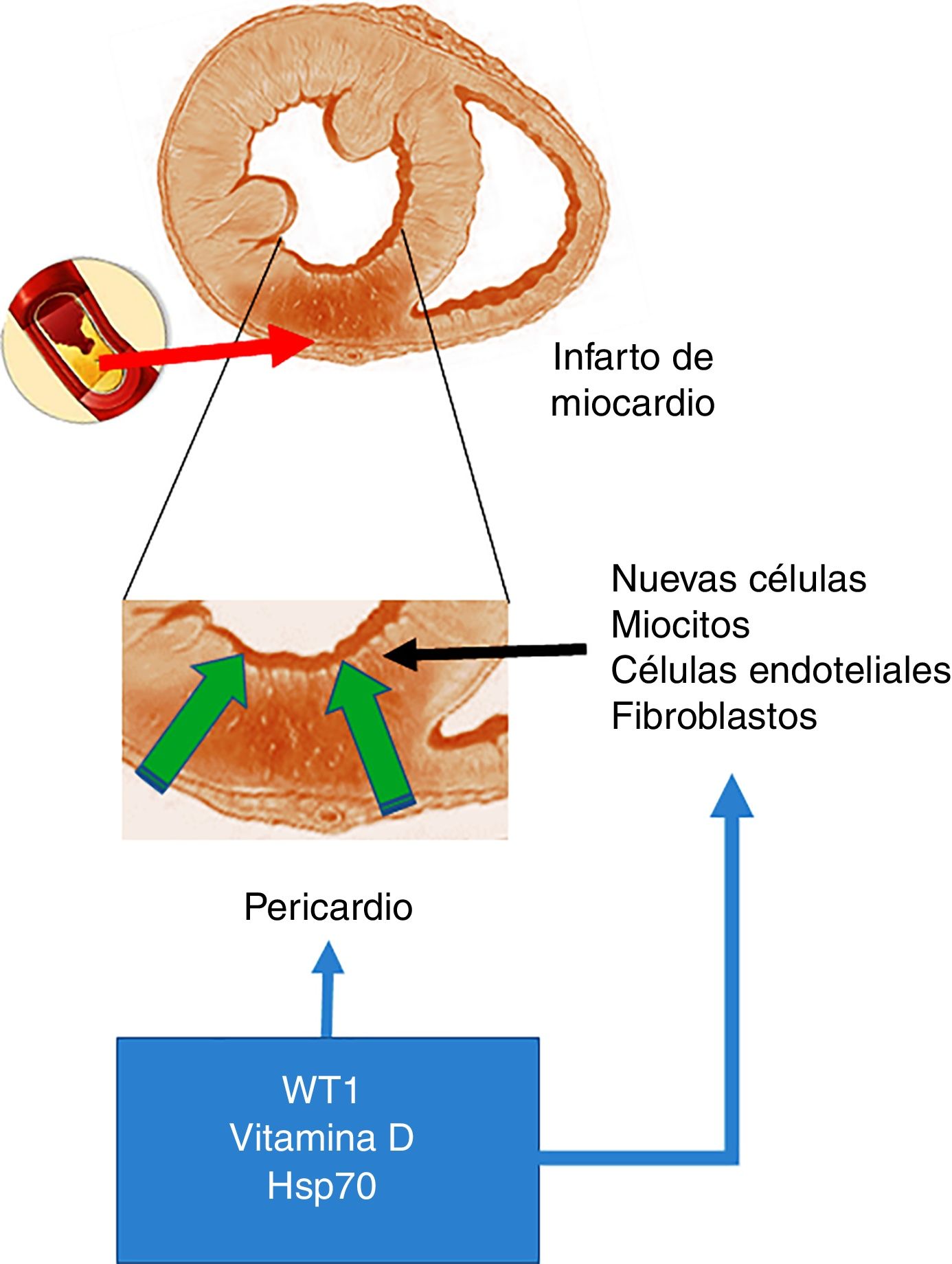
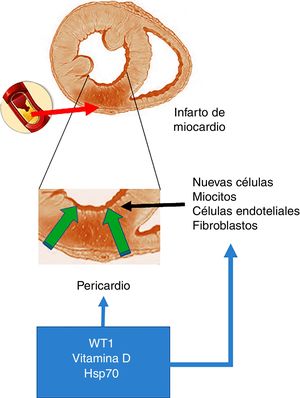
Como fue mencionado al inicio del presente capítulo, el factor de transcripción WT1 fue originalmente descripto en cáncer renal (nefroblastoma) y tiene como función primaria la activación de múltiples genes y además estaría involucrado en los procesos postranscripcionales de numerosos órganos. Así, y con especial interés en el corazón, la expresión de WT1 comienza en el lado epicárdico y se expande hacia el sitio luminal del corazón modulando la expresión de células precursoras de vasos19. No obstante, y como previamente se señaló, en post-IAM se produce una reexpresión de WT1 en todo el pericardio que comienza dentro de las 24h siguientes. Inicialmente, WT1 se observa en las células endoteliales de la zona fronteriza al área infartada y más tarde en el segmento infartado con una expresión pico en el día 7 después del IAM para volver al estado basal al cabo de los 3 meses. En este sentido y frente a la pregunta de cuáles serían los determinantes de este cambio en la expresión surge como candidata la vía inflamatoria como desencadenante potencial para la activación de la expresión de WT1 después del IAM. Esta hipótesis se encuentra respaldada por estudios que demuestran que citoquinas proinflamatorias como TNF-α, IL-1β e IL-6 regularían positivamente a WT16 (fig. 1).
Infarto agudo de miocardio. En la parte superior de la figura se esquematiza una oclusión de la arteria coronaria, lo que provoca el desarrollo de un área con infarto agudo de miocardio. En el centro de la figura se destaca —como imagen ampliada— que este evento determina un área necrótica, lo que promueve la activación de células con capacidad de regeneración. La parte inferior de la figura representa a células que invaden la pared ventricular infartada desde el pericardio y que dichas células conjuntamente con las que poseen la capacidad de regeneración serían moduladas positivamente por WT1, los niveles de vitamina D y Hsp70.
Además, la expresión epicárdica de WT1 después de la lesión también puede ser inducida por factores solubles liberados por el miocardio dentro del fluido pericárdico, en donde algunas de las respuestas se encuentran mediadas a través del factor de crecimiento endotelial vascular (VEGF), la proteína beta 4 timosina (Thymosin ß4) y las procineticinas. Esta vía de señalización puede ser activada por distintos mediadores, y entre ellos se destaca la vitamina D, que a su vez puede estimular la expresión de WT1. De hecho ha sido descripto que los receptores de vitamina D (VDR) resultan modulados a nivel transcripcional por WT119.
La vitamina D es de naturaleza liposoluble y actualmente se la reconoce como una verdadera hormona. Se incorpora al organismo mediante la dieta y/o por exposición a la luz solar. Su metabolismo puede variar en función de la dieta, la región geográfica, la latitud, las estaciones del año, los hábitos culturales y el estrés, entre los más importantes. Sus principales acciones están mediadas por la unión al VDR a través del cual regula la transcripción de más de 200 genes. El VDR se encuentra presente en casi todos los órganos y también en el corazón10. En este sentido, resulta de interés que el 50% de los enfermos coronarios presentan déficit de vitamina D. La hipovitaminosis D es una condición altamente prevalente en la población general, siendo del 30-50%, y esto se encuentra asociado a un aumento de mortalidad cardiovascular, IAM, hipertensión arterial, diabetes, con un denominador común de inflamación13. En acuerdo, la utilización de paricalcitol (un análogo de vitamina D) ha demostrado una disminución de la mortalidad cardiovascular. Los efectos cardiovasculares positivos se observan por reducción de la expresión de genes que producen calcificación, reducción del estrés oxidativo, reducción de absorción de calcio y fósforo por el intestino. Consistentemente, en pacientes con niveles bajos de vitamina D se recomienda suplementar con la misma, pero teniendo en cuenta las concentraciones de la hormona paratiroidea (PTH) para evitar el hiperparatiroidismo secundario.
Con especial atención sobre la vía de señalización inflamatoria se ha descripto que el paricalcitol reduce los niveles de IL-1, IL-6 y TNF-α. Por otro lado, existe una creciente evidencia de ensayos básicos y clínicos dando cuentas sobre la estrecha relación entre la ECV, su correlato con la deficiencia en los niveles de vitamina D y la exaltación del sistema renina-angiotensina (RAS). Más específicamente, la vitamina D además de su función clásica sobre el metabolismo fosfocálcico también tiene múltiples acciones inmunorreguladoras y citoprotectoras como consecuencia y/o inhibición de la actividad del sistema RAS20. En este sentido, la vitamina D se une a diversas proteínas y disminuye la lesión miocárdica post-IAM en donde el VDR normalmente se expresa poco en miocardio normal pero este aumenta su expresión durante la hipertrofia ventricular izquierda. Así, el tratamiento con vitamina D parece tener un potencial protector para mejorar la miocardiopatía diabética a expensas de modular la señalización del VDR, en parte a través de la vía PARP1/SIRT1/mTOR21. En detalle, SIRT1 potencia enzimáticamente la señalización de la vitamina D a través de la desacetilación del VDR, lo que resulta de interés desde que se conoce que SIRT1 es una enzima con actividad desacetilasa que contribuye a la viabilidad celular22. Por otro lado, mTOR es regulada por los niveles de la vitamina D y sus receptores. mTOR es una proteína con actividad serina/treonina quinasa y funciona como un componente esencial de complejos conservados en eucariotas. La proteína mTOR regula una gran variedad de procesos, como el crecimiento, proliferación, motilidad, transcripción y traducción23. Además, los niveles de vitamina D pueden regular la actividad de PARP124, una proteína que pertenece a una familia de polimerasas que participan en un gran número de procesos celulares que implican principalmente reparación del ADN y muerte celular programada.
Por lo expuesto resulta evidente la noción de deficiencia de vitamina D y su impacto sobre el desarrollo de hipertrofia e inflamación del miocardio. Paralelamente, en múltiples investigaciones se ha demostrado una elevación en los niveles de proteínas de golpe de calor (HSP) en pacientes con hipertensión sistémica, enfermedad de la arteria coronaria, aterosclerosis carotidea, infarto de miocardio e isquemia25. Información de relevancia debido a que una de ellas, de peso molecular de 70kDa, Hsp70, puede interactuar con VDR antes de la activación de este último por la unión a su ligando endógeno, la vitamina D26. Este mecanismo nos permitiría inferir que el proceso inflamatorio elevaría los niveles de Hsp70, y esta podría interactuar con VDR en beneficio del miocardio.
Las HSP son un grupo de proteínas que originalmente fueron descriptas como activadas durante el aumento de la temperatura27, sin embargo, hoy se sabe que además son inducidas por el frío, el estrés, la hipoxia y la inflamación, entre otros factores. Según su peso molecular, han sido exhaustivamente clasificadas. Específicamente sobre Hsp70, las investigaciones han demostrado que esta familia de proteínas ayuda en procesos de plegado y montaje de proteínas recién sintetizadas, el repliegue de las proteínas agregadas, la translocación de la membrana, las proteínas secretoras, y el control de la actividad de regulación de múltiples proteínas estructurales y funcionales. También, las Hsp70 son producidas en grandes cantidades por las células como respuesta al estrés mecánico o isquémico y la estimulación con citosinas. Actúan como un mecanismo ancestral altamente conservado de protección frente a diversas condiciones adversas. Dentro de la célula, las HSP actúan como verdaderas chaperonas moleculares, esto es, facilitando el ensamblaje correcto de las proteínas así como la translocación de oligómeros, pero también favorecen la eliminación de las proteínas que están dañadas de forma irreversible. Son activadas por citoquinas proinflamatorias y regulan la apoptosis28-30.
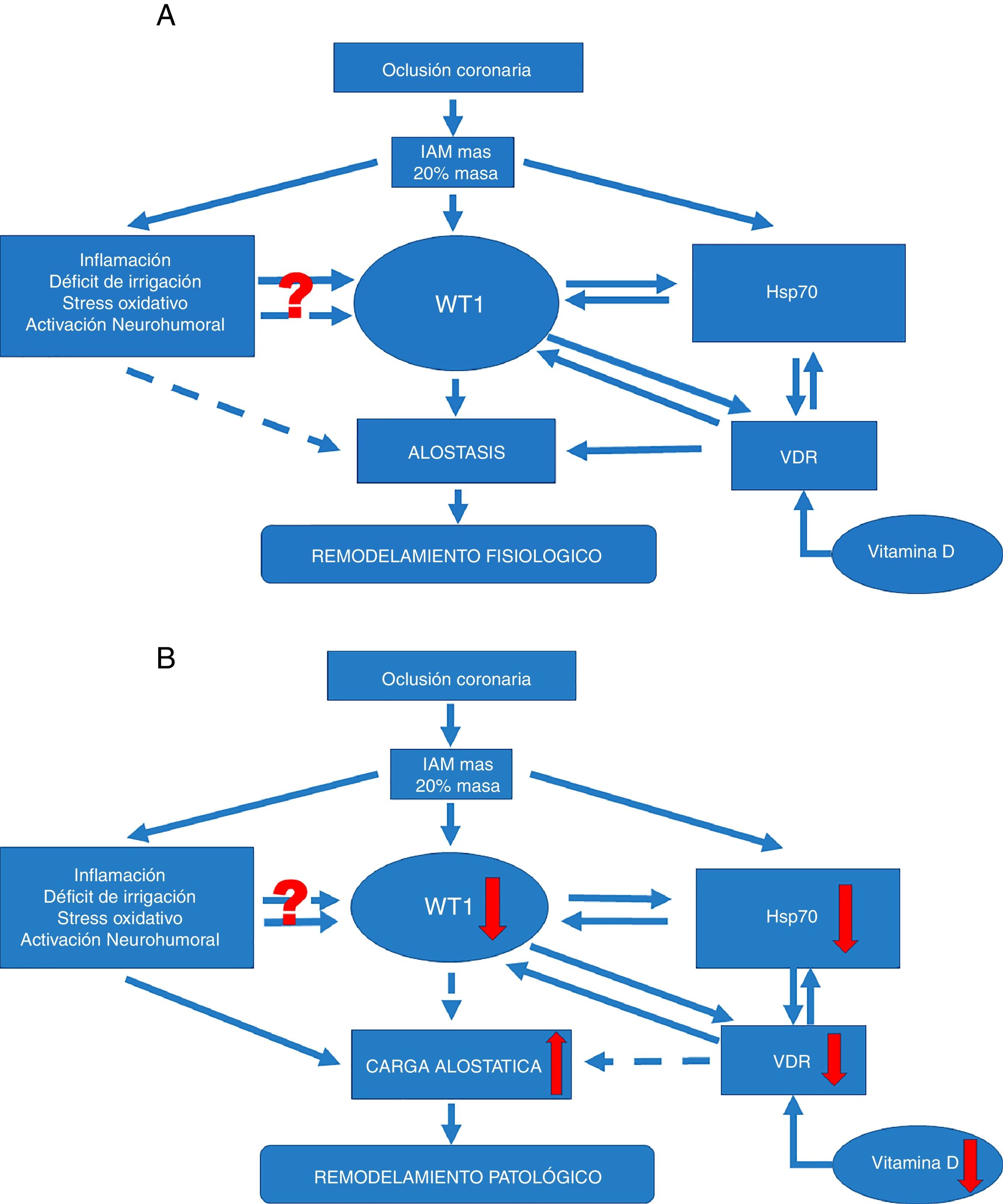
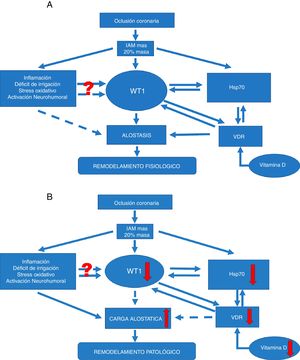
La modulación que ejercen estas chaperonas puede conducir a regular diversos procesos relacionados con la aterosclerosis, como el estrés oxidativo, la inflamación y la apoptosis (fig. 2A). Dicha regulación propiciaría la regulación positiva de WT1 como factor asociado en la vía de señalización para disminuir el efecto deletéreo de los procesos de remodelado. En este sentido, los niveles de Hsp70 parecen exhibir un efecto protector contra la isquemia. El aumento de la expresión de Hsp70 mejoraría la recuperación de corazones isquémicos. Hsp70 funciona como un cofactor clave para la función de WT1, y en este sentido, ha sido demostrado un papel clave potencial para esta chaperona durante la diferenciación renal. Además, muy recientemente ha sido sugerido este mismo mecanismo a nivel cardiaco. También se ha demostrado que la expresión de WT1 sería modulada por la disponibilidad del óxido nítrico (ON)31. Esto es relevante, desde que se conoce que los niveles de ON condicionarían la expresión de Hsp70, y así podría postularse que Hsp70 funcionaría como un factor central en la regulación de la expresión de WT1 durante el remodelado miocárdico favoreciendo la expresión y formación de neovasos en el área infartada. Esta hipótesis estaría respaldada por el hallazgo original que describe la importancia de Hsp70 para la funcionalidad de WT117 (fig. 2B).
Vías de señalización. (A) Vía de señalización en remodelado ventricular fisiológico. Si una oclusión coronaria determina un área infartada igual o superior al 20%, esto puede condicionar el remodelado fisiológico-alostático. Este mecanismo involucra factores conocidos, como la inflamación, la hipoxia tisular, el estrés oxidativo, entre otros. Pero también induce la expresión de factores menos conocidos, como el factor de transcripción WT1 y la proteína de respuesta a estrés Hsp70. Además, otro efector poco conocido, como la vitamina D y sus receptores, favorecería las acciones de Hsp70 así como WT1 y consecuentemente el remodelado fisiológico-alostático. No resulta claro aún de qué manera la inflamación, el déficit de irrigación, el estrés oxidativo y la activación neurohumoral podrían actuar modulando la expresión de WT1 y menos el hecho de que este efecto resulta temporal. Las flechas continuas indican inducción, mientras que las discontinuas indican inhibición. Por alostasis se entiende a los mecanismos de ajuste biológico que poseen valores de ajuste mayores que los regulados por homeostasis. Estos serían capaces —temporalmente— de adaptación dentro de una cierta inestabilidad como la verificada en el IAM.
(B) Vía de señalización en remodelado ventricular fisiopatológico. Si la oclusión coronaria determina un área infartada igual o superior al 20%, esto puede condicionar el remodelado fisiopatológico por carga o sobrecarga alostática. Este mecanismo patológico involucra factores conocidos, como son la inflamación, la hipoxia tisular, el estrés oxidativo, entre otros. Del mismo modo que para el remodelado fisiológico, aquí también se involucran factores menos conocidos pero con caída de los mismos. Reducción en la expresión del factor de transcripción WT1 y la proteína de respuesta a estrés Hsp70. También se ve afectado otro efector poco conocido, como es la vitamina D y sus receptores; alteraciones que favorecerán el desarrollo del remodelado fisiopatológico. Nuevamente se pone de manifiesto que no resulta claro aún de qué manera la inflamación, el déficit de irrigación, el estrés oxidativo y la activación neurohumoral podrían actuar modulando la expresión de WT1 y menos el hecho de que este efecto resulta temporal. Las flechas continuas indican inducción, mientras que las flechas discontinuas indican inhibición. La carga alostática representa los mecanismos involucrados en la respuesta alostática —activados en tiempo y forma— para permitir una efectiva adaptación pero que si no se inactivan también en tiempo y forma adecuada pueden causar daños en el organismo y en los sistemas involucrados con la alostasis.
Estos mecanismos de adaptación sobrerregulados por mecanismos aún no esclarecidos durante la inestabilidad del IAM podrán determinar el denominado remodelado fisiopatológico por sobrecarga alostática.
Finalmente, un muy reciente estudio, realizado en el corazón del pez cebra sobre microARN involucrados en la activación del epicardio durante la regeneración del corazón, evaluó a WT1 como marcador de epicardio, Hsp70 como chaperona activada durante la regeneración y la troponina T cardiaca (cTnT), un marcador de cardiomiocitos diferenciados. Los resultados informaron que WT1 y Hsp70 marcan el sitio de regeneración cardiaca 2-3 días después de la resección ventricular, lo que refuerza su importancia y posible interacción32.
Conclusiones y perspectivasEl remodelado ventricular aparece en el marco del IAM e implica cambios que aumentan la morbimortalidad a largo plazo. La restitución temprana del flujo es un acto de comprobada eficacia, así como el uso de los betabloqueantes, inhibidores de la enzima convertidora de angiotensina y estatinas. De interés, existen nuevos avances en el conocimiento de mecanismos implicados en el desarrollo de posibles tratamientos que proponen reponer células miocárdicas perdidas. Concretamente, WT1, su relación con el pericardio y la formación de células para nuevos vasos sería una nueva vía de tratamiento para mantener activa la regeneración de células y así limitar la progresión a largo plazo, favoreciendo a este grupo de pacientes. Además, la utilización de vitamina D es uno de los instrumentos que se postula permitiría —a través del VDR y en su asociación con Hsp70— mantener activo por más tiempo a WT1 logrando un remodelamiento fisiológico y favorable. La mayor profundización de los mecanismos fisiopatológicos puestos en juego durante el IAM nos permitirá postular nuevas estrategias en el tratamiento de las complicaciones y tratar de manera más agresiva, con la intención de prevenir, atenuar o, aún mejor, revertir el daño progresivo durante el remodelado fisiopatológico post-IAM.
FinanciaciónAgradecemos los siguientes apoyos para la investigación, autoría y publicación de este artículo: Consejo de Investigación y Tecnología de la Universidad de Cuyo (SECyT), Mendoza, Argentina, y Agencia Nacional de la Investigación Científica y Técnica (ANPCyT); ambos fueron adjudicados a Walter Manucha. Subvención PICT 2016-4541.
Conflicto de interesesNinguno de los autores declara conflicto de intereses con el contenido del manuscrito.