Introducción
La lipoproteína de baja densidad (LDL) electronegativa (LDL[]) es una fracción minoritaria de la LDL con mayor carga negativa presente en la circulación plasmática1-3. La proporción de esta partícula se encuentra aumentada en enfermedades de alto riesgo cardiovascular como la hipercolesterolemia familiar4 o la diabetes mellitus5. Diferentes estudios sugieren un papel aterogénico y proinflamatorio de la LDL(). Esta lipoproteína puede inducir en cultivos de células endoteliales apoptosis6 y/o citotoxicidad7,8, procesos que frecuentemente aparecen en las lesiones ateroscleróticas. Además, la LDL() promueve la liberación de moléculas inflamatorias al interaccionar con células endoteliales, que es una de sus propiedades más relevantes. Concretamente, en este tipo celular la LDL() induce las quimiocinas interleucina (IL)-8, monocyte chemotactic protein 1 (MCP-1) y growth-related oncogene (GRO), la citocina IL-6, el factor de crecimiento GM-CSF y la molécula de adhesión VCAM9-12.
La LDL(), al estar presente en el plasma, podría interaccionar, además de con las células endoteliales, con otros tipos celulares presentes en circulación, como las células mononucleares. Estas células son muy relevantes en el inicio de la lesión arteriosclerótica, en la que monocitos y linfocitos son atraídos al endotelio y penetran en la íntima arterial donde inducen una amplia gama de mediadores inflamatorios13. Si la LDL() activara los leucocitos ya en circulación o atraídos al endotelio, esta lipoproteína modificada estaría potenciando la respuesta inflamatoria que se da en la lesión arteriosclerótica, favoreciendo el reclutamiento de leucocitos, así como promoviendo el avance de la lesión. Sin embargo, no se ha evaluado los efectos de la LDL() sobre células mononucleares; éste es el objetivo del presente trabajo. Concretamente, se analizaron moléculas inflamatorias implicadas en el proceso arteriosclerótico que son inducidas por la LDL() en monocitos y linfocitos humanos, mediante un sistema de array de proteínas que permite una detección simultánea de moléculas. Posteriormente, se cuantificó la cantidad de las proteínas inducidas por la LDL() y el número de copias de ARN que codifican para éstas.
Material y métodos
Obtención de las fracciones de LDL
Se utilizó plasma-EDTA procedente de voluntarios normolipémicos (colesterol total < 5 mmol/l, triglicéridos < 1,3 mmol/ l), normoglucémicos y normotensos. Para conseguir la cantidad de muestra necesaria para llevar a cabo los experimentos se hicieron mezclas de plasma de distintos individuos. La LDL total (1,019-1,050 kg/l) se aisló mediante ultracentrifugación secuencial de flotación a 4 ºC y con 1 mmol/l de EDTA.
La LDL total se fraccionó en LDL(+) y LDL() mediante cromatografía de intercambio aniónico con un gradiente salino escalonado, utilizando una columna preparativa HiLoad 26/10 Q-Sepharose High Performance (GE Healthcare) adaptada a un sistema de AKTA-FPLC (GE Healthcare), siguiendo la metodología descrita14. Posteriormente se concentraron las fracciones por ultracentrifugación y se conservaron a 4 ºC hasta el momento de realizar los experimentos, que se desarrollaron en un período de 2 días.
Composición y características físico-químicas
El contenido de las LDL en colesterol total, triglicéridos y apolipoproteína B (apoB) (Roche Diagnostics), y en fosfolípidos totales, colesterol libre y ácidos grasos no esterificados (Wako Chemicals) se determinó en un autoanalizador Hitachi 911.
Las diferencias en electronegatividad de las 2 fracciones se confirmaron por movilidad electroforética utilizando geles de agarosa comerciales (Biomidi).
Aislamiento de células mononucleares
A partir de sangre periférica de voluntarios se aislaron monocitos y linfocitos humanos mediante centrifugación en gradiente de densidad15 (LinfoSep, Biomedics). Se sembraron inóculos de 106 células/ml en placas de cultivo y después de 4 h se separaron los 2 tipos celulares entre sí a partir de la capacidad adhesiva de los monocitos. Se controló la correcta separación de los tipos celulares mediante la tinción May Grünwald/ Giemsa y se valoró la viabilidad celular por el ensayo de LDH (Roche) y la tinción con bromuro de etidio-naranja de acridina. Las células fueron cultivadas a 37 ºC y 5% CO2 en medio RPMI 1640 (Biowhittaker) completo (suplementado con 10% suero bovino fetal [SBF], 2 mmol/l glutamina, 1 mmol/l piruvato sódico, 0,1 U/l penicilina y 100 mg/l estreptomicina).
Por otra parte, se probaron líneas celulares de linfocitos Jurkat (ATCC TIB-152) y de monocitos THP-1 (ATCC TIB-202) y MonoMac-6 (amablemente cedidas por el Dr. Enric Espel, del Departament de Fisiologia, Facultat de Biologia, Universitat de Barcelona).
Incubación de células mononucleares con las fracciones de LDL
A las 24 h se realizó el experimento de incubación de los monocitos y linfocitos con las diferentes fracciones de LDL; en este punto el medio completo fue cambiado por medio deficiente en lipoproteínas (medio RPMI 1.640 completo con sólo el 1% de SBF). Previamente a la incubación, se dializó las 2 fracciones de LDL frente medio deficiente en lipoproteínas en columnas Sepharose G25M (GE Healthcare) y se filtró en condiciones estériles. Se incubaron las células con las fracciones de LDL (150 mg apo B/l) o LPS (0,1 mg/l) como control positivo de inducción de citocinas. La incubación tuvo lugar a 37 ºC durante 20 h en los experimentos de valoración de proteínas, y durante 4 y 20 h en el caso de estudios de transcripción. El sobrenadante del medio de cultivo y, en su caso, el pellet celular, se guardaron a 80 ºC hasta el momento de su valoración o procesado.
Array de proteínas
A partir de los sobrenadantes celulares se determinó la liberación en el medio de cultivo de moléculas relacionadas con la inflamación mediante el sistema de detección simultánea RayBioTM Human Cytokine Array III (Ray Biotech). Este array de proteínas, en el que las moléculas son reconocidas mediante anticuerpos, permite la detección simultánea de 42 citocinas, quimiocinas y mediadores inflamatorios. Se incubó las muestras con las membranas del array y se procesaron según las instrucciones del fabricante10. La detección de señal quimioluminescente se determinó mediante densitómetro (Chemi Doc, Bio-Rad. Quantity One 1-D Analysis software).
Ensayos de ELISA
Después de conocer las citocinas inducidas por la LDL(), se realizaron otros experimentos con el objetivo de confirmar y cuantificar los resultados positivos obtenidos con el array de proteínas. Previamente, se realizaron cinéticas de liberación de las citocinas inducidas para valorar a lo largo del tiempo la liberación de cada molécula. Se incubaron monocitos y linfocitos con las LDL, se recogieron alícuotas del medio de cultivo de las células a diferentes tiempos (3, 6, 11, 22, 34 y 48 h) y se valoraron por ELISA las moléculas liberadas. Estas cinéticas permitieron conocer el tiempo óptimo de incubación de las células con las muestras. Se escogió recoger los sobrenadantes celulares de los experimentos posteriores a las 20 h de incubación.
Así pues, se realizaron los experimentos de cuantificación incubando las células durante 20 h y valorando los sobrenadantes mediante ELISA. La IL-6, IL-8, IL-10 y MCP-1 se valoraron mediante ELISA comerciales siguiendo las instrucciones del fabricante (Bender MedSystems). Para GROß y GRO* se adaptó un método mediante anticuerpos policlonales (PeproTech), peroxidasa conjugada con estreptavidina (Sigma) y sustrato TMB (Calbiochem)10. Los sobrenadantes celulares se diluyeron según la citocina evaluada: IL-10 (1/3), MCP-1 (1/6), IL-6 e IL-8 (1/10), y GROß y GRO* (1/40)10.
Ensayos de PCR a tiempo real (RT-PCR)
Se realizaron experimentos con el objetivo de evaluar si la producción de las citocinas era inducida a nivel transcripcional. La primera aproximación fue incubar las células con actinomicina D (Sigma) (1 mg/l) para inhibir la transcripción del ADN. Por otro lado, se llevaron a cabo estudios en los que se evaluó por reacción en cadena de la polimerasa a tiempo real (RT-PCR) la expresión de los genes de las citocinas inducidas. Para ello, después de la incubación de 4 o 20 h, se recogió las células en condiciones libres de ARNasas y se congelaron a 80 ºC. La extracción de ARN se realizó con el kit de extracción RNeasy minikit (Qiagen) siguiendo las instrucciones del fabricante. La transcripción reversa se llevó a cabo a partir de 1 µg de ARN de cada muestra con la transcriptasa reversa H- (Promega). El análisis cuantitativo de ARN se realizó por RT-PCR (AbiPrism 7000; Applied Biosystems). Se estudió la expresión de ARN mensajero (ARNm) de los genes seleccionados usando sondas prediseñadas validadas (assays-on-demand; Applied Biosystems) y se utilizó ß-actina humana como control interno de expresión constitutiva de ARN.
Análisis estadístico
Los resultados se expresan como media ± desviación estándar. Las diferencias entre grupos de datos apareados se analizaron con la prueba de Wilcoxon. Se consideró significativa una significación de p < 0,05.
Resultados
Composición y características físico-químicas de las LDL
La composición lipídica y proteica de las 2 fracciones de LDL coincidió con las caracterizaciones descritas sobre la LDL(+) y la LDL(). La LDL(-) presentó, de forma significativa, un incremento en el contenido de colesterol libre, triglicéridos y ácidos grasos no esterificados, y una disminución en los valores de apoB (datos no mostrados) de acuerdo con resultados previos9. Igualmente, la movilidad electroforética fue mayor en la LDL() debido a su carga electronegativa aumentada (datos no mostrados).
Array de proteínas
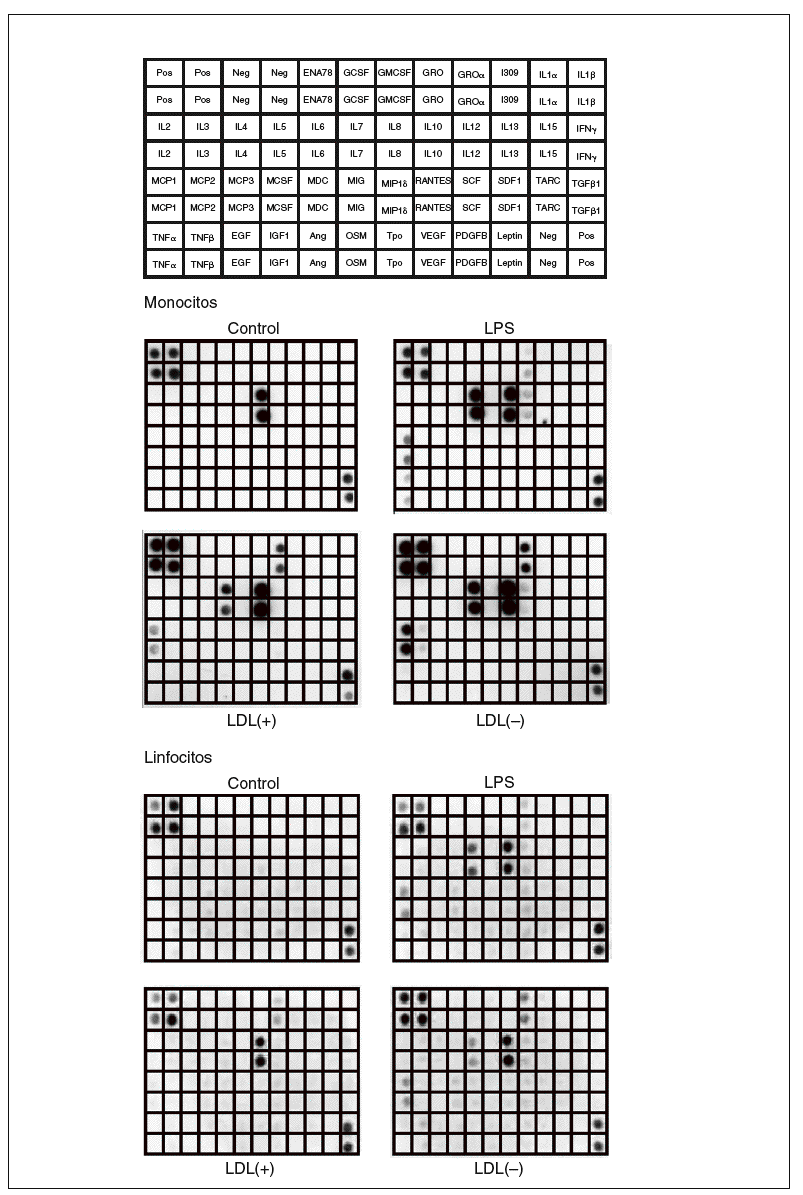
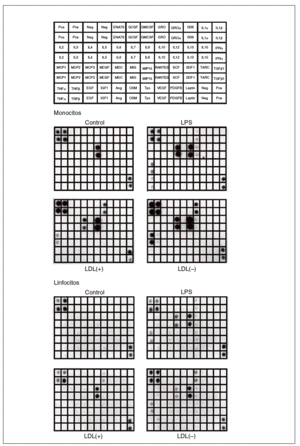
Los resultados obtenidos al valorar los sobrenadantes celulares de monocitos y linfocitos humanos mediante el array de citocinas humanas III (RayBiotech) se muestran en la figura 1. Los monocitos sin ningún estímulo liberaron la quimiocina IL-8. En presencia de LDL(+) aumentó la liberación de IL-8, e indujo la producción de GRO, IL-6 y MCP-1. Estos efectos se vieron incrementados cuando se incubaron los monocitos con LDL(), y además se indujo la liberación de IL-10 y MCP-2. El control positivo (LPS) produjo unos efectos proinflamatorios parecidos a los de la LDL() y también indujo TNF*.
Figura 1. Membranas del array de proteínas que muestran los resultados de los sobrenadantes de monocitos y linfocitos incubados con LDL(+), LDL(), lipopolisacárido (LPS) o sin ningún estímulo (control). En la figura superior se muestra la distribución en la membrana de las diferentes moléculas detectables por el array de citocinas humanas III (RayBiotech) utilizado. Imágenes de un experimento representativo de n = 2. Neg: control negativo del array; Pos: control positivo del array.
Respecto a los linfocitos, las células control no presentaron producción basal de ningún mediador inflamatorio detectable mediante el array. La LDL(+) indujo la secreción de IL-8 y GRO, mientras que la LDL() potenció más esta liberación e indujo la producción de IL-6, IL-10 y MCP-1. La incubación con LPS aumentó la producción de estas moléculas y también de pequeñas cantidades de RANTES.
La respuesta observada en las líneas celulares de Jurkat, THP-1 y MonoMac-6 fue notablemente inferior que la de las células aisladas de sangre (datos no mostrados). Por tanto, se optó por utilizar monocitos y linfocitos aislados de sangre periférica humana, que además son un modelo más fisiológico que las líneas celulares.
Cinéticas de liberación de citocinas
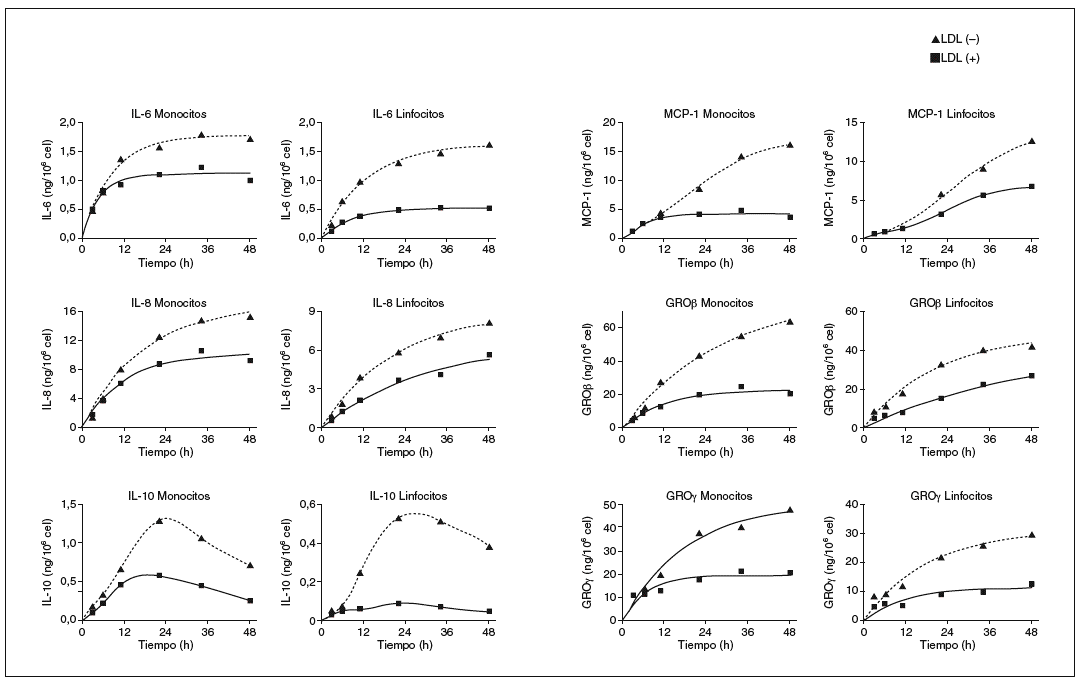
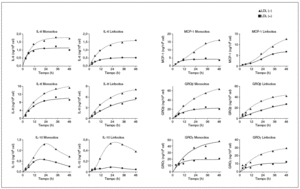
Después de determinar las citocinas inducidas por la LDL() en monocitos y linfocitos humanos, se realizaron nuevos experimentos para valorar a lo largo del tiempo la liberación de cada molécula. En la figura 2 se muestran las cinéticas de liberación de cada citocina inducida por la LDL() y la LDL(+). En general, se observa una respuesta creciente de las células a las fracciones de LDL, la respuesta es rápida a tiempos cortos y a las 24-36 h empieza a saturarse. La cinética de MCP-1 a las 48 h continúa sin saturarse, mientras que la de IL-10 presenta un máximo de liberación a las 20 h y un descenso a tiempos más largos, tanto en monocitos como en linfocitos. Esta información permitió confirmar que el tiempo de incubación de 20 h era adecuado para observar la respuesta diferencial entre la LDL(+) y la LDL() para la mayoría de las citocinas. Además, a tiempos más largos no aumenta la diferencia y disminuye la viabilidad celular (viabilidad celular a las 20 h: 89-94%; y a las 48 h: 80-86%).
Figura 2. Cinéticas de liberación de citocinas después de incubar monocitos y linfocitos con LDL(+) y LDL(), y cuantificar las citocinas liberadas mediante el método de ELISA. Resultado de un ejemplo representativo de n = 3. GRO: growth-related oncogene; IL: interleucina; LDL: lipoproteína de baja densidad; MCP-1: monocyte chemotactic protein1.
Estudios de cuantificación mediante ELISA
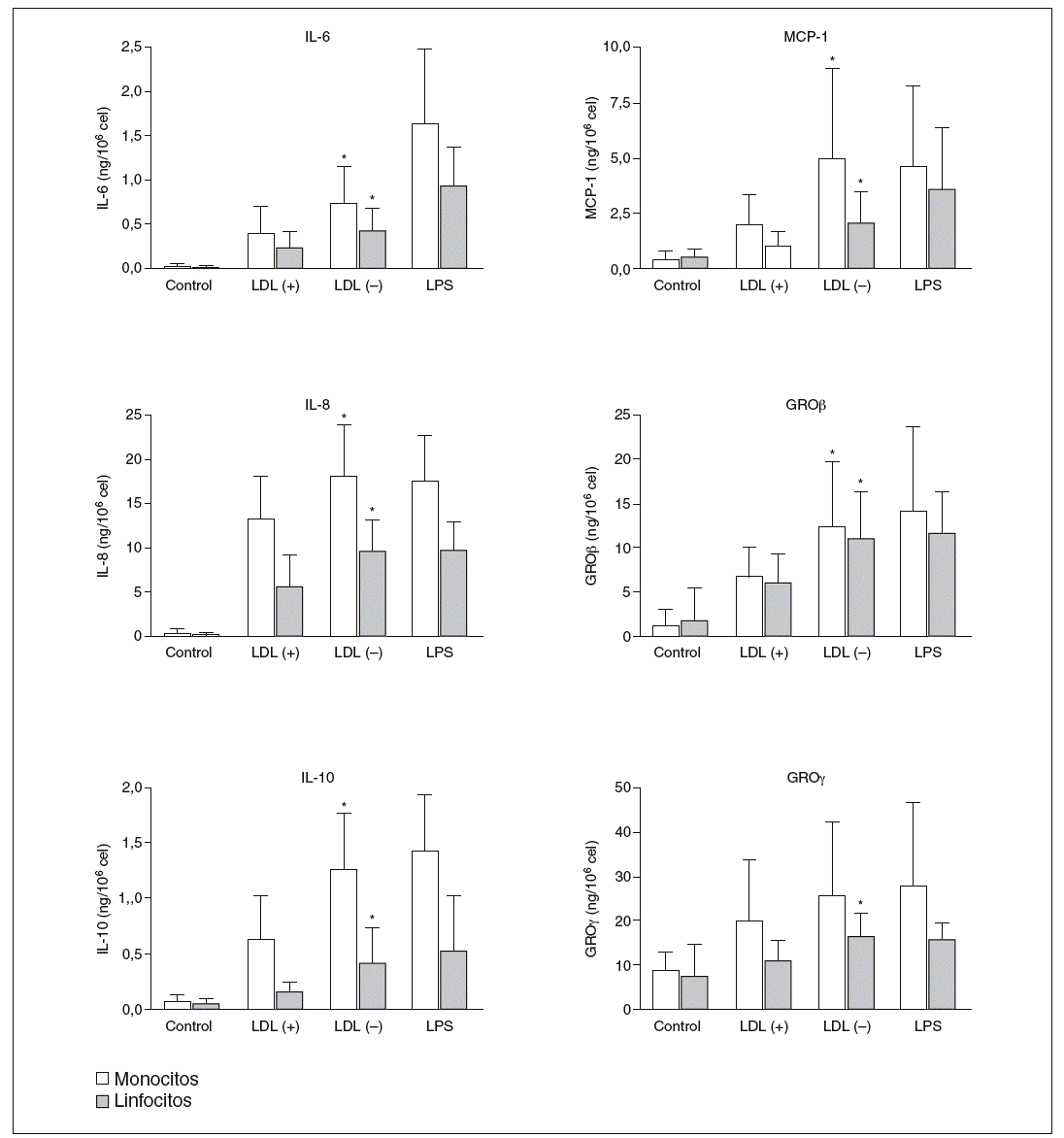
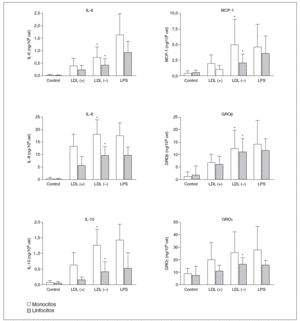
Los resultados positivos del array de proteínas se evaluaron y cuantificaron mediante ELISA. Respecto a GRO, en la LDL() se observó señal en la posición GRO, que según el sistema de array puede detectar GRO*, GROß y/o GRO*, pero no apareció señal en la posición concreta de GRO*. De estos resultados se deduce que las moléculas inducidas por la LDL() son GROß y/o GRO*, por lo que se evaluaron por ELISA estas 2 moléculas. La figura 3 muestra la producción de citocinas liberadas por monocitos o linfocitos en respuesta a LDL(+), LDL(), LPS o de las células sin nin gún estímulo (control). Se puede observar una mayor liberación de citocinas por parte de los monocitos respecto a los linfocitos en todas las citocinas, excepto en GROß donde la producción es similar en ambos tipos celulares. En la ma yoría de los casos la LDL() indujo una liberación de citocinas significativamente mayor que la LDL(+). La inducción de citocinas por la LDL() respecto la LDL(+), restando la producción ba sal, fue de 1,4 a 3,6 veces más según la citocina (tabla 1).
Figura 3. Producción de citocinas, valoradas por ELISA, por parte de monocitos y linfocitos incubados durante 20 h con LDL(+), LDL(), lipopolisacárido (LPS) o sin estímulo (control).
GRO: growth-related oncogene; IL: interleucina; LDL: lipoproteína de baja densidad; MCP-1: monocyte chemotactic protein1. *p < 0,05 LDL() frente a LDL(+) restando la producción basal (n = 15).
Inducción transcripcional
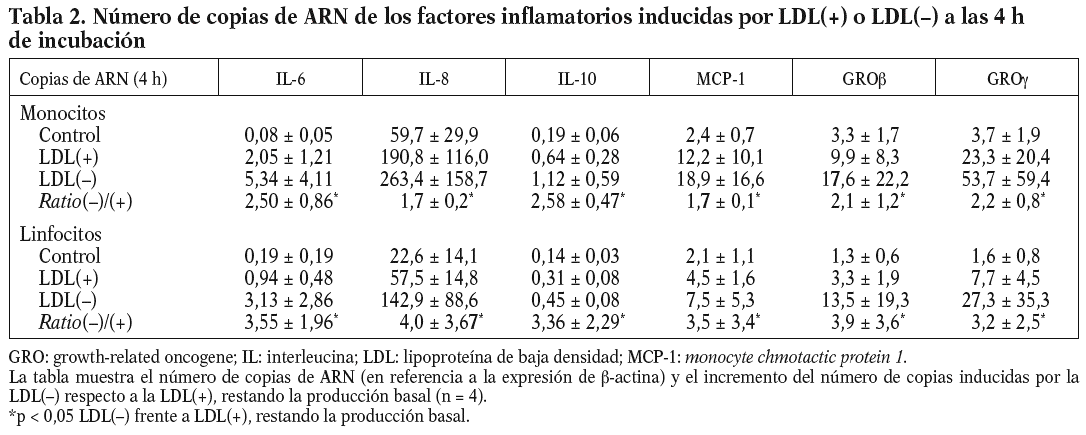
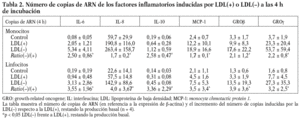
Se realizaron experimentos con el objetivo de establecer si la liberación de factores inflamatorios por efecto de la LDL() era inducida por mecanismos transcripcionales. La primera aproximación fue incubar las células con actinomicina D, lo que inhibió la liberación de citocinas inducidas por la LDL() de entre 60-100%, dependiendo de la citocina evaluada (n = 3) (datos no mostrados). También se llevaron a cabo estudios en los que se evaluó por RT-PCR la expresión de los genes que codifican para las citocinas inducidas por la LDL(). Para ello, monocitos y linfocitos se incubaron durante 4 o 20 h con los estímulos antes de realizar la extracción de ARN y el ensayo de RT-PCR (n = 4). El número de copias de ARN fue mayor a las 4 h que a las 20 (datos no mostrados); este descenso de ARN en el tiempo no coincide con la acumulación creciente de proteína que se observa en las cinéticas de liberación (excepto la de la IL-10) dado que las proteínas llevan un retraso respecto al ARN y se acumulan en el sobrenadante celular en lugar de ser degradadas. De todos modos, la diferencia en la inducción de la LDL() respecto la LDL(+) se mantuvo igual, tanto a las 4 como a las 20 h, y coincidió con los resultados de proteínas. En la tabla 2 se muestra el número de copias de ARN de las distintas citocinas inducidas a las 4 h de incubación. En resumen, estos resultados indican que la LDL() induce la liberación de citocinas en las células mononucleares a nivel transcripcional.
Discusión
La LDL() es una fracción modificada de LDL que parece estar implicada en el desarrollo de la arteriosclerosis ya que se le han atribuido propiedades inflamatorias; una de las más importantes es la liberación de citocinas en células endoteliales2. En este aspecto, en el presente trabajo se ha estudiado el efecto que puede tener la LDL() sobre otro tipo celular, el de las células mononucleares, con las que es muy probable su interacción en la circulación plasmática. Los resultados obtenidos reafirman la evidencia de que la LDL() presenta una amplia acción inflamatoria, ya que esta LDL modificada fue capaz de inducir en células mononucleares la liberación de diversos factores relacionados con la inflamación que actúan en distintas etapas del proceso aterosclerótico.
Una de las fases iniciales de la aterogénesis, como es el reclutamiento de leucocitos hacia las áreas lesionadas, parece estar potenciada por la LDL() a través de la liberación de factores quimiotácticos. En células endoteliales ya se había descrito una secreción aumentada de las quimiocinas IL-8 y MCP-1 inducida por la LDL()9,12, y recientemente de GRO10,12. En este trabajo, monocitos y linfocitos en respuesta a la LDL() también presentan una transcripción y liberación incrementada de las mencionadas quimiocinas (IL-8, MCP-1, GROß y GRO*). De esta forma, la LDL(), a través de la producción de distintas quimiocinas liberadas por monocitos y linfocitos, puede estimular el reclutamiento de células T y neutrófilos (atraídos por IL-8 y GRO), y monocitos (atraídos también por IL-8 y GRO, y además, por MCP-1,). A su vez, los leucocitos activados producirán más quimiocinas, amplificando aún más la respuesta inflamatoria.
La LDL(), además de inducir la secreción de moléculas involucradas en el reclutamiento de leucocitos, también induce en monocitos y linfocitos la producción de IL-6 que participa en otras acciones de la respuesta inflamatoria. Se trata de una citocina con efectos pleiotrópicos, como el interferón alfa o IL-1ß, que está involucrada en múltiples funciones. Fue originariamente identificada como un factor diferenciador de células B, y una de sus principales funciones es promover la producción de anticuerpos16. También se trata de un mediador importante de la respuesta inflamatoria de la fase aguda ya que induce la expresión de varios genes relacionados, como el de la proteína C reactiva (CRP). Se ha observado que individuos con enfermedades arteriales coronarias presentan valores plasmáticos de CRP incrementados17. Dado que la proporción de LDL() está aumentada en individuos con enfermedad coronaria18,19, podría ser que la producción incrementada de IL-6 inducida por parte de la LDL() contribuya al estado sistémico proinflamatorio de estos individuos.
Las moléculas estimuladas por la LDL() citadas hasta ahora presentan propiedades proinflamatorias y son producidas también por células endoteliales arteriales12 y venosas9,10. En cambio, monocitos y linfocitos, en respuesta a la LDL(), también secretan IL-10, considerada una citocina antiinflamatoria. La IL-10 es una citocina que puede inhibir la producción y/o efecto de otras citocinas, modulando de este modo la respuesta inflamatoria20. Además, también inhibe otros procesos celulares importantes en la progresión de la placa de ateroma, rotura o trombosis, como son la activación del factor nuclear-*B, la producción de metaloproteínas o del factor tisular21.
De este modo, la LDL() al secretar IL-10 podría regular la liberación de los otros factores inflamatorios, disminuyéndolos. De manera que, sin la acción de esta citocina antiinflamatoria, aún habría una mayor secreción de las citocinas proinflamatorias anteriores, hecho que promovería el avance de la lesión. Así pues, la LDL() provoca la liberación de factores proinflamatorios, pero también de factores antiinflamatorios por lo que se produce un balance de las distintas moléculas. Este efecto inesperado de la LDL(), una lipoproteína teóricamente proinflamatoria, requiere el desarrollo de estudios dirigidos a definir el papel de la IL-10 en la respuesta celular inducida por la LDL().
Por otra parte, observando las cinéticas de liberación de IL-10, en monocitos y en linfocitos, había un máximo de secreción a las 24 h y un posterior descenso de la concentración a 36 y 48 h. También se observa por RT-PCR una inhibición con el tiempo que concordaría con estos datos. Esta disminución de IL-10 a tiempos más largos, que no vemos en las otras citocinas, ya se ha descrito por otros autores en monocitos sin estímulo22, hecho que explican debido a que la IL-10 liberada se une a la superficie de los monocitos.
En conclusión, los resultados obtenidos sugieren la naturaleza proaterogénica de la LDL, ya que estimula monocitos y linfocitos a producir citocinas y quimiocinas que tienen funciones importantes en varias etapas del desarrollo de la arteriosclerosis, como son el reclutamiento de leucocitos o la inducción de un estado sistémico proinflamatorio. A su vez, la LDL() también estimula la liberación de IL-10 que puede estar involucrada en la modulación de esta respuesta inflamatoria.
Agradecimientos
Los autores quieren agradecer las aportaciones de muestras de los voluntarios y del personal encargado de la extracción de sangre.