La hipercolesterolemia familiar (HF) heterocigota es un trastorno genético del metabolismo de las lipoproteínas que conlleva un riesgo cardiovascular (RCV) muy elevado. El estudio de la pared arterial y su función son de especial interés en pacientes con HF. La rigidez arterial está asociada a un incremento del RCV. El objetivo del estudio fue determinar la rigidez arterial en pacientes con HF y su asociación con parámetros bioquímicos y vasculares.
MétodosSe incluyeron 125 pacientes con HF y 59 controles sanos (GC). Se obtuvieron datos clínicos, antropométricos y parámetros bioquímicos. Se determinó la rigidez arterial basada en el índice de aumento ajustado por 75 latidos por minuto (IAx@75), mediante tonometría arterial periférica, el grosor íntima-media carotídeo (GIMc) y el índice tobillo-brazo (ITB).
ResultadosLos pacientes con HF presentaron un incremento significativo en el IAx@75 con respecto a GC (9,8±18,3 vs. 2,4±11,1%; p=0,011), también un mayor GIMc (0,758±0,280 vs. 0,635±0,160mm; p<0,001). El ITB no mostró diferencias entre grupos. El IAx@75 se correlacionó positivamente con las concentraciones de c-LDL, c-noHDL, Apolipoproteína-B100 (Apo-B100), triglicéridos y sE-selectina. La Apo-B100, la presión arterial sistólica y la glucosa fueron los mayores determinantes del IAx@75. El IAx@75 (β=0,224; p=0,014) fue un determinante independiente del GIMc.
ConclusionesLos pacientes con HF presentan rigidez arterial incrementada. El IAx@75 está asociado con las concentraciones de Apo-B100 y es un determinante del GIMc. El IAx@75 podría utilizarse como marcador precoz de RCV en pacientes con HF.
Familial hypercholesterolemia (FH) is a genetic disease of lipoprotein metabolism conferring a high cardiovascular risk (CVR) to patients. Arterial wall properties and function study are of interest in FH subjects. Arterial stiffness is associated with a higher CVR. The aim of our study was to determine the arterial stiffness in FH patients and its association with vascular and biochemical parameters.
MethodsOne hundred and twenty-five FH subjects and 59 healthy volunteers were included. Clinical, anthropometrical and biochemical data were collected. Vascular studies were performed by measuring the augmentation index adjusted for 75 beats per minute of heart rate (AIx@75) as an arterial stiffness marker by peripheral artery tonometry, the carotid intima media thickness (cIMT) by ultrasonography and the brachial-ankle index (ABI).
ResultsFH patients showed a significant increase in the AIx@75 respect to control group (CG) (9,8±18,3 vs 2,4±111,1%; p=0,001), and higher cIMT (0,758±0,280 vs 0,635±0,160mm; p<0,001). We did not observe differences in ABI between groups. The AIx@75 values were directly correlated with LDL cholesterol, Apolipoprotein-B100 (Apo-B 100), triglycerides and sE-selectin. Apo-B100, systolic blood pressure and fasting glucose were the main determinants of the AIx@75. AIx@75 was also an independent predictor of cIMT.
ConclusionsFH patients have increased arterial stiffness. The AIx@75 is clearly associated with Apo-B100 concentrations and it is a cIMT determinant. The AIx@75 may be an early marker of CVR in FH subjects.
La hipercolesterolemia familiar (HF) heterocigota es un trastorno genético que se transmite de forma autosómica dominante. Se caracteriza por elevaciones muy importantes en las concentraciones plasmáticas de colesterol, que se detectan ya desde el nacimiento, y pueden desarrollarse lesiones vasculares tempranas que se manifiestan en forma de cardiopatía isquémica prematura. En la era previa a las estatinas, aproximadamente el 50% de pacientes con HF desarrollaban patología coronaria antes de los 60 años1,2. En la actualidad, el tratamiento intensivo de la hipercolesterolemia ha reducido la mortalidad cardiovascular hasta prácticamente alcanzar la tasa de la población general3,4. Las últimas guías publicadas para el manejo de la dislipidemia y avaladas por importantes sociedades científicas incluyen a los pacientes con HF dentro del grupo de pacientes de alto riesgo cardiovascular (RCV)5.
La disfunción del endotelio arterial se considera la alteración más precoz en el desarrollo de la arteriosclerosis. Estudios previos han demostrado que la función endotelial está alterada desde la infancia en pacientes con HF, mientras que otros parámetros de arteriosclerosis subclínica permanecen normales6. Diferentes métodos no invasivos son utilizados para identificar pacientes con riesgo de desarrollar enfermedad cardiovascular. Entre los métodos no invasivos podemos destacar la medición de la función endotelial, el grosor íntima-media carotídeo (GIMc) y la determinación del índice tobillo-brazo (ITB)7–9. Más recientemente, la rigidez de la pared arterial se ha considerado como un predictor preclínico de daño vascular. Para evaluar dicho factor, se han desarrollado múltiples índices, incluyendo la velocidad de onda de pulso aórtica (PWV) y el índice de aumento (IAx)10,11. La contracción del ventrículo izquierdo y la eyección rítmica de la sangre producen en la aorta y la arteria pulmonar ondas de pulso que se transmiten hasta los capilares. En condiciones normales, la onda de pulso se propaga a 5-6m por segundo, alcanzando al final de la sístole la totalidad del árbol arterial periférico. La elasticidad arterial, la viscosidad de la sangre y las bifurcaciones existentes en el árbol arterial son los factores que condicionan la velocidad con la que se propaga la onda de pulso. En las bifurcaciones arteriales es donde se generan ondas de pulso reflejas que se suman y se propagan parcialmente en dirección al corazón, alcanzándolo incluso antes que finalice la sístole. Si las arterias son muy rígidas, las ondas centrífugas y centrípetas se desplazan mucho más rápidamente, alcanzando el corazón en una fase más temprana de la sístole. Las implicaciones clínicas de la rigidez arterial aumentada son el incremento de la presión central sistólica, la presión de pulso central y el aumento de la carga ventricular favoreciendo la hipertrofia ventricular izquierda y la reducción de la perfusión coronaria durante la diástole, lo que conlleva el aumento del riesgo de isquemia coronaria. El análisis de la onda de pulso permite generar variables relacionadas con la rigidez arterial. El IAx es una medida de cuánto aumenta la presión de pulso arterial central y se calcula como el cociente entre el incremento (en mmHg) que ocasiona la onda reflejada sobre la onda original, dividido entre el total de la presión de pulso central (también en mmHg). Por lo tanto, consiste en la diferencia entre el primer y el segundo pico sistólico, expresada como porcentaje de la presión de pulso. El primer pico coincide con el momento en que la onda reflejada choca con la onda centrífuga. El segundo corresponde con la presión arterial sistólica (PAS) máxima. El IAx está relacionado con múltiples factores de RCV, incluyendo la edad, la hipertensión, la diabetes, la hiperhomocisteinemia y el tabaco12. En la cohorte de Framingham, la rigidez arterial medida mediante PWV se asoció a un incremento de riesgo en el desarrollo de episodios cardiovasculares, mejorando así la predicción de riesgo de los factores clásicos13.
La asociación entre la rigidez arterial y la dislipidemia en general, o la hipercolesterolemia en particular, no se conoce adecuadamente, y los datos de que disponemos en la actualidad son escasos y conflictivos14–16. Aunque se ha demostrado una asociación entre el incremento de la rigidez arterial y la hipercolesterolemia, su papel independiente en la elasticidad de la pared arterial no ha sido bien establecido todavía. La identificación de cambios en la pared arterial mediante métodos no invasivos contribuye a la estimación de riesgo elevado en etapas tempranas.
El principal objetivo de este estudio fue determinar la rigidez arterial mediante el IAx y su asociación con otros parámetros de arteriosclerosis subclínica, en un grupo de pacientes adultos con HF, controlados en una Unidad especializada de Medicina Vascular y Metabolismo.
Material y métodosPacientes del estudioSe incluyeron un total de 125 hombres y mujeres de entre 20 y 60 años de edad con HF controlados en la Unidad de Medicina Vascular y Metabolismo del Hospital Universitario Sant Joan de Reus, así como 59 individuos como grupo control (GC), comparables en edad y sexo. A todos los participantes se les realizó la historia clínica completa recogiendo los antecedentes familiares y personales, así como la presencia de otros factores de RCV. En la exploración física se buscaron con especial interés la presencia de estigmas de hipercolesterolemia familiar (xantomas, xantelasmas y arco corneal). Se recogieron los datos antropométricos, así como el tratamiento habitual. El diagnóstico de HF fue establecido mediante test genético (n=89) o bien basándose en los criterios clínicos de MedPed (n=34)17. Se excluyeron pacientes con antecedentes de enfermedad cardiovascular conocida, neoplasias y otras enfermedades crónicas. Todos los pacientes habían recibido tratamiento con estatinas con una mediana de 8±4años. El 66,6% de los pacientes con HF habían recibido tratamiento con estatinas en monoterapia y el 33,4% en combinación. La mayoría de los pacientes del estudio estaban tomando atorvastatina (82%), mientras que el 14% tomaban simvastatina. El resto estaba distribuido entre fluvastatina y pravastatina. Las dosis de estatinas fueron prescritas con la intención de alcanzar el objetivo terapéutico de c-LDL o bien la dosis máxima tolerada. Se indicó un periodo de lavado de 4 semanas para estatinas y ezetimiba y de 6 semanas para fibratos. Tras este periodo, se realizaron los estudios bioquímicos y vasculares. El estudio fue aprobado por el Comité de Ética de nuestro Hospital y todos los participantes firmaron el consentimiento informado.
Mediciones de la función arterialLa rigidez arterial fue determinada mediante el IAx utilizando la tonometría arterial periférica (PAT) (Endo-PAT 2000; Itamar Medical Ltd., Israel). La valoración se realizó a todos los participantes en un ambiente tranquilo, con una temperatura ambiental controlada entre 22-24°C, sin haber fumado ni haber realizado ejercicio físico las 24h previas. Para determinar las mediciones, el paciente permaneció cómodamente en posición de decúbito supino. Se colocó en el tercer dedo de cada mano un detector de amplitud de onda de pulso. Tras 5min de reposo, se indujo isquemia en un brazo probando mediante insuflación con un manguito de presión durante 5min, 20mmHg por encima de la presión sistólica determinada antes del inicio de la prueba. Se comparó la dilatación (antes y después de la isquemia) entre el brazo probando y el brazo control. De forma automática, el software calculaba el IAx mediante el análisis de las diferencias existentes entre la amplitud de onda de pulso antes y después de la isquemia. Posteriormente se calculó la variable IAx ajustada por 75latidos por minuto de frecuencia cardíaca (IAx@75).
Determinación del grosor íntima-media carotídeoEl GIMc de las arterias carótidas fue evaluado mediante un ecógrafo Accuson Sequoia 512 (Siemens Medical Solutions, Erlangen, Alemania), con un transductor lineal de alta resolución multifrecuencia 5-8MHz. Se realizaron un total de 6 mediciones: 3 en la carótida derecha y otras 3 en la carótida izquierda (carótida común [CC], bifurcación de la carótida [BC] y carótida interna [CI]). En todas las mediciones se utilizó el sofware Thicksoft para la evaluación del GIMc de las imágenes digitalizadas. La media del GIMc y la máxima del GIMc fueron determinadas mediante la media y la máxima de estas 6 determinaciones18.
Determinación del índice tobillo-brazoAntes de llevar a cabo la valoración del índice tobillo-brazo (ITB), el paciente permaneció en posición supina durante 5min. Se utilizó un manguito convencional adecuado de la presión arterial para la medición de la PAS de ambos brazos, de la arteria tibial posterior y de la pedia de ambas extremidades inferiores, utilizando un Doppler continuo bidireccional de 8MHz (Hadeco Mini Doppler Es 100X). Se consideró patológico un valor de ITB<0,9 o bien >1,4.
Determinaciones bioquímicasLas muestras de sangre se obtuvieron tras un periodo de ayunas de 12h, se centrifugaron inmediatamente y fueron congeladas a –80°C hasta ser analizadas. Los parámetros bioquímicos estándares se determinaron mediante métodos usuales de laboratorio clínico. Las concentraciones de colesterol total, triglicéridos, glucosa, c-LDL directa, c-HDL, Apo-B100, lipoproteína(a) y proteína C reactiva ultrasensible (PCR-us) fueron determinados mediante ensayos enzimáticos e inmunoturbidimétricos (Spinreact S.A., España) adaptados al autoanalizador Cobas Mira Plus (Diagnósticos Roche, España). Las concentraciones de sICAM-1 y sE-selectina fueron evaluadas mediante un kit comercial (R&D Systems, España).
Análisis estadísticoTodas las variables fueron analizadas con el test de Kolmogorov-Smirnov para estudiar si seguían una distribución normal. Las variables continuas con distribución normal se presentan como la media±DE, y las variables con distribución no-normal, como mediana±rango intercuartil. Las diferencias entre los grupos de estudio fueron evaluadas utilizando el test ANOVA o Kruskal-Wallis para variables continuas, y el chi-cuadrado para variables categóricas. Para determinar la asociación entre el IAx y los datos antropométricos, bioquímicos y vasculares se utilizó un modelo estadístico univariante. Las curvas ROC se usaron para analizar las diferencias de la rigidez arterial entre pacientes con HF y los del GC. Se utilizó el test lineal multivariante para ajustar el IAx a la frecuencia cardiaca. Para la evaluación del mayor predictor del IAx@75 y el GIMc en pacientes con HF se utilizó un modelo de regresión lineal multivariante. El test estadístico y el valor de p correspondiente fue bilateral, considerando significación estadística si p<0,050. Para el análisis estadístico se utilizó el programa SPSS versión 18,0 (SPSS Inc., Chicago, IL, EE.UU.).
ResultadosLos valores del IAx fueron mayores en pacientes con HF que en el GC (9,6±17,2 vs. 2,6±10,3%; p=0,011) (tabla 1). La media total del GIMc fue significativamente superior en los pacientes con HF que en el GC (0,758±0,280 vs. 0,635±0,160mm; p<0,001). Entre los parámetros bioquímicos se observó que los pacientes con HF presentaban mayores concentraciones de c-LDL (antes de realizar el lavado del fármaco 4,36±1,75 vs 3,19±0,74mmol/l; p<0,004) y Apo-B100 que en el GC. Los pacientes con HF también mostraron tener mayores concentraciones de sE-selectina (33,57±12,2 vs. 27,71±11,7ng/ml; p=0,005). Entre los pacientes con HF, un total del 32% eran fumadores activos. A pesar de este hecho, no se observaron diferencias estadísticamente significativas entre el IAx (10,7±15,1 vs 6,3±14,2%; p=0,101) o en el GIMc máximo en CCA entre fumadores y no fumadores (0,935±0,241 vs. 0,844±0,152mm; p=0,088). No se observaron diferencias en el IAx entre los pacientes con diagnóstico genético y los diagnosticados siguiendo los criterios MedPed (8,5±16,8 vs. 14±17,7%; p=0,105).
Datos demográficos, antropométricos, bioquímicos y vasculares de los 2 grupos estudiados
| Grupo HF (n=125) | Grupo control (n=59) | p | |
| Edad (años) | 45±13 | 47±10 | 0,303 |
| Hombres (%) | 48,8 | 42,4 | 0,433 |
| Hipertensión (%) | 12 | * | |
| DM2 (%) | 1,6 | * | |
| Fumadores (%) | 32 | * | |
| Perímetro de cintura (cm) | 88±12 | 85±9 | 0,119 |
| Presión arterial sistólica (mmHg)a | 120±19 | 115±23 | <0,001 |
| Presión arterial diastólica (mmHg)a | 77±9 | 75±8 | 0,403 |
| Colesterol total (mmol/l) | 9,1±1,73 | 4,91±0,88 | <0,001 |
| c-LDL (mmol/l) | 7,32±1,64 | 3,19±0,74 | <0,001 |
| c-HDL (mmol/l) | 1,29±0,34 | 1,38±0,42 | 0,140 |
| Triglicéridos (mmol/l)a | 0,90±0,70 | 0,60±0,50 | 0,003 |
| Apolipoproteína-B100 (mmol/l) | 1,85±0,37 | 0,95±0,21 | <0,001 |
| Lipoproteína(a) (mg/dl)a | 30,10±21,16 | 6,40±3,78 | <0,001 |
| Glucosa (mmol/l)a | 4,90±0,70 | 4,90±0,65 | 0,520 |
| PCR-us (mg/l)a | 1,61±3,50 | 1,54±2,15 | 0,826 |
| IAx (%) | 9,6±17,2 | 2,6±10,3 | 0,011 |
| IAx@75 (%) | 9,8±18,3 | 2,4±11,1 | 0,011 |
| sE-Selectina (ng/ml) | 33,57±12,25 | 27,71±11,73 | 0,005 |
| sICAM-1 (ng/ml) | 206,59±62,31 | 201,94±56,73 | 0,639 |
| CC media (mm)a | 0,659±0,209 | 0,641±0,155 | 0,376 |
| CC máxima (mm)a | 0,886±0,191 | 0,701±0,131 | <0,001 |
| GIMc medio (mm)a | 0,758±0,280 | 0,635±0,16 | <0,001 |
| GIMc máximo (mm)a | 1,224±0,661 | 0,781±0,159 | <0,001 |
| ITB | 1,04±0,09 | 1,06±0,09 | 0,248 |
CC: arteria carótida común; c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2; GIMc: grosor íntima-media carotídeo; HF: hipercolesterolemia familiar heterocigota; IAx: índice de aumento; IAx@75: índice de aumento ajustado por 75 latidos por minuto de frecuencia cardíaca; ITB: índice tobillo-brazo; PCR-us: proteína C reactiva ultrasensible; sICAM-1: molécula de adhesión intercelular-1 soluble.
Los valores se expresan en porcentaje de pacientes, media±DE o amediana±rango intercuartil. Valor p entre grupos: diferencias entre los grupos comparados mediante ANOVA o test de Kruskal-Wallis.
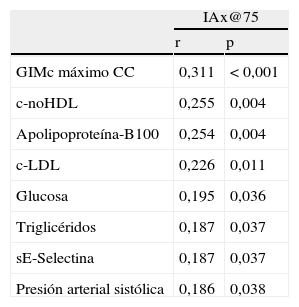
En el análisis univariante, los valores del IAx en pacientes con HF tuvieron una correlación directa con las concentraciones de c-LDL (r=0,227; p=0,004), c-noHDL (r=0,255; p=0,004), Apo-B100 (r=0,2574; p=0,002), triglicéridos (r=0,186; p=0,038), glucosa (r=0,192; p=0,032), PAS (r=0,183; p=0,041) y con el máximo GIMc de CC (r=0,281; p=0,002). La asociación más fuerte fue la observada con respecto a la edad (r=0,7; p<0,001). Debido a esta interacción, esta variable se corrigió utilizando un test de modelo logístico lineal. El IAx@75 ajustado por edad mantuvo incluso una asociación más fuerte con los parámetros bioquímicos y vasculares descritos (fig. 1). Por otra parte, la sE-selectina presentó una correlación positiva con el IAx@75 (r=0,187; p=0,037) (tabla 2).
Relación del índice de aumento con los parámetros vasculares y metabólicos en pacientes con hipercolesterolemia familiar
| IAx@75 | ||
| r | p | |
| GIMc máximo CC | 0,311 | < 0,001 |
| c-noHDL | 0,255 | 0,004 |
| Apolipoproteína-B100 | 0,254 | 0,004 |
| c-LDL | 0,226 | 0,011 |
| Glucosa | 0,195 | 0,036 |
| Triglicéridos | 0,187 | 0,037 |
| sE-Selectina | 0,187 | 0,037 |
| Presión arterial sistólica | 0,186 | 0,038 |
Test de correlación de Pearson.
c-LDL: colesterol ligado a lipoproteínas de baja densidad; c-noHDL: colesterol-noHDL; GIMc máximo CC: grosor íntima-media carotídeo máximo en la carótida común; IAx@75: índice de aumento ajustado por 75 latidos por minuto de frecuencia cardíaca.
Para evaluar los predictores de rigidez arterial se realizó un análisis de regresión lineal multivariante, utilizando el IAx@75 como variable dependiente. Las variables independientes incluyeron la PAS, perímetro de cintura, glucosa, colesterol total, c-LDL, c-noHDL, triglicéridos, Apo-B100 y sE-selectina. Después de ajustar por interacciones, el mejor modelo predictivo incluyó la PAS, perímetro de cintura, glucosa, Apo-B100, triglicéridos y sE-selectina (Durbin-Watson=2,16 y r2=0,383). Cuando este modelo fue forzado, la Apo-B100 (β=0,201; p=0,03) permaneció como predictor independiente de AIx@75 (tabla 3A).
Determinantes del índice de aumento en pacientes con hipercolesterolemia familiar
| IAx@75 | ||
| Coeficiente de regresión β | p | |
| Apolipoproteína-B100 | 0,201 | 0,03 |
| R2 | 383 | |
Test de regresión lineal paso a paso.
Variable dependiente: IAx@75.
Variables independientes: glucosa, presión arterial sistólica, Apolipoproteína-B100, triglicéridos.
Durbin-Watson: 1.956.
IAx@75: índice de aumento ajustado por 75 latidos por minuto de frecuencia cardíaca.
El GIMc máximo de CC fue la medición carotídea más discriminativa entre HF y GC, utilizando las curvas de ROC. El área bajo la curva para esta medición entre los 2 grupos de estudio fue 0,796 (0,720-0,872; p<0,001) (no mostrada en las tablas). Los individuos en el tercil inferior del IAx@75 también presentaron el GIMc máximo CC más bajo con respecto a los individuos del segundo tercil (0,794±0,137 vs. 0,895±0,207mm; p=0,033) y a los individuos del tercil superior (0,794±0,137 vs. 0,974±0,178mm; p<0,001) (fig. 2).
Diferencias entre el grosor íntima-media máximo (GIMc) de la arteria carótida común y los terciles de IAx@75. Los individuos en el tercil inferior de IAx tienen GIMc máximo CC bajo comparado con los individuos del segundo tercil (0,794±0,137 vs. 0,895±0,207; p=0,033) y los del tercil más alto (0,794±0,137 vs. 0,974±0,178; p<0,001). Las comparaciones entre grupos se han realizado mediante ANOVA (Bonferroni test).
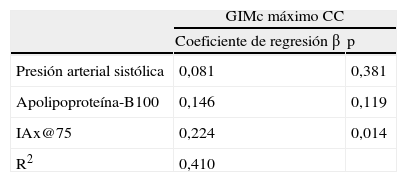
El GIMc máximo de CC fue usado como variable dependiente en nuestro modelo de regresión lineal paso a paso. Las variables asociadas con esta variable dependiente incluyeron la PAS, el colesterol total, el c-LDL, la Apo-B100, el c-noHDL, los triglicéridos, la glucosa y los niveles del IAx@75. Tras ajustar con interacciones, el mejor modelo predictor incluyó el IAx@75 con niveles de Apo-B100, PAS, triglicéridos y glucosa (Durbin-Watson=1,68 y r2=0,410). En el modelo forzado, el IAx@75 fue el principal factor asociado con el GIMc máximo de CC (β=0,224; p=0,014) (tabla 3B).
Determinantes del grosor máximo de la arteria carótida común en pacientes con hipercolesterolemia familiar
| GIMc máximo CC | ||
| Coeficiente de regresión β | p | |
| Presión arterial sistólica | 0,081 | 0,381 |
| Apolipoproteína-B100 | 0,146 | 0,119 |
| IAx@75 | 0,224 | 0,014 |
| R2 | 0,410 | |
Test de regresión lineal paso a paso.
Variable dependiente: GIMc máximo CC.
Variables independientes: glucosa, presión arterial sistólica, Apolipoproteína-B100, triglicéridos, IAx@75.
Durbin-Watson: 1.567.
GIMc máximo CC: grosor íntima-media carotídeo máximo en carótida común; IAx@75: índice de aumento ajustado por 75 latidos por minuto de frecuencia cardíaca.
El dato más relevante de este estudio es que los pacientes con HF presentaron rigidez arterial incrementada, evaluada mediante el IAx, apareados con el GC según edad y sexo. Existen suficientes evidencias que indican que la rigidez arterial supone un factor de RCV independiente, observado en la población general y también de alto riesgo basada en estudios poblacionales11,19,20. El mecanismo fisiopatológico subyacente en la rigidez arterial no es conocido en su conjunto, pero los trastornos hemodinámicos físicos globales, como el flujo turbulento y la hipertensión arterial tanto sistólica como diastólica, se han descrito como implicados21. En un reciente metaanálisis de estudios transversales con más de 26.000 sujetos con y sin hipertensión, los autores observaron que con la excepción de la edad y la hipertensión, la rigidez arterial es un factor de riesgo independiente de los factores de riesgo clásicos de arteriosclerosis16. Nuestros resultados muestran que en un grupo con un 90% de normotensos pero con hipercolesterolemia pura, la dislipidemia y sobre todo las partículas ricas en Apo-B100 juegan un papel decisivo en la elasticidad de la pared arterial. De hecho, el mayor parámetro lipídico asociado con el IAx@75 en nuestra población fue la concentración de Apo-B100, incluso cuando esta relación fue ajustada para otros posibles factores de confusión. Se ha descrito un incremento de la rigidez arterial en hipercolesterolemia inducida por dieta en monos22. Por otro lado, la disfunción de la elasticidad aórtica ha sido observada en el inicio de la juventud23 y en pacientes con HF de edad media tratados o no de hipertensión24,25. Toikka et al.26 observaron que en sujetos con una ratio disminuida de c-HDL/CT comparados con aquellos con una ratio elevada presentaban disminución de distensibilidad carotídea. Parece que el c-LDL, especialmente el de menor tamaño, y las LDL oxidadas aumentan la proliferación celular del músculo liso y la vasoconstricción mediada por un aumento de concentración de calcio intracelular27–29. Las alteraciones de la pared arterial pueden considerarse como la consecuencia de un proceso iniciado por la disfunción endotelial. En nuestro estudio el IAx@75 se asoció a marcadores bioquímicos de función endotelial, como la sE-selectina, lo que apoyaría la relación entre la disfunción endotelial y la rigidez de la pared arterial.
La rigidez arterial fue el único determinante de GIMc en pacientes con HF, siendo mayor que en el GC. Esta observación apoya de manera contundente el papel del IAx como medidor de riesgo vascular en pacientes con HF. Debido a que el IAx@75 se mostró fuertemente asociado a la cantidad de lipoproteínas que contienen Apo-B100, nuestro estudio sugiere que la hipercolesterolemia residual a largo plazo en pacientes con HF influye sobre la calidad de la arteria. Nuestros pacientes fueron controlados en una unidad especializada en lipidología clínica y fueron tratados con dosis altas de estatinas en monoterapia o bien en combinación con ezetimiba, con el fin de alcanzar el objetivo terapéutico por un mínimo periodo de 3años6. A pesar de haber sido tratados intensamente para alcanzar estos objetivos, se encontraron alteraciones claras de la pared arterial. Por tanto, nuestros datos confirman que es necesario iniciar tratamientos precoces y más intensos con el fin de alcanzar objetivos terapéuticos de c-LDL propuestos en las últimas guías de las Sociedades Europeas de Cardiología y de Arteriosclerosis5.
Una limitación de nuestro estudio incluye el hecho de haber determinado la rigidez arterial mediante IAx, obtenida por tonometría arterial periférica y no por técnicas invasivas; este método tiene la ventaja de ser independiente del operador y fácil de realizar en un entorno clínico. Otra limitación de nuestro estudio es su naturaleza observacional; por tanto, no podemos concluir que el incremento de la rigidez arterial o el descenso de niveles de Apo-B100 puedan influir de manera causal en el GIMc. El tamaño muestral de nuestro estudio fue pequeño, a pesar de haber incluido pacientes con HF de acuerdo a criterios genéticos o clínicos. Nuestros datos fueron obtenidos de un grupo de pacientes con HF; por lo tanto, la extrapolación con respecto al c-LDL o terapia con estatinas en otros escenarios clínicos se tiene que realizar con cautela.
Los pacientes con HF incluidos en este estudio presentaron un incremento de los valores del GIMc y del IAx@75, a pesar de estar tratados con estatinas a dosis elevadas. Hemos demostrado que el IAx@75 está claramente asociado con las concentraciones de c-LDL, siendo este un determinante de GIMc. Por tanto, se deberían considerar nuevas dianas terapéuticas y tratamientos más agresivos, con el fin de disminuir el RCV global.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo ha sido financiado con una beca FEA/SEA en investigación clínico-epidemiológica, Madrid, 2008.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AutoríaNúria Plana diseño el estudio. Núria Plana, Daiana Ibarretxe, Raimon Ferré, Jordi Merino y Lluís Masana participaron en la selección de pacientes. Núria Plana, Daiana Ibarretxe, Raimon Ferré, Jordi Merino y Lluís Masana participaron en la realización del estudio vascular. Mercedes Heras y Josefa Girona participaron en la elaboración de los datos bioquímicos. Jordi Merino y Raimon Ferré participaron en el estudio estadístico. Núria Plana, Daiana Ibarretxe, Raimon Ferré, Jordi Merino, Lluís Masana, Mercedes Heras y Josefa Girona participaron en la elaboración del manuscrito.
A Gemma Aragonés por su colaboración en la determinación de la tonometría arterial periférica.