THP-1. Conclusiones. La rosiglitazona incrementa la expresión de caveolina-1 en macrófagos, a través de la activación de los PPAR y, probablemente, como consecuencia de la unión al PPRE identificado en la secuencia del promotor del gen de la caveolina-1.
Introducción
Las caveolinas son una familia de proteínas que comprende 3 isoformas: la caveolina-1 y la caveolina-2 se expresan en la mayoría de tipos celulares, y son especialmente abundantes en células endoteliales, fibroblastos, adipocitos y neumocitos de tipo I, mientras que la caveolina-3 es específica del tejido muscular1. La caveolina-1 es una proteína integral de membrana de 22 kDa identificada como marcador principal de las caveolas2, microdominios de membrana ricos en colesterol y esfingolípidos3. La caveolina-1 posee la capacidad de unirse al colesterol4, es esencial para la formación de las caveolas1, actúa como inhibidor de distintas moléculas de señalización, como la óxido nítrico sintasa endotelial5, y está involucrada en el transporte vesicular y la tumorogénesis6.
Hasta el momento, los estudios sobre la expresión de la caveolina-1 en macrófagos han ofrecido resultados contradictorios. Así, la expresión de caveolina-1 fue detectada en células THP-1 por immunodetección y por la reacción de la transcriptasa inversa acoplada a la reacción en cadena de la polimerasa (RT-PCR)7, mientras que en otras líneas celulares de macrófagos (J774 y RAW264.7) se detectó la expresión de caveolina-1 por RT-PCR8, pero no por western blot7. Recientemente, se ha detectado la expresión de caveolina-2 en células J7749, pero no en células THP-17.
La caveolina-1 parece estar involucrada en la homeostasis del colesterol, ya que afecta su transporte intracelular y participa en su intercambio con el medio extracelular, es decir, en los procesos de captación y eflujo de colesterol1. El papel de las caveolas y la caveolina en la salida de colesterol de la célula es un tema controvertido. Así, algunos estudios muestran que la expresión de caveolina-1 favorece el eflujo de colesterol10,11, mientras que en otros no se observa ningún efecto12 o incluso se produce una reducción13. Algunos autores sugieren que la caveolina podría desempeñar un papel indirecto en este proceso, transportando el colesterol hacia las caveolas, desde donde sería distribuido por difusión lateral hacia dominios de la membrana colindantes ricos en ABCA11.
Los receptores activados por proliferadores peroxisómicos (PPAR) son factores de transcripción dependientes de ligando que heterodimerizan con el receptor del ácido 9-cis-retinoico (RXR) y se unen a secuencias específicas del ADN conocidas como elementos de respuesta a proliferadores peroxisómicos (PPRE), modulando la transcripción de genes involucrados en el metabolismo lipídico, la inflamación y la diferenciación celular14,15. Hay 3 subtipos de PPAR, *, ß/* y *, que presentan distinto patrón de expresión tisular. El receptor PPAR* se expresa en macrófagos y en células espumosas derivadas de macrófagos, presentes en lesiones ateroscleróticas humanas. Las tiazolidindionas, entre ellas la rosiglitazona, utilizadas en el tratamiento de la diabetes mellitus tipo 2 por su efecto de mejora de la sensibilidad del organismo a la acción de la insulina, se comportan como ligandos de PPAR*. A pesar de que los agonistas PPAR* ejercen algunas acciones que no dependen de su unión directa con el ADN16, las tiazolidindionas llevan a cabo la mayoría de sus efectos a través de la activación del receptor PPAR*. Así, la activación PPAR* produce un aumento en la expresión del receptor scavenger de clase B CD36 en macrófagos, efecto que parece favorecer la captación de lipoproteínas oxidadas, y con ello la formación de la célula espumosa17. Por otra parte, los ligandos PPAR* activan el receptor LXR*, que a su vez induce la expresión del transportador ABCA118. ABCA1 participa en el transporte activo de colesterol y fosfolípidos hacia aceptores extracelulares de colesterol, principalmente la apoliproteína A-I19. Este aumento del eflujo de colesterol mediado por ABCA1 compensa el incremento de CD36 y, por ello, el efecto neto de la activación PPAR* parece ser antiaterogénico20.
Recientemente, se ha descrito que los ligandos PPAR* incrementan la expresión de caveolina 1 y 2 en células cancerosas humanas21, y que la sobreexpresión de PPAR* en ratones deficientes en PPAR* induce la expresión de caveolina-1 en el hígado22. Teniendo en cuenta que tanto PPAR* como caveolina-1 se expresan en macrófagos, el objetivo de este trabajo fue estudiar el efecto de la rosiglitazona sobre la expresión de la caveolina-1 en macrófagos humanos THP-1.
Material y métodos
La rosiglitazona utlilizada en este estudio fue proporcionada por GlaxoSmithkline (Reino Unido). Los reactivos usados para el cultivo celular son de Gibco, Invitrogen (Paisley, Reino Unido). El suero bovino fetal, el 4-ß phorbol 12 miristato 13 acetato (PMA), la actinomicina D y la cicloheximida se obtuvieron de Sigma-Aldrich (St. Louis, MO). El antagonista de PPAR* es de Cayman Chemical. El reactivo Ultraspect utilizado para la obtención del ARN total se obtuvo de Biotecx (Houston, TX). Los reactivos usados para la reacción de RT-PCR fueron de Invitrogen (Paisley, Reino Unido), a excepción de los random hexamers y los oligonucleótidos específicos o primers, obtenidos de Roche Diagnostics (Mannheim, Alemania), y del *-[32P]dATP, de Amersham Biosciences (Freiburg, Alemania). El anticuerpo policlonal de conejo utilizado para la inmunodetección de la caveolina-1 se obtuvo de BD Transduction Laboratories, mientras que para la inmunodetección de la ß-actina se utilizó un anticuerpo monoclonal de ratón de Sigma-Aldrich. El resto de reactivos utilizados fueron de grado analítico, y se obtuvieron de fuentes comerciales.
Cultivo celular
La línea de leucemia monocítica humana THP-1 se obtuvo de la European Collection of Cell Cultures (ECACC), y se mantuvo en medio RPMI 1640 con 25 mM de tampón Hepes, suplementado con un 10% de suero bovino fetal, un 1% de L-glutamina 200 mM, 100 U/ml de penicilina y 100 µg/ml de estreptomicina, a 37 °C en un 5% de CO2.
Preparación y análisis del ARN
El ARN total se aisló mediante el reactivo Ultraspect, siguiendo las indicaciones del fabricante. Los valores relativos de ARN mensajero (ARNm) se determinaron mediante RT-PCR. El ADN complementario (ADNc) se sintetizó a partir de 0,5 µg de ARN total mediante su incubación con 125 ng de random hexamers en presencia de 75 mM KCl, 3 mM MgCl2, 10 mM ditiotreitol, 200 U de la enzima M-MLV-transcriptasa reversa, 20 U ARNsin y 0,5 mM de cada dNTP en un volumen total de 20 µl de tampón Tris/HCl 50 mM pH 8,3. La reacción se llevó a cabo a 37 °C durante 1 h. Una alícuota de 5 µl de la reacción de RT se utilizó para la reacción de amplificación de PCR junto con los oligonucleótidos específicos. Así, cada 50 µl de la reacción de PCR contenían 5 µl de la reacción de RT, 1,2 mM MgCl2, 200 µM dNTP, 0,25 µCi *-[32P]dATP (3.000 Ci/mmol), 1 U de TaqADN polimerasa, y 0,5 µg de cada oligonucleótido específico (sentido y antisentido) en tampón Tris/HCl 20 mM pH 8,5. Para evitar posibles hibridaciones inespecíficas, el ADNc y la Taq polimerasa se separaron de los oligonucleótidos específicos y de los dNTP mediante una capa de parafina; de este modo sólo entran en contacto cuando la parafina funde a 60 °C. Las secuencias de los oligonucleótidos sentido y antisentido utilizados para estudiar cada uno de los genes fueron: caveolina-1, 5'-ACAAGCCCAACAACAAGGCCA-3' y 5'-GAGGGCAGACAGCAAGCGGTA-3'; PPAR*, 5'-CATTCTGG-
CCCACCAACTTTGG-3' y 5'-TGGAGATGCAGGCTCCACTTTG-3'; CD11b, 5'-AAGAGAACGCAAGGGGCTTCG-3' y 5'-AGGGACAGGCCCAGGGACATG-3', y gapdh, 5'-CAGTCCATGCCATCACTG-CCA-3' y 5'-AGGTGGAGGAGTGGGTGTCGC-3'. La reacción de PCR se realizó en un termociclador MJ Research equipado con un sistema Peltier y una sonda de temperatura. Después de una desnaturalización de 1 min a 94 °C, la reacción de PCR se llevó a cabo en 22 (caveolina-1) y 20 (PPAR* y CD11b) ciclos de amplificación. Cada ciclo consistió en una desnaturalización a 92 °C durante 1 min, una hibridación con los oligonucleótidos específicos a 60 °C durante 1 min y 15 s, y una etapa de síntesis a 72 °C durante 1 min y 50 s. La reacción se terminó, al final del último ciclo de amplificación, con 5 min de síntesis final a 72 °C. Un total de 5 µl de la reacción de PCR fueron sometidos a electroforesis en gel de poliacrilamida al 5% y los productos de amplificación fueron visualizados mediante autorradiografía (Agfa, Medical X-ray film). La amplificación de cada gen dio lugar a la visualización de una sola banda del tamaño esperado (caveolina-1, 245 pb; PPAR*, 229 pb; CD11b, 195 pb, y gapdh, 302 pb). Para cada uno de los genes estudiados se realizaron ensayos preliminares de número de ciclos de amplificación y cantidad de ADNc amplificado para determinar las condiciones óptimas de trabajo (por debajo del límite de saturación). Finalmente, la intensidad de las bandas fue cuantificada por densitometría (Vilbert Lourmat Imaging). Este método permite la cuantificación relativa de los valores de ARNm de cada uno de los genes estudiados, normalizados utilizando la gapdh como control interno.
Análisis de western blot
Se sometieron 50 µg de extracto de proteína total a electroforesis en geles de SDS-poliacrilamida (12,5%). Posteriormente, las proteínas fueron transferidas a membranas de PVDF (Immobilon-P de Millipore, Bedford, MA). Las membranas se bloquearon durante 1 h a temperatura ambiente en tampón TBS que contenía un 0,5% de Tween 20 y un 5% de leche en polvo no grasa, y la inmunodetección se realizó utilizando un anticuerpo policlonal de conejo anticaveolina-1 (dilución 1:5.000 en solución de bloqueo, durante 1 h a temperatura ambiente). Las membranas se lavaron 4 veces durante 10 min en TBS con un 0,5% de Tween 20 y un 0,2% de leche. Posteriormente, se procedió a la incubación de las membranas con un anticuerpo secundario adecuado (dilución 1:2.000), en las mismas condiciones utilizadas para la incubación con el anticuerpo primario. La inmunodetección se llevó a cabo por quimioluminiscencia utilizando el enhanced chemiluminiscence (ECL) detection system (Biological Industries, Israel). Las membranas fueron también incubadas con un anticuerpo monoclonal anti-ß-actina (dilución 1:5.000), para comprobar que la carga de proteína entre las distintas muestras era equivalente. El tamaño de las proteínas detectadas se estimó mediante unos estándares de peso molecular conocido (BioRad).
Ensayos de retardo de la movilidad electroforética (EMSA)
Los extractos nucleares de macrófagos THP-1 se prepararon según describen Dignam et al23, utilizando un 0,03% de Tritón X-100 para el lisado de las células. Las concentraciones de proteína de estos extractos se determinaron por el método de Bradford24, y posteriormente fueron congelados en N2 líquido y almacenados a 80 °C. La sonda PPRE-Cav-1 se generó mediante la síntesis de una doble cadena de 2 oligonucleótidos complementarios (Roche Diagnostics) situados entre las posiciones 278 y 258 del promotor del gen de la caveolina-1 humano, respecto al lugar de inicio de la traducción. Las secuencias de oligonucleótidos utilizadas para la construcción de esta sonda fueron: cadena sentido, 5'-GCGCGGGACAACGTTCTCA-CT-3' y cadena complementaria o antisentido, 5'-AGTGAGAA-CGTTGTCCCGCGC-3'. Finalmente, el oligo de doble cadena se sometió a una reacción de marcado con T4 polinucleótido cinasa y *-[32P]ATP.
Los ensayos de retardo de la movilidad electroforética o EMSA se llevaron a cabo, básicamente, según describen Noé et al25. Los 20 µl de volumen de reacción contenían un 5% de glicerol, 1 mM de MgCl2, 0,5 mM EDTA, 0,5 mM ditiotreitol, 60 mM KCl, 2 µg de extracto de proteína nuclear, 1 µg de esperma de arenque, 20,000 cpm de sonda marcada y Tris/HCl 25 mM, pH 8.0. La mezcla se incubó durante 15 min en ausencia de la sonda marcada, y luego durante 30 min en su presencia. Los complejos proteína-ADN se separaron por electroforesis en gel de poliacrilamida al 5% en 0,5X Tris/borato/EDTA a 4 °C. Finalizada la electroforesis, se procedió al secado de los geles, que se pusieron en contacto con pantallas de europio, y posteriormente fueron escaneadas mediante un phosphorimager (Storm 840, Molecular Dynamics, Sunnyvale, CA).
Análisis estadístico
Los resultados mostrados corresponden a la media ± desviación estándar. La significación estadística de las diferencias se evaluó mediante el test ANOVA combinado con el test de Student-Newman-Keuls, con el programa informático GraphPad Instat, versión 3.05.
Resultados
La rosiglitazona incrementa los valores de ARNm de caveolina-1
Los monocitos THP-1 se diferenciaron a macrófagos por exposición a PMA durante 24 h, y se trataron posteriormente con concentraciones crecientes de rosiglitazona (0,005-2 µM) durante 24 h adicionales. El tratamiento produjo un notable incremento del ARNm de caveolina-1, que resulta significativo a 0,05 µM de rosiglitazona (p < 0,01). El efecto máximo (inducción de 3,4 veces respecto a las células control) se alcanzó a la concentración de 1 µM (fig. 1 A). A esta concentración de rosiglitazona, los valores de ARNm de caveolina-1 se incrementaron a las 3 h de tratamiento (p < 0,05 respecto a las células tratadas durante 3 h con vehículo) y se mantuvieron elevados 2-2,6 veces entre las 6 y las 24 h (fig. 1 B).
Figura 1. La rosiglitazona incrementa los valores de ARNm de caveolina-1. A) Análisis de los valores de ARNm de caveolina-1 en células THP-1 incubadas con distintas concentraciones (0,005-2 µM) de rosiglitazona durante 24 h. B) Análisis de los valores de ARNm de caveolina-1 en macrófagos THP-1 expuestos a rosiglitazona 1 µM durante 1, 3, 6, 12 y 24 h. Se analizaron 0,5 µg de ARN total por RT-PCR. Se muestran las autorradiografías representativas y las cuantificaciones correspondientes a los valores de ARNm normalizados por el gen control gapdh. Los datos se expresan como la media ± desviación estándar (DE) de 3 experimentos independientes realizados por duplicado. *p < 0,05, **p < 0,01, ***p < 0,001 y ****p < 0,0001, respecto a las correspondientes células control (CT).
La rosiglitazona incrementa la expresión de la proteína de caveolina-1 en macrófagos THP-1
Con el objetivo de comprobar si las modificaciones en los valores de ARNm de caveolina-1 estaban asociadas con cambios en la expresión de la correspondiente proteína, se realizaron ensayos de western blot. Tal como se puede observar en la figura 2 A, el tratamiento con rosiglitazona incrementó la expresión de la proteína de caveolina-1 de forma dependiente de la dosis, alcanzando el efecto máximo a 0,1-1 µM.
Figura 2. La rosiglitazona induce los valores de proteína de caveolina-1 de forma dependiente de la dosis y el tiempo. A) Se trataron células THP-1 con varias concentraciones (0,005-1 µM) de rosiglitazona durante 24 h. B) Los macrófagos THP-1 fueron incubados con rosiglitazona 1 µM durante 3, 6, 12 y 24 h. 50 µg de extracto de proteína total fueron resueltos en geles de SDS-poliacrilamida (12,5%). Las membranas fueron incubadas con un anticuerpo anticaveolina-1 que permite la detección de 2 bandas de, aproximadamente, 22 kDa correspondientes a las isoformas * y ß. Para comprobar que se cargaron cantidades equivalentes de proteína para cada muestra se incluye la inmunodetección de la ß-actina. Se muestran las autorradiografías representativas y las cuantificaciones correspondientes. Los datos se expresan como la media ± DE de 3 experimentos independientes. *p < 0,05 y **p < 0,01, respecto a las correspondientes células control (CT).
En la figura 2 B se muestra el efecto del tratamiento con rosiglitazona 1 µM a diferentes tiempos sobre la expresión de la proteína de caveolina-1. Después de 6 h de tratamiento, los valores de caveolina-1 se incrementaron de forma significativa (p < 0,05), se alcanzó el máximo efecto (aumento de 3,3 veces) a las 24 h de la exposición.
La rosiglitazona no induce la diferenciación de las células THP-1 y no modifica los valores de ARNm de PPAR*
Para descartar que el incremento de la expresión de caveolina-1 por rosiglitazona pudiera estar relacionado con la capacidad de los agonistas PPAR* de promover la diferenciación celular, se examinó la expresión del marcador de diferenciación de macrófagos CD11b a diferentes tiempos. El tratamiento con rosiglitazona 1 µM no parece inducir la diferenciación de las células THP-1, ya que los valores de ARNm de CD11b no se modificaron durante un tratamiento de 24 h (fig. 3 A). Por otro lado, se ha descrito que los valores de ARNm de PPAR* aumentan durante el proceso de diferenciación. En este aspecto, nuestros resultados muestran que el tratamiento con rosiglitazona no incrementó la expresión del gen de PPAR* durante las 24 h de tratamiento (fig. 3 B). Además, y de forma contraria a lo que sucede con la rosiglitazona, la exposición de macrófagos THP-1 al agente diferenciador PMA (50 nM) durante 6 o 24 h adicionales no modificó los valores de ARNm de caveolina-1 (fig. 3 C). Todos estos resultados sugieren que el incremento de los valores de ARNm de caveolina-1 inducido por la rosiglitazona es independiente del estado de diferenciación de la célula.
Figura 3. La rosiglitazona no induce la diferenciación de las células THP-1 y no modifica los valores de ARNm de PPAR*. Análisis de los valores de ARNm de CD11b (A) y PPAR* (B) en células THP-1 expuestas a rosiglitazona 1 µM durante 1, 3, 6, 12 y 24 h. C) Análisis de los valores de ARNm de caveolina-1 en células THP-1 incubadas con rosiglitazona 1 µM o PMA 50 nM durante 6 y 24 h. 0,5 µg de ARN total fueron analizados por RT-PCR. Se muestran las autorradiografías representativas y las cuantificaciones correspondientes a los valores de ARNm normalizados por el gen control gapdh. Los datos se expresan como la media ± DE de 3 experimentos independientes. ***p < 0,001, respecto a las correspondientes células control (CT).
La inducción de caveolina-1 es un efecto dependiente de PPAR
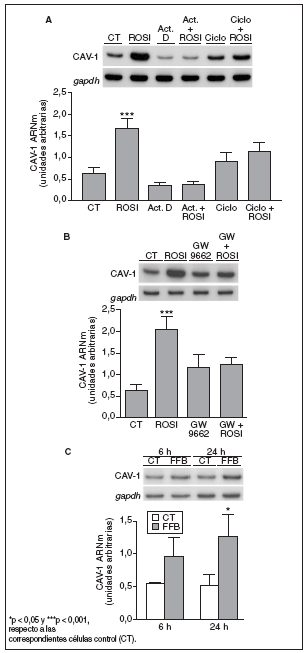
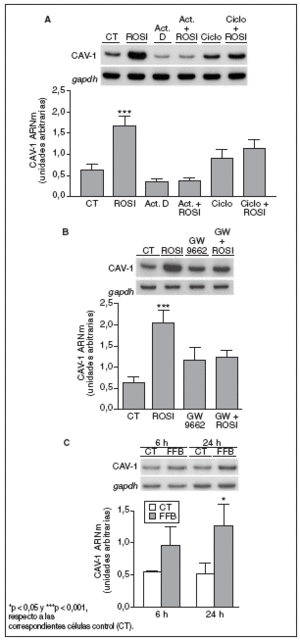
Para profundizar en el mecanismo a través del cual la rosiglitazona aumenta la expresión de caveolina-1 en macrófagos THP-1, se estudió su efecto en presencia o en ausencia de inhibidores de la transcripción génica y de la síntesis de novo de proteínas. El incremento de los valores de ARNm de caveolina-1, inducido por el tratamiento con rosiglitazona 1 µM durante 6 h, fue anulado por completo en presencia del inhibidor de la transcripción génica actinomicina D (1 µg/ml) o del inhibidor de la síntesis de proteínas cicloheximida (2 µg/ml) en el medio de cultivo (fig. 4 A). Estos resultados indican que en este efecto de la rosiglitazona pueden estar implicados tanto mecanismos transcripcionales como postranscripcionales.
Figura 4. La inducción de caveolina-1 (CAV-1) es un efecto dependiente de PPAR, pero no específico de PPAR*. A) Análisis de los valores de ARNm de CAV-1 en células THP-1 tratadas con actinomicina D (Act. D) (1 µg/ml) o cicloheximida (Ciclo) (2 µg/ml) ± rosiglitazona (ROSI) (1 µM) durante 6 h. B Análisis de los valores de ARNm de CAV-1 en células THP-1 incubadas con ROSI 1 µM, GW 9662 (20 µM) o la combinación de ambos (el antagonista PPAR* se adicionó media hora antes que la ROSI) durante 6 h. C) Análisis de los valores de ARNm de CAV-1 en células THP-1 expuestas a fenofibrato (100 µM) durante 6 y 24 h. 0,5 µg de ARN total fueron analizados por RT-PCR. Se muestran las autorradiografías representativas y las cuantificaciones correspondientes a los valores de ARNm normalizados por el gen control gapdh. Los datos se expresan como la media ± DE de 3 experimentos independientes realizados por duplicado.
Para determinar si la inducción de caveolina-1 por rosiglitazona tiene lugar a través de un mecanismo dependiente de receptor, se examinó el efecto del antagonista PPAR GW9662. Este compuesto es un antagonista potente y selectivo, que se une de forma irreversible al receptor PPAR*26. La adición de GW9662 (20 µM) revirtió claramente el aumento de los valores de ARNm de caveolina-1 en macrófagos tras el tratamiento con rosiglitazona 1 µM durante 6 h (fig. 4 B). Finalmente, el agonista del receptor PPAR* fenofibrato (100 µM) también produjo una inducción de los valores de ARNm de caveolina-1 de 1,8 y 2,5 veces después de 6 y 24 h de tratamiento, respectivamente (fig. 4 C).
Identificación de un PPRE en el promotor del gen de la caveolina-1
La secuencia del promotor del gen de la caveolina-1 (número de GenBank: AF019742) se analizó mediante el programa MATCH 1.0. Este programa está diseñado para buscar posibles lugares de unión para factores de transcripción, utilizando la librería de matrices TRANSFAC 6.0. El análisis reveló la existencia de un posible lugar de unión PPAR/RXR entre las posiciones 281 y 261 respecto al lugar de inicio de la traducción en el promotor de la caveolina-1 (fig. 5 A).
Figura 5. El promotor del gen de la caveolina-1 contiene un posible lugar de unión PPAR/RXR. A) Secuencia correspondiente a la región 5' flanqueante del gen de la caveolina-1 humana. El posible lugar de unión PPAR/RXR se encuentra localizado entre las posiciones 281 y 262 respecto al lugar de inicio de la traducción. B) Autorradiografía representativa de un ensayo de EMSA utilizando la sonda cav-1-PPRE y extracto nuclear (EN) de células THP-1 incubadas con rosiglitazona 1 µM durante los períodos indicados. También se muestra la cuantificación de las 2 bandas que aparecen, mediante phosphoimager.
Para comprobar la funcionalidad de este PPRE se realizaron ensayos de retardo de la movilidad electroforética (EMSA) y como sonda se utilizó una doble cadena de oligonucleótidos (21 pb) que contenía la secuencia del lugar de unión PPAR/RXR identificado. La unión de esta sonda a extractos nucleares de células THP-1 dio lugar al patrón de retardo que se observa en la figura 5 B. La intensidad de las bandas se incrementó tras el tratamiento con rosiglitazona de forma dependiente del tiempo, con un máximo a 1 h de tratamiento.
Discusión
En este estudio se demuestra que la rosiglitazona, a concentraciones que activan el receptor PPAR*27, induce la expresión de la caveolina-1 en macrófagos THP-1 de forma dependiente de la dosis y el tiempo. El aumento de los valores de ARNm de caveolina-1 se manifiesta ya a las 3 h de incubación con la rosiglitazona, y persiste durante 24 h. Este patrón de inducción rápida coincide con los resultados obtenidos por Burgermeister et al21 en células cancerosas humanas, en las cuales diferentes ligandos PPAR* dieron lugar a un importante incremento de los valores de ARNm de caveolina-1. La sobreexpresión de PPAR* en el hígado también induce la expresión de caveolina-1, junto con la de otros genes que se expresan en adipocitos, como adiponectina, aP2 y CD3622. Estos genes se expresan igualmente en macrófagos, y su expresión está controlada por PPAR*. De hecho, los macrófagos y adipocitos comparten una serie de características comunes: su diferenciación es promovida por PPAR*, los 2 tipos celulares son capaces de acumular grandes cantidades de lípidos en su interior, y expresan genes involucrados en el control de la homeostasis lipídica.
Algunos estudios sugieren que la caveolina-1 puede actuar como una proteína inhibitoria del crecimento de células cancerosas, efecto que se atribuye en parte a su capacidad de promover la diferenciación celular6. Sin embargo, en líneas celulares de cáncer de intestino y de mama, se ha observado que la inducción de la expresión de caveolina-1 por ligandos PPAR* es independiente de la diferenciación celular21. Por otro lado, se ha descrito que la activación del heterodímero PPAR-RXR promueve la diferenciación de células monocíticas17, y que la diferenciación induce la expresión de caveolina-1 en células THP-17. Por esta razón, nos planteamos estudiar si el incremento de la expresión de caveolina-1 inducido por rosiglitazona en nuestras células podía ser una consecuencia directa del efecto promotor de la diferenciación celular ejercido por los agonistas PPAR*28. En este sentido, nuestros resultados demuestran que los valores de ARNm de CD11b, ampliamente utilizado como marcador de la diferenciación de macrófagos29, no aumentan en las células tratadas con rosiglitazona durante 3 o 24 h, mientras que el aumento en la expresión de caveolina-1 ya se observa tras 3 h de exposición a la rosiglitazona. Por otro lado, tampoco se detecta un incremento de los valores de ARNm de PPAR* después del tratamiento con rosiglitazona. Finalmente, el tratamiento con el agente diferenciador PMA durante 24 h adicionales no causó inducción de los valores de ARNm de caveolina-1. Por tanto, la inducción de caveolina-1 descrita en este estudio parece ser independiente del estado de diferenciación celular, de forma similar a lo que describen Burgemeister et al21 en células cancerosas.
Para determinar si la regulación de la expresión de caveolina-1 por rosiglitazona se produce de forma transcripcional, se utilizaron actinomicina D y cicloheximida como inhibidores de la transcripción génica y de la síntesis de novo de proteínas, respectivamente. Nuestros resultados muestran que la rosiglitazona no modifica los valores de ARNm de caveolina-1 en presencia de actinomicina D, lo que indica que el agonista PPAR* está afectando la transcripción génica o la vida media del ARNm de caveolina-1. La inhibición de la síntesis de novo de proteínas con cicloheximida también anuló el incremento de la expresión del gen de la caveolina-1 producido por la rosiglitazona, lo que sugiere que también participan mecanismos postranscripcionales. En conjunto, estos resultados indican que la inducción de caveolina-1 por rosiglitazona es dependiente de PPAR, ya que otros efectos de las glitazonas independientes de PPAR no son contrarrestados por actinomicina o cicloheximida30,31.
En apoyo a esta hipótesis cabe mencionar que el incremento en la expresión de caveolina-1 por rosiglitazona se anuló por completo en presencia del antagonista PPAR* GW9662. Sin embargo, la incubación de las mismas células con el agonista PPAR* fenofibrato también aumentó los valores de ARNm de caveolina-1, lo cual indica que el efecto no es específico PPAR*. A la concentración utilizada en este estudio (100 µM), el fenofibrato se comporta como activador selectivo de la isoforma PPAR*, mientras que la IC50 para que éste sea capaz de activar también PPAR* en tejidos humanos es de 300 µM32.
Así pues, parece lógico pensar que si el incremento de caveolina-1 es dependiente de la activación PPAR, se podría encontrar un posible lugar de unión a PPAR (o PPRE) en la región promotora del gen de la caveolina-1. El análisis del promotor de caveolina-1, mediante el programa MATCH 1.0, que utiliza la base de datos TRANSFAC 6.0, permitió identificar un posible lugar de unión PPAR/RXR entre las posiciones 281 y 261 respecto al lugar de inicio de la traducción. Para comprobar la funcionalidad de este lugar de unión PPAR/RXR, se realizaron ensayos de retardo de la movilidad electroforética (EMSA) utilizando como sonda una doble cadena de oligonucleótidos que contenía la secuencia del PPRE identificado. Además, la unión de esta sonda a extractos nucleares de células THP-1 se incrementó tras el tratamiento con el agonista PPAR* rosiglitazona. Todo esto sugiere que la inducción de la expresión de caveolina-1 por rosiglitazona podría estar mediada por una activación de la transcripción como consecuencia de la unión de heterodímeros PPAR-RXR al PPRE, identificado, por primera vez, en el promotor del gen de la caveolina-1.
Todos estos resultados parecen indicar que el incremento de la expresión de caveolina-1 por rosiglitazona es principalmente un efecto mediado por PPAR, aunque no se puede descartar totalmente la participación de otros mecanismos. Según Burgermeister et al21, la inducción de caveolina-1 por rosiglitazona podría producirse por mecanismos indirectos, a través de la interacción con otros factores de transcripción. A pesar de que no se conoce qué factores de transcripción pueden mediar la inducción de caveolina, diversos autores han sugerido recientemente que podrían estar involucrados los receptores de tipo nuclear33,34. Por otra parte, los PPAR pueden regular también la transcripción génica de forma independiente a su unión directa con el ADN, interfiriendo con las vías de otros factores de transcripción, como NF*B, AP-1 o STAT-116.
En conclusión, en este estudio se ha podido demostrar que los activadores PPAR, como el agonista PPAR* rosiglitazona, incrementan la expresión de caveolina-1 en macrófagos a través de la activación de los PPAR, probablemente como consecuencia de la unión al PPRE identificado en la secuencia del promotor del gen de la caveolina-1.
Agradecimientos
Queremos expresar nuestra gratitud a la Sociedad Española de Arteriosclerosis, por conceder una mención especial a la comunicación: "La rosiglitazona incrementa la expresión de caveolina-1 en macrófagos a través de un mecanismo dependiente de PPAR", en el pasado Congreso de la SEA celebrado en Murcia (junio de 2004).