El interés por los fibratos ha ido de la mano, a lo largo del tiempo, con la evidencia científica del papel de las lipoproteínas ricas en triglicéridos en el desarrollo de la aterosclerosis y las enfermedades cardiovasculares derivadas. Aunque no existe ninguna duda sobre la reducción del riesgo cardiovascular aportada por el tratamiento con estatinas, esta es, como máximo, de 30-35%, quedando 70% del riesgo cardiovascular restante en los pacientes tratados con estatinas, no directamente relacionado con el colesterol-LDL (cLDL), sin un adecuado control. Si excluimos el caso particular de la lipoproteína(a) [Lp (a)], en este segmento se encontrarían otros dos factores lipídicos de riesgo, la hipertrigliceridemia y las concentraciones bajas de colesterol HDL (cHDL), muchas veces asociados a síndrome metabólico o diabetes mellitus tipo 2 (DMT2). Hasta el momento, desde el punto de vista de la reducción del riesgo cardiovascular, las medidas farmacológicas encaminadas a incrementar el cHDL han tenido una nula eficacia, como lo demuestra el fracaso de los inhibidores de la proteína de transferencia de ésteres de colesterol (CETP). En consecuencia, el control de la hipertrigliceridemia permanece como una intervención posible para reducir el riesgo cardiovascular en pacientes tratados con estatinas1, y es aquí donde se renueva el interés por los fibratos.
¿Por qué los triglicéridos plasmáticos son un factor de riesgo cardiovascular?Los triglicéridos plasmáticos se vehiculizan en lipoproteínas que contienen, como apolipoproteína estructural, la apolipoproteína B, apo B-100 cuando el origen es hepático (VLDL), en situaciones de ayuno, o apo B-48, cuando el origen es intestinal (quilomicrones), en situaciones posprandiales. Tanto los quilomicrones como las VLDL nacientes presentan un tamaño excesivo para que puedan ser incorporados al espacio subendotelial del sistema arterial. Sin embargo, ambos tipos de lipoproteínas son remodeladas intensamente en el transcurso de su estancia en el compartimento sanguíneo, por procesos lipolíticos que proporcionan ácidos grasos a diversos tejidos, como el muscular esquelético o el adiposo. Durante dichos procesos se transforman en lipoproteínas intermedias o remanentes, modificándose su contenido en apolipoproteínas y su composición lipídica, y reduciéndose proporcionalmente su contenido en triglicéridos y enriqueciéndose en colesterol, dando lugar finalmente, en el caso de las VLDL, a las lipoproteínas LDL, que contienen únicamente apo B-100. Estos cambios hacen que las lipoproteínas remanentes presenten un elevado potencial aterogénico, debido a una serie de características, como son un menor tamaño y un mayor contenido en colesterol, así como el hecho de que los ácidos grasos presentes en los triglicéridos de las lipoproteínas remanentes, así como sus derivados por modificación enzimática, procesos redox, etc., tienen la capacidad de promover procesos inflamatorios crónicos de baja intensidad que favorecen el desarrollo de la placa ateromatosa2–4.
Fibratos e hipertrigliceridemiaLos fibratos constituyen, junto con las resinas de intercambio iónico, uno de los primeros grupos terapéuticos utilizados en el control de las dislipemias. Aunque modifican favorablemente las concentraciones de las tres lipopoproteínas mayoritarias (VLDL, LDL y HDL), su efecto más marcado radica en la reducción de los triglicéridos plasmáticos, por lo que se han utilizado tradicionalmente en el tratamiento de la hipertrigliceridemia y la dislipemia mixta o aterogénica, típica del diabético. Los tres fibratos más utilizados son el gemfibrozilo, el bezafibrato y el fenofibrato. En la era preestatinas, el gemfibrozilo demostró una reducción del riesgo de eventos cardiovasculares, tanto en prevención primaria como secundaria, pero su uso ha decaído porque su administración combinada con estatinas altera el metabolismo de estas (especialmente de la simvastatina), potenciando la aparición de reacciones adversas asociadas a toxicidad en el músculo esquelético. Bezafibrato y fenofibrato no han alcanzado en la era de las estatinas una utilización extensiva en el control de las dislipemias, por dos razones básicas:
- •
La falta de eficacia en la reducción de accidentes cardiovasculares, en su utilización combinada con estatinas.
- •
La alteración en el perfil de seguridad de la combinación estatina-fibrato, debido a los posibles efectos adversos hepáticos y renales asociados a la utilización de fibratos.
Los fibratos actúan como ligandos selectivos de un receptor nuclear de tipo II (factores de transcripción activados por unión a ligandos específicos), el receptor activado por proliferadores peroxisómicos de tipo alfa o PPARα. Entre los fibratos tradicionales, el gemfibrozilo y el fenofibrato presentan básicamente afinidad por PPARα, mientras que el bezafibrato presenta una afinidad similar por las tres isoformas de PPAR, α, β y γ. La unión del ligando al receptor PPARα promueve la actividad del mismo, incrementado:
- •
La actividad de transactivación de genes que presentan un elemento de respuesta a PPAR en su zona promotora, como es el caso de APOAI, APOAV, LPL, ACO o CPTI, aumentando la actividad lipolítica sobre las lipoproteínas plasmáticas y el catabolismo de ácidos grasos en el hígado.
- •
La actividad de transrepresión sobre factores de transcripción proinflamatorios, como es el caso de NFκB o AP-1, reduciendo así los procesos inflamatorios de baja intensidad asociados a las alteraciones crónicas del metabolismo energético presentes en el síndrome metabólico5.
Aunque, como ya se ha indicado, los fibratos no han mostrado una reducción de los eventos cardiovasculares en su asociación con estatinas, el estudio específico de subgrupos de pacientes incluidos en los ensayos FIELD y ACCORD, en los que se utilizó fenofibrato, indican una posible reducción significativa en pacientes con niveles elevados de triglicéridos y bajos de cHDL, situación denominada dislipemia aterogénica, característica de pacientes con DMT2 o síndrome metabólico6,7.
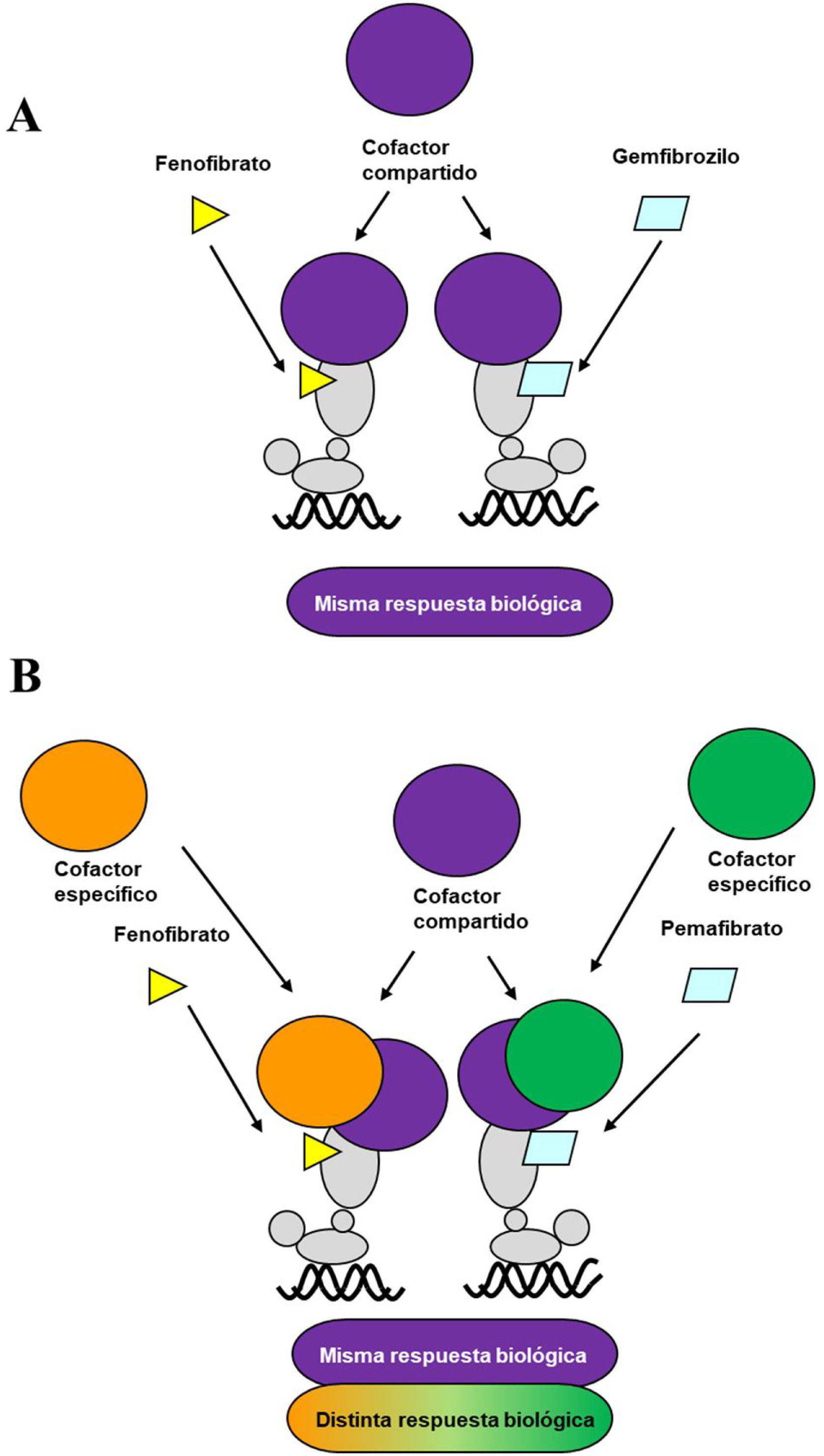
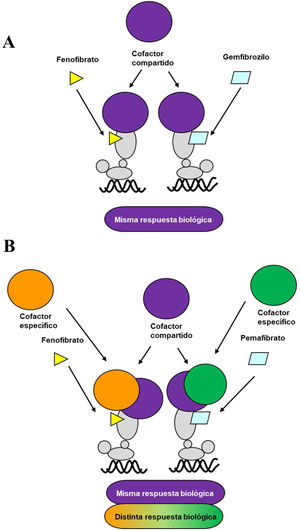
Durante la última década se ha desarrollado un nuevo fibrato, el pemafibrato, que presenta una alta afinidad por el receptor PPARα, un intenso efecto hipotrigliceridemiante y un buen perfil de seguridad, hecho que ha posibilitado su aprobación, por parte de las autoridades sanitarias japonesas, para el control de la dislipemia en combinación con estatinas. El pemafibrato, cuya excreción se produce por vía biliar, a diferencia del fenofibrato, que se excreta mayoritariamente por la orina, se ha clasificado como un modulador selectivo del receptor PPARα, en comparación a los ligandos clásicos, como el fenofibrato8. Por su interacción molecular específica con el sitio de unión a ligando o LBD del PPARα, favorece la asociación del mismo con un complejo de proteínas coactivadoras de la transcripción que potencia la expresión de los genes responsables del efecto hipolipemiante, mientras que reduce la intensidad de los efectos adversos hepáticos y renales típicos de los fibratos. A diferencia del fenofibrato, el pemafibrato induce en hepatocitos humanos, de forma PPARα-dependiente, la expresión de genes como ACO, VLDLR, FGF21 o ABCA1, modulando de forma positiva el metabolismo lipídico (fig. 1).
A. Ligando clásico del receptor PPARα: ambos ligandos (fenofibrato y gemfibrozilo) reclutan los mismos coactivadores de transcripción y producen efectos similares. B. Modulador del receptor PPARα: pemafibrato comparte coactivadores con el ligando clásico (fenofibrato), pero recluta también coactivadores diferentes, presentando así un perfil de eficacia y seguridad diferenciado del fenofibrato.
Estas características particulares del pemafibrato han hecho que su uso clínico se asocie a una mejora evidente del cociente eficacia/riesgo frente a los fibratos tradicionales, especialmente el fenofibrato, propiciando el desarrollo del ensayo clínico PROMINENT9, con la intención de verificar el posible efecto de pemafibrato en la reducción del riesgo cardiovascular en pacientes diabéticos. PROMINENT es un ensayo clínico randomizado, doble-ciego, multinacional que incluyó más de 10.000 pacientes con DMT2 que presentaban hipertrigliceridemia (200-499 mg/dL) y un cHDL ≤ 40 mg/dL, tratados mayoritariamente con estatinas y con un cLDL ≤ 80 mg/dL. El objetivo primario del ensayo era la incidencia agregada de infarto de miocardio, ictus isquémico, revascularización coronaria y muerte por causa cardiovascular. Durante los 3,4 años de seguimiento medio, el tratamiento con pemafibrato no disminuyó el objetivo primario con respecto al grupo placebo, a pesar de inducir una marcada reducción en los triglicéridos, en el colesterol contenido en las VLDL y las lipoproteínas remanentes, y en la apo C-III circulante. A diferencia de los ensayos clínicos realizados en el proceso de autorización del pemafibrato (en los que no se asoció con estatinas), en el estudio PROMINENT se detectó un modesto incremento, pero significativo, en las concentraciones de apo B (4,8%) y cLDL (12,3%) en los pacientes tratados con pemafibrato respecto al grupo placebo, lo que indicaría que la capacidad lipolítica de transformación de VLDL en LDL, aumentada por el pemafibrato, superaría a la capacidad de depuración hepática de LDL en dichos pacientes. A este respecto, cabe indicar los resultados de un ensayo de fase III en el que se comparó el efecto de pemafibrato a dos dosis, 0,2 y 0,4 mg/día, en comparación con fenofibrato (107 mg/día). Aunque el pemafibrato, a ambas dosis, mostró un efecto hipotrigliceridemiante superior al fenofibrato, a la dosis de 0,4 mg/día (dosis utilizada en el estudio PROMINENT), incrementó en un 4% (p = 0,054) los niveles de cLDL respecto al grupo fenofibrato10. Los resultados del ensayo PROMINENT, publicados en noviembre de 20229, han asestado un rudo golpe a la teoría del riesgo vascular asociado a las lipoproteínas ricas en triglicéridos y a la posible utilización del pemafibrato para su reducción en pacientes ya tratados con estatinas. Dado que la concentración de cLDL es el principal factor de riesgo cardiovascular, el incremento en los valores de cLDL observado en el ensayo PROMINENT podría haber sido suficiente para anular los posibles efectos beneficiosos de la reducción de la concentración de triglicéridos plasmáticos, de las lipoproteínas remanentes o de la actividad antiinflamatoria asociada al tratamiento con pemafibrato. En este sentido, cabe destacar que en el estudio ACCORD, en el que, al igual que en el estudio PROMINENT, los pacientes incluidos se encontraban mayoritariamente tratados con estatinas, la utilización adicional de fenofibrato (dosis inicial de 160 mg/día) no supuso ningún cambio significativo en la concentración de cLDL respecto al grupo placebo (reducciones de 100,0 a 81,1 mg/dL en el grupo fenofibrato y de 101,1 a 80,0 mg/dL en el grupo placebo al final del estudio).
Pemafibrato: ¿olvido o reposicionamiento?Un análisis somero de los resultados del estudio PROMINENT indicaría como posible destino del pemafibrato la lista de nuevas terapias en prevención cardiovascular que no superaron las expectativas depositadas en ellas, encabezada por los inhibidores de la CETP. Sin embargo, un escrutinio más cercano nos indica que la utilización del pemafibrato, a pesar del ligero incremento en los niveles de cLDL, no incrementa significativamente el riesgo cardiovascular, ni empeora globalmente la incidencia de efectos adversos respecto a placebo. Aunque según los resultados del estudio PROMINENT no parece haber diferencias entre las manifestaciones de toxicidad renal y la incidencia de trombosis venosa respecto al fenofibrato, el pemafibrato sí que mejora sensiblemente la seguridad hepática, reduciendo de forma significativa el número total de eventos adversos hepáticos. El pemafibrato no incrementó los niveles de transaminasas respecto al grupo placebo y, de hecho, redujo en 22%, de forma significativa, la incidencia de enfermedad hepática no alcohólica (EHNA). Este último efecto es de capital trascendencia, por dos razones:
Según un estudio reciente, la EHNA presenta una prevalencia de 32,4% a nivel mundial y con tendencia al alza11. Hay que recalcar que, hasta el momento, la EHNA no presenta ningún tratamiento farmacológico aprobado y es la puerta al desarrollo futuro de cirrosis y carcinoma hepatocelular, patologías ambas con un pronóstico difícil.
Hoy en día se considera la EHNA como un factor de riesgo cardiovascular, ya que se asocia a una mayor morbimortalidad cardiovascular12,13.
Recientemente, Nakajima et al. han comunicado los resultados de un ensayo en fase II en pacientes con esteatohepatitis (118 pacientes), en el que el tratamiento con pemafibrato reduce la rigidez hepática, evaluada por elastografía de resonancia magnética, y los niveles sanguíneos de cLDL y ALT vs. placebo14. El reposicionamiento del pemafibrato para el tratamiento de la EHNA no solo podría suponer una terapia efectiva para dicha patología, sino que podría contribuir a reducir el riesgo cardiovascular en dichos pacientes.
Aunque se considera que aproximadamente 50% de los pacientes con obesidad y/o DMT2 presentan EHNA, no parece ser este el caso de los pacientes participantes en el estudio PROMINENT (200 casos en más de 5.000 pacientes incluidos en el grupo placebo, prevalencia menor de 5%), ya que de hecho los pacientes con enfermedad hepática con sintomatología clínica fueron excluidos del estudio. Estaría por ver cuál habría sido el resultado del estudio PROMINENT si se hubiera incorporado como criterio de inclusión la presencia de EHNA.
FinanciaciónSe ha obtenido financiación por parte de la beca PID2020-112870RB-I00 del MCIN/AEI/10.13039/501100011033, beca 2021 SGR 00345 de la Generalitat de Catalunya, hay una beca de investigación básica 2020 de la SEA R.B es un estudiante predoctoral PREDOCS-UB.
Conflicto de interesesNo se declara ningún conflicto de intereses.