Establecer las concentraciones plasmáticas de factor de necrosis tumoral alfa (FNT-α) en preeclámpsicas y embarazadas normotensas, y relacionar los valores de los parámetros de velocimetría Doppler de las arterias uterinas con las concentraciones séricas.
Material y métodosSe seleccionó a 160 sujetos. Se incluyó a80 preeclámpsicas como los casos (grupo A) y a un grupo control de 80 embarazadas sanas (grupo B) que fueron seleccionadas por tener una edad y un índice de masa corporal similares alos del grupo de estudio. Las muestras de sangre para la determinación de FNT-α y las mediciones de los índices de pulsatilidad, índice de resistencia y relación de flujo sístole/diástole de las arterias uterinas se realizaron en todas las pacientes antes del parto e inmediatamente después del diagnóstico en el grupo de casos.
ResultadosLas pacientes del grupo A presentaron concentraciones significativamente más elevadas de FNT-α que las embarazadas del grupo B (p<0,05). Las mediciones del índice de pulsatilidad, índice de resistencia y relación de flujo sístole/diástole de las arterias uterinas mostraron valores significativamente más altos en el grupo de las preeclámpsicas (p<0,05). Al correlacionar las concentraciones de FNT-α plasmáticas con los valores de velocimetría Doppler de las arterias uterinas se observó que esta era significativa con los 3 parámetros evaluados (p<0,05).
ConclusionesLas preeclámpsicas presentan concentraciones plasmáticas de FNT-α más altas que las embarazadas normotensas y existe correlación significativa entre las concentraciones plasmáticas y los parámetros de velocimetría Doppler de las arterias uterinas.
To establish plasma tumor necrosis factor alpha (TNF-α) concentrations in patients with preeclampsia and healthy normotensive pregnant women and to determine the association between Doppler velocimetry with serum concentrations.
Material and methodsWe selected 160 women. Eighty preeclamptic patients were selected as cases (group A) and 80 healthy pregnant women with a similar age and body mass index to patients in group A were selected as controls (group B). Blood samples for TNF-α and measurements of the pulsatility index, resistance index and the systolic/diastolic blood flow ratio of the uterine arteries were performed in all patients before labor and immediately after diagnosis in group A.
ResultsConcentrations of TNF-α were significantly higher in group A than in group B (P<.05). Measurements of the pulsatility index, resistance index and the systolic/diastolic blood flow ratio of the uterine arteries were higher in group A (P<.05). When TNF-α concentrations were correlated with Doppler velocimetry values, a significant association was observed with all three of the parameters evaluated (P<.05).
ConclusionsPreeclamptic patients showed higher plasma TNF-α concentrations than normotensive pregnant women. Plasma TNF-α concentrations were significantly correlated with parameters of Doppler velocimetry of the uterine arteries.
La preeclampsia es una enfermedad multisistémica caracterizada por una alteración endotelial difusa, con incremento de la resistencia vascular periférica, alteraciones de la coagulación, estrés oxidativo, dislipidemia y aumento de las citocinas producidas por los leucocitos1.
La hipótesis de la mala adaptación inmune sugiere que la preeclampsia es causada por la inadecuada regulación de la respuesta inmune Th2 materna, lo cual lleva a un aumento de la dañina inmunidad Th12. La disfunción endotelial observada en la preeclampsia puede ser parte de una activación incontrolada y excesiva de la respuesta inflamatoria materna al embarazo. La respuesta inflamatoria inmune generalizada que ocurre en la preeclampsia es secundaria al aumento de las concentraciones de citocinas circulantes3.
El factor de necrosis tumoral alfa (FNT-α) es un inmunoestimulante y mediador de la inflamación capaz de promover algunos factores de crecimiento. Lo producen los macrófagos, las células T citotóxicas, la placenta y los tejidos deciduales4, ejerce función en la implantación, es capaz de modular la invasión del trofoblasto al útero, así como de inhibir in vitro la síntesis de ADN y la proliferación celular del trofoblasto5,6. Diferentes datos sugieren que el FNT-α contribuye a las alteraciones endoteliales y a la dislipidemia que caracterizan la fisiopatología de la preeclampsia.
El uso obstétrico de la ecografía Doppler para la monitorización de los embarazos de alto riesgo es en la actualidad un procedimiento indispensable. Los resultados de los metaanálisis demuestran que se puede lograr una disminución significativa en la mortalidad materna y perinatal utilizando la ecografía Doppler en comparación con el uso rutinario de la cardiotocografía fetal y la biometría por ultrasonido7.
En casos de hipertensión durante el embarazo y de preeclampsia, se han descrito los cambios patológicos específicos en el espectro del flujoDoppler y se han correlacionado los hallazgos histopatológicos como alteraciones en el desarrollo de las vellosidades, grandes áreas de infarto y disminución de las áreas de fijación decidual8. El número de pequeñas arterias en las vellosidades fetales está significativamente disminuido en los hallazgos patológicos Doppler9. La dilatación insuficiente de las arterias espirales, la cual puede ser detectada por la ecografía Doppler como resultado de una invasión trofoblástica deficiente, es actualmente considerada la base patogénica de la preeclampsia10.
Los estudios sobre los cambios en las concentraciones de citocinas en plasma y la posible relación con la velocimetría Doppler son escasos y las posibles asociaciones no han sido confirmadas en forma consistente, por lo que el objetivo de la investigación fue establecer las concentraciones plasmáticas de FNT-α en preeclámpsicas y embarazadas normotensas y comparar los valores de los parámetros de velocimetría Doppler de las arterias uterinas de acuerdo con las concentraciones séricas.
Materiales y métodosEste estudio de casos y controles se realizó con embarazos de más de 32 semanas que acudieron a urgenciasobstétricas del Servicio de Obstetricia del Hospital Central Dr. Urquinaona de Maracaibo (Venezuela).Se obtuvieron las concentraciones plasmáticas de FNT y la velocimetría Doppler de flujo sanguíneo de las arterias uterinas. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo consentimiento por escrito de todas las pacientes.
Se incluyó a80 mujeres con preeclampsia (grupo A). El grupo control (grupo B) fue seleccionado por tener edades maternas y gestacionales similares alasdel grupo en estudio y consistió en 80 embarazadas sanas. Solo se incluyó aembarazadas nulíparas.
Se excluyó a las embarazadas polihidramnios, con hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), con sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, autoinmune, respiratoria, hepática, renal o sistémica crónica, diabetes mellitus pre- o gestacional, hábito tabáquico. También se excluyó a las pacientes que se negaron a participar en la investigación.
La preeclampsia se definió como la presión arterial sistólica de 140 mm de Hg o más, o presión arterial diastólica de 90 mm de Hg o más, confirmada por 6 h o más de diferencia, mientras que la proteinuria se definió como 300 mg o más de proteína en una muestra de 24 h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación.La presión sanguínea se midió en posición sentada después de 15 min de descanso.
En todas las pacientes se realizó la ecografía antes del uso de cualquier intervención. Se midieron el índice de pulsatilidad, el índice de resistencia y la relación del flujo sanguíneo sístole/diástole de las arterias uterinas. Las arterias uterinas fueron identificadas en una visualización longitudinal de las caras laterales del útero con la paciente reclinada.En esa posición, demostró la bifurcación de la arteria ilíaca común. La medición se realizó en el punto donde la arteria uterina y la ilíaca externa parecen cruzarse. En ese punto se midieron los parámetros de velocimetría Doppler de ambas arterias uterinas y se calculó el promedio de ambos vasos.
Las muestras de sangre de la vena antecubital para la determinación de factor de necrosis tumoral se recolectaron antes del tratamiento en las preeclámpsicas y se las dejó coagular a temperatura ambiente. Todas las muestras se almacenaron a −70°C hasta el momento de procesarlas. Posteriormente, fueron centrifugadas a 1.000 g por 15 min a los 60 min de tomada la muestra y almacenadas con posterioridad a −80°C. Se utilizó una prueba de inmunoabsorbencia ligada a enzima para la medición cuantitativa del FNT-α en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio fue el resultado final. La sensibilidad fue de 3,5 pg/ml. El coeficiente de variación intra- e interensayo fue menor del 5%.
Los datos se presentan como valores promedios± desviación estándar. El análisis estadístico entre los grupos se realizó con la prueba t de Student para muestras no relacionadas para comparar los datos sobre edad materna, edad gestacional, presión arterial sistólica y diastólica, concentraciones de FNT-α, índice de pulsatilidad, índice de resistencia y relación del flujo sanguíneo sistólico/diastólico de las arterias uterinas entre las preeclámpsicas (grupo A) y las embarazadas controles (grupo B). Las concentraciones de FNT-α se dividieron por cuartiles (concentración baja, media, alta y muy alta) y se compararon los valores promedio de los parámetros de velocimetría Doppler de los cuartiles medio, alto y muy alto con el cuartil de concentraciones bajas utilizando la prueba de análisis de varianza (ANOVA) con postest de Dunett. Los coeficientes de correlación entre el FNT y los valores promedio de los parámetros de velocimetría Doppler de las arterias uterinas se evaluaron mediante la prueba de Pearson. Se consideró p<0,05 como estadísticamente significativa.
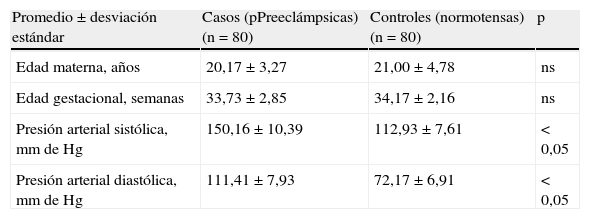
ResultadosLas características de las mujeres de ambos grupos se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas en la edad materna ni en la edad gestacional (p=ns). Se encontraron diferencias estadísticamente significativas en los valores promedio de presión arterial sistólica y diastólica entre los 2 grupos de mujeres (p<0,05).
Características generales de las preeclámpsicas y las embarazadas normotensas
| Promedio±desviación estándar | Casos (pPreeclámpsicas) (n=80) | Controles (normotensas) (n=80) | p |
| Edad materna, años | 20,17±3,27 | 21,00±4,78 | ns |
| Edad gestacional, semanas | 33,73±2,85 | 34,17±2,16 | ns |
| Presión arterial sistólica, mm de Hg | 150,16±10,39 | 112,93±7,61 | < 0,05 |
| Presión arterial diastólica, mm de Hg | 111,41±7,93 | 72,17±6,91 | < 0,05 |
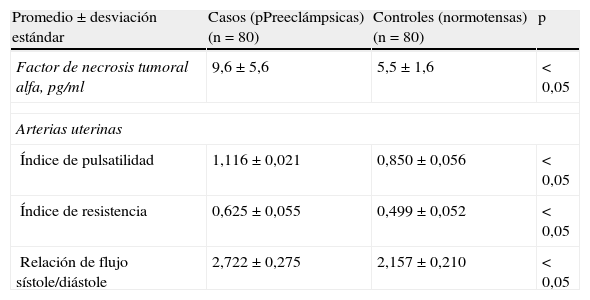
En la tabla 2 se muestran las concentraciones plasmáticas de FNT-α y los valores de la velocimetría Doppler de los 2 grupos de estudio. Las pacientes del grupo A presentaron concentraciones significativamente más elevadas de FNT-α (9,6± 5,6 pg/ml) que las mujeres del grupo B (5,5±1,6 pg/ml; p<0,05). Las mediciones del índice de pulsatilidad (1,116±0,021 comparado con 0,850±0,056), índice de resistencia (0,625±0,055 comparado con 0,499±0,052) y relación de flujo sanguíneo sístole/diástole (2,722±0,275 comparado con 2,157±0,210) de las arterias uterinas demostraron valores significativamente más altos en el grupo de las preeclámpsicas que en los controles (p<0,05).
Concentraciones de factor de necrosis tumoral alfa ydeterminaciones hemodinámicas en las diferentes arterias en las preeclámpsicas y las embarazadas normotensas
| Promedio±desviación estándar | Casos (pPreeclámpsicas) (n=80) | Controles (normotensas) (n=80) | p |
| Factor de necrosis tumoral alfa, pg/ml | 9,6±5,6 | 5,5±1,6 | < 0,05 |
| Arterias uterinas | |||
| Índice de pulsatilidad | 1,116±0,021 | 0,850±0,056 | < 0,05 |
| Índice de resistencia | 0,625±0,055 | 0,499±0,052 | < 0,05 |
| Relación de flujo sístole/diástole | 2,722±0,275 | 2,157±0,210 | < 0,05 |
Al correlacionar las concentraciones de FNT-α plasmáticas con los valores de velocimetría Doppler de las arterias uterinas se observó que la correlación era moderada, positiva y significativa con los valores del índice de pulsatilidad (r=0,429; p<0,05), con la relación de flujo sístole/diástole (r=0,379; p<0,05) y débil, positiva y significativa con el índice de resistencia (r=0,419; p<0,05).
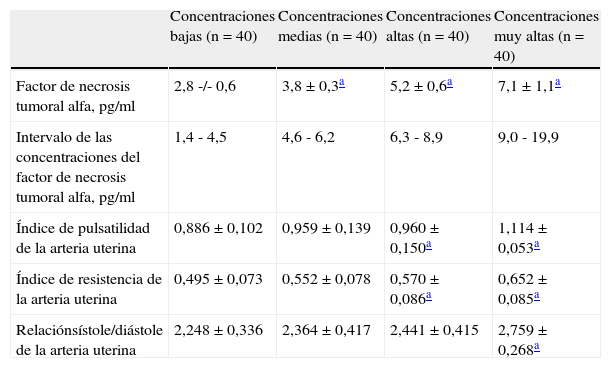
Los valores promedio de los diferentes parámetros de velocimetría Doppler por cada cuartil de concentración de FNT-α se muestran en la tabla 3. Los valores promedio del índice de pulsatilidad e índice de resistencia fueron significativamente más altos en los grupos con concentraciones moderadas, altas y muy altas de FNT-α (p<0,05). Sin embargo, solo los valores promedios de relación de flujo sanguíneo sístole/diástole en el grupo de concentraciones muy altas mostraron diferencias estadísticamente significativas al compararlos con los del grupo de concentraciones bajas de FNT-α (2,775±0,251 comparado con 2,2269±0,351; p<0,05).
Valores promedio de la velocimetría Doppler de la arteria uterina de acuerdo a la concentración del factor de necrosis tumoral alfa por cuartiles
| Concentraciones bajas (n=40) | Concentraciones medias (n=40) | Concentraciones altas (n=40) | Concentraciones muy altas (n=40) | |
| Factor de necrosis tumoral alfa, pg/ml | 2,8 -/- 0,6 | 3,8±0,3a | 5,2±0,6a | 7,1±1,1a |
| Intervalo de las concentraciones del factor de necrosis tumoral alfa, pg/ml | 1,4 - 4,5 | 4,6 - 6,2 | 6,3 - 8,9 | 9,0 - 19,9 |
| Índice de pulsatilidad de la arteria uterina | 0,886±0,102 | 0,959±0,139 | 0,960±0,150a | 1,114±0,053a |
| Índice de resistencia de la arteria uterina | 0,495±0,073 | 0,552±0,078 | 0,570±0,086a | 0,652±0,085a |
| Relaciónsístole/diástole de la arteria uterina | 2,248±0,336 | 2,364±0,417 | 2,441±0,415 | 2,759±0,268a |
Los resultados de esta investigación demuestran que las preeclámpsicas tienen concentraciones plasmáticas de FNT-α más altas que las embarazadas normotensas. También demuestran que las concentraciones de FNT-α presentan una correlación positiva con los valores de los parámetros de velocimetría Doppler de la arteria uterina. La elevación de esta citocina es fundamental para el desarrollo tanto de la preeclampsia como de otras condiciones del embarazo, como el aborto, el parto pretérmino y la restricción del crecimiento intrauterino11.
Kupfermincet etal.12 reportaronque las preeclámpsicas tienen concentraciones superiores del FNT-αa las embarazadas normales. Durante el parto, las cifras fueron superiores en las preeclámpsicas, tanto en plasma como en líquido amniótico. Al igual que lo reportado en esta investigación, Heyl et al.13 reportaron concentraciones elevadas de FNT-αbioactivo en plasma de preeclámpsicas. Livingston et al.14, por el contrario, no encontraron diferencias significativas en las concentraciones de FNT-α de pacientes entrepreeclámpsicas y controles, pero reportaron que los valores de la citocina son inferiores, tanto en plasma fetal como materno, cuando existe restricción intrauterina del crecimiento del feto de causa indeterminada.
La fuente de la producción excesiva de FNT-α en la preeclampsia es desconocida: puede tener su origen en los monocitos, los neutrófilos o la placenta misma. Ambas clases de monocitos están activados en la preeclampsia15. Uno de los posibles mecanismos es que en la preeclampsia uno o más factores derivados de la placenta estimulan los monocitos o los neutrófilos para producir la citocina, lo cual, a su vez, causa las alteraciones subyacentes en el síndrome materno. La producción por la placenta puede tener algún papel fisiológico o patológico, ya que el sinciciotrofoblasto de la placenta normal contiene ARN mensajero del factor y factor biológicamente activo16.
El FNT-α puede causar daño tisular mediante la acción de proteasas, colagenasas o fosfolipasa A2, o a través de radicales de oxígeno. La afectación de las células endoteliales lleva a alteraciones locales del flujo sanguíneo, obstrucción de vasos y aumento de la permeabilidad del endotelio, elementos señalados como característicos de la secreción patológica de esta citocina17. Entre sus acciones también figuran la facilitación de la actividad procoagulante, por inducción del factor tisular de células endoteliales y supresión de la activación de la proteína C, y la liberación de sustancias vasopresoras, como la endotelina-1 y el factor de crecimiento derivado de plaquetas18. Todas estas alteraciones son compatibles con lo que sucede en la preeclampsia. También ejerce acciones sobre la activación plaquetaria que en fases preclínicas tiene la preeclampsia.
Las citocinas pueden tener un efecto tóxico que produce un aumento en la producción de sintetasa de óxido nítrico, ciclooxigenasa y liberación de radicales libres19. Estos hechos confirman la relación entre el aumento de las concentraciones de FNT-α y la inflamación o destrucción tisular y apoya los hallazgos encontrados en la presente investigación sobre la relación entre las modificaciones de la circulación sanguínea en las arterias uterinas y las concentraciones de FNT-α.
La disminución del flujo uteroplacentario, sugerida por la comparación de los hallazgos en las mediciones Doppler (aumento del índice de pulsatilidad y de la resistencia y de la relación de flujo sístole/diástole) entre las preeclámpsicas y las controles normotensas, demostrada por los resultados de esta investigación, puede ser el resultado directo de un incremento inapropiado de la vasoconstricción acompañado de una disminución de la relajación dependiente del endotelio como previamente reportaron Trapani et al.20.
Las variaciones en la resistencia de las arterias uterinas durante el embarazo demuestran ser importantes para la función placentaria normal,debido a que las arterias espirales se transforman en vasos de conducción por la invasión trofoblástica durante la placentación. Se ha sugerido que la relajación dependiente del endotelio en la preeclampsia está disminuida y que esto puede alterar la perfusión placentaria21. Sin embargo, se ha indicado que la disminución de la reactividad vascular en las arterias maternas no es completamente responsable de la reducción del flujo placentario22.
Las lesiones maternas y fetales pueden ser el resultado de la hipoxia tisular o de la infección de los tejidos, o puede ser secundaria a la respuesta inflamatoria. La circulación en el circuito materno y en el fetal está controlada por mediadores metabólicos, neurales y químicos, pero ambas son capaces de autorregularse. Se observa la vasodilatación en casos de disminución en la perfusión y vasoconstricción en presencia de un aumento de la presión de perfusión23. La autorregulación produce flujos sanguíneos relativamente constantes a pesar de la variación moderada de la presión del flujo. La autorregulación podría, además, ser un mecanismo de protección del feto de la hipoxia y de las fluctuaciones de presión. Varios autores han reportado que estos signos pueden ser transitorios y que pueden desaparecer secundarios a la aparición de alguna complicación de la preeclampsia24,25. Los resultados de esta investigación prueban que la velocimetría Doppler de las arterias uterinas demuestra un aumento en la resistencia del flujo sanguíneo en presencia de altas concentraciones de FNT, lo cual podría ser un signo de alteración de la autorregulación.
Las citocinas también pueden influir la adhesión celular intravascular, coagulación y trombosis26.Pueden activar el endotelio y estimular sus propiedades procoagulantes, mientras inhiben la anticoagulación y los efectos fibrinolíticos27. Esto podría explicar porqué los cambios en los parámetros Doppler de las arterias uterinas se relacionan con las concentraciones de FNT. Por lo que el incremento de las concentraciones podría no solo ser un reflejo de las alteraciones endoteliales o vasculares, sino también del daño tisular de la placenta a través de la trombosis que caracteriza las complicaciones de la preeclampsia. Si la placenta es la principal fuente de FNT, las muestras de sangre de los vasos umbilicales podrían aportar el mismo resultado, debido a que el FNT de la placenta se encontraría tanto en la circulación materna como en la fetal.
Los resultados de la investigación promueven la realización de posteriores investigaciones, particularmente en la evaluación de marcadores de inflamación tisular en relación con las mediciones de los parámetros de velocimetría Doppler, lo que podría ser de gran valor en situaciones clínicas complejas en el manejo de las preeclámpsicas.
En conclusión, los hallazgos de esta investigación demuestran que las preeclámpsicas presentan concentraciones plasmáticas de FNT-α más altas que las embarazadas normotensas y que hay una moderada correlación positiva entre las concentraciones plasmáticas y los parámetros de velocimetría Doppler de las arterias uterinas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.