El tumor de células de la granulosa pertenece al grupo de los tumores de los cordones sexuales y del estroma, y su frecuencia oscila entre el 2–5%. Existen dos subtipos: el del adulto, que representa un 95%, con edades comprendidas entre 50–54 años, y el juvenil, que representa el 5% restante y que debuta generalmente antes de la pubertad.
Es un tumor con potencial maligno por la tendencia a recurrir años después del diagnóstico inicial.
Se describen dos casos clínicos de este tipo de tumor, analizando su comportamiento, evolución y pronóstico, que difiere y es más favorable que el cáncer epitelial de ovario.
Granulosa cell tumor belongs to the group of sex cord-stromal tumors of the ovary and has a frequency of 2–5%. These tumors are categorized into two subtypes: the adult type represents 95% and develops in persons aged 50–54 years, while the juvenile type accounts for 5% and typically develops before puberty.
This type of tumor has malignant potential due to its tendency to recur and metastasize. We report two cases of adult granulosa cell tumor and analyze its behavior, course and prognosis, which is more favorable than that of epithelial ovarian tumor.
El tumor de células de la granulosa (TCG) pertenece a los tumores de los cordones sexuales del estroma que representan un 5–8% de las neoplasias primarias de ovario.
Son tumores funcionantes, con capacidad para producir hormonas esteroides y debuta con signos de exceso estrogénico. Secretan proteínas como la inhibina, que pueden constituir un marcador diagnóstico específico.
La cirugía confirma el diagnóstico y es el principal tratamiento. En contraste con los tumores epiteliales de ovario, las pacientes son diagnosticadas en un estadio temprano y son tumores de bajo potencial de malignidad, por lo que el pronóstico es más favorable, aunque se caracterizan por su tendencia a recurrir incluso tiempo después de la cirugía.
Se describen dos casos de TCG de tipo adulto y se realiza una revisión bibliográfica de este tipo de tumor, infrecuente pero con características propias que lo diferencian notablemente de los tumores epiteliales de ovario.
Caso clínico 1Paciente de 46 años G1P1A0, sin antecedentes médicos de interés, que consulta por trastornos menstruales. En la ecografía pélvica se visualiza quiste anexial derecho de 47mm con marcadores tumorales CEA, CA 19.9, CA 125 dentro de la normalidad.
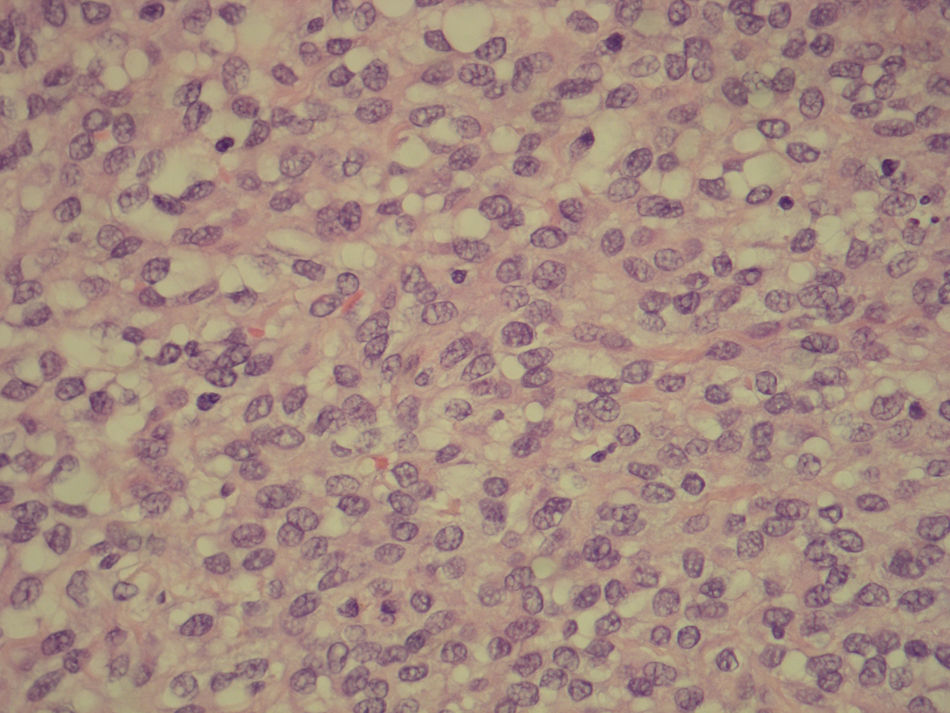
Se propone laparoscopia quirúrgica, que confirma la presencia de quiste anexial derecho, y se realiza anexectomía derecha con ruptura accidental del quiste durante la intervención. La anatomía patológica confirma presencia de TCG de tipo adulto variante difusa. Las células presentan núcleos ovoides dispuestos al azar con presencia de hendiduras longitudinales a modo de grano de café, adoptando un patrón difuso. Inmunohistoquímicamente presentan inhibina débilmente+, vimentina+, CD10+, calretinina+, −S-100−, alfa-actina−, AE1-AE3−, CD99− (figs. 1 y 2).
Con este diagnóstico y debido a la edad de la paciente, se le propone realizar histerectomía total y anexectomía izquierda para completar el tratamiento. La anatomía patológica de la segunda intervención demuestra dos implantes capsulares en el ovario izquierdo, compatibles morfológica e inmunohistoquímicamente con células de la granulosa.
Con el diagnóstico de TCG estadio IIC, se realiza tratamiento adyuvante con quimioterapia, 3 ciclos según esquema BEP (bleomicina, etopósido, cisplatino). El seguimiento se realiza con ecografía y niveles de inhibina B, que se mantuvieron dentro de la normalidad en el control realizado al año.
Caso clínico 2Paciente de 26 años G0P0 que acude a la consulta por sensación de distensión abdominal y masa pélvica. A la exploración se palpa una masa a nivel supraumbilical que en el tacto vaginal abomba en el fondo del saco de Douglas. Se realiza ecografía abdominopélvica que demuestra una tumoración de aproximadamente 14cm, que parece depender del ovario derecho. Marcadores tumorales CEA, CA 19.9 y CA 125: negativos.
Se realiza laparatomía exploradora que confirma una masa pélvica sólida dependiente del ovario derecho; el ovario contralateral es de aspecto macroscópicamente normal. No se objetivan implantes en el peritoneo. Se recoge líquido ascítico para citología y se realiza anexectomía derecha.
La anatomía patológica confirma presencia de TCG de tipo adulto variante folicular. Morfológicamente, la tumoración está poblada de células que presentan núcleos ovalados con hendiduras y aspecto de grano de café. Estas células crecen con un patrón difuso en unas zonas y en otras trabecular o cordonal, sin mitosis en número relevante. Inmunohistoquímica: inhibina+, vimentina+, actina y S-100+; HMB 45−, EMA−, CK7−, AE1AE3− (figs. 3 y 4).
Con el diagnóstico de TCG, dada la edad de la paciente y su condición genésica, se decide cirugía conservadora. Con un probable estadio IA y una masa de gran tamaño de 14cm, se propone a la paciente quimioterapia adyuvante, que rechaza y decide observación.
En controles posteriores con ecografía pélvica se visualiza al año una formación quística de 34×30mm de aspecto benigno en el anejo izquierdo, que persiste a los 6 meses pero que desaparece en el control del 2.o año. El último control ecográfico realizado al tercer año postintervención es normal. Los niveles de inhibina B se han mantenido negativos durante todo el seguimiento.
DiscusiónEl TCG representa un 70% de los tumores de los cordones sexuales y del estroma, y su frecuencia es del 2–5% de los tumores de ovario.
Existen dos subtipos: el juvenil y el adulto. El subtipo adulto, que es el que presentamos, es el más frecuente y representa el 95% de los casos, con una edad comprendida entre 50 y 54 años. El subtipo juvenil (5%) debuta antes de la pubertad típicamente en mujeres menores de 30 años y tiene un alto grado de proliferación pero menor riesgo de recurrencia que en el adulto1,2.
Generalmente son unilaterales, de gran tamaño y se presentan como una masa quística amarillenta por acúmulo lipídico.
Histológicamente, el subtipo adulto se caracteriza por células que proliferan en una variedad de patrones que se pueden mezclar. De éstos, el microfolicular se caracteriza por unas formaciones similares a rosetas que son los cuerpos de Call-Exner. Existen otros, como el macrofolicular, trabecular, insular o difuso, dependiendo fundamentalmente de la distribución de las células. En todos ellos se pueden apreciar las típicas células con citoplasma escaso y núcleo hendido que conocemos como células en grano de café (figs. 1 y 3). El subtipo juvenil se diferencia del adulto por presentar células de la granulosa con abundante citoplasma y núcleo hipercromático (sin el típico núcleo en grano de café ni los cuerpos de Call-Exner)11.
El diagnóstico histológico se completa con la inmunohistoquímica utilizando anticuerpos contra células de la granulosa como inhibina like, CD99, sustancia mülleriana inhibidora (MIS), vimentina, citokeratinas, S-100, proteína actínica del músculo5–7. De todas éstas, la inhibina es la más sensible y específica para tumores de células de la granulosa (figs. 2 y 4). Aun así, no es exclusivo de estos tumores, sino que puede tener positividad para tumores endometriales y metástasis de carcinomas ováricos3,4.
El pronóstico en ningún caso guarda relación con el patrón histológico que presentan estos tumores3,4,8.
La forma de presentación clínica más frecuente es la masa abdominal asintomática, como en el segundo caso que presentamos. Otras formas clínicas son el sangrado uterino anormal y la pubertad precoz (típica del patrón juvenil), a causa del hiperestrogenismo ovárico5,6,11.
El diagnóstico es histológico, y la cirugía es necesaria para confirmarlo y llevar a cabo estadificación y tratamiento.
Como marcador sérico se utiliza la inhibina, un péptido producido por el ovario en respuesta a la hormona foliculoestimulante (FSH) y hormona luteinizante (LH), con dos isoformas bien diferenciadas, inhibina A y B. Usualmente, la inhibina no se detecta en mujeres posmenopaúsicas, pero ciertos tumores, como el carcinoma epitelial mucinoso de ovario y el TCG, pueden elevar su nivel. Con más frecuencia se detecta aumento de la inhibina B y estos niveles pueden ser usados para el seguimiento del tratamiento y para detectar recidivas7,8. El estradiol puede estar elevado en un 30% de los casos, pero lo más específico es la MIS, que puede elevarse hasta 12 meses antes de una recaída clínica o radiológica9.
Debido a que se asocia a hipersecreción estrogénica con hiperplasia endometrial en el 25–50% y con adenocarcinoma en el 5–10% de los casos, se debe practicar una biopsia endometrial antes de la cirugía5,6.
En estos tumores, el tratamiento de elección es la cirugía, que asimismo nos permite confirmar el diagnóstico. En peri o posmenopaúsicas o mujeres con deseos genésicos completos, la histerectomía con doble anexectomía es el tratamiento de elección, recomendándose cirugía de estadificación, siendo lo más importante para el pronóstico.
Si existen deseos genésicos, está indicada la cirugía conservadora con anexectomía unilateral. Las guías de oncología americanas recomiendan realizar cirugía de estadiaje a todas las pacientes aunque se realice cirugía conservadora, incluyendo una biopsia endometrial13.
Para estadios IA, la salpingooforectomía unilateral es lo indicado y se acepta como único tratamiento, con una supervivencia del 90%10,12,13.
En el caso de estadios I con factores de mal pronóstico, como el gran tamaño (10–15cm), la ruptura del tumor (IC) o el índice mitótico elevado, se puede beneficiar de tratamiento con quimioterapia adyuvante a base de cisplatino o radioterapia, aunque también la observación es una opción válida12–15. En los estadios II–IV está demostrado el beneficio de la quimioterapia o de la radioterapia adyuvante para limitar la extensión de la enfermedad12–14.
En los casos que presentamos, un TCG estadio II fue tratado con cirugía de estadiaje y se completó el tratamiento con 3 ciclos de BEP. En el segundo caso se realizó una salpingooforectomía unilateral sin cirugía de estadiaje (probable estadio IA).
La quimioterapia adyuvante también demostró aumentar el período libre de recidiva en el subtipo juvenil, recomendándose también en estadio IC o estadios más avanzados y alto índice mitótico11.
El régimen más comúnmente empleado es la combinación BEP20,22.
El pronóstico depende fundamentalmente del estadio en el momento de la cirugía y de la presencia de masa residual16,19.
La supervivencia a 5 años en estadio I con resección quirúrgica óptima es del 90%16–18. En presencia de factores de mal pronóstico o estadios avanzados se registra mayor riesgo de recurrencias tempranas y menor supervivencia12,16,19.
El comportamiento de este tumor se caracteriza por una tasa más elevada de recidiva que los tumores epiteliales de ovario, presentando a pesar de ello mejor pronóstico que estos últimos18.
El tiempo medio de aparición de una recidiva desde el diagnóstico es de 6 años, pero se han descrito recidivas hasta 40 años más tarde17,18, lo que obliga a un seguimiento a largo plazo, a pesar de una cirugía óptima. Las recomendaciones para el seguimiento consisten en un examen pélvico y determinación de niveles de inhibina B cada tres meses durante los 2 primeros años, cada 6 meses del tercer al quinto año y posteriormente anuales17,20.
Las recidivas suelen ser a nivel pélvico y la cirugía es el tratamiento inicial. Si persiste recurrencia pélvica, la radioterapia o la quimioterapia con BEP, paclitaxel/carboplatino son opciones válidas con las que se consigue respuesta en un 54–84%. Desafortunadamente, los estadios avanzados no tienen remisiones duraderas13,20,21,23.
ConclusionesLos casos de TCG son infrecuentes, pero en su comportamiento existen particularidades específicas que hay que conocer para realizar un adecuado tratamiento y seguimiento.
Se caracterizan por producir clínica de hiperestrogenismo, para tener en cuenta en el momento del diagnóstico, recomendándose realizar biopsia endometrial para descartar adenocarcinoma y/o hiperplasia endometrial, sobre todo si se lleva a cabo una cirugía conservadora.
La cirugía es el pilar fundamental del tratamiento. En mujeres en edad reproductiva está indicado realizar una cirugía conservadora con salpingooforectomía unilateral y la histerectomía total con doble anexectomía en peri y posmenopaúsicas. La quimioterapia adyuvante es beneficiosa en todos los estadios y se ha asociado con prolongación de la supervivencia libre de enfermedad, especialmente importante en estos tumores porque presentan tasas de recidiva más elevadas que en otros tumores ováricos. Es razonable llevar a cabo un seguimiento a largo plazo, que consiste en un examen pélvico y determinación de inhibina B.
En términos de supervivencia, el pronóstico de este tumor es más alentador que los tumores epiteliales de ovario debido a una menor agresividad y, por tanto, a un estadio más localizado en el momento del diagnóstico.