La determinación de tiroglobulina (Tg) por métodos inmunorradiométricos presenta interferencia por anticuerpos antitiroglobulina hasta en el 30% de los casos, sugiriendo la necesidad de encontrar métodos alternativos para el seguimiento de un número significativo de pacientes con cáncer de tiroides.
ObjetivosEvaluar la sensibilidad, especificidad y valores predictivos de los niveles de ARN mensajero de la Tg (ARNm Tg) medidos con la técnica de PCR cuantitativa en tiempo real (qRT-PCR) en sangre periférica de pacientes en seguimiento por cáncer diferenciado de tiroides.
MétodosEstudio prospectivo de los niveles de ARNm Tg determinados por qRT-PCR cuantitativa. Se extrajo una muestra de sangre periférica en pacientes con respuesta excelente (n=69), y con respuesta estructural incompleta al tratamiento (n=23). Los resultados fueron analizados por el programa Unity Real-Time y expresados en fg/μg ARN. Se realizó una curva ROC para establecer el punto de corte de niveles de ARNm Tg.
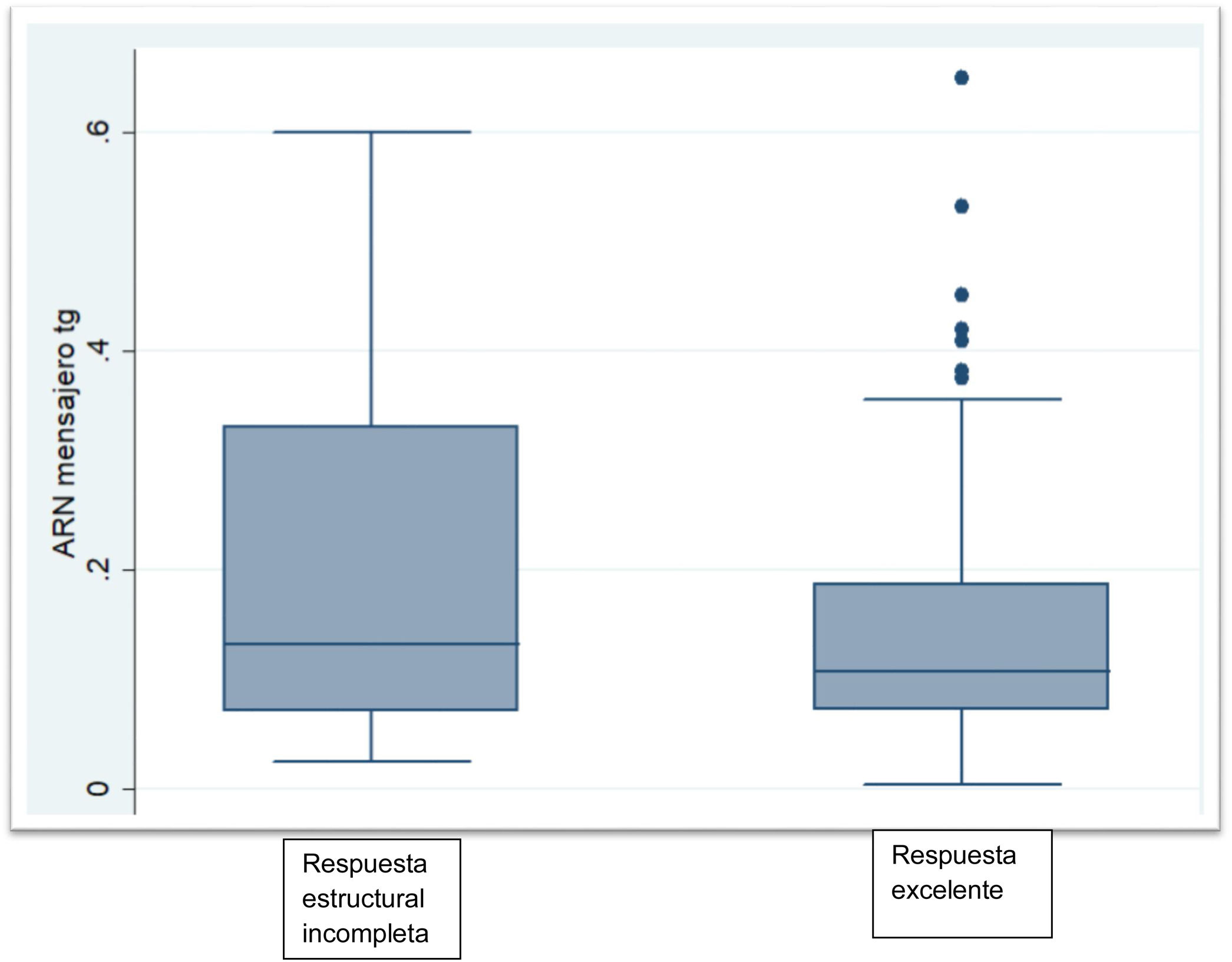
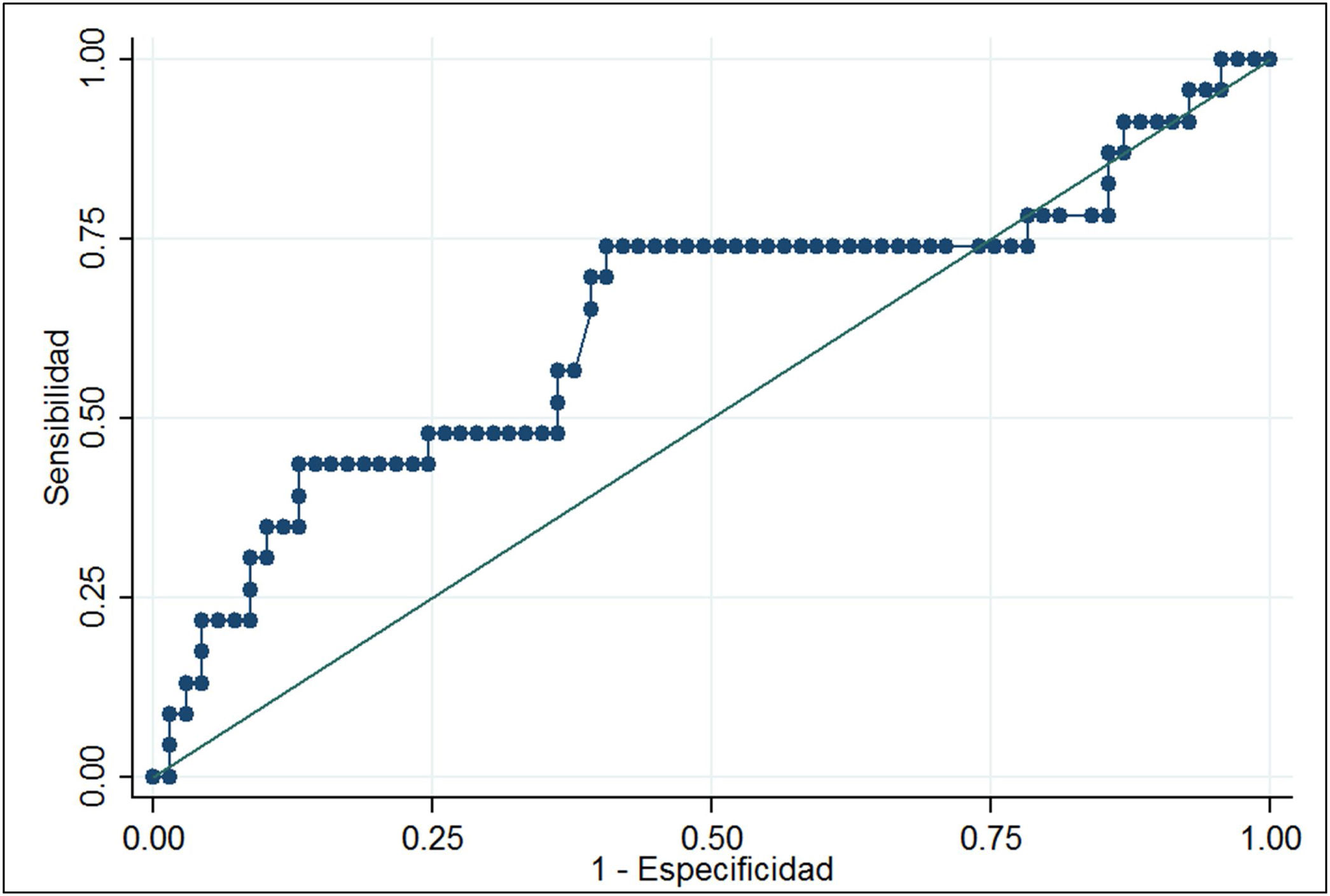
ResultadosLos niveles de ARNm Tg no fueron significativamente diferentes entre el grupo con respuesta excelente [0,10fg/μg ARN (0,08-0,17)] y el grupo respuesta estructural incompleta [0,133fg/μg ARN (0,07-0,33)] (p<0,06). La sensibilidad fue del 69,6%, la especificidad del 59,4%, el valor predictivo negativo del 85,4% y el valor predictivo positivo del 36,4%.
ConclusionesNuestra experiencia muestra que esta técnica tendría utilidad como prueba de exclusión en casos seleccionados, pero sus características no permiten su utilización como una prueba de primera línea.
The determination of thyroglobulin (Tg) levels by immunoassay is subject to interference by antithyroglobulin antibodies in up to 30% of cases, suggesting a need to find alternative methods for the follow-up of a significant number of thyroid cancer patients.
ObjectivesAssess the sensitivity, specificity, and predictive values of thyroglobulin messenger RNA (Tg-mRNA) levels measured by quantitative Real Time-PCR (qRT-PCR) in the blood of patients followed for differentiated thyroid cancer.
MethodsThis is a prospective study of Tg-mRNA levels measured with qRT-PCR. A peripheral blood sample was taken in patients with excellent response (n=69) and with structural incomplete response to treatment (n=23). Results were analysed using the Unity Real-Time program and expressed as fg/μg RNA. A Receiver Operating Characteristic curve was constructed to establish Tg-mRNA cut-off values.
ResultsTg-mRNA levels were not significantly different between the group with excellent response [0.10fg/μg RNA (0.08-0.17)] and the group with incomplete structural response [0.133fg/μg RNA (0.07-0.33)] (p<0.06). Test sensitivity was 69.6%, specificity was 59.4%, negative predictive value was 85.4% and positive predictive value was 36.4%.
ConclusionsOur experience shows that this technique could be useful as a rule-out test in selected cases, but its low sensitivity and specificity preclude its usefulness as a first-line test.
El cáncer de tiroides ha evidenciado un marcado incremento de su incidencia a nivel mundial en los últimos 20 años1. De acuerdo con datos de los institutos de salud de los Estados Unidos (NIH), ocupa ya el quinto lugar de incidencia en el sexo femenino con una incidencia de 23,1/100.000hab/año2, constituyendo un significativo problema de salud pública. Este aumento de la incidencia ha sido a expensas del cáncer diferenciado de tiroides ya que la de los otros tipos de cáncer de tiroides, como el cáncer medular o el anaplásico, se ha mantenido estable. Este aumento de la incidencia de cáncer de tiroides también se ha registrado en la población argentina3,4.
El seguimiento del cáncer de tiroides, una vez completado el tratamiento inicial de cirugía y ablación con yodo radioactivo en casos seleccionados, se basa en la ecografía de cuello y la medición del nivel sérico de tiroglobulina (Tg). En la actualidad, el paradigma de seguimiento sugerido por las últimas recomendaciones nacionales e internacionales ha hecho que dicho seguimiento se ajuste a las categorías de riesgo de recurrencia, que a su vez determinan las conductas de control y tratamiento posteriores. Las mediciones de Tg, con o sin estímulo de tirotrofina (TSH), son una pieza fundamental de dicho algoritmo diagnóstico-terapéutico5,6.
La Tg es una glicoproteína de 660kD sintetizada por el retículo endoplásmico rugoso de los tirocitos y sus funciones consisten en el depósito de yodo y la hormonogénesis tiroidea7. Parte de la Tg almacenada en el coloide es internalizada y sigue una vía alternativa a la proteólisis lisosomal que libera las hormonas tiroideas de la Tg para su secreción. Mediante su unión a megalina, esta vía alternativa transporta la Tg hacia la membrana basolateral de los tirocitos, desde donde es vertida a la circulación general8. En pacientes tiroidectomizados por cáncer de tiroides, su medición es utilizada como marcador tumoral, ya que sus niveles en este contexto se correlacionan con la masa de tejido patológico funcionante9. Sin embargo, su excelente valor pronóstico se ve comprometido en el 20-30% de los pacientes que tienen anticuerpos antitiroglobulina (ATGu); por ejemplo, en quienes padecen una tiroiditis de Hashimoto concomitante. La presencia de ATGu interfiere con la medición de Tg por métodos inmunométricos como el ensayo inmunorradiométrico (IRMA), resultando en niveles de Tg falsamente bajos o indetectables10. Por lo tanto, la utilización de los niveles de Tg medidos por métodos inmunométricos presenta esta deficiencia en el seguimiento de un número significativo de pacientes con cáncer de tiroides.
Nuestro objetivo fue evaluar la detección y el valor pronóstico de los niveles de ácido ribonucleico mensajero de la Tg (ARNm Tg) como un método alternativo a la medición de los niveles de Tg medidos por métodos inmunométricos en el seguimiento de pacientes operados de cáncer de tiroides.
Objetivos específicosEvaluar la sensibilidad y especificidad clínicas de los niveles de ARNm Tg medidos con la técnica de PCR cuantitativa en tiempo real (qRT-PCR) en sangre periférica de pacientes en seguimiento por cáncer diferenciado de tiroides que recibieron ablación con yodo radioactivo. Estudio exploratorio descriptivo de los niveles de ARNm Tg en pacientes que no recibieron ablación con yodo radioactivo y con ausencia de enfermedad estructural en los estudios por imágenes o de medicina nuclear.
MétodosTécnicas de laboratorioDeterminación de ARNm TgExtracción de sangre: La extracción de sangre se realizó por venopunción. Se extrajeron 12mL de sangre en tubos con EDTA. Se separaron las células mononucleares por gradiente con Ficoll-Paque Plus (GE Healthcare) según recomendación del fabricante. Se diluyó la sangre en igual volumen con solución fisiológica, se colocó por encima de 15mL de Ficoll y se centrifugó a 400G por 40min, separando luego la capa correspondiente a las células mononucleares. Estas células fueron lavadas con solución fisiológica y sedimentadas por centrifugación para la extracción de ARN.
Extracción de ARNm: La extracción de ARNm se realizó utilizando el kit Ribo Pure Blood (Invitrogen) siguiendo las recomendaciones del fabricante. Brevemente, las células obtenidas en el paso anterior se lisan agregando 800μL de solución de lisis y 50μL de solución de acetato de sodio al pellet, se mezcla con vórtex para completar la lisis. Para la extracción, se agregan 500μL de ácido-fenol: cloroformo y se incuba 5min a temperatura ambiente, se centrifuga y se recupera la fase acuosa a la cual se le agregan 600μL de etanol 100%. La purificación se lleva a cabo pasando la muestra a través de las columnas de purificación del kit, centrifugando 10segundos, se lava la columna con 700μL de soluciones de lavado.
Elución del ARN de la columna: Se eluyó con 50μL de la solución de elución previamente calentada a 75°C.
Tratamiento con DNAsa: Se agregó al ARN 2,5μL de 20X DNase Buffer+0,5μL DNase I y se incubó 30min a 37°C. Finalmente se agregó 10μL de DNase Inactivation Reagent, se mezcló con vórtex y se incubó 2min a temperatura ambiente, se centrifugó 1min a velocidad máxima y se pasó el sobrenadante a un tubo nuevo.
Transcripción reversa: La transcripción reversa se realizó con el reactivo Improm-ii-reverse-transcription-system (Promega) a partir de 1μg de ARN total siguiendo las recomendaciones del fabricante.
Reacción de Real time PCR: Se realizó cuantificación absoluta utilizando una curva de calibración realizada por amplificación del ARNm Tg a partir de ARN total de tejido tiroideo obtenido de un procedimiento quirúrgico. El producto de PCR fue purificado, cuantificado y analizado por secuenciación. Cada reacción de RT-PCR se realizó por duplicado, a partir 5μL del ADN complementario (cDNA) utilizando la Mezcla Real (Biodynamics) con SyBrGreen según recomendaciones del fabricante. Se utilizó el Light Cycler 96 RealTime PCR Roche. Se utilizaron los siguientes primers para Tg: Forward Tg 1F: CTATCGACGGCTCCTTCTTG y antisense Tg 1R:nCCAGTTGCCACTCACCTCTC. Estos primers generan un fragmento de 116 pares de bases que comprenden los exones 40 y 41 del cDNA de la Tg11. Los resultados fueron analizados por el programa Unity Real Time y expresados en fg/μg ARN. Se procesaron muestras de ARN sin retrotranscribir en la reacción de RT para ser utilizadas como controles para la detección de contaminación con DNA. No se encontró contaminación.
Mediciones hormonalesSe determinaron TSH y ATGu en plasma, y Tg en suero, sin la suspensión del tratamiento con hormona tiroidea (TSH no estimulada). Las muestras fueron centrifugadas y procesadas en equipos automatizados. La medición de niveles hormonales se realizaron por quimioluminiscencia: TSH (Architect ABBOTT, valor de referencia [VR] 0,35-4,94μUI/mL), sensibilidad funcional (SF) de 0,01UI/mL, coeficiente de variación (CV%): menor del 10%; ATGu (Architect ABBOTT, VR 0,2-4,1UI/mL), SF 0,31UI/mL, CV%: menor del 10%. Los niveles de Tg se midieron con un equipo Immulite 2000, Siemens. Los VR para este ensayo de Tg son: hasta 2,0ng/mL (atireóticos con TSH elevada) y de 0,7 a 84,0ng/mL (no atireóticos). La SF del ensayo es 0,5ng/mL y el CV% 10%.
Los niveles de Tg se clasificaron para su análisis en tres categorías: 1) niveles menores o iguales a 0,5ng/mL; 2) niveles de Tg mayores de 0,5 y menores de 1ng/mL, y 3) niveles mayores o iguales a 1ng/mL. Dado que la sensibilidad de nuestro método para medir niveles de Tg era menor que la utilizada en la clasificación de la Asociación Americana de Tiroides (ATA), hicimos una segunda evaluación de laboratorio y de estudios de imágenes en forma prospectiva en 31 pacientes ablacionados, para evaluar si eran posibles errores de alocación, sobre todo posibles casos mal incluidos en el grupo ablacionado de respuesta excelente. La presencia de anticuerpos se consideró positiva cuando su nivel era mayor de 4,1UI/mL.
PacientesSe realizó una búsqueda de pacientes de ambos sexos mayores de 18 años con cáncer de tiroides en los registros de anatomía patológica y se convocó a los médicos del servicio de Endocrinología del Hospital Italiano y del Instituto Roffo que estuvieran siguiendo pacientes con cáncer de tiroides a que invitaran a sus pacientes a participar. Los criterios de inclusión fueron: haber sido sometidos a una tiroidectomía total por lo menos 6 meses antes y haber tenido por lo menos una evaluación completa del estado de enfermedad posterior a la cirugía, tener los datos de seguimiento completos para así poder categorizarlos adecuadamente. Se consideraron los niveles de riesgo de recurrencia postoperatoria según la modificación de los riesgos de recurrencia propuesta por las últimas guías de la ATA6 (Apéndice A, en material adicional).
Para establecer los grupos objeto de comparación se los clasificó de acuerdo con la respuesta al tratamiento según una modificación de los criterios de la ATA6. 1) Respuesta terapéutica excelente: Tg menor o igual a 0,5ng/mL y estudios de imágenes negativos. En este grupo también se incluyeron pacientes sin evidencia de enfermedad estructural con ATGu positivos que tuvieran un seguimiento lo suficientemente largo como para descartar la presencia de enfermedad persistente. 2) Respuesta estructural incompleta: presencia de enfermedad detectada en estudios de imágenes y confirmada por estudio anatomopatológico cuando correspondiese, independientemente de los niveles de Tg. 3) Respuesta bioquímica incompleta: pacientes con niveles de Tg mayores o iguales a 1ng/mL o con curva ascendente de los niveles de ATGu, pero sin presencia de enfermedad estructural en los métodos de imágenes. 4) Respuesta indeterminada: pacientes con niveles de Tg superiores a 0,5ng/mL pero inferiores a 1ng/mL o imágenes inespecíficas en los estudios de imágenes.
En el análisis se incluyeron solamente los pacientes que recibieron una dosis ablativa o terapéutica con radioyodo en el postoperatorio, y que al momento del reclutamiento tenían una respuesta excelente o respuesta estructural incompleta para poder hacer una comparación de la precisión predictiva de los niveles de ARNm Tg utilizando verdaderos positivos (pacientes con respuesta estructural incompleta) y verdaderos negativos (pacientes con respuesta excelente) confiables. Los datos de pacientes con respuesta incompleta bioquímica o indeterminada están presentados en el Apéndice B (material adicional).
Aquellos que cumplían con los criterios de inclusión luego fueron contactados por teléfono por la investigadora principal para acordar una cita en la cual explicar el protocolo y administrar el consentimiento informado escrito. La extracción de la muestra se realizó en la misma visita o en una cita posterior, según la conveniencia del paciente.
Todos los pacientes reclutados para la evaluación de los niveles de ARNm Tg como parámetro de diagnóstico y seguimiento habían recibido ablación con yodo radioactivo (objetivo principal). Además, se evaluó por separado un grupo de pacientes con respuesta excelente que no habían recibido ablación con yodo radioactivo (objetivo secundario).
El protocolo fue aprobado por el Comité de Ética de Protocolos de Investigación del Hospital Italiano de Buenos Aires con el número 2828.
Los procedimientos utilizados en los pacientes fueron realizados tras la obtención del consentimiento informado escrito.
Análisis estadísticoEste es un trabajo observacional de diseño transversal. Las variables continuas se expresaron como mediana y rango intercuartil (RIC) o rango, según distribución, mientras que las variables categóricas se informaron como número absoluto y porcentaje del total de casos. Para realizar la comparación de las características de los distintos grupos, se utilizaron las pruebas estadísticas de chi cuadrado o ANOVA. Las comparaciones entre medianas de los grupos ablacionados con respuesta excelente y respuesta estructural incompleta fueron realizadas con la prueba de Mann-Whitney cuando correspondiere. Se consideró estadísticamente significativo un valor de p<0,05.
Se construyó una curva ROC tomando como verdaderos negativos aquellos pacientes que habían recibido yodo radioactivo y estaban libres de enfermedad estructural, y como verdaderos positivos a aquellos pacientes que habían recibido yodo radioactivo y presentaban enfermedad estructural confirmada.
Los cálculos estadísticos fueron realizados con el software Stata versión 13.0.
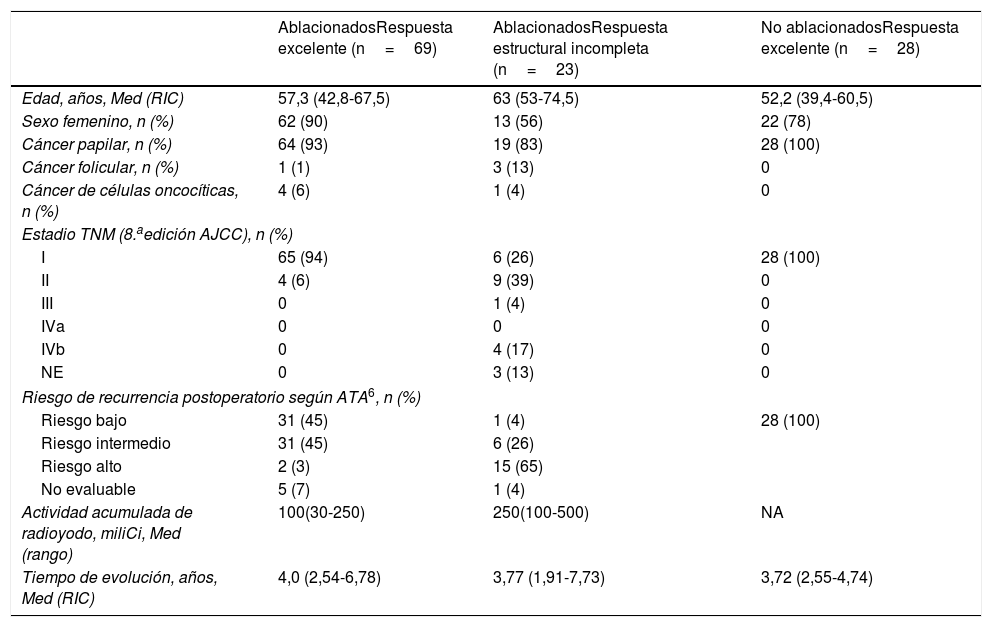
ResultadosReclutamos 120 pacientes, 97 mujeres y 23 hombres, edad 54,8 (43,3-66,6) años. Todos fueron sometidos a una tiroidectomía total y 92 habían recibido ablación con yodo radioactivo. El tipo histológico preponderante fue cáncer papilar de tiroides (n=111, 92%), 50 (45%) de ellos con variante clásica, y 99 (82%) estaban en estadio I según la 8.a. edición del AJCC12. La mitad de los pacientes (60; 50%) pertenecían al grupo de bajo riesgo de recurrencia y la mayoría presentaban una respuesta al tratamiento excelente (97; 75,8%) según los criterios de la ATA (tabla 1). Dentro del grupo que había recibido ablación con yodo radioactivo, 69 presentaban una respuesta excelente al tratamiento. En este grupo se incluyeron 4 pacientes con Tg de 0,5ng/mL, por estar este valor en el límite de cuantificación del método y no presentar evidencia de enfermedad estructural en su seguimiento (30, 45, 82 y 109 meses de seguimiento). Estos pacientes fueron incluidos en el grupo de 31 pacientes que repitió la extracción con una mediana de 8,46 (7,53-11,06) meses después de la primera evaluación, y los niveles de Tg en la segunda extracción fueron indetectables. Ninguno de los pacientes que repitieron la evaluación de respuesta al tratamiento debió ser cambiado de grupo por resultados no coincidentes con su alocación en el estudio. Veintitrés pacientes presentaban respuesta estructural incompleta; 16 de ellos con metástasis a distancia. La actividad de radioyodo recibida acumulada fue significativamente mayor en el grupo con respuesta estructural incompleta (p<0,001). Cuatro de los pacientes con enfermedad metastásica a distancia estaban recibiendo tratamiento con fármacos inhibidores de las tirosina-kinasas (1 con sorafenib y 3 con lenvatinib) en el momento de la extracción. El grupo con respuesta excelente no ablacionado incluyó 28 pacientes.
Características de los pacientes por estadio de enfermedad
| AblacionadosRespuesta excelente (n=69) | AblacionadosRespuesta estructural incompleta (n=23) | No ablacionadosRespuesta excelente (n=28) | |
|---|---|---|---|
| Edad, años, Med (RIC) | 57,3 (42,8-67,5) | 63 (53-74,5) | 52,2 (39,4-60,5) |
| Sexo femenino, n (%) | 62 (90) | 13 (56) | 22 (78) |
| Cáncer papilar, n (%) | 64 (93) | 19 (83) | 28 (100) |
| Cáncer folicular, n (%) | 1 (1) | 3 (13) | 0 |
| Cáncer de células oncocíticas, n (%) | 4 (6) | 1 (4) | 0 |
| Estadio TNM (8.aedición AJCC), n (%) | |||
| I | 65 (94) | 6 (26) | 28 (100) |
| II | 4 (6) | 9 (39) | 0 |
| III | 0 | 1 (4) | 0 |
| IVa | 0 | 0 | 0 |
| IVb | 0 | 4 (17) | 0 |
| NE | 0 | 3 (13) | 0 |
| Riesgo de recurrencia postoperatorio según ATA6, n (%) | |||
| Riesgo bajo | 31 (45) | 1 (4) | 28 (100) |
| Riesgo intermedio | 31 (45) | 6 (26) | |
| Riesgo alto | 2 (3) | 15 (65) | |
| No evaluable | 5 (7) | 1 (4) | |
| Actividad acumulada de radioyodo, miliCi, Med (rango) | 100(30-250) | 250(100-500) | NA |
| Tiempo de evolución, años, Med (RIC) | 4,0 (2,54-6,78) | 3,77 (1,91-7,73) | 3,72 (2,55-4,74) |
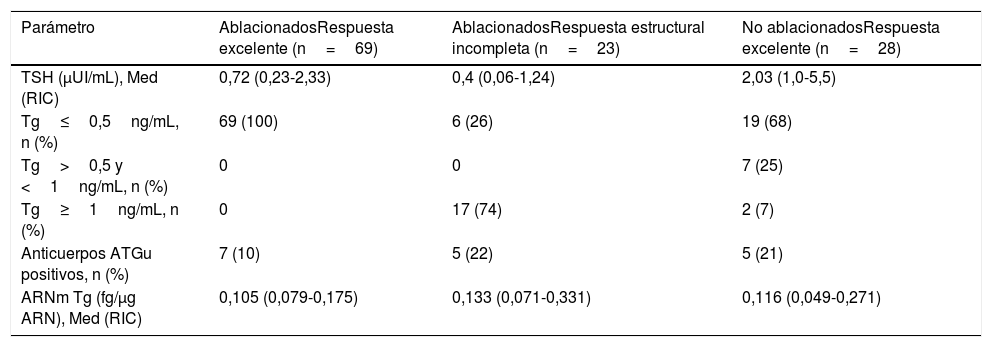
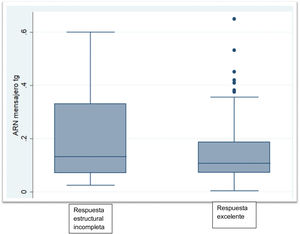
Las características bioquímicas se muestran en la tabla 2. La TSH en el grupo sin ablacionar fue significativamente más alta que la de los grupos ablacionados (p<0,002). La proporción de pacientes con Tg menor o igual a 0,5ng/mL fue significativamente mayor en el grupo ablacionado libre de enfermedad (p<0,001). Hubo 2 pacientes dentro del grupo no ablacionado con Tg mayores de 1ng/mL pero por debajo de 2ng/mL. Los niveles de ARNm Tg no fueron significativamente diferentes entre el grupo sin evidencia de enfermedad y el grupo con persistencia estructural de la enfermedad (p<0,06). El grupo que no recibió ablación con yodo radioactivo mostró niveles similares a los grupos que sí habían recibido ablación con yodo radioactivo (fig. 1).
Características bioquímicas de los pacientes por estado de enfermedad
| Parámetro | AblacionadosRespuesta excelente (n=69) | AblacionadosRespuesta estructural incompleta (n=23) | No ablacionadosRespuesta excelente (n=28) |
|---|---|---|---|
| TSH (μUI/mL), Med (RIC) | 0,72 (0,23-2,33) | 0,4 (0,06-1,24) | 2,03 (1,0-5,5) |
| Tg≤0,5ng/mL, n (%) | 69 (100) | 6 (26) | 19 (68) |
| Tg>0,5 y <1ng/mL, n (%) | 0 | 0 | 7 (25) |
| Tg≥1ng/mL, n (%) | 0 | 17 (74) | 2 (7) |
| Anticuerpos ATGu positivos, n (%) | 7 (10) | 5 (22) | 5 (21) |
| ARNm Tg (fg/μg ARN), Med (RIC) | 0,105 (0,079-0,175) | 0,133 (0,071-0,331) | 0,116 (0,049-0,271) |
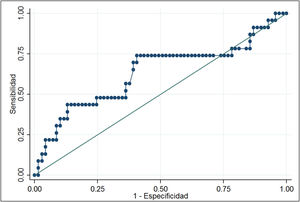
La curva ROC de los niveles de ARNm Tg arrojó un área bajo la curva de 0,6320 (0,48-0,78). El análisis demostró que niveles de ARNm Tg mayores de 0,116fg/μg ARNm Tg se asociaban a un mayor riesgo de persistencia de enfermedad estructural (OR 3,35; IC95% 1,22-9,19), con una sensibilidad del 69,6% y una especificidad del 59,4%. En una población con el 25% de prevalencia de casos con enfermedad estructural persistente, el valor predictivo positivo fue del 36,4% y el valor predictivo negativo fue del 85,4% (fig. 2).
DiscusiónEn nuestro trabajo evaluamos la sensibilidad, especificidad y valores predictivos de los niveles de ARNm Tg medidos por qRT-PCR cuantitativa por primera vez en una población local de pacientes con cáncer diferenciado de tiroides. Nuestra experiencia muestra que esta técnica tendría utilidad limitada en el seguimiento de pacientes con cáncer diferenciado de tiroides, ya que los niveles de ARNm Tg fueron similares en pacientes con respuesta excelente al tratamiento y en aquellos con respuesta estructural incompleta confirmada, con baja sensibilidad y especificidad para detectar enfermedad estructural persistente. Sin embargo, el alto valor predictivo negativo del 85% sugiere que podría ser una prueba de descarte de utilidad en casos seleccionados.
El seguimiento habitual de los pacientes con carcinoma de tiroides se lleva a cabo con la medición de niveles de Tg en sangre por métodos inmunométricos y ecografía de cuello6; menos frecuentemente se incluye también un rastreo corporal total con yodo radioactivo. Esta estrategia tiene la desventaja de que la medición de la Tg tiene interferencias metodológicas, entre ellas los ATGu9. Los métodos inmunométricos más comúnmente utilizados arrojan valores inadecuadamente bajos para el estadio de la enfermedad en presencia de ATGu10. Por esta razón, la presencia de anticuerpos en niveles estables o en descenso coloca a un paciente en un estado indeterminado de su enfermedad. Esto ocurre en alrededor del 8 al 29% de los pacientes, y un 15-20% de estos pacientes desarrollan enfermedad estructural en su seguimiento13. Se han ensayado otros métodos para medir la Tg que no tengan interferencia por la presencia de anticuerpos, como la espectrometría de masa, pero estos no han demostrado tener ventajas en este contexto14,15.
La hipótesis de la utilidad de los niveles del ARNm Tg en el seguimiento de pacientes con cáncer de tiroides se basa en la detección de células tiroideas circulantes en pacientes sin patología tiroidea, pacientes con patología benigna y pacientes con cáncer de tiroides16. Los primeros ensayos, utilizando RT-PCR de carácter cualitativa, mostraron una sensibilidad adecuada pero adolecieron de una baja especificidad17. Se desarrollaron entonces técnicas de medición cuantitativas, con resultados dispares. Ringel et al. comunicaron una sensibilidad del 84% y especificidad del 62% amplificando un fragmento de 87 pares de bases entre los pares de bases 262 y 348 del cDNA de la Tg18. Una publicación posterior del mismo grupo comunicaba una mejor exactitud (proporción de pacientes correctamente identificados como libres de enfermedad o con enfermedad persistente) con respecto al nivel de Tg medidos por inmunoensayo (84% vs. 75%, respectivamente)19. Estos resultados no pudieron ser replicados por otros autores. Takano et al. encontraron niveles de ARNm Tg similares en pacientes con cáncer de tiroides sin metástasis y con metástasis comprobadas; en esta experiencia los niveles de séricos de Tg medidos por métodos inmunométricos fueron un marcador de enfermedad superior que los niveles de ARNm Tg20. Span et al., utilizando los mismos primers que Ringel et al., tampoco encontraron diferencias en los niveles de ARNm Tg entre pacientes con y sin carcinoma de tiroides metastásico, ya sea estratificados según la presencia de captación en el centellograma con yodo radioactivo o según los niveles de Tg sérica medida por métodos inmunorradiométricos21. Todos estos trabajos utilizan como gold standard para identificar enfermedad persistente la captación de yodo radioactivo en el centellograma o niveles de Tg sérica medidas con ensayos que en la actualidad son considerados poco sensibles (SF>1ng/mL). Asimismo, la presencia de ATGu también fue evaluada con métodos poco sensibles (hemaglutinación) poniendo en duda la capacidad de identificar Tg inadecuadamente bajas debido a la interferencia por anticuerpos en el grupo de enfermos considerados «libres de enfermedad». Elisei et al., en cambio, utilizaron niveles séricos de Tg medidos por métodos ultrasensibles (SF de 0,9ng/mL y otro de 0,03ng/mL para confirmar la ausencia de enfermedad) y la captación de yodo radioactivo en el centellograma para estratificar a los pacientes. Con esta metodología, la sensibilidad fue del 82,3%, la especificidad del 24,2%, el valor predictivo positivo fue del 65,6% y el valor predictivo negativo del 47,3%22. En 2010, Boldarine et al., con una estrategia novedosa, generaron y validaron un par de primers que no incluyen sitios de splicing alternativo. En su trabajo lograron un punto de corte de ARNm Tg que discriminaba la población libre de enfermedad de la que presentaba persistencia estructural con una sensibilidad del 94,7% y una especificidad del 95,8%18. Sin embargo, en nuestra experiencia, el mismo par de primers no logró un punto de corte que superara el 90% de sensibilidad y/o especificidad. Muchos autores coinciden en que las diferencias entre los distintos ensayos pueden explicarse por diferencias técnicas17,18. Una de las diferencias más importantes entre nuestra experiencia y la de Boldarine et al. es la masa de ARNm Tg comparativamente menor en nuestro ensayo. Esto podría atribuirse a una menor recuperación de células tumorales circulantes. Hipotéticamente, si la pérdida no es simétrica entre los grupos podría contribuir a una disminución de la sensibilidad y especificidad.
Nuestro estudio cuenta con una población de pacientes con cáncer de tiroides bien definidos y estadificados de acuerdo con los conceptos actuales de estadio de enfermedad6. Casi todos los trabajos publicados previamente basaron la estadificación de sus pacientes en niveles de Tg de menor sensibilidad que las actualmente recomendadas (radioinmunoensayos [RIA] o ensayos inmunorradiométricos con sensibilidades de 1ng/mL) y muchos usaron el rastreo corporal con 2 a 5mCi de yodo radioactivo como gold standard para definir la presencia de metástasis a distancia18–22.
De esta manera, pacientes considerados libres de enfermedad podrían en realidad tener persistencia estructural de bajo volumen solamente asequible por métodos de mayor sensibilidad como la ecografía de cuello, que es el método de elección en la actualidad6. La detección de ARNm Tg en pacientes considerados libres de enfermedad (38% a 75,8%)18,22 parece apoyar esta hipótesis, con la consecuente pérdida de especificidad. Nuestros pacientes fueron categorizados de acuerdo con los resultados de la ecografía de cuello realizada por operadores expertos, otros métodos diagnósticos cuando indicados, y los niveles de Tg con una sensibilidad funcional de 0,5ng/mL, lo que implica una población libre de enfermedad más adecuadamente definida. A pesar de ello, el 40% de nuestros pacientes libres de enfermedad en el grupo ablacionado presentaron niveles circulantes de ARNm Tg por encima del valor de corte. Es posible que dada la menor sensibilidad funcional de nuestro ensayo de Tg se hayan incluido pacientes que con un método más sensible hubieran sido considerados como respuesta indeterminada por tener niveles de Tg superiores a 0,2ng/mL, del 15 al 20% de los cuales progresan a una respuesta estructural incompleta. La presencia de una persistencia estructural de bajo volumen indetectable por los métodos de imágenes en el grupo de respuesta excelente podría haber contribuido a los niveles relativamente altos de ARNm Tg en este grupo. Sin embargo, cuando repetimos la medición de Tg e imágenes en un grupo de pacientes, incluyendo aquellos con Tg detectables en el grupo de respuesta excelente, los resultados fueron concordantes y no fue necesario cambiar los grupos de alocación. Hipótesis alternativas contemplan la transcripción ilegítima en células no tiroideas de la sangre, que dificulte la detección del ARNm Tg originado en las células tiroideas circulantes22.
Hasta la fecha no hay un método de uso clínico que pueda evaluar los niveles de Tg en presencia de ATGu. Se han ensayado la medición de parámetros alternativos como el ARNm del receptor de TSH23, BRAF V600E24 y más recientemente, ha despertado mucho interés la medición de microARN25,26. Ninguno de estos métodos ha demostrado ser todavía un buen sustituto de los niveles de Tg medida por métodos inmunorradiométricos. ¿Tendría la medición de ARNm de Tg un papel en el seguimiento de pacientes con ATGu? En estas circunstancias los niveles de ARNm Tg podrían ser de utilidad como prueba de descarte, habida cuenta de su alto valor predictivo negativo y considerando que la prevalencia de recurrencias en la población de indeterminados es de alrededor del 20%, muy cercana al 25% de nuestro trabajo. Sin embargo, esta hipótesis debería ser comprobada en un estudio prospectivo de pacientes con respuesta indeterminada ya que nuestro trabajo no fue diseñado para ello.
ConclusionesLa medición de los niveles de ARNm Tg medidos por qRT-PCR cuantitativa no tiene sensibilidad ni especificidad suficientes para ser utilizada de rutina como reemplazo de los niveles de Tg medidos por métodos inmunorradiométricos. Sin embargo, podría tener un papel como prueba de descarte en el seguimiento de pacientes específicos, como aquellos que tienen ATGu positivos. Esta hipótesis debería ser comprobada en un estudio prospectivo.
FinanciaciónEste trabajo ha sido financiado por el Fondo para la Investigación Científica y Tecnológica (FONCYT) de la Agencia Nacional de Promoción Científica y Tecnológica. Ministerio de Ciencia, Tecnología e Innovación Productiva de la República Argentina.
Proyectos de Investigación Científica y Tecnológica Orientados (2016) número de ID de la beca: 011. (ID: PICTO 2016-011).
La agencia solo se involucró en la evaluación inicial y seguimiento del proyecto.
Conflicto de interesesNinguno de los autores presenta conflicto de interés en relación con este trabajo de investigación.