Sr. Director:
Una mujer de 65 años con antecedentes de depresión mayor, síndrome metabólico y esteatosis hepática fue derivada a nuestra unidad de trasplante hepático en febrero del año 2012 con diagnóstico de hepatitis fulminante. Un mes antes había comenzado con coluria y astenia, y 3 días previos a la admisión a nuestro centro se agregó flapping. A las 72h de su ingreso se le realizó un trasplante hepático. En los estudios pretrasplante se descartaron la presencia de hepatitis virales (virus hepatotropos y no hepatotropos), autoinmunes y enfermedad de Wilson. La paciente no consumía alcohol, ni medicación homeopática. Los fármacos que recibía eran: valsartan, atorvastatina, clonazepam, paroxetina y agomelatina. Esta última la había iniciado aproximadamente 20 días antes del inicio del cuadro. La agomelatina es un fármaco utilizado para la depresión mayor. Se sugiere realizar estudios de función hepática en los pacientes que reciben este fármaco, ya que ha sido asociado a la presencia de aumento de las enzimas hepáticas. También se destaca que la presencia de enfermedad hepática es una contraindicación para su uso.
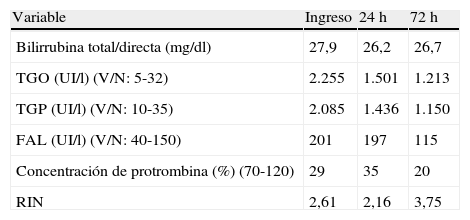
Observación clínicaUna paciente de 65 años con depresión mayor, síndrome metabólico (diabetes tipo 2, obesidad e hipertensión arterial) y esteatosis hepática fue derivada a nuestra unidad de hepatología y trasplante hepático en febrero del año 2012 con diagnóstico de hepatitis fulminante. Un mes antes de la admisión hospitalaria había comenzado con coluria, leve tinte ictérico y astenia, sin realizar consulta médica en dicha oportunidad. La paciente no consumía alcohol, ni medicación homeopática, y los fármacos que recibía habitualmente desde hacía años eran: valsartan, atorvastatina, clonazepam, paroxetina y aproximadamente 20 días antes del inicio del cuadro se le había prescrito agomelatina como tratamiento de la depresión mayor. Tres días antes de la admisión hospitalaria, la paciente comenzó con mayor ictericia, flapping y franca tendencia al sueño. Fue admitida en unidad de cuidados intensivos, y evaluada para trasplante hepático con diagnóstico de hepatitis fulminante. En el examen físico se destacaba la presencia de ictericia y encefalopatía hepática grado ii. No mostraba estigmas de hepatopatía crónica. Se le realizó una tomografía de cerebro, que fue normal, y una ecografía Doppler abdominal en la que se evidenciaba la presencia de esteatosis moderada, sin esplenomegalia, ni ascitis. Los flujos vasculares presentaban dirección fisiológica. Los estudios serológicos y virológicos para hepatitis virales fueron negativos, descartando así la presencia de virus A, B, C y E, citomegalovirus y Epstein-Barr. Los autoanticuerpos solicitados (FAN, ASMA y anti-LKM1) fueron negativos, y las gammaglobulinas e inmunoglobulinas A, M y G fueron normales. Se descartó, también, la enfermedad de Wilson, ya que la paciente presentaba ceruloplasmina, cobre sérico y urinarios normales. Tampoco presentaba alteraciones en los niveles de ferritina, ni de la saturación de transferrina. Con respecto a los factores pronósticos, la paciente cumplía con los criterios del King's College1 (etiología no asociada a paracetamol: edad mayor a 40 años, bilirrubina total mayor de 17,5mg/dl e INR mayor de 3,5), pero no con los de Clichy2. El MELD (Model for End Stage Liver Disease) era de 31 puntos y presentaba un Score de RUCAM de 4 puntos3. Durante su hospitalización, progresó el deterioro de la función hepática (tabla 1) y profundizó la encefalopatía, llegando a grado iii. Tres días después de su ingreso en lista de espera, se realizó un trasplante hepático con donante cadáver. La evolución fue satisfactoria, siendo externada en el día 15 postrasplante. El análisis del explante mostró necrosis masiva. Actualmente presenta buena función del injerto y realiza controles ambulatorios periódicos.
Variables de laboratorio (del ingreso hasta previo al trasplante)
| Variable | Ingreso | 24 h | 72 h |
| Bilirrubina total/directa (mg/dl) | 27,9 | 26,2 | 26,7 |
| TGO (UI/l) (V/N: 5-32) | 2.255 | 1.501 | 1.213 |
| TGP (UI/l) (V/N: 10-35) | 2.085 | 1.436 | 1.150 |
| FAL (UI/l) (V/N: 40-150) | 201 | 197 | 115 |
| Concentración de protrombina (%) (70-120) | 29 | 35 | 20 |
| RIN | 2,61 | 2,16 | 3,75 |
FAL: fosfatasa alcalina; RIN: rango internacional normalizado; TGO: transaminasa glutámico oxalacética; TGP: transaminasa glutámico pirúvica; UI/l: unidades internacionales/l; V/N: valor normal.
La depresión mayor es un trastorno muy incapacitante con una prevalencia estimada a lo largo de la vida del 12,8% en Europa Occidental y del 16% en Estados Unidos con un ligero predominio en el sexo femenino4. Suele tener un curso crónico, con una tasa de recurrencia, tras un primer episodio, del 50%5. Existen numerosos fármacos para su tratamiento. La agomelatina es un antidepresivo, análogo estructural de la melatonina, que tiene una acción dual: agonista melatoninérgico (actuando sobre los receptores MT1 y MT2) y antagonista serotoninérgico (actuando en los receptores 5-HT2c). Es bien tolerada luego de su absorción oral, y la biodisponibilidad en mujeres es mayor que en los hombres. La dosis inicial es 25mg por día, pudiendo aumentarse a 50mg en caso de falta de respuesta. Su metabolismo es fundamentalmente hepático, a través de las subunidades 1A2 (90%) y 2C9/19 (10%) del citocromo P450 (CYP), por lo que los fármacos que las inhiben disminuyen su metabolismo, aumentando, por consiguiente, los niveles plasmáticos de la agomelatina6. Ha demostrado superioridad respecto al placebo, la paroxetina y la venlafaxina en cuanto a los trastornos del sueño y en el control de la ansiedad asociada a la depresión6–8. Además de sus efectos en el tratamiento agudo, es eficaz en el tratamiento de mantenimiento y ha sido asociada a menores recaídas y a menor deterioro de la respuesta sexual9,10. En cuanto a los episodios adversos conocidos se destacan náuseas, somnolencia, alteración del ritmo evacuatorio y fatiga. Se ha comunicado elevación de las enzimas hepáticas en aproximadamente 3 veces el valor normal (en aproximadamente el 1,3% de los pacientes). Si esta hipertransaminasemia persiste (a las 48 h de ser detectada), el tratamiento con agomelatina debería ser suspendido y controlar la función hepática hasta su normalización. Se recomienda realizar seguimientos seriados de las transaminasas a diferentes intervalos (pretratamiento; semanas 3, 6, 12 y 24 y ante indicación clínica). La ictericia debe ser causa de suspensión del fármaco y se ha indicado especial atención en pacientes con factores de riesgo para enfermedades hepáticas, como sobrepeso, obesidad, esteatohepatitis no alcohólica (NASH), alcoholismo y uso de otros fármacos asociados a hepatotoxicidad. La cirrosis y la enfermedad hepática activa son contraindicaciones para su uso11.
Aunque la hepatotoxicidad inducida por fármacos es un episodio adverso poco frecuente, con una incidencia estimada en un rango que oscila entre 1/100.000 y 1/1.000.000 de casos anuales, su aparición es la causa más común para la no aprobación de un medicamento en las fases preclínica o clínica, o para que su uso sea restringido, luego de la aprobación inicial12. Se cree que existen bases genéticas para la susceptibilidad de la hepatotoxicidad inducida por fármacos, como la asociación entre el HLA-B*570113 y el HLA-II14. La mayor parte de los eventos de hepatotoxicidad por fármacos son leves y autolimitados una vez interrumpida la administración del agente causal, sin embargo, existen algunos casos con evolución más severa. Se estima que un 10% de los pacientes que desarrollan ictericia secundaria a un severo daño hepatocelular morirán o requerirán trasplante hepático15 y se calcula que aproximadamente un 13% de los casos de hepatitis fulminante en Estados Unidos corresponden a casos de hepatotoxicidad16. Para el diagnóstico deben tenerse en cuenta tanto la exclusión de otras causas de enfermedad hepática, como hepatitis virales o autoinmunes, la relación cronológica entre la administración del fármaco y la manifestación de la hepatotoxicidad, la existencia de factores de riesgo, la medicación concomitante, los reportes previos de hepatotoxicidad, el curso de la hepatopatía tras retirarse el fármaco y la histología hepática17. La readministración del fármaco, para evaluar si ocurre el mismo evento («desafío»), no suele realizarse ya que puede resultar arriesgado.
Si bien no existe un gold standard para evaluar el rol de un fármaco en el desarrollo de un evento adverso, se han elaborado diferentes scores que señalan la posibilidad de toxicidad hepática por fármacos. La mayoría tienen en cuenta los parámetros que han sido mencionados previamente (la cronología, los factores de riesgo, la ausencia de otras causas, los antecedentes conocidos del fármaco, etc.), así como la existencia de manifestaciones extrahepáticas como fiebre, exantema, artralgias y eosinofilia. El Score de Roussel Uclaf Causality Assessment Method (RUCAM)3 es uno de los más difundidos, y a cada variable que contempla se le asigna una puntuación, lo que permite obtener 5 categorías: ≤ 0: relación excluida; 1-2: relación poco probable; 3-5: relación posible; 6-8: relación probable; > 8: relación muy probable. Su sensibilidad y especificidad es de 78 y 68%, respectivamente (utilizando 5 como punto de corte), por lo que es una herramienta razonable para utilizar ante un posible caso de hepatotoxicidad18.
El caso clínico presentado es de especial interés debido a su evolución a hepatitis fulminante, con necesidad de trasplante hepático, nunca antes comunicado con el uso de agomelatina. La paciente presentaba antecedentes de síndrome metabólico y esteatosis hepática, ambas situaciones pueden asociarse a fibrosis y enfermedad hepática avanzada19. Si bien la incidencia de hígado graso no alcohólico (NAFLD) es variable, dependiendo de la región y población estudiadas, así como también dependiendo de la definición utilizada, se estima que la prevalencia mundial oscila entre un 6,3 y 33%, con una mediana de 20%. La prevalencia de NASH está estimada en un 3-5%20, por lo tanto, el NAFLD es una de las principales causas de enfermedad hepática crónica. Un estudio prospectivo mostró una elevada prevalencia de hepatotoxicidad en pacientes con NAFLD21. Los autores examinaron 248 pacientes con hepatopatía crónica (sin cirrosis), 174 de ellos con hepatitis C (con una mediana de score de fibrosis de 2) y 74 con NAFLD. Durante el seguimiento de 6 años, 6 pacientes desarrollaron toxicidad por fármacos, todos pertenecientes al grupo NAFLD. El riesgo relativo de presentar algún grado de hepatotoxicidad fue casi 4 veces más en el grupo de hígado graso en comparación con el grupo de hepatitis C, según lo comunicado por los autores.
Se sabe que la metabolización de los fármacos es llevada a cabo principalmente en el hígado mediante la acción del CYP P450, y por la fase ii de las reacciones de conjugación (glucuronidación, acetilación, conjugación con sulfato, etc.). Datos actuales tanto en animales de experimentación como en humanos indican que en el NAFLD existiría una alteración en la actividad de los sistemas celulares encargados de la metabolización de los fármacos (por ejemplo, menores niveles de glutatión-S-transferasas), lo que no solo causaría alteraciones intracelulares, sino que podría afectar también la farmacocinética de diferentes fármacos22.
Como conclusión, el caso presentado corresponde a una paciente con esteatosis hepática, que tras la administración de agomelatina presentó una evolución no esperada hacia hepatitis fulminante, con necesidad de trasplante hepático. Como ha sido comentado, el hígado graso es muy prevalente y puede asociarse a una mayor susceptibilidad para la hepatotoxicidad por fármacos, por lo que debe ponerse especial atención en el seguimiento de la función hepática en este tipo de pacientes.