DILI (drug-induced liver injury) es la denominación utilizada actualmente para designar las lesiones inducidas por fármacos. Su expresión clínica es muy diversa, y pueden semejar a cualquiera de las enfermedades hepáticas agudas y crónicas de otra etiología. Dos mecanismos pueden causar esta alteración: una reacción por idiosincrasia metabólica, por fármacos que se metabolizan en más del 50% en el hígado, o una reacción de hipersensibilidad1. Una forma peculiar de DILI es debida a una respuesta inmunitaria contra proteínas del hígado que puede manifestarse clínicamente como una hepatitis autoinmune (HAI)2. Es un evento raro, con una incidencia que oscila entre 1:10.000 a 1:100.000 pacientes tratados3. Puede ir desde una forma asintomática hasta un fallo hepático fulminante4.
En caso de hipersensibilidad una reexposición al fármaco induce un cuadro más grave, con un mayor riesgo de mortalidad5. En el estudio de Lucena et al., del registro español de DILI, que comprendía una cohorte de 742 pacientes, 9 (1,2%) presentaron un segundo episodio, ninguno grave. El 44% (4 de 9 de estos pacientes) desarrollaron un cuadro de DILI, con los criterios de probable o definitivo para HAI de acuerdo a la puntuación simplificada6,7.
Reportamos aquí un caso de hepatitis autoinmune diagnosticada mediante la puntuación simplificada para HAI (7 puntos) por una reexposición a levofloxacino, con excelente respuesta al tratamiento combinado (prednisona y azatioprina).
Observación clínicaMujer de 59 años de edad con antecedentes de alergia a antiinflamatorios no esteroideos (AINE) y ácido acetilsalicílico (AAS). Tiene rinitis alérgica y asma, en tratamiento con esteroides y broncodilatadores.
Consultó por una elevación de la alanino aminotransferasa (ALT) 389 U/l (rango 5-40), aspartato aminotransferasa (AST) 213 U/l (rango 5-40) y leucocitos 7×109/l (eosinófilos 16,6%), como hallazgo en una valoración de rutina. Clínicamente estaba asintomática. Refirió haber tomado al momento de los análisis levofloxacino 500mg al día durante 7 días por un cuadro de infección de vías respiratorias. En el momento de consultar a nuestro servicio la paciente tomaba esteroides tópicos (vía nasal). Los análisis anteriores practicados por su médico de cabecera no mostraban alteraciones de la biología hepática.
En la exploración física no hubo hallazgos relevantes, excepto la presencia de pólipos en fosas nasales. Como parte del abordaje de la hipertransaminasemia se le realizó serología para virus de hepatitis (A, B, C y E), citomegalovirus y Epstein-Barr y un perfil de autoinmunidad como anticuerpos antinucleares (ANA), anticuerpos antiantígenos microsomales de hígado y riñón (anti-LKM-1), anticuerpos antimúsculo liso (ASMA), anticuerpos anti-f-actina, anticuerpos antimitocondriales (AMA) y anticuerpos anticitosol hepático (anti-LC1), que fueron negativos. Una ecografía hepática fue normal.
Se suspendió el levofloxacino, bajo la sospecha de toxicidad hepática por este fármaco y a los 2 meses de seguimiento se encontró sin eosinofilia periférica y las transaminasas hepáticas habían disminuido a AST 68 U/l y ALT 93 U/l. Debido a la persistencia de las transaminasas ligeramente elevadas se repitió el perfil de autoinmunidad que solo mostró unos ANA positivos (453 URF), pero sin criterios para HAI de acuerdo con la puntuación simplificada7.
Después de 7 meses de mantener las pruebas de funcionamiento hepático normales y estar asintomática, presentó un nuevo pico de transaminasas, llegando a valores de AST 355 U/l y ALT 414 U/l. En el hemograma destacaba una cifra de leucocitos de 7,8×109/l con incremento de eosinófilos (12,2%). Esta alteración coincidió nuevamente con la toma de levofloxacino por la misma indicación que en el primer episodio. Los ANA seguían positivos (640 URF, patrón homogéneo) y los niveles de IgG (inmunoglobulina G), ligeramente elevados, 16,2g/l (rango 6,8-15,3).
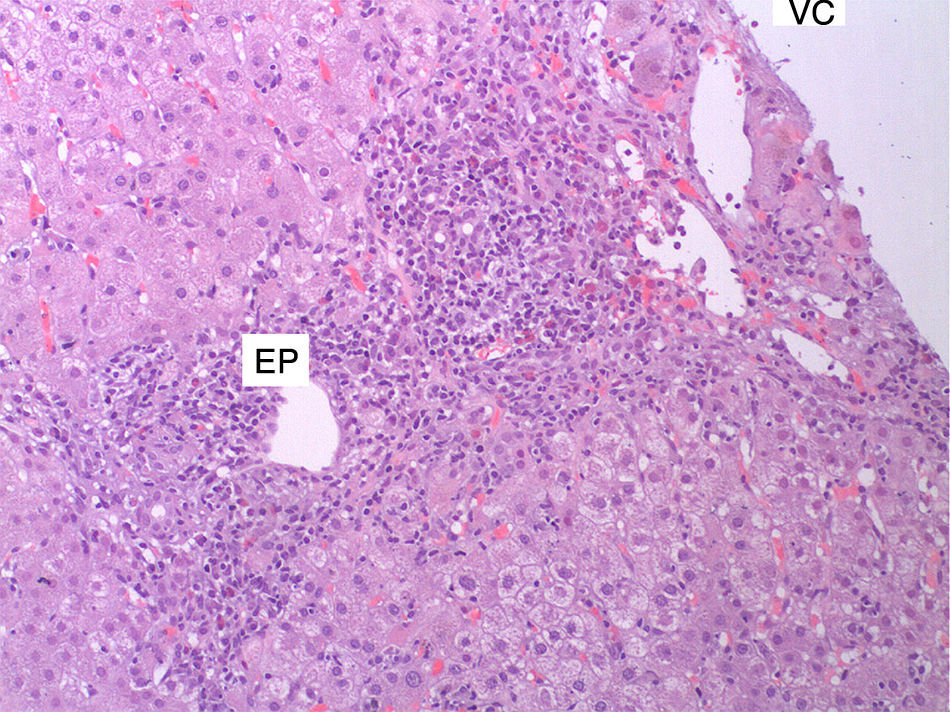
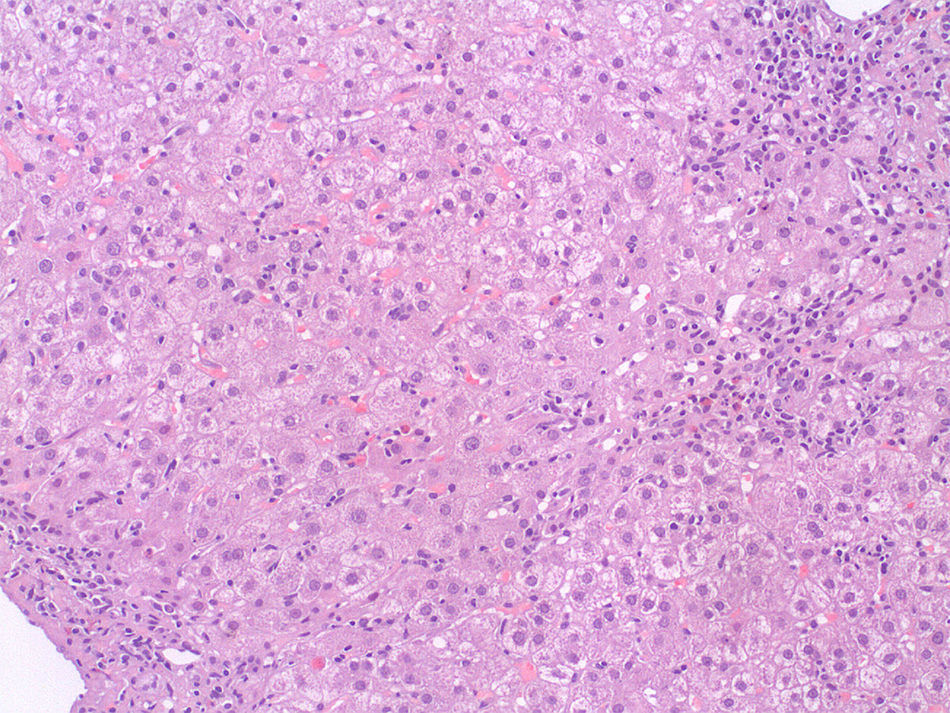
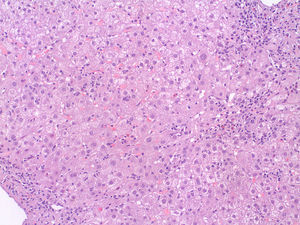
Se decidió realizar una biopsia hepática percutánea que mostró espacios porta densamente infiltrados por células redondas que en algunos puntos rebasan la membrana limitante, con muchas plasmáticas, presencia de áreas de necrosis portocentral, formación rosetoide de los hepatocitos y abundantes eosinófilos (figs. 1 y 2)7, compatible con una HAI. Los espacios porta presentaban una fibrosis portal incipiente. En la puntuación diagnóstica simplificada presentó 7 puntos, considerada como diagnóstico definitivo.
Tras 8 semanas sin la toma de levofloxacino las transaminasas persistían elevadas (AST 241 U/l y ALT 262 U/l), por lo que se decidió iniciar tratamiento con el esquema combinado de prednisona 30mg en pauta descendente semanalmente y azatioprina 50mg/día. A las pocas semanas del tratamiento se produjo una normalización de las transaminasas y de los valores de IgG. Al año de iniciado el tratamiento, dada la normalidad analítica (incluida la normalidad de IgG) y el hecho de que la paciente está clínicamente asintomática, se decide una reducción progresiva de la medicación hasta su interrupción. Los análisis permanecen normales tras 2 meses de la suspensión del tratamiento inmunosupresor.
La relación de causalidad entre la ingesta de levofloxacino y la alteración de la analítica hepática (y los hallazgos anatomopatológicos) resultó muy probable tras la aplicación de la escala de RUCAM (11 puntos) (tabla 1).
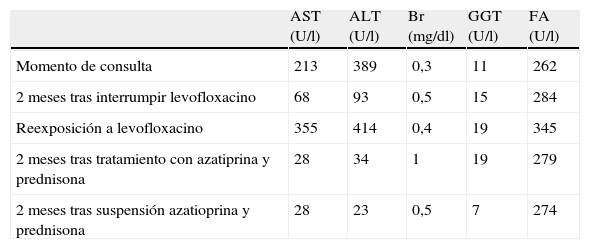
Evolución de la analítica hepática durante el curso de la hepatitis
| AST (U/l) | ALT (U/l) | Br (mg/dl) | GGT (U/l) | FA (U/l) | |
| Momento de consulta | 213 | 389 | 0,3 | 11 | 262 |
| 2 meses tras interrumpir levofloxacino | 68 | 93 | 0,5 | 15 | 284 |
| Reexposición a levofloxacino | 355 | 414 | 0,4 | 19 | 345 |
| 2 meses tras tratamiento con azatiprina y prednisona | 28 | 34 | 1 | 19 | 279 |
| 2 meses tras suspensión azatioprina y prednisona | 28 | 23 | 0,5 | 7 | 274 |
La elevación de transaminasas en un paciente que toma un medicamento obliga a plantear, en ausencia de otras causas de hipertransaminasemia, el diagnóstico de DILI. No obstante, en pocas ocasiones se manifiesta como una HAI. Su diagnóstico se basa en la presencia de ANA, ASMA y en hallazgos histológicos típicos de HAI, es decir, una reacción inflamatoria con presencia de células plasmáticas8.
Cuando se expresa como una HAI no siempre es posible diferenciar entre una HAI idiopática preexistente, pero no reconocida, en un paciente que recibe un tratamiento farmacológico y una HAI producida por el fármaco, ya que no existen signos clínicos o histológicos que puedan caracterizar uno u otro cuadro9.
En nuestra paciente el diagnóstico de HAI se basó en la puntuación simplificada (7 puntos),7 calculada después de la segunda exposición al levofloxacino. Sin embargo, no podemos afirmar con seguridad que el levofloxacino fuera el responsable de inducir la HAI. Es posible que la reexposición al levoflaxacino que experimentó esta paciente desencadenara la aparición de la hepatitis, tal como sucedió en algunos pacientes del estudio de Lucena et al. En los pacientes de este estudio, cuya HAI se atribuyó a quinolonas, hubo una resolución completa al suspender el fármaco, sin necesidad de tratamiento6,7, mientras que en nuestra paciente esto no ocurrió, por lo que se inició tratamiento inmunosupresor.
En la práctica clínica es un reto diferenciar una HAI idiopática de una HAI medicamentosa. En el estudio de Björnsson et al. se consideró que en 24 (9,2%) pacientes con diagnóstico de HAI de una cohorte de 261, la enfermedad hepática fue inducida por fármacos, principalmente antibióticos (nitrofurantoína y minociclina), sin existir diferencias en marcadores serológicos, histológicos e incluso en la respuesta al tratamiento entre los casos idiopáticos y los inducidos por fármacos10. La tasa de recaídas en el momento de suspender el tratamiento inmunosupresor fue 0% en el grupo de HAI medicamentosa y del 65% en el grupo de HAI idiopática10. Aunque el seguimiento de nuestra paciente todavía es corto tras la suspensión de la medicación (2 meses), todo hace pensar que no va a producirse una recurrencia, hecho que refuerza la idea de que se trataba de un DILI en forma de HAI.
En conclusión, consideramos que todos aquellos pacientes con DILI y, sobre todo, los que presentan un segundo episodio por reexposición al mismo fármaco o a un segundo fármaco con estructura bioquímica similar, siempre debe descartarse una asociación con HAI (de acuerdo con la puntuación simplificada) e iniciar el tratamiento de forma oportuna. De acuerdo a la evidencia son pacientes con un mejor pronóstico, dado que no hay recaídas después de parar el tratamiento.