Las infecciones son una de las principales causas de morbilidad y mortalidad en pacientes trasplantados, dado el tratamiento con terapia inmunosupresora. Las infecciones por micobacterias no tuberculosas (MNT) son infrecuentes, pero pueden causar una gran morbilidad. El tratamiento está asociado a limitaciones terapéuticas debido al aumento de toxicidad y a las interacciones con el tratamiento inmunosupresor. Las infecciones por MNT pueden tratarse con cirugía, reduciendo la dosis de inmunosupresores y/o con antimicobacterianos. La American Thoracic Society (ATS) recomienda tratamiento con isoniazida, rifampicina y etambutol, que debe mantenerse durante 18 meses en el caso de infección pulmonar por Mycobacterium kansasii.
Presentamos a continuación el caso clínico de un paciente inmunodeprimido a causa de un trasplante hepático, con evolución infausta debido a una colangitis aguda, que presentó además una infección respiratoria concomitante por un microorganismo poco frecuente, M. kansasii, en el período tardío postrasplante.
Infections are one of the leading causes of morbidity and mortality in solid organ transplant recipients because of treatment with immunosuppressive agents. Infections due to nontuberculous mycobacteria (NTM) are infrequent but may be a major cause of morbidity. Treatment is associated with therapeutic limitations due to drug interactions with immunosuppressive agents and enhanced toxicity. Treatment of NTM infection most commonly involves surgery, reducing the doses of immunosuppressive medications and/or therapy with antimycobacterial medications The American Thoracic Society recommends isoniazid, rifampicin, and ethambutol. The current duration for treatment of pulmonary disease caused by Mycobacterium kansasii is 18 months.
We describe the case of an immunosuppressed liver transplant recipient with poor outcome due to acute cholangitis who also developed concomitant infection with an uncommon organism, M. kansasii, in the late posttransplantation period.
Las complicaciones infecciosas son una de las más importantes relacionadas con el trasplante de órganos sólidos. Estos pacientes reciben terapia inmunosupresora que les hace más susceptibles a presentar determinadas infecciones, y su tratamiento es complicado debido a la disfunción hepática que presentan en ocasiones y a las interacciones con otros fármacos1.
Exponemos a continuación el caso clínico de un paciente inmunodeprimido a causa de un trasplante hepático, con evolución infausta debido a una colangitis aguda, que presentó además una infección respiratoria concomitante por un microorganismo poco frecuente, Mycobacterium kansasii, en el período tardío postrasplante.
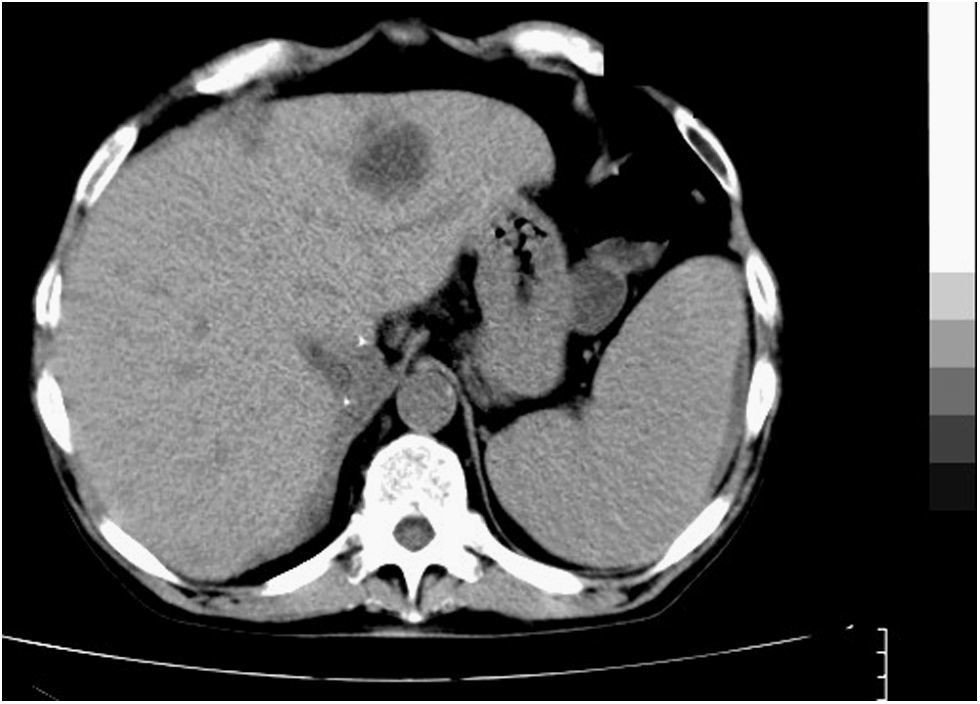
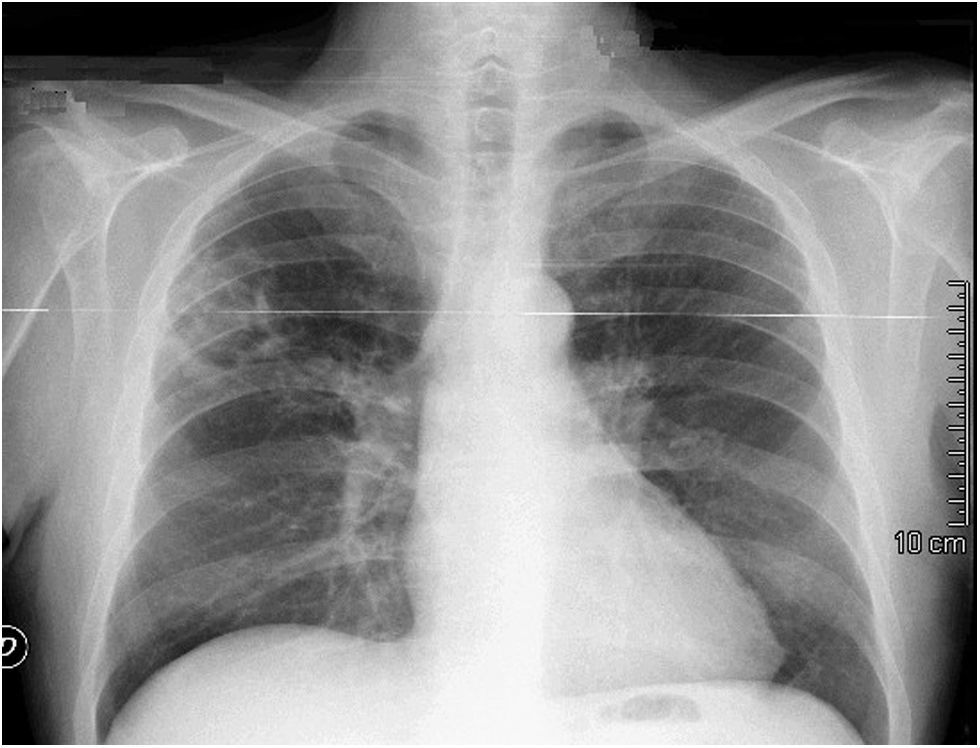
Caso clínicoSe trata de un varón de 58 años de edad, sin alergias medicamentosas conocidas, con diabetes mellitus tipo 1 y neuropatía diabética, así como hipercolesterolemia e hiperuricemia. Fue trasplantado el 31 de abril de 2001 a causa de una cirrosis alcohólica en estadio Child C; además, como complicaciones presentaba insuficiencia renal, hepatotoxicidad por tracrolimus, diarrea por tacrolimus y mofetil micofenolato, rechazo agudo-moderado (tratado con bolos de esteroides), estenosis biliar resuelta con stent endoscópico en junio de 2001, colestasis progresiva desde 2002, con colangiografía normal en junio de 2002 y biopsia compatible con rechazo ductopénico, por lo que actualmente estaba en tratamiento con everolimus, ácido micofenólico y prednisona. Se remitió a nuestro centro trasladado desde el hospital de su ciudad, con clínica de fiebre e ictericia de varios días de evolución, por lo que fue diagnosticado de colangitis aguda, con abscesos hepáticos visualizados por tomografía computarizada (TC) (fig. 1). Se inició tratamiento antibiótico de amplio espectro con imipenem y se realizó una primera colangiopancreatografía retrógrada endoscópica (CPRE), en la que se observaba un cálculo coledocal, que se extrajo, además de un contenido purulento de la vía biliar. Asimismo, en la radiografía de tórax (fig. 2) se observaba una imagen cavitada en el lóbulo superior derecho (LSD). Se le había realizado en su hospital de referencia una broncoscopia con lavado broncoalveolar, en la que se observaban bacilos ácido-alcohol resistentes (BAAR). A su llegada a nuestro hospital se mantuvo el tratamiento con imipenem y se inició tratamiento con 4 tuberculostáticos (isoniacida 50mg, rifampicina 120mg, piracinamida 300mg y etambutol 1.200mg), ajustando las dosis debido al deterioro de su función hepática. Por otra parte, se redujo la inmunodepresión (rápida retirada de esteroides, y cambio de everolimus por tacrolimus con posterior retirada), estando al mes del ingreso, en monoterapia con ácido micofenólico. En los días siguientes la evolución inicial fue favorable, con desaparición de la fiebre y gran mejora de las puebas hepáticas, así como una disminución de las imágenes radiológicas (tanto de la caverna de LSD como de los abscesos hepáticos). Pero 20 días después reapareció la clínica de colangitis aguda (fiebre, ictericia y prurito), por lo que se le realizó una nueva CPRE en nuestro hospital, en la que se observaba de nuevo una colodedocolitiasis, que no se pudo extraer porque estaba impactada en el conducto hepático derecho, por lo que se le colocó una prótesis biliar y recibió tratamiento con piperacilina-tazobactam. Ante el síndrome febril, se le extrajeron hemocultivos, que resultaron positivos para Escherichia coli, sensible al tratamiento que venía realizando, así como un lavado broncoalveolar, en el que se seguían observando BAAR. Se decidió continuar con los tuberculostáticos, pendientes del cultivo microbiológico. En pocos días el paciente presentó un empeoramiento progresivo, clínico y analítico. Se realizó una nueva CPRE, en la que tampoco se pudo extraer la litiasis intrahepática. Todo ello condujo a la aparición de un shock séptico en pocas horas, con fracaso multiorgánico y fallecimiento del paciente. Días después se recibió el resultado microbiológico del lavado broncoalveolar, positivo para M. kansasii.
DiscusiónLos pacientes que han sido sometidos a un trasplante hepático, al igual que con cualquier otro órgano sólido, tienen mayor susceptibilidad de sufrir infecciones debido a la situación de inmunodepresión que presentan1. Aunque no todos reaccionan de la misma manera. Hay pacientes que presentan una buena función del injerto y reciben la dosis mínima de inmunodepresión, por lo que su riesgo de padecer infecciones está disminuido. Otros, en cambio, presentan una infección crónica desde los primeros meses postrasplante por virus inmunomoduladores (virus de Epstein-Barr, citomegalovirus…), con manifestaciones clínicas en el período tardío. Por último, hay un grupo de paciente trasplantados que presentan una mala función del injerto y reciben dosis elevadas de fármacos inmunodepresores, por lo que mantienen un elevado riesgo de padecer enfermedades por gérmenes oportunistas2,3. El caso descrito podríamos incluirlo dentro de en este último grupo, y lo que destaca de este paciente no es tanto su complicación aguda de la vía biliar, sino la infección causada por ese otro grupo de microorganismos, las micobacterias, que en general es poco frecuente, pero en este tipo de pacientes conlleva una morbimortalidad muy elevada. Si la infección se ha producido por micobacterias, M. tuberculosis es el agente hallado con más frecuencia, a pesar de la escasa información acerca de su incidencia, clínica y tratamiento en receptores de un trasplante hepático. Según un estudio multicéntrico español la incidencia de tuberculosis en el receptor de un trasplante hepático es del 1%, al igual que en el trasplante renal o cardíaco, y 20 veces superior a la población general. Presenta dos picos de infección: a los 9 meses postrasplante o a los 2 años, y puede ser la causa de una reactivación de una tuberculosis (TBC) latente o una infección exógena, respectivamente. Provoca una elevada mortalidad en los pacientes trasplantados (33%)4, y no se sabe todavía cuáles son los factores de riesgo para que un receptor de un trasplante desarrolle TBC, por lo que ante un cuadro de fiebre inexplicada se debería considerar esta entidad, tanto en su afectación pulmonar como extrapulmonar o diseminada. Respecto a las micobacterias no tuberculosas, las infecciones en pacientes postrasplantados son anecdóticas, y suelen aparecer tras el primer año de la cirugía5. Se presentan como infecciones subagudas o crónicas con aceptable respuesta clínica al tratamiento combinado medicoquirúrgico. Estas micobacterias comparten con M. tuberculosis su ácido-alcohol-resistencia, su pared celular con alto contenido lipídico, la capacidad de persistencia intracelular y su gran resistencia a las condiciones ambientales6. Los principales reservorios de estas micobacterias atípicas son el agua, el suelo, las aves y los mamíferos. Habitualmente sus interacciones con el hombre son transitorias y autolimitadas, excepto en pacientes inmunodeprimidos, como es el caso de los trasplantados hepáticos, en los cuales pueden dar lugar a infecciones.
M. kansasii es la segunda micobacteria no tuberculosa después de M. avium, implicada en la afectación pulmonar según series publicadas en Estados Unidos7, tanto en pacientes inmunocompetentes como en inmunodeprimidos8. La incidencia de esta infección está aumentando debido al mayor número de trasplantes que se llevan a cabo actualmente, la intensidad de las terapias inmunodepresoras, la mayor supervivencia que presentan los receptores y la mejora en las técnicas diagnósticas9. Se trata de una micobacteria fotocromógena de crecimiento lento, cuya transmisión al hombre es a través del agua y de los aerosoles. La enfermedad pulmonar que provoca se asemeja a la de M. tuberculosis, e implica la aparición de un cuadro subagudo de febrícula, tos con expectoración herrumbrosa, disnea, pérdida de peso y astenia10. El patrón radiológico más frecuente es el infiltrado, con o sin cavitación, y afecta principalmente a los lóbulos pulmonares superiores (70–90%). Raramente se disemina, pero los pacientes trasplantados, al presentar un grave deterioro de la inmunidad celular, son más susceptibles7.
Las piedras angulares del diagnóstico siguen siendo el cultivo y la identificación posterior del organismo. El diagnóstico microbiológico es fundamentalmente directo, mediante el aislamiento de las micobacterias en las distintas muestras biológicas.
El tratamiento habitual de la infección por M. kansasii se basa en la combinación de rifampicina e isoniazida11, y en ocasiones etambutol, con tasas de negativizacion del esputo del 95–98%, y una recidiva del 2% a los 5 años de seguimiento10. En este paciente el antibiograma demostró además resistencia de M. kansasii a estreptomicina, isoniacida y etambutol, y era sensible sólo a rifampicina. Se recomienda una duración del tratamiento de 9 meses si la inmunidad no está alterada, pero si no es así, lo correcto es tratar durante 18–24 meses12. En pacientes trasplantados el tratamiento se ve comprometido por la toxicidad hepática de los tuberculostáticos (más alta en pacientes que reciben 4 o más tuberculostáticos, que en pacientes que reciben 3) y las interacciones que presentan con las terapias inmunodepresoras3. La hepatotoxicidad de la isoniazida implica ser cautos en su aplicación tras el trasplante hepático, y la rifampicina reduce la concentración sérica de los inhibidores de la calcineurina, incluso semanas después de cesar el tratamiento. El etambutol, por su parte, puede provocar una alteración de las enzimas hepáticas de forma reversible. Dada la escasa frecuencia de infección por estas micobacterias y su alta morbimortalidad, en los pacientes inmunodeprimidos parece esencial tener una sospecha clínica, con el fin de poder determinar un diagnóstico precoz y llevar a cabo el tratamiento adecuado de este tipo de complicaciones13,14.