La hepatitis B sigue siendo un importante problema de salud pública a nivel mundial. Si bien las indicaciones de tratamiento están bien establecidas en las guías de práctica clínica, existen ciertos grupos de riesgo como las embarazadas y los pacientes inmunosuprimidos, que requieren de un manejo diferente y específico de la infección por el virus de la hepatitis B (VHB). En el caso de las mujeres gestantes, la indicación de tratamiento debe individualizarse y valorar el riego de transmisión del VHB al recién nacido, y a que a pesar de la inmunoprofilaxis activa y pasiva, todavía existen casos de transmisión vertical de la hepatitis B. Con respecto a los pacientes que reciben tratamiento inmunosupresor, la reactivación del VHB se asocia a una alta morbimortalidad incluso en pacientes con infección por el VHB pasada enfatizando la importancia tanto del despistaje como de la necesidad valoración de tratamiento profiláctico en algunos casos.
Hepatitis B virus (HBV) infection continues to be a major public health problem worldwide. Although treatment indications are well established in clinical practice guidelines, there are some risk groups, such as pregnant women and immunosuppressed patients, who require different and specific management of HBV infection. In pregnant women, treatment indication should be individualized and the risk of HBV transmission to the newborn evaluated because cases of vertical transmission continue to be reported, despite active and passive immunoprophylaxis. In patients receiving immunosuppressive therapy, HBV reactivation is associated with high morbidity and mortality, even in patients with past HBV infection, highlighting the importance of screening and the need to evaluate prophylactic therapy in some cases.
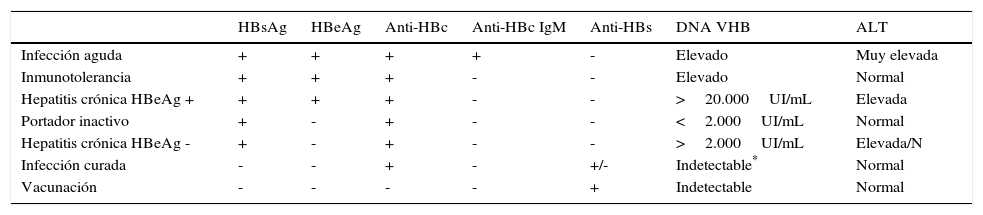
A nivel mundial, unos 350-400 millones de personas son portadores de antígeno de superficie del virus de la hepatitis B (HBsAg), y se estima que unas 600.000 personas mueren cada año como consecuencia de la hepatitis B. Aproximadamente un tercio de la población mundial presenta evidencia de infección presente o pasada por el virus de la hepatitis B (VHB)1,2. Existen distintos marcadores serológicos de infección por VHB que están resumidos en la tabla 1.
Caracterización serológica, virológica y bioquímica del virus de la hepatitis B
| HBsAg | HBeAg | Anti-HBc | Anti-HBc IgM | Anti-HBs | DNA VHB | ALT | |
|---|---|---|---|---|---|---|---|
| Infección aguda | + | + | + | + | - | Elevado | Muy elevada |
| Inmunotolerancia | + | + | + | - | - | Elevado | Normal |
| Hepatitis crónica HBeAg + | + | + | + | - | - | >20.000UI/mL | Elevada |
| Portador inactivo | + | - | + | - | - | <2.000UI/mL | Normal |
| Hepatitis crónica HBeAg - | + | - | + | - | - | >2.000UI/mL | Elevada/N |
| Infección curada | - | - | + | - | +/- | Indetectable* | Normal |
| Vacunación | - | - | - | - | + | Indetectable | Normal |
N: normal.
Las principales vías de transmisión de la hepatitis B incluyen la horizontal, por medio de transfusión de hemoderivados contaminados, empleo de drogas por vía intravenosa o contacto sexual, y la transmisión vertical, de madres a hijos, que continúa siendo una de las vías primordiales para la persistencia de la infección por VHB, sobre todo en zonas endémicas como el sudeste asiático y África subsahariana3. El riesgo de cronicidad tras la infección aguda varía según la edad, siendo del 80-90% entre los neonatos infectados nacidos de madres portadores del antígeno e del VHB (HBeAg) positivo, 30% en niños menores de los 6 años, 16% entre los 5-9 años y 7% en niños infectados entre los 10-19 años4,5.
La historia natural de la infección por VHB es un proceso dinámico, que esquemáticamente puede dividirse en 5 fases6: la fase de inmunotolerancia, hepatitis crónica HBeAg positivo, fase de portador inactivo, hepatitis crónica HBeAg negativo y seroaclaramiento del HBsAg (curación).
Las recomendaciones actuales de tratamiento de la Asociación Europea y Española para el Estudio de Hígado (EASL y AEEH)6,7, se basan en la presencia de DNA VHB>2.000UI/mL junto con elevación de los niveles de alanina aminotransferasa (ALT) y presencia de necroinflamación o fibrosis moderada en la biopsia hepática. Sin embargo, el manejo clínico de la infección por VHB se modifica en ciertas situaciones especiales como la inmunosupresión, dado el elevado riesgo de reactivación de la infección, o embarazo, de cara a prevenir la transmisión vertical del virus.
Hepatitis B y embarazoLa planificación familiar debe ser siempre valorada en mujeres en edad reproductiva previamente al inicio de tratamiento antivírico, dada la potencial teratogenicidad del tratamiento durante el embarazo (tabla 2)8. En los casos con fibrosis leve y niveles de ALT normales o mínimamente elevados, el tratamiento para el VHB puede ser potencialmente diferido. Por contra, en aquellas mujeres con fibrosis avanzada o cirrosis, el tratamiento debería iniciarse de forma inmediata independientemente de la planificación familiar. Si se consensúa un «embarazo planificado», se podría plantear tratamiento finito con Peg-Interferon (Peg-IFN), siempre que una contracepción efectiva pueda asegurarse. En caso de que exista contraindicación para el tratamiento con Peg-IFN o no haya respuesta al mismo, tratamiento con análagos de los nucleósidos/nucleótidos (AN) es una opción terapéutica. Existe controversia sobre el empleo de AN durante los primeros meses de la gestación, sin embargo estudios recientes sugieren que la administración de lamivudina o tenofovir (TDF) no se asocia a una mayor teratogenicidad9. De hecho, datos derivados del registro internacional Antiretroviral Pregnancy Registry entre 1989-2012, mostraron un riesgo de malformaciones del 2,4% en pacientes bajo tratamiento con TDF9, similar al riesgo de 2,7% de la población general10. Por todo ello, actualmente el fármaco de elección tanto por su seguridad durante el embarazo como por su alta barrera genética, es el TDF.
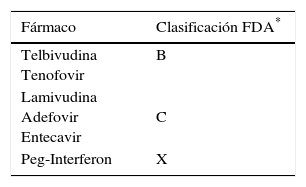
Grado de teratogenicidad de los fármacos con actovidad contra el VHB según la clasificación de la US Food and Drug Administration (FDA)
| Fármaco | Clasificación FDA* |
|---|---|
| Telbivudina Tenofovir | B |
| Lamivudina Adefovir Entecavir | C |
| Peg-Interferon | X |
B: estudios en animales no han demostrado riesgos para el feto, aunque no exiten datos sobre estudios controlados en mujeres embarazadas; C: estudios en animales han demostrado efectos adversos en fetos. Sin embargo, aunque no hay datos sobre estudios controlados en mujer embarazdas, aunque efectos potencialmente beneficiosos podrían garantizar su uso en embarazadas a pesar de los riesgos potenciales; X: estudios en animales o humanos han demostrado malformaciones fetales y/o existe evidencia de riesgo fetal basado en reacciones adversas de estudios experimentales, por lo que el riesgo del uso del fármaco durante el embarazo claramente supera el potencial beneficio.
Si una mujer se queda embarazada mientras recibe tratamiento, la indicación de tratamiento debe ser reevaluada, manteniéndolo en aquellos casos con fibrosis evolucionada o cirrosis, siendo el AN de elección TDF por las características comentadas previamente. En aquellas pacientes en las que se decide continuar tratamiento, en caso de recibir tratamiento con lamivudina, tenofovir o telbivudina, no es necesario el cambio de AN. Sin embargo, si el tratamiento basal era entecavir, adefovir o PegIFN, se recomienda suspensión y cambiar a TDF.
El mayor riesgo de transmisión vertical se encuentra en el período perinatal. A pesar de una adecuada inmunoprofilaxis activa, mediante la administración de la inmunoglobulina de la hepatitis B (IGHB), y pasiva, por medio de la vacunación en las primeras 12 horas de vida, la transmisión perinatal del VHB todavía no se ha eliminado completamente11. La HBeAg es una proteína del VHB cuya presencia en suero aumenta significativamente la infectividad del virus y se correlaciona con una alta carga viral, siendo el riesgo de transmisión 17 veces mayor en hijos de madres HBeAg positivo (OR=17,07, IC 95% 3,39-86,01), según datos de un estudio de casos y controles realizado en China, que también constató que los otros factores asociados a un aumento, en este caso lineal, de la tasa de infección intrauterina del VHB eran el título de HBsAg (p=0,0117) y la carga viral del VHB (p<0,01)12. De hecho, se estima que el riesgo de transmisión vertical en embarazadas HBeAg positivo con carga viral elevada (DNA VHB >106-107UI/mL), se sitúa en torno al 10%. La importancia de evitar la transmisión vertical radica, básicamente, en el hecho de que el riesgo de progresión a infección crónica es inversamente proporcional a la edad al ser infectado, siendo superior al 80% en los recién nacidos13. La actual recomendación tanto de la Asociación Europea para el Estudio del Hígado (EASL) como de la Asociación Americana para el Estudio del Hígado (AASLD), es iniciar tratamiento en el tercer trimestre en aquellas gestantes con DNA superior a 106-107UI/mL6,13. Esta decisión está apoyada por resultados de un estudio realizado en China, en el que a las embarazadas HBeAg positivo con DNA VHB>107 copias/mL se les recomendaba tratamiento con telbuvina entre la semana 20-32 de gestación, sirviendo como grupo control aquellas mujeres que optaron por no recibir tratamiento. Hasta un tercio de las paciente tratadas presentaron carga viral<500 copias/mL en el momento del parto, en comparación con el 0% del grupo de no tratadas, y ninguno de los niños nacidos de madres tratadas se infectaron, en contraste con el 8% de los recién nacidos de madres sin tratamiento14.
Con respecto al parto, un estudio mostró que el parto vaginal se asociaba a una mayor tasa de transmisión a pesar de inmunoprofilaxis (19,9 vs <5%, p0,03)15. Sin embargo, posteriormente Wang et al. constataron que, al alargar el seguimiento a un año, no existían diferencias significativas entre cesárea, fórceps y parto vaginal en cuanto a la reducción de incidencia de fracasos de la vacuna (7,3%, 7,7%, 6,8%, p=0,89)16. Otros factores como la rotura prematura de membranas, prematuridad, bajo peso o baja puntuación Apgar al nacer (<7) tampoco se han relacionado con una mayor frecuencia de transmisión11. Asimismo, varios trabajos, incluyendo un metaanálisis, han descartado que la lactancia sea un factor de riesgo para la transmisión de la infección17,18, por lo que, a pesar de que el HBsAg pueda ser detectado en la leche materna, actualmente la lactancia no está contraindicada6. En relación con el tratamiento con NA y lactancia materna, se sabe que el TDF se elimina por la leche, por lo que la lactancia materna no está indicada debido a que todavía existen pocos datos sobre la seguridad del tratamiento con AN durante la misma.
Recomendaciones- •
Las mujeres con fibrosis avanzada o cirrosis deben recibir tratamiento antiviral frente al VHB.
- •
En caso de fibrosis leve, la decisión de iniciar tratamiento puede diferirse a después del parto.
- •
La inmunoprofilaxis mediante IGHB y vacunación en las primeras horas del nacimiento evita la transmisión en la mayoría de los casos, recomendándose además tratamiento con AN a partir de las 20 semanas en gestantes con DNA VHB>106-107UI/mL.
- •
En caso de requerirse tratamiento durante el embarazo, actualmente el fármaco de elección dado su bajo riesgo de teratogenicidad (FDA B) y su alta barrera genética es el TDF.
La prevalencia en nuestro medio de portadores de infección por el VHB (HBsAg positivo) o infección curada (HBsAg negativo/anticuerpos contra el core (anti-HBc) positivo) se sitúa en torno al 0,7 y 8,7%, respectivamente19. Ambos grupos de pacientes presentan alto riesgo de reactivación de la infección cuando están sometidos a quimioterapia, o tratamiento inmunosupresor ya sea por trasplante de órgano sólido o hematopoyético, o por enfermedad reumatológica, gastrointestinal o dermatológica.
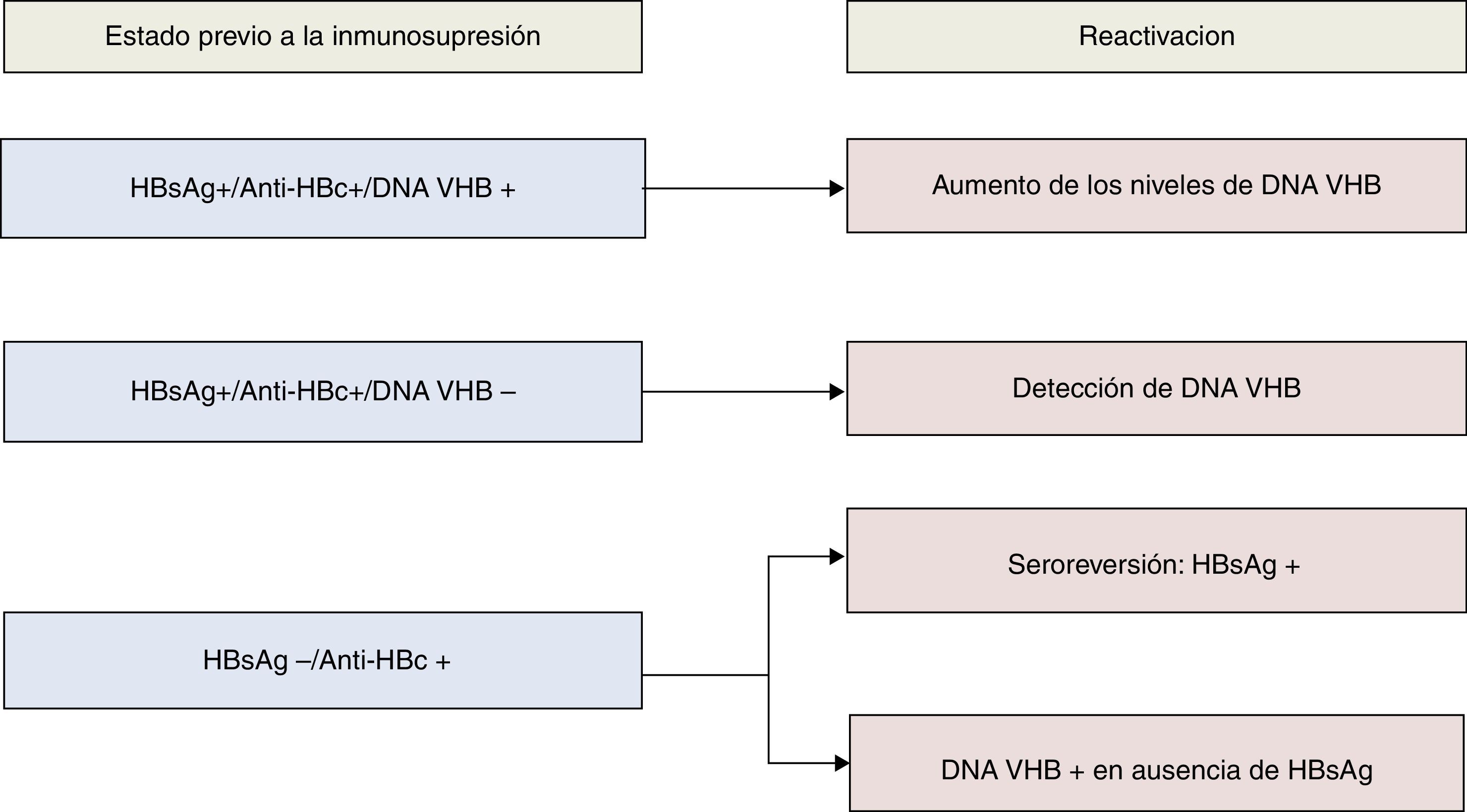
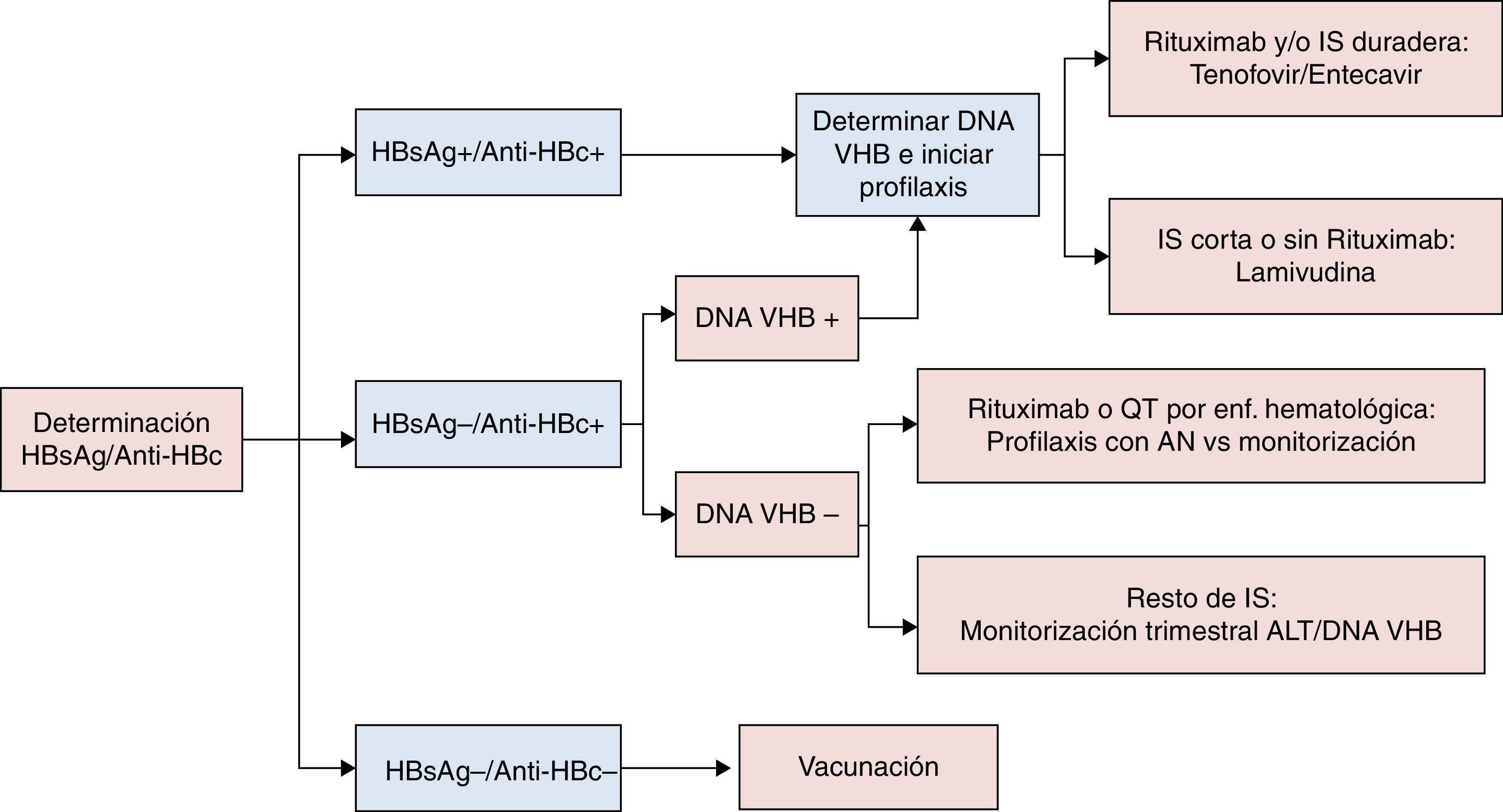
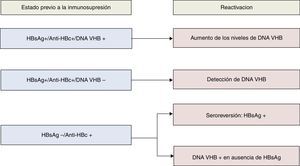
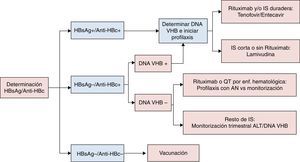
La recomendaciones de la AASLD definen reactivación del VHB el aumento de la replicación viral (aumento ≥2 log en comparación con los niveles basales o aparición del DNA VHB a niveles superiores a ≥100UI/ml) en un individuo con niveles previos estables o indetectables20. La reactivación de la hepatitis B se describió por primera vez hace casi 40 años21, y desde entonces se ha observado un riesgo más elevado en pacientes del ámbito onco-hematológico, principalmente aquellos que reciben tratamiento biológico con agentes anti-CD2022,23. No obstante, casos de reactivación del VHB han sido descritos en relación con prácticamente todos los fármacos inmunosupresores, pudiendo asociarse a una alta tasa de morbimortalidad24,25, motivo por el que actualmente se recomienda realizar cribado de infección por VHB a todo paciente que va a ser sometido a quimioterapia, tratamiento inmunosupresor o biológico. En la figura 1 se recogen los diferentes tipos de reactivación de la infección por VHB en función al estado serológico del paciente previamente al inicio de terapia inmunosupresora. De acuerdo al anterior esquema, el despistaje recomendado debería incluir determinación del HBsAg y IgG anti-HBc, debiendo completarse el estudio mediante cuantificación del DNA VHB, y también anti-HBs en aquellos casos en los que el anti-HBc es positivo (fig. 2). Aquellos pacientes HBsAg positivo, independientemente del DNA VHB, que vayan a recibir tratamiento inmunosupresor o quimiterápico deben recibir profilaxis con AN durante el tratamiento y hasta 12 meses después de su finalización6,7. Con respecto al AN de elección, el fármaco con el que posee mayor experiencia es la lamivudina, que podría ser suficiente en pacientes con baja carga viral (DNA VHB<2.000UI/mL) y corta exposición al tratamiento inmunosupresor. Sin embargo, dada la alta morbimortalidad asociada a los casos de reactivación del VHB, en casos con carga viral elevada o que vayan a requerir de tratamiento inmunosupresor a largo plazo, se recomienda el uso de un AN más potente y con alta barrera genética como el entecavir o TDF6,7. Aquellos pacientes sin marcadores serológicos de infección por VHB deberían ser vacunados, aunque probablemente requerirán de dosis mayores a las habituales para alcanzar títulos de anti-HBs6.
Tipos serológicos y virológicos de reactivación del VHB según los marcadores al inicio del tratamiento inmunosupresor*.
*Modificado del original de Hwang et al.26.
Clínicamente, la reactivación del VHB puede manifestarse como una hepatitis aguda sintomática, que en casos graves, puede conducir a fallo hepático agudo e incluso a la muerte25,26. Sin embargo, algunos casos de reactivación son asintomáticos y se resuelven espontáneamente, o pueden conllevar la persistencia de la infección por el VHB, que puede pasar desapercibida hasta que se presenta como enfermedad hepática avanzada o cuando se transmite26.
En los casos de reactivación, la fase inicial que tiene lugar durante el tratamiento inmunosupresor o citotóxico, se caracteriza por una acentuación de la replicación viral reflejándose en un aumento brusco del DNA VHB. La segunda fase, definida por la restauración de la función inmunitaria tras la retirada del tratamiento inmunosupresor, produce una rápida destrucción de hepatocitos infectados por el VHB mediada por los linfocitos T, y que clínicamente se manifiesta en forma de hepatitis o fallo hepático agudo, con elevación analítica de los niveles de ALT, y en los casos más severos, también de bilirrubina. Por último, la fase de recuperación, durante la cual, en la mayoría de los casos, los niveles de DNA VHB disminuyen, y el daño hepático mejora, volviendo los marcadores serológicos a su situación basal25,26.
La incidencia de reactivación del VHB no está bien establecida, y depende de muchos factores como las características del huésped, la enfermedad subyacente, el tipo de terapia inmunosupresora y el estado serológico previo. Entre las variables que han sido descritas como factores de riesgo para la reactivación del VHB se encuentran características basales de los individuos, ciertos tipos de tumores e inmunosupresores y el estado serológico previo, tal y como aparece resumido en la tabla 3.
Factores de riesgo relacionados con el desarrollo de reactivación del virus de la hepatitis B
| Características basales huésped | Sexo masculino27,33 |
| Edad joven27 | |
| Estado serológico del huésped | HBsAg positivo27,33 |
| HBeAg positivo33 | |
| DNA VHB detectable40,41,54,70 Anti-HBs <10UI/mL65 | |
| Tipo de tumor | Linfoma27,41 |
| Cáncer de mama41 | |
| Tratamiento inmunosupresor | Tratamiento inmunosupresor previo34,40 Rituximab29,35,71 Corticoesteroides41,72 Antraciclinas27,41 |
| Complicaciones asociadas | Enfermedad injerto contra huésped66 |
Con respecto a la cronología, la reactivación del VHB puede tener lugar en cualquier momento tras el inicio de la terapia inmunosupresora, sin embargo, en aquellos casos secundarios al uso de quimioterapia, suele acontecer típicamente tras el segundo o tercer ciclo27, y en los pacientes tratados con rituximab, el VHB suele reactivar a los 6 meses del inicio de tratamiento28, y hasta un año después de finalizado el tratamiento29.
Anticuerpos monoclonalesAnticuerpos monoclonales anti-CD 20Desde su aprobación en 1997 por la FDA para el tratamiento de linfomas B como el folicular, difuso de células grandes y la leucemia linfática crónica, el uso del rituximab ha aumentado exponencialmente, extendiéndose su uso también a otras enfermedades hematológicas como citopenias autoinmunes, enfermedades reaumatológicas como la artritis reumatoide, autoinmunes como el lupus eritematoso sistémico, poliangeítis granulomatosa o vasculitis pANCA positiva, enfermedades neurológicas como neuromielitis óptica o encefalitis paraneoplásicas o autoinmunes, o más recientemente, en los pacientes trasplantados como tratamiento del rechazo humoral o linfoma postrasplante (PTLD)30,31.
Actualmente, el tratamiento con rituximab se considera uno de los principales factores de riesgo para presentar reactivación del VHB. De hecho, en septiembre 2013 hubo una comunicación por parte de la FDA sobre el riesgo de hepatitis fulminante y muerte en paciente con rituximab y ofatumumab, en relación con reactivación del VHB32, basada en una serie 109 casos de hepatitis aguda grave (106 tratados con rituximab y 3 con ofatumumab).
Se ha descrito una frecuencia de reactivación en pacientes HBsAg positivo del 20-55%27,33,34 y del 3-27% en pacientes anti-HBc positivos35. Así bien, en un metaanálisis realizado en pacientes anti-HBc positivos afectos de procesos linfoproliferativos, el tratamiento con rituximab conllevó un riesgo 6 veces mayor de reactivación que aquellos pacientes tratados con regímenes de quimioterapia libres sin rituximab29. Recientemente Seto et al. reportaron que un 24,2% de los pacientes anti-HBc positivo con DNA VHB indetectable tratados con rituximab, presentaron reactivación de la infección por el VHB, principalmente durante los 9 primeros meses (86,7%)28. Un dato a destacar fue que, niveles más bajos de anti-HBs se asociaron a una mayor tasa de reactivación de la infección28, remarcando la importancia de su determinación previa al inicio del tratamiento con anti-CD20. En nuestro país, un estudio multicéntrico con pacientes anti-HBc positivo y DNA VHB indetectable tratados con rituximab (Estudio Preblin), 13% de los pacientes sin profilaxis presentaron reactivación de la hepatitis B, en comparación con el 0% en el grupo tratado profilácticamente con TDF36.
Tal y como se recoge en la figura 1, todos los pacientes HBsAg positivo o anti-HBc positivo con DNA VHB detectable deben recibir profilaxis previo al inicio de tratamiento con rituximab, que se debería continuar hasta 12 meses después de la finalización del tratamiento inmunosupresor. Esta recomendación se afianza con los datos publicados recientemente en el trabajo de Seto et al., donde no se detectaron reactivaciones del VHB después del año de seguimiento28. Sin embargo, para los pacientes anti-HBc positivo con DNA VHB indetectable, no existe consenso a día de hoy sobre qué estrategia seguir, por lo que tanto el tratamiento con análogos como la monitorización trimestral de los niveles de ALT y DNA, serían actitudes correctas.
Como ya se ha citado previamente, cada día es más frecuente el uso de agentes anti-CD20, también en pacientes trasplantados, por ejemplo para el tratamiento del rechazo agudo, rechazo mediado por anticuerpos, PTLD o el acondicionamiento pretrasplante para los receptores de progenitores hematopoyéticos37, aconsejándose también en estos pacientes el despistaje tanto de infección activa como curada por VHB previo al tratamiento con rituximab31.
También han sido descritos casos de reactivación del VHB en relación con agentes antiCD52 como alemtuzumab38,39, por lo que el manejo clínico debería ser similar al recomendado para rituximab.
Anti-tumor necrosis factor alfaLas terapias biológicas contra el anti-tumor necrosis factor alfa (TNFα) se emplean para un amplio espectro de patologías, incluyendo enfermedades reumatológicas como la artritis reumatoide, digestivas como la enfermedad inflamatoria intestinal, y dermatológicas como la psoriasis. Una revisión de pacientes tratados con algún agente anti-TNFα (infliximab, etanercept, adalimub) mostró que el 39% de los pacientes HBsAg positivo y el 5% de los anti-HBc positivo/HBsAg negativo, presentaron reactivación del VHB, incluyendo 5 casos de hepatitis fulminante, 4 de los cuales fallecieron a causa del mismo40. En la citada serie del grupo del BIOGEAS, la media de meses hasta la reactivación del VHB fue de 11, y los pacientes tratados con infliximab presentaron mayor riesgo que los que recibieron terapia biológica con algún otro anti TNFα40.
QuimioterapiaSe estima que la reactivación del VHB en pacientes que reciben tratamiento quimioterápico se sitúa en torno al 10-58%27,33,41. Uno de los primeros trabajos a este respecto, realizado en Hong Kong en 100 pacientes afectos de linfoma, observó una frecuencia de reactivación del VHB del 48% en individuos HBsAg positivo, 4% en los anti-HBc positivo y 0% en pacientes sin marcadores de hepatitis B previa. El riesgo de fallo hepático secundaria a reactivación del VHB fue del 7, 2 y 0%, respectivamente33. Un porcentaje similar de reactivación, 3%, fue descrito en otro estudio prospectivo en individuos anti-HBc positivo con linfomas tratados con quimioterapia42. Con respecto a los tumores sólidos, uno de los que se ha relacionado con una mayor frecuencia de reactivación es el carcinoma de mama, presentado el 41% de pacientes HBsAg positivo reactivación, en contraste con el 7% en los tumores gastrointestinales, 23% carcinomas de pulmón y 29% en los de cabeza y cuello (p=0,004)41.
Teóricamente, cualquier tipo de quimioterápico puede conllevar la reactivación del VHB33,42, habiéndose descrito casos tanto con alquilantes (ciclofosfamida, carboplatino, cisplatino), antimetabolitos (citarabina, fluorouracilo, mercaptopurinas, metrotexate), antibióticos antitumorales (antraciclinas, bleomicina, mitomicina D), corticoides como alcaloides (vincristina, vinblastina)43.
Además, la reactivación del VHB puede ser una causa de interrupción del tratamiento quimioterápico con los inconvenientes y consecuencias que esto supone en la enfermedad de base. Así bien, en un grupo de pacientes con cáncer de mama, hasta el 71% de los casos de reactivación tuvieron que terminar prematuramente o retrasar la continuación de la quimioterapia, en comparación el 33% de las pacientes que no presentaron reactivación del VHB (p=0,019)44.
Una mención aparte merece la quimioembolización arterial (QEA), tratamiento paliativo empleado en algunos casos de hepatocarcinoma celular (HCC) de gran tamaño, no subsidiarios de tratamiento curativo o como paso previo al trasplante hepático. A pesar de que en la QEA el tratamiento quimioterápico es administrado directamente en la rama que suple el tumor, minimizando los efectos adversos sistémicos, casos de reactivación del VHB también han sido descritos45–47. Es más, en un estudio prospectivo en pacientes con hepatitis crónica B que desarrollaban un HCC tratado mediante QEA con epirrubicina y cisplatino, el 2,8% de los pacientes que recibieron además tratamiento profiláctico con lamivudina presentaron reactivación del VHB en contraste con el 29,7% en el grupo control sin profilaxis (p=0,002)46.
Otros tratamientos inmunosupresoresSe han descrito casos de reactivación del VHB en pacientes con artritis reumatoide tratados con fármacos antirreumáticos modificadores de la enfermedad, principalmente metotrexate en individuos portadores del HBsAg48,49, aunque también algunos casos aislados en pacientes anti-HBc positivo50,51.
Con respecto a los corticoides y la azatrioprina, fármacos con los que existe una amplia experiencia en pacientes con enfermedad inflamatoria intestinal52–54, en una revisión realizada por el grupo español de Enfermedades de Crohn y Colitis Ulcerosa (GETECCU), el 36% de los pacientes HBsAg positivos presentó reactivación del VHB bajo tratamiento inmunosupresor, principalmente corticoides asociados a azatioprina54. En la citada cohorte, el principal factor de riesgo asociado a la reactivación fue el tratamiento con dos más fármacos inmunosupresores (OR 8,75). Tan solo hubo un paciente anti-HBc positivo que presentó elevación de DNA VHB, aunque sin elevación de los niveles de transaminasas. De hecho, en la literatura tan solo existe un caso aislado de reactivación con hepatitis fulminante en un paciente anti-HBc positivo tratado con azatioprina55, motivo por el que se recomienda también en estos casos realizar despistaje de infección por VHB, incluyendo DNA y anti-HBs en aquellos casos anti-HBc positivos, tal y como se resume en la figura 2.
Menos datos existen con respecto al papel de los corticoides en monoterapia como agentes desencadenantes de reactivación del VHB. Aunque se ha demostrado que pueden inducir disminución de la función de los linfocitos T, con aumento significativo de su actividad y elevación de los niveles de transaminasas tras su retirada56, y a pesar de su uso ampliamente extendido para enfermedades neumológicas, autoinmunes y dermatológicas, pocos son los casos descritos hasta la fecha de reactivación del VHB tras su administración sistémica57–59. Sin embargo, un estudio retrospectivo en pacientes HBsAg positivo con asma o enfermedad pulmonar obstructiva, mostró que hasta el 11% de los individuos tratados con corticoides sistémicos presentó reactivación del VHB, siendo el riesgo 3 veces mayor en este grupo en comparación con los tratados tan solo con corticoides inhalados60. Asimismo, otro trabajo retrospectivo, en este caso con pacientes HBsAg positivo con dermatomiositis o pénfigo vulgar, también mostró una frecuencia de reactivación del 3%, aunque la validez del estudio es escasa ante la ausencia de DNA VHB basal con el que comparar61. Por todo ello, se recomienda profilaxis tan solo en pacientes HBsAg positivo que vayan a recibir corticoterapia sistémica prolongada, aunque se requerirían estudios prospectivos para afianzar dicha recomendación.
Trasplante de órgano sólido y progenitores hematopoyéticosEn aquellos pacientes HBsAg positivo que van a recibir un injerto hepático por cirrosis evolucionada o HCC, se recomienda tratamiento con AN potentes con alta barrera genética, con el fin de lograr un DNA VHB indetectable previa al trasplante6. Posteriormente al procedimiento, el tratamiento con AN en combinación con administración de IGHB ha reducido el riesgo de infección del injerto a menos del 10%6. A día de hoy no existe ni una dosis o frecuencia de administración de la IGHB estandarizada, aunque sí datos a favor de que dosis reducidas (1.000-2.000UI/mes) son suficientes en pacientes con DNA VHB indetectable en el momento del trasplante hepático7. Asimismo, tampoco existen actualmente datos suficientes para recomendar la profilaxis inicial sin IGHB, basadas únicamente en la administración de AN potentes62. Por otra parte, debido a la disparidad entre el número de pacientes en lista de trasplante y el número de donaciones, cada día es más frecuente el empleo de órganos de pacientes anti-HBc positivo31, recomendándose en ese caso la profilaxis indefinida con lamivudina6.
Con respecto a los receptores de progenitores hematopoyéticos, la frecuencia de reactivación en pacientes con infección crónica se sitúa entre el 32-50% y la de seroreversión del HBsAg entre el 14-50%, aunque no se ha documentado mortalidad relacionada con dichos eventos63,64. En este grupo de pacientes, los principales factores de riesgo para la reactivación del VHB son los títulos previos de anti-HBs65,66, títulos más bajos previos al trasplante se asocian en pacientes con infección curada a una mayor tasa de seroreversión, y el desarrollo como complicación de enfermedad injerto contra huésped66.
Un dato a tener muy en cuenta, es que la reactivación puede tener lugar años después de trasplante, estimándose que la probabilidad acumulada de seroconversión al año del trasplante es del 9%, y al final del cuarto año del 43%66, motivo por el que algunos autores han planteado la vacunación en aquellos casos de anti-HBc positivo con títulos bajos de anti-HBs67,68, o incluso alargar la duración de la profilaxis69. Sin embargo, a día de hoy, no existe un consenso sobre la mejor estrategia a seguir.
Recomendaciones- •
Se define como reactivación del VHB el aumento de los niveles de DNA VHB ≥2 log o aparición del DNA VHB a niveles superiores a ≥100 UI/ml en un individuo con niveles previos estables o indetectables.
- •
Entre los factores de riesgo para la reactivación del VHB se encuentran el tratamiento con rituximab o antraciclinas, el sexo masculino, HBsAg positivo, DNA VHB detectable previa a la inmunosupresión, o la enfermedad injerto contra huésped.
- •
Previamente al inicio de tratamiento inmunosupresor se recomienda realizar despistaje de infección por VHB mediante la determinación del HBsAg y anti-HBc. En los casos anti-HBc positivo, deberían determinarse los anticuerpos anti-HBs y el DNA VHB.
- •
Todos los pacientes portadores del HBsAg que vayan a recibir terapia biológica, quimioterapia u otro tratamiento inmunosupresor, deben recibir tratamiento con análogos de nucleós(t)idos, al igual que los pacientes con DNA-VHB detectable con anti-HBc positivo/HBsAg negativo.
- •
En los pacientes anti-HBc positivo con DNA VHB indetectable, en caso de tratamiento con rituximab se recomienda profilaxis con análogos, o control trimestral mediante DNA VHB y niveles de ALT durante el tratamiento inmunosupresor y hasta un año después.
Los autores declaran no tener ningún conflicto de intereses.