las características clínicas y el tratamiento recibido por los pacientes hospitalizados por COVID-19 han ido modificándose con el tiempo. El objetivo fue analizar la evolución clínico-terapéutica de los pacientes en las ondas epidémicas y estimar un modelo predictivo de la mortalidad.
Métodosestudio observacional de cohortes retrospectivo considerando los pacientes ingresados con infección confirmada por SARS-CoV-2 hasta marzo de 2022. Se recogieron variables sociodemográficas, comorbilidades y tratamientos, y se creó un modelo predictivo de fallecimiento mediante regresión logística multivariante.
Resultadosse incluyeron 1.784 pacientes. Se encontraron diferencias entre las ondas epidémicas con respecto a la edad, sexo, hipertensión arterial, diabetes mellitus, obesidad y enfermedad renal crónica. Ceftriaxona, azitromicina, hidroxicloroquina, metilprednisolona y lopinavir-ritonavir fueron los fármacos más frecuentemente utilizados en la primera onda. Amoxicilina, dexametasona y tocilizumab se prescribieron en mayor frecuencia en ondas sucesivas. El porcentaje de fallecimientos varió desde un 5,6% en la cuarta onda a un 14,1% en la tercera (p<0,001). Los factores resultantes asociados con la mortalidad (OR; IC 95%) fueron el ingreso en UCI (56,5; 27,4-121), la edad (1,09; 1,08-1,11), los días de ingreso (0,98; 0,96-0,99), la enfermedad renal crónica (1,67; 1,16-2,40) y haber recibido tratamiento con tocilizumab (2,49; 1,43-4,30), dexametasona (1,58; 1,10-2,26) y metilprednisolona (2,46; 1,63-3,68). El área bajo la curva alcanzado por el modelo fue de 0,863.
Conclusionesparecen existir diferencias clínico-terapéuticas en los pacientes durante las 6 primeras ondas epidémicas. El conocimiento de los factores de riesgo de mortalidad permitirá la detección de los pacientes hospitalizados con mayor riesgo y optimizar precozmente su manejo terapéutico.
The clinical characteristics and treatment received by patients hospitalized with COVID-19 have changed over time. The objective was to analyze the clinicaltherapeutic evolution of patients in the epidemic waves and estimate a predictive model for mortality.
MethodsRetrospective cross-sectional study considering patients admitted with confirmed SARS-CoV-2 infection until March 2022. Sociodemographic variables, comorbidities and treatments were collected and a predictive model for mortality was created using multivariate logistic regression.
Results1,784 patients were included. Significant differences were found between the epidemic waves with respect to age, sex, arterial hypertension, diabetes mellitus, obesity and chronic kidney disease. Ceftriaxone, azithromycin, hydroxychloroquine, methylprednisolone and lopinavir-ritonavir were the most frequently used drugs in the first wave. Amoxicillin, dexamethasone and tocilizumab were prescribed more frequently in successive waves. The percentage of deaths varied from 5.6% in the fourth wave to 14.1% in the third (p<0.001). The resulting factors associated with mortality (OR; 95% CI) were ICU admission (56.5; 27.4-121), age (1.09; 1.08-1.11), days of admission (0.98; 0.96-0.99), chronic kidney disease (1.67; 1.16-2.40) and having received treatment with tocilizumab (2.49; 1.43-4.30), dexamethasone (1.58; 1.10-2.26) and methylprednisolone (2.46; 1.63-3.68). The area under the curve achieved by the model was 0.863.
ConclusionThere are significant clinical-therapeutic differences in patients along the first six epidemic waves. Knowledge of mortality risk factors will allow the detection of hospitalized patients at higher risk and early optimization of their therapeutic management.
Desde que el 31 de diciembre de 2019 las Autoridades de la República Popular China comunicaron a la Organización Mundial de la Salud (OMS) varios casos de neumonía de etiología desconocida en Wuhan (capital de la provincia china de Hubei), en España hasta la fecha se han notificado 13.868.227 de casos confirmados de COVID-191. De los casos confirmados a la Red Nacional de Vigilancia Epidemiológica, se estima un porcentaje de hospitalizaciones que oscila entre un 57,7% en la primera onda y un 6,7% en la sexta onda2.
Entre los análisis con importancia clínica y epidemiológica en esta cohorte de pacientes, destaca el estudio de los factores asociados de forma independiente a la mortalidad, encontrándose en la literatura predictores como la edad, el sexo masculino o diversas comorbilidades (hipertensión arterial, enfermedad renal o pulmonar crónicas y obesidad)3–6. Disponemos de menos datos sobre la potencial relación de los diferentes tratamientos empleados para el COVID-19 con la mortalidad.
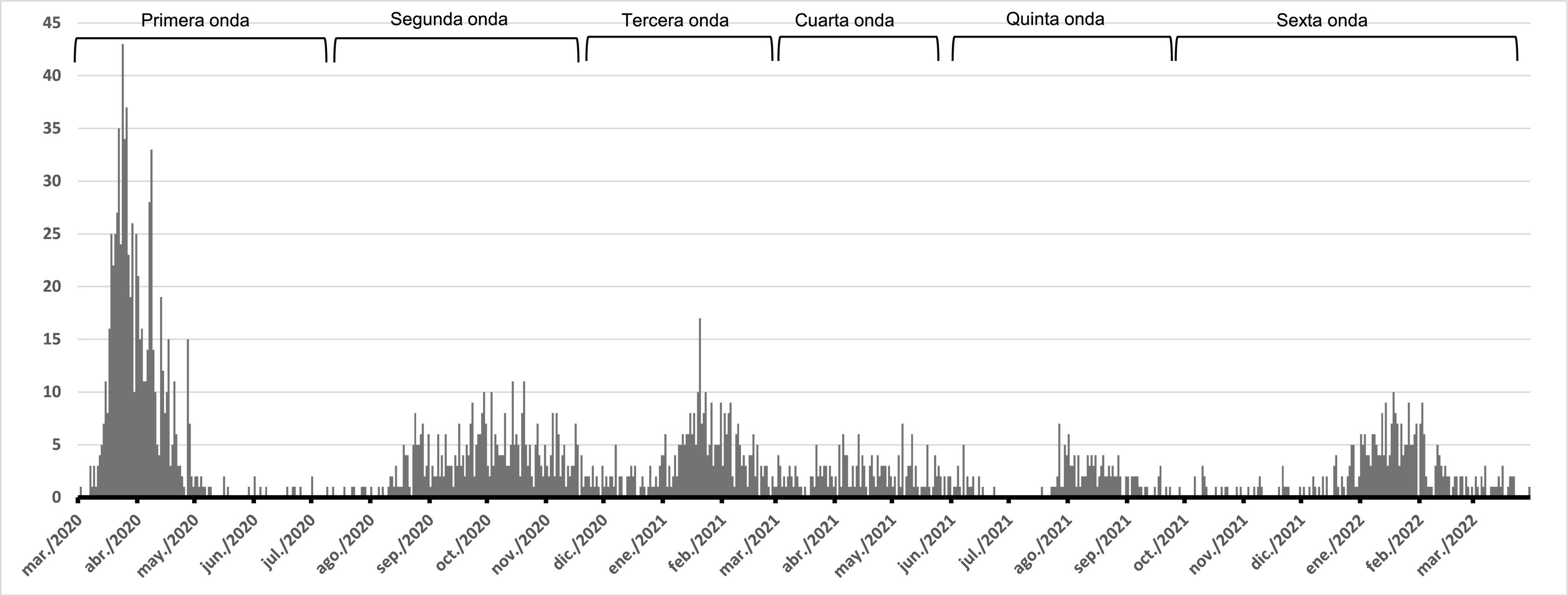
Las características sociodemográficas de los pacientes ingresados, así como la duración media de ingreso, porcentaje de ingresos en unidad de cuidados intensivos (UCI), fallecimientos y tratamientos utilizados han ido evolucionando a lo largo de las diferentes ondas epidémicas7,8 y sus diferencias no se han desglosado suficientemente en la literatura existente. La primera onda en España abarcó desde los primeros ingresos hasta el 12 de julio de 2020, con la mayor incidencia de casos ingresados, dando paso posteriormente a la segunda onda, que se extendió hasta el 6 de diciembre de 2020. La tercera onda tuvo lugar hasta el 21 de marzo de 2021, seguido de la cuarta onda, en la que predominó la circulación de la variante alfa y se extendió hasta el 27 de junio de 2021. La quinta onda, con predominio de la variante delta, abarcó hasta el 10 de octubre de 2021, momento en el que se inicia la sexta onda, asociada a la variante ómicron, que finalizó el 13 de marzo de 20229.
El objetivo del presente estudio fue describir las características sociodemográficas, comorbilidades y tratamientos utilizados en los pacientes ingresados con infección confirmada por SARS-CoV-2 en un hospital primario, analizar su evolución a lo largo de las diferentes ondas epidémicas e identificar los factores de riesgo que, de forma conjunta, están asociados con la mortalidad por COVID-19 mediante un modelo predictivo.
Material y métodosDiseño y participantesSe realizó un estudio observacional de cohortes retrospectivo para analizar las características de los pacientes ingresados con infección confirmada por SARS-CoV-2. La población a estudio estuvo constituida por los pacientes ingresados en el Hospital Universitario de Sureste (HUS), hospital de primer nivel de la Comunidad de la Madrid, tanto en planta de hospitalización como en la UCI, con una infección confirmada por SARS-CoV-2. Esta se definió por la obtención de una prueba de diagnóstico de infección aguda (PDIA) positiva, bien mediante pruebas de polimerase chain reaction (PCR) o test antigénico, realizados tanto en el HUS como en atención primaria. El periodo de estudio abarcó desde el mes de marzo del año 2020 (fecha de los primeros casos ingresados con COVID-19 confirmada) hasta el mes de marzo del año 2022, ambos inclusive, lo que incluye las 6 primeras ondas epidémicas descritas en España. Para las referencias de las fechas de las diferentes ondas se aplicó la distribución temporal de casos de la Comunidad de Madrid9. Se excluyeron los pacientes con sospecha de COVID-19, pero sin documentación de positividad de una PDIA, lo que incluía aquellos test antigénicos domiciliarios que no estaban registrados en la historia clínica del paciente.
Se incluyó la información disponible en la historia clínica electrónica del paciente. Se recogieron datos sociodemográficos (sexo, edad y fechas de ingreso y alta en hospitalización y/o UCI). Se estudió el desenlace del paciente teniendo en cuenta si el paciente había sido dado de alta, había fallecido durante dicho ingreso o había sido trasladado a otro centro. Los pacientes trasladados se consideraron pérdidas en el seguimiento. Asimismo, se recogió si el paciente reingresó en el hospital tras el alta por un motivo relacionado con el COVID-19 durante el periodo de estudio. Las características clínicas incluidas fueron los antecedentes patológicos del paciente (hipertensión arterial, diabetes mellitus, obesidad, enfermedad respiratoria crónica, enfermedad neurológica, enfermedad renal crónica, cirrosis, inmunodepresión e infección por el virus de la inmunodeficiencia humana [VIH]), recogidos a través de su registro en la historia clínica del paciente. Se recogieron también los tratamientos farmacológicos recibidos (hidroxicloroquina, lopinavir-ritonavir, remdesivir, dexametasona, metilprednisolona, anakinra, interferón-β 1b, tocilizumab, amoxicilina con o sin ácido clavulánico, azitromicina, ceftriaxona y levofloxacino).
Análisis estadísticoEn primer lugar, se realizó un análisis descriptivo de las características sociodemográficas, comorbilidades, tratamiento y evolución de los pacientes incluidos en el estudio durante su ingreso. Globalmente, las variables cuantitativas se expresaron mediante la media y desviación típica (SD). Sin embargo, tras rechazar la hipótesis nula de distribución normal (p<0,05), en cada una de las variables para alguna de las ondas epidémicas observadas individualmente (test Liliefords), se emplearon la mediana (Mdn) y rango intercuartílico (RIQ) por cada onda analizada. Las variables cualitativas se expresaron mediante frecuencias absolutas y porcentuales en cada una de las distintas categorías.
En segundo lugar, se compararon las características sociodemográficas, clínicas (comorbilidades y evolución) y los tratamientos utilizados entre las diferentes ondas epidémicas, utilizando el test chi cuadrado o el test de Fisher para las variables categóricas y el test de Kruskal-Wallis para analizar las diferencias en cada una de las variables cuantitativas. Para estas últimas, se llevaron a cabo comparaciones múltiples mediante el método de Dunn para estudiar la probabilidad (p) de haber encontrado las diferencias observadas entre cada par de ondas asumiendo como verdadera, entre otros supuestos, la hipótesis nula de igualdad de promedios. Además, se estimó la V de Cramer como medida de asociación para informar de la fuerza asociativa en aquellos contrastes de independencia que informaron de p menores de 0,05. Igualmente, se reportó el índice de tamaño del efecto Epsilon Square ordinal (ξ2) para informar de la intensidad de las diferencias encontradas entre las ondas epidémicas para cada variable cuantitativa.
Por último, para determinar los factores asociados a la mortalidad se llevaron a cabo estudios de independencia y modelos de regresión logística univariante, considerando como variable dependiente el fallecimiento del paciente durante el ingreso hospitalario. Finalmente se construyó un modelo predictivo de mortalidad en pacientes con COVID-19 mediante un análisis de regresión logística multivariante incluyendo todas aquellas variables que resultaron asociadas en los modelos univariantes (p<0,05) y también aquellas con relevancia clínica, aplicando un procedimiento de elección de variables por pasos hacia atrás. Se comparó el modelo inicial y el final mediante índices como AIC corregido, BIC, el test de la ratio de verosimilitud y la prueba ANOVA. Por último, se estimaron índices de discriminación, calibración, sensibilidad, especificidad y valores predictivos entre otros, además de generar una curva ROC con el punto de corte óptimo que maximizó el índice Youden. El error tipo I asumido en todos los análisis fue un α=0,05. Se hizo uso del software estadístico R (versión 4.3.1.).
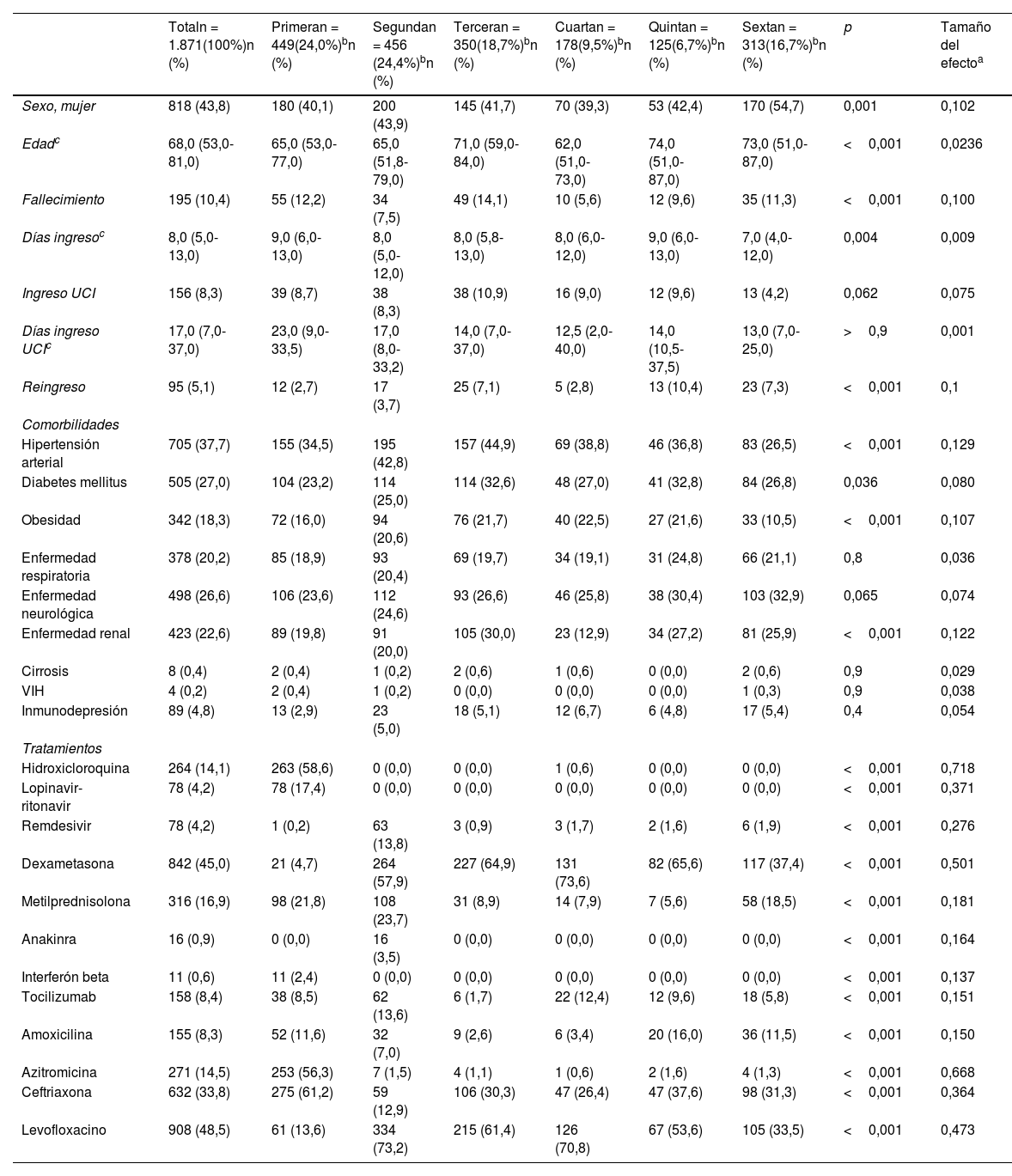
ResultadosAnálisis descriptivoSe incluyeron en el estudio 1.784 pacientes, que correspondieron a 1.871 ingresos hospitalarios, debido a que 78 pacientes (4,4%) reingresaron durante el periodo estudiado. Las características sociodemográficas, comorbilidades y desenlace de los pacientes a lo largo de las 6 ondas epidémicas se muestran en la tabla 1. El 56,2% del total de ingresos fueron hombres, con una mediana de edad de 68 años (RIQ= 53-81). El 10,4% del total de ingresos hospitalarios falleció y un 4,4% de ellos fue trasladado a otro centro hospitalario. El 8,3% de los ingresos requirió ingreso en UCI, con una mediana de estancia hospitalaria en dicha unidad de 17 días (RIQ= 7-37). El 26,7% de los pacientes ingresados en UCI falleció. La estancia total hospitalaria de los pacientes estudiados tuvo una mediana de 8 días (RIQ= 5-13). Las enfermedades crónicas más prevalentes fueron la hipertensión arterial (37,7%), diabetes mellitus (27,0%) y las enfermedades neurológicas (26,6%). Un 22,6% del total de ingresados presentaban enfermedad renal crónica y un 20,2% enfermedad respiratoria crónica. Con respecto a los tratamientos, el más utilizado globalmente durante todo el periodo de estudio fue el levofloxacino (48,5% de los ingresos), seguido de la dexametasona (45,0%) y la ceftriaxona (33,8%).
Características sociodemográficas, clínicas y tratamientos por ondas epidémicas
| Totaln = 1.871(100%)n (%) | Primeran = 449(24,0%)bn (%) | Segundan = 456 (24,4%)bn (%) | Terceran = 350(18,7%)bn (%) | Cuartan = 178(9,5%)bn (%) | Quintan = 125(6,7%)bn (%) | Sextan = 313(16,7%)bn (%) | p | Tamaño del efectoa | |
|---|---|---|---|---|---|---|---|---|---|
| Sexo, mujer | 818 (43,8) | 180 (40,1) | 200 (43,9) | 145 (41,7) | 70 (39,3) | 53 (42,4) | 170 (54,7) | 0,001 | 0,102 |
| Edadc | 68,0 (53,0-81,0) | 65,0 (53,0-77,0) | 65,0 (51,8-79,0) | 71,0 (59,0-84,0) | 62,0 (51,0-73,0) | 74,0 (51,0-87,0) | 73,0 (51,0-87,0) | <0,001 | 0,0236 |
| Fallecimiento | 195 (10,4) | 55 (12,2) | 34 (7,5) | 49 (14,1) | 10 (5,6) | 12 (9,6) | 35 (11,3) | <0,001 | 0,100 |
| Días ingresoc | 8,0 (5,0-13,0) | 9,0 (6,0-13,0) | 8,0 (5,0-12,0) | 8,0 (5,8-13,0) | 8,0 (6,0-12,0) | 9,0 (6,0-13,0) | 7,0 (4,0-12,0) | 0,004 | 0,009 |
| Ingreso UCI | 156 (8,3) | 39 (8,7) | 38 (8,3) | 38 (10,9) | 16 (9,0) | 12 (9,6) | 13 (4,2) | 0,062 | 0,075 |
| Días ingreso UCIc | 17,0 (7,0-37,0) | 23,0 (9,0-33,5) | 17,0 (8,0-33,2) | 14,0 (7,0-37,0) | 12,5 (2,0-40,0) | 14,0 (10,5-37,5) | 13,0 (7,0-25,0) | >0,9 | 0,001 |
| Reingreso | 95 (5,1) | 12 (2,7) | 17 (3,7) | 25 (7,1) | 5 (2,8) | 13 (10,4) | 23 (7,3) | <0,001 | 0,1 |
| Comorbilidades | |||||||||
| Hipertensión arterial | 705 (37,7) | 155 (34,5) | 195 (42,8) | 157 (44,9) | 69 (38,8) | 46 (36,8) | 83 (26,5) | <0,001 | 0,129 |
| Diabetes mellitus | 505 (27,0) | 104 (23,2) | 114 (25,0) | 114 (32,6) | 48 (27,0) | 41 (32,8) | 84 (26,8) | 0,036 | 0,080 |
| Obesidad | 342 (18,3) | 72 (16,0) | 94 (20,6) | 76 (21,7) | 40 (22,5) | 27 (21,6) | 33 (10,5) | <0,001 | 0,107 |
| Enfermedad respiratoria | 378 (20,2) | 85 (18,9) | 93 (20,4) | 69 (19,7) | 34 (19,1) | 31 (24,8) | 66 (21,1) | 0,8 | 0,036 |
| Enfermedad neurológica | 498 (26,6) | 106 (23,6) | 112 (24,6) | 93 (26,6) | 46 (25,8) | 38 (30,4) | 103 (32,9) | 0,065 | 0,074 |
| Enfermedad renal | 423 (22,6) | 89 (19,8) | 91 (20,0) | 105 (30,0) | 23 (12,9) | 34 (27,2) | 81 (25,9) | <0,001 | 0,122 |
| Cirrosis | 8 (0,4) | 2 (0,4) | 1 (0,2) | 2 (0,6) | 1 (0,6) | 0 (0,0) | 2 (0,6) | 0,9 | 0,029 |
| VIH | 4 (0,2) | 2 (0,4) | 1 (0,2) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 (0,3) | 0,9 | 0,038 |
| Inmunodepresión | 89 (4,8) | 13 (2,9) | 23 (5,0) | 18 (5,1) | 12 (6,7) | 6 (4,8) | 17 (5,4) | 0,4 | 0,054 |
| Tratamientos | |||||||||
| Hidroxicloroquina | 264 (14,1) | 263 (58,6) | 0 (0,0) | 0 (0,0) | 1 (0,6) | 0 (0,0) | 0 (0,0) | <0,001 | 0,718 |
| Lopinavir-ritonavir | 78 (4,2) | 78 (17,4) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | <0,001 | 0,371 |
| Remdesivir | 78 (4,2) | 1 (0,2) | 63 (13,8) | 3 (0,9) | 3 (1,7) | 2 (1,6) | 6 (1,9) | <0,001 | 0,276 |
| Dexametasona | 842 (45,0) | 21 (4,7) | 264 (57,9) | 227 (64,9) | 131 (73,6) | 82 (65,6) | 117 (37,4) | <0,001 | 0,501 |
| Metilprednisolona | 316 (16,9) | 98 (21,8) | 108 (23,7) | 31 (8,9) | 14 (7,9) | 7 (5,6) | 58 (18,5) | <0,001 | 0,181 |
| Anakinra | 16 (0,9) | 0 (0,0) | 16 (3,5) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | <0,001 | 0,164 |
| Interferón beta | 11 (0,6) | 11 (2,4) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | <0,001 | 0,137 |
| Tocilizumab | 158 (8,4) | 38 (8,5) | 62 (13,6) | 6 (1,7) | 22 (12,4) | 12 (9,6) | 18 (5,8) | <0,001 | 0,151 |
| Amoxicilina | 155 (8,3) | 52 (11,6) | 32 (7,0) | 9 (2,6) | 6 (3,4) | 20 (16,0) | 36 (11,5) | <0,001 | 0,150 |
| Azitromicina | 271 (14,5) | 253 (56,3) | 7 (1,5) | 4 (1,1) | 1 (0,6) | 2 (1,6) | 4 (1,3) | <0,001 | 0,668 |
| Ceftriaxona | 632 (33,8) | 275 (61,2) | 59 (12,9) | 106 (30,3) | 47 (26,4) | 47 (37,6) | 98 (31,3) | <0,001 | 0,364 |
| Levofloxacino | 908 (48,5) | 61 (13,6) | 334 (73,2) | 215 (61,4) | 126 (70,8) | 67 (53,6) | 105 (33,5) | <0,001 | 0,473 |
UCI: Unidad de Cuidados Intensivos; VIH: virus de la inmunodeficiencia humana.
En el análisis por las diferentes ondas epidémicas (tabla 1), se incluyeron 449 ingresos en la primera onda (24,0%), 456 en la segunda (24,4%), 350 en la tercera (18,7%), 178 en la cuarta (9,5%), 125 en la quinta (6,7%) y 313 en la sexta (16,7%). En la figura 1 se muestra la curva epidémica de los casos confirmados ingresados en el HUS a lo largo del periodo estudiado. Pareció observarse una asociación de intensidad leve con respecto a la distribución del sexo de los pacientes ingresados y las ondas analizadas (p<0,001; VCramer=0,09), encontrándose una menor proporción de hombres en la sexta onda (45,3%) frente al resto, que oscilaron entre el 56 y el 61%. La diferencia observada de promedios de edad entre ondas también pareció ser poco usual o probable asumiendo como verdadera la hipótesis nula de igualdad de promedios en la edad entre las 6 ondas (p<0,001) aunque con un tamaño del efecto pequeño (ξ=0,02). El promedio de edad más pequeño fue encontrado en la cuarta onda (Mdn=62 [51-73]) y el mayor en la quinta (Mdn=74 [51-87]). El porcentaje de fallecimientos varió de forma leve entre los diferentes periodos, desde un 5,6% en la cuarta onda a un 14,1% en la tercera (p<0,001, VCramer=0,08). Asimismo, el promedio de los días de ingreso fue solo menor en la sexta ola (Mdn=7 [4-12]) en comparación con la tercera (Mdn=8 [6-13]; p=0,03) y la primera (Mdn=9 [6-13]; p<0,001). Reingresaron mayor porcentaje de pacientes en la quinta y sexta onda (10,4 y 7,3%, respectivamente) y un menor porcentaje lo hicieron en la primera (2,7%) (p<0,001; VCramer =0,10) aunque no hay una tendencia ascendente en el tiempo. Las frecuencias observadas entre las distintas olas y haber ingresado en UCI no parecieron ser demasiado infrecuentes (p=0,062) asumiendo la hipótesis nula de independencia entre estas 2 variables como verdadera, oscilando los porcentajes de ingreso en dicha unidad entre 4,2% (sexta onda) y 10,9% (tercera onda).
En relación a las comorbilidades de los pacientes incluidos en el estudio, se ha encontrado asociación de intensidad leve entre las ondas epidémicas y padecer hipertensión arterial (44,9% en la tercera onda frente a 26,5% en la sexta; p<0,001; VCramer= 0,129), diabetes mellitus (32,8% y 32,6% en la quinta y tercera onda, respectivamente, frente a 23,2% en la primera; p<0,001; VCramer= 0,08), obesidad (22,5% en la cuarta onda frente a 10,5% en la sexta; p<0,001; VCramer= 0,107) y enfermedad renal crónica (30,0% en la tercera onda frente a 12,9% en la cuarta; p<0,001; VCramer= 0,122). Por otro lado, las frecuencias observadas de las diferentes ondas en los pacientes con respecto a padecer enfermedad respiratoria crónica, enfermedad neurológica, cirrosis, infección por VIH e inmunodepresión, no obtuvieron probabilidades menores de 0,05 asumiendo como verdadera cada hipótesis nula de independencia.
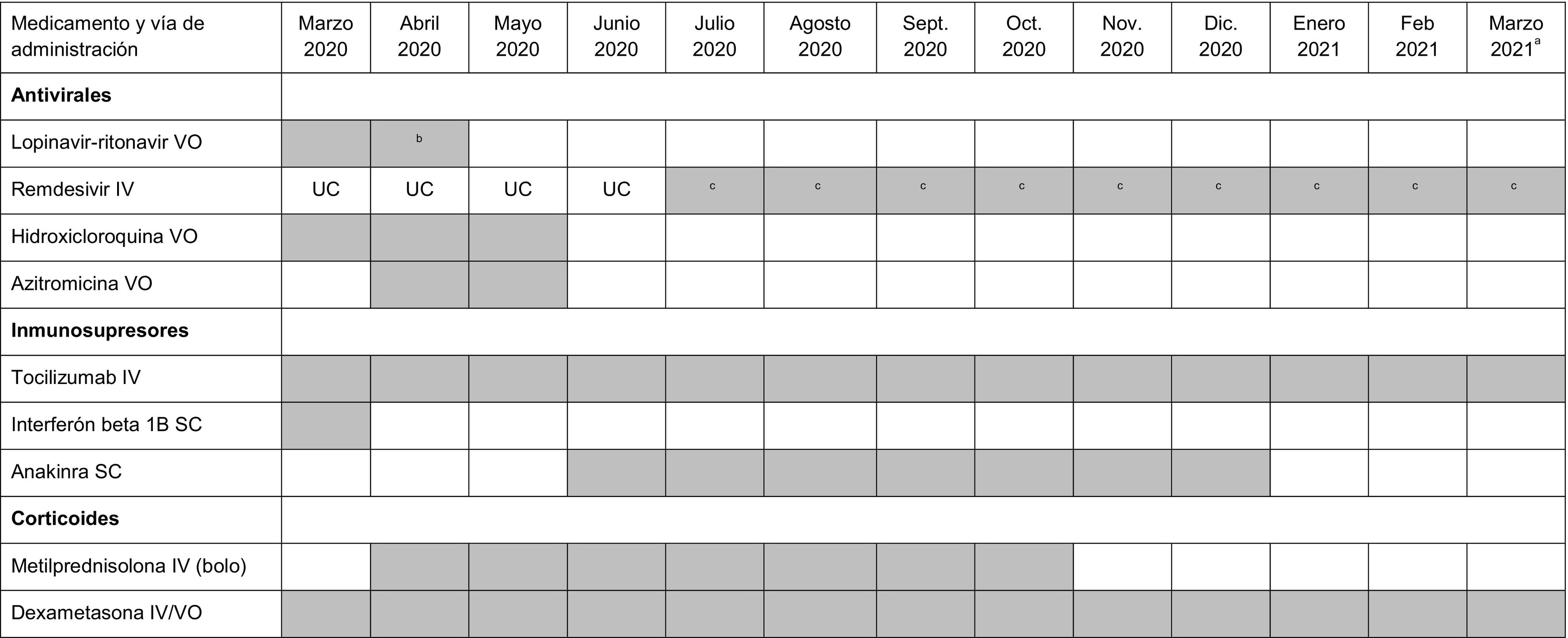
En la tabla 1 se muestra el cambio observado en los fármacos utilizados en cada onda epidémica para el tratamiento de la infección aguda por SARS-CoV-2. Se observaron posibles asociaciones entre la prescripción de los 12 tratamientos estudiados y las ondas epidémicas en las que se usaron (p<0,001) siendo la mayoría de intensidad moderada-alta salvo la amoxicilina, anakinra, metilprednisolona, tocilizumab e interferón que reportaron una fuerza de asociación débil (VCramer=0,150, VCramer=0,164, VCramer=0,181, VCramer=0,151, VCramer=0,137, respectivamente). En la primera onda epidémica se utilizaron fundamentalmente ceftriaxona (61,2%), azitromicina (56,3%), hidroxicloroquina (58,6%), metilprednisolona (21,8%), lopinavir-ritonavir (17,4%) e interferón (2,4%), disminuyendo su uso en los siguientes periodos e incluso cesando su utilización, como en el caso del interferón. Por el contrario, amoxicilina y dexametasona se prescribieron en mayor frecuencia en las ondas sucesivas, con una frecuencia máxima del 16,0% de uso de amoxicilina en la quinta onda y del 73,6% de dexametasona en la cuarta onda. Remdesivir y anakinra se usaron fundamentalmente en el tratamiento de los pacientes en la segunda onda (13,8 y 3,5%, respectivamente), y levofloxacino entre la segunda y la quinta con mayor porcentaje con respecto a la primera y la sexta (VCramer=0,473). Con respecto a tocilizumab, se utilizó en mayor proporción en los pacientes de la segunda (13,6%) y la cuarta onda (12,4%). La evolución cronológica de la utilización de los diferentes tratamientos antivirales e inmunomoduladores utilizados en el hospital según la evidencia disponible en cada momento temporal se describe en la tabla 2. En nuestro hospital no se emplearon tratamientos basados en los anticuerpos monoclonales contra la COVID-19 (sotrovimab, casivirimab/imdevimab y cilgavimab/tixagevimab). Tampoco se incluyen fármacos antivirales que no aplican al estudio, como nimatrelvir/ritonavir (solo para uso de paciente ambulatorio) o molnupinavir (no autorizado en el momento del estudio).
Evolución cronológica de los tratamientos antivirales, inmunosupresores y corticoides utilizados en el hospital
VO: vía oral; IV: vía intravenosa; SC: vía subcutánea; UC: uso compasivo.
a Desde marzo 2021 hasta la finalización del estudio (marzo 2022).
b Utilización solo en UCI (Unidad de Cuidados Intensivos).
c Restricciones de uso.
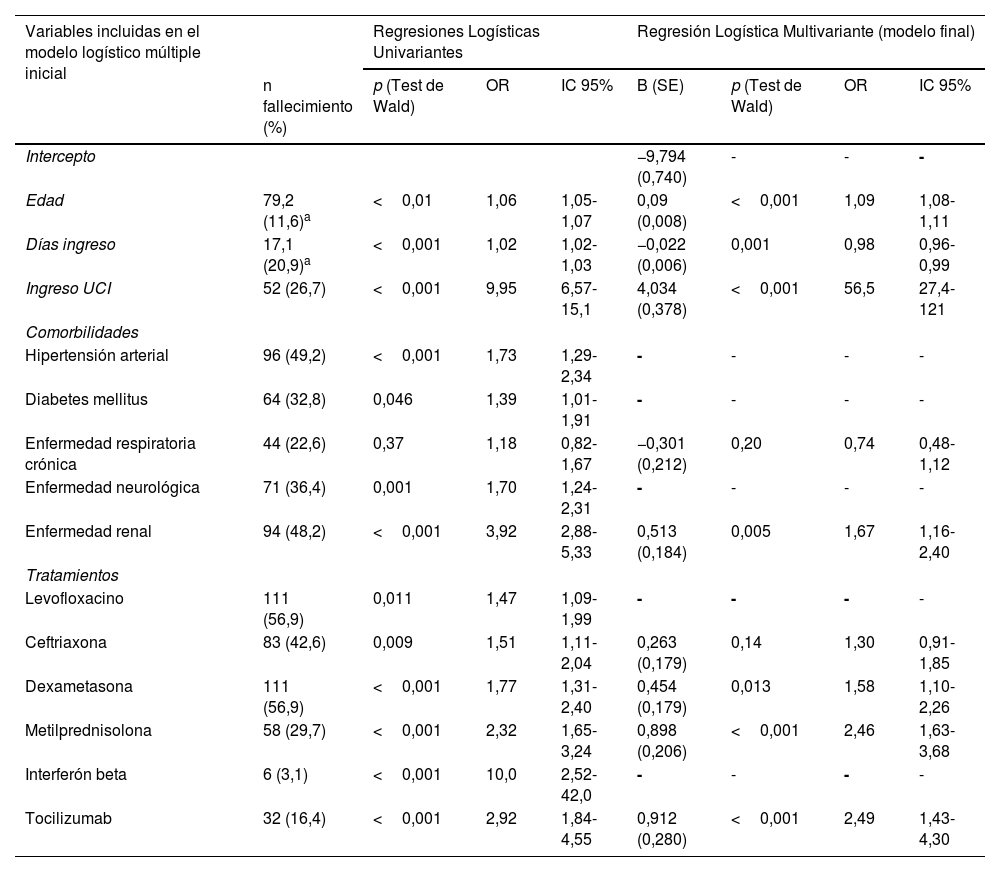
Tras el análisis univariante de cada una de las 28 variables recogidas, un total de 13 presentaron frecuencias observadas con respecto a fallecer, cuyas probabilidades parecieron ser menores de 0,05; asumiendo como verdaderas las hipótesis nulas de independencia. Del mismo modo, se encontraron intervalos de OR que no comprendían el valor 1 (tabla 3). Las 7 variables que finalmente predijeron la mortalidad en el modelo de regresión logística multivariante (AICcorregida= 897,4; BIC= 957,6) fueron el ingreso en la UCI, como la variable con mayor OR del modelo manteniendo a nivel fijo el resto de variables ya incluidas (OR 56,5; IC 95%: 27,4-121), la enfermedad renal crónica (OR 1,67; IC 95%: 1,16-2,40), la edad (OR 1,09; IC 95%: 1,08-1,11), los días de ingreso (OR 0,98; IC 95%: 0,96-0,99), la enfermedad respiratoria crónica (OR 0,70; IC 95%: 0,48-1,12), el tratamiento con tocilizumab (OR 2,49; IC 95%: 1,43-4,30), metilprednisolona (OR 2,46; IC 95%: 1,63-3,68) y dexametasona (OR 1,58; IC 95%: 1,10-2,26).
Variables identificadas como factores de riesgo para mortalidad en el análisis multivariantea
| Variables incluidas en el modelo logístico múltiple inicial | Regresiones Logísticas Univariantes | Regresión Logística Multivariante (modelo final) | ||||||
|---|---|---|---|---|---|---|---|---|
| n fallecimiento (%) | p (Test de Wald) | OR | IC 95% | B (SE) | p (Test de Wald) | OR | IC 95% | |
| Intercepto | −9,794 (0,740) | - | - | - | ||||
| Edad | 79,2 (11,6)a | <0,01 | 1,06 | 1,05-1,07 | 0,09 (0,008) | <0,001 | 1,09 | 1,08-1,11 |
| Días ingreso | 17,1 (20,9)a | <0,001 | 1,02 | 1,02-1,03 | −0,022 (0,006) | 0,001 | 0,98 | 0,96-0,99 |
| Ingreso UCI | 52 (26,7) | <0,001 | 9,95 | 6,57-15,1 | 4,034 (0,378) | <0,001 | 56,5 | 27,4-121 |
| Comorbilidades | ||||||||
| Hipertensión arterial | 96 (49,2) | <0,001 | 1,73 | 1,29-2,34 | - | - | - | - |
| Diabetes mellitus | 64 (32,8) | 0,046 | 1,39 | 1,01-1,91 | - | - | - | - |
| Enfermedad respiratoria crónica | 44 (22,6) | 0,37 | 1,18 | 0,82-1,67 | −0,301 (0,212) | 0,20 | 0,74 | 0,48-1,12 |
| Enfermedad neurológica | 71 (36,4) | 0,001 | 1,70 | 1,24-2,31 | - | - | - | - |
| Enfermedad renal | 94 (48,2) | <0,001 | 3,92 | 2,88-5,33 | 0,513 (0,184) | 0,005 | 1,67 | 1,16-2,40 |
| Tratamientos | ||||||||
| Levofloxacino | 111 (56,9) | 0,011 | 1,47 | 1,09-1,99 | - | - | - | - |
| Ceftriaxona | 83 (42,6) | 0,009 | 1,51 | 1,11-2,04 | 0,263 (0,179) | 0,14 | 1,30 | 0,91-1,85 |
| Dexametasona | 111 (56,9) | <0,001 | 1,77 | 1,31-2,40 | 0,454 (0,179) | 0,013 | 1,58 | 1,10-2,26 |
| Metilprednisolona | 58 (29,7) | <0,001 | 2,32 | 1,65-3,24 | 0,898 (0,206) | <0,001 | 2,46 | 1,63-3,68 |
| Interferón beta | 6 (3,1) | <0,001 | 10,0 | 2,52-42,0 | - | - | - | - |
| Tocilizumab | 32 (16,4) | <0,001 | 2,92 | 1,84-4,55 | 0,912 (0,280) | <0,001 | 2,49 | 1,43-4,30 |
UCI: Unidad de Cuidados Intensivos.
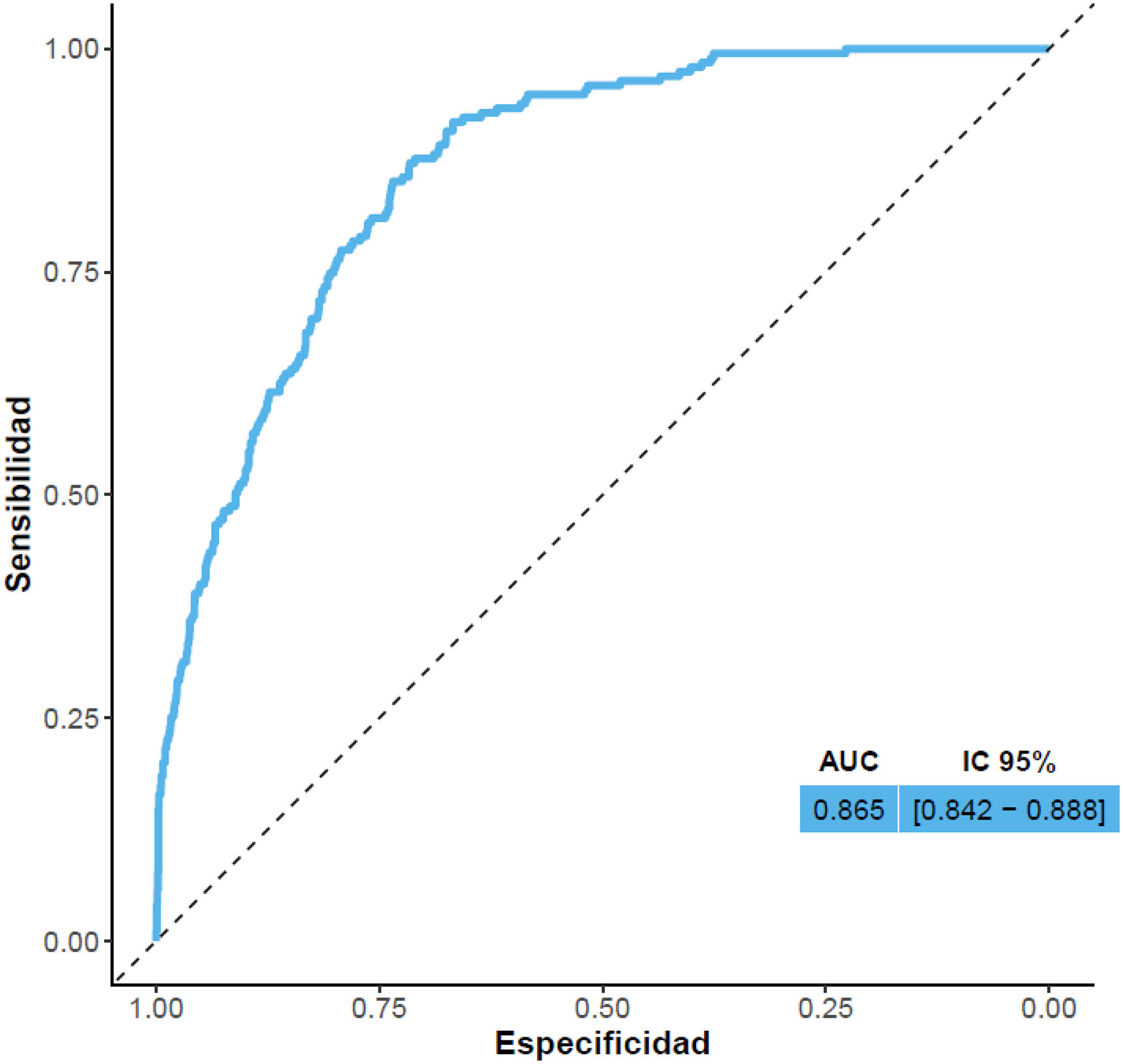
En cuanto a la bondad de ajuste, el modelo final consigue explicar un 36,28% de la variancia (seudoR2 Nagelkerke). Además, según la prueba de bondad de ajuste de Hosmer y Lemeshow, lo esperado bajo el modelo final parece ajustarse a los datos observados (p=0,211).También se obtuvo un estadístico C= 0,865 como medida de discriminación (equivalente al AUC o área debajo de la curva ROC) (fig. 2), una sensibilidad=0,866, una especificidad=0,717, una precisión=0,733 (IC 95%: 0,712 – 0,754) (precisión balanceada = 0,791), un coeficiente Kappa=0,297, un valor predictivo positivo= 0,273 y un valor predictivo negativo=0,977 (punto óptimo de punto de corte=0,095 con el máximo índice Youden=0,588).
DiscusiónEn nuestro estudio se muestran las características clínicas principales de los pacientes hospitalizados por COVID-19, con una media de edad de 65,8 años y predominantemente varones, acorde a otros estudios similares en la población española3,6,10, pero superior a las descritas en otras publicaciones de ámbito internacional11–13. Con respecto a las comorbilidades de los pacientes incluidos, su prevalencia en nuestro estudio es similar a la descrita en otras series publicadas en España3,10,14, si bien en nuestra población la enfermedad renal y respiratoria crónicas fueron más frecuentes. Todo lo anterior podría explicarse por la población de referencia de nuestro centro, que procede de un área geográfica con una alta ruralidad, de edad avanzada y con una alta tasa de institucionalización.
El porcentaje de pacientes que fallecieron durante el ingreso es nuestro estudio fue de un 10,4%, dato inferior a los publicados anteriormente en nuestro medio3,6, confirmándose variabilidad entre las ondas epidémicas, aspecto no estudiado en estas series. Esta menor mortalidad puede ser debida a que hasta un 4,4% de los pacientes fueron trasladados a otros centros de mayor complejidad al ser el nuestro un hospital primario. También existieron traslados al hospital monográfico de la Comunidad de Madrid HEEIZ (Hospital de Emergencias Enfermera Isabel Zendal), pero sus características exigían estabilidad del paciente, así que esto no contribuye a explicar la menor mortalidad. La proporción de pacientes que requirieron ingreso en la UCI (8,3%) ha sido globalmente superior a publicaciones recientes10. Una posible explicación de este mayor porcentaje de ingreso podría ser que nuestro centro no disponía de UCRI (Unidades de Cuidados Respiratorios Intermedios). Estas unidades son áreas hospitalarias con dotación técnica y humana suficiente para proporcionar una vigilancia y cuidados asistenciales con nivel inferior a las UCI, pero muy superior a las áreas convencionales de hospitalización.
Estudios previos han comparado las ondas epidémicas15–17, pero no se han encontrado trabajos que analicen las diferencias clínicas, de tratamiento y de factores de riesgo de mortalidad en nuestro país en cada uno de los periodos. Lee et al.11 analizaron una muestra de 3.261 pacientes hospitalizados en Japón durante las 5 primeras ondas epidémicas, encontrando, como en nuestro estudio, diferencias en la edad y el número de días de hospitalización de los pacientes entre los periodos estudiados. Sin embargo, en nuestra población los pacientes con menor edad se detectaron en la cuarta onda, a diferencia de Lee et al., que fue en la quinta. Esto puede estar influido por los traslados de pacientes más jóvenes, con menor comorbilidad, en las primeras ondas epidémicas al HEEIZ.
Con respecto a la estancia hospitalaria, fue menor en la sexta onda, correspondiente a la infección por la variante ómicron, que se asocia a una mayor transmisibilidad y evasión de la respuesta inmune, pero también a una disminución de la gravedad de la infección18. Llama la atención que la mortalidad media del 11,3% en esta sexta onda epidémica es la segunda mayor y ello podría explicarse por la edad más avanzada de los pacientes en esta onda. En dicha onda se registra el menor porcentaje de pacientes ingresados en UCI de todo el periodo, y esto sí está de acuerdo con la menor gravedad de la infección en ese momento.
En nuestra serie, la mayor tasa de fallecimientos se produjo en la primera y en la tercera onda y fue disminuyendo con el paso de los meses, gracias a la introducción de la vacunación en enero del año 2021, a la disminución de la gravedad de la infección y al avance y un mejor manejo de los tratamientos disponibles19. Asimismo, las comorbilidades presentadas por el paciente fueron menores en la sexta onda de ómicron, frente a las precedentes de alfa y delta, que demostraron una mayor severidad.
El tratamiento de la infección por SARS-CoV-2 experimentó cambios rápidos durante la pandemia. Se propusieron fármacos para evitar la progresión de la enfermedad que actuaban sobre el curso bifásico de la misma. En la primera fase de replicación vírica activa se emplearon los antivirales y en la segunda fase de respuesta hiperinflamatoria se utilizaron los inmunosupresores como tocilizumab, interferón, anakinra o corticoides20. El ensayo clínico abierto de Gautret et al.21 fue el que supuso la introducción precoz en la terapéutica de la hidroxicloroquina con azitromicina, a pesar del limitado número de pacientes. En nuestro estudio observamos cómo en las primeras ondas epidémicas predominó la utilización de antiobioterapia (ceftriaxona, fundamentalmente), así como la hidroxicloroquina, decayendo su uso en ondas posteriores tras posicionarse las guías clínicas en contra de su uso7,8. Lo mismo ocurrió con lopinavir-ritonavir, que inicialmente se consideró tratamiento de elección por su potencial efecto sobre la replicación vírica, desestimándose su utilización con el tiempo al demostrarse ausencia de evidencia en la reducción del riesgo de mortalidad22. La alta frecuencia de reacciones adversas alertadas con lopinavir-ritonavir condicionó también la disminución de su uso23. Estos resultados son consistentes con las revisiones publicadas acerca de los tratamientos utilizados durante la primera onda de la pandemia en España, en las que se muestra predominio de utilización de lopinavir-ritonavir, hidroxicloroquina, tocilizumab y azitromicina23,24. Posteriormente se confirmó que hidroxicloroquina, lopinavir-ritonavir e interferón no mostraron beneficios en la mortalidad, tiempo hasta el inicio de la ventilación o duración de la estancia25, por lo que dejaron de usarse. Con respecto a remdesivir, fue el primer antiviral autorizado para el tratamiento de la COVID-19 en la Unión Europea en julio del año 202026. En nuestros pacientes fue utilizado de forma predominante, coincidiendo con la segunda onda, siendo su uso muy limitado en ondas sucesivas, debido en parte a las restricciones de uso del fármaco.
Por otra parte, encontramos que la utilización de corticoides ha sido paralela a la aparición de información sobre su eficacia en los sucesivos estudios. Inicialmente se empleó empíricamente metilprednisolona y fue sustituida por dexametasona al conocerse los datos del estudio RECOVERY19. Junto con la dexametasona, el tocilizumab también ha demostrado en diversos metaanálisis disminuir la mortalidad por todas las causas a los 28 días27.
Los factores de riesgo asociados a la mortalidad de la infección por SARS-CoV-2 de nuestra serie en el análisis multivariante fueron la edad, el ingreso en UCI y días totales de ingreso, la insuficiencia renal crónica y la utilización de esteroides y tocilizumab. Estos resultados son similares a los publicados en otras series españolas6,14 y son consistentes con otros estudios que identifican fundamentalmente la edad como un importante predictor de la mortalidad10,12, así como la enfermedad renal crónica14. En nuestra serie llama la atención que el número de días de ingreso se asocia con una disminución de la mortalidad. Una explicación podría ser que estancias breves se acompañaran de mortalidad precoz y por tanto la menor estancia fuera un marcador de enfermedad mortal en el corto plazo. Los pacientes tratados con corticoterapia (metilprednisolona y dexametasona) parecieron presentar mayor riesgo de muerte, datos similares a los encontrados en la literatura24. Esto puede explicarse, en primer lugar, porque los esteroides fueron el tratamiento de elección en los pacientes de mayor gravedad, y por tanto la asociación con la mortalidad no es de causalidad, sino que se comportan como marcadores del enfermo grave o crítico. Por otro lado, los pacientes que reciben corticoterapia tienen un mayor riesgo de desarrollar complicaciones infecciosas y metabólicas, lo que también contribuiría a una mayor mortalidad. Aunque en un primer momento hubo controversias en la utilización de los corticoides, finalmente estos demostraron una reducción de la mortalidad28, aunque este beneficio no se ha visto en los pacientes sin requerimientos de oxígeno27. Los pacientes tratados con tocilizumab se asociaron también en nuestro estudio a un mayor riesgo de mortalidad debido, al igual que la corticoterapia, a un uso predominante en los pacientes con mayor gravedad.
La variabilidad explicada por el modelo fue del 35,35% superior a otros modelos similares reportados en España29, y con un área bajo la curva similar a la obtenida. En la mayor parte los estudios publicados que estiman los valores ROC obtienen también escenarios favorables con valores superiores a 0,730, si bien no puede descartarse que este hallazgo pueda deberse a un sesgo de publicación.
La fortaleza de nuestro estudio radica en que cuenta con una amplia muestra de pacientes ingresados y ha analizado las características clínicas y terapéuticas por ondas epidémicas, encontrando diferencias en las mismas, a diferencia de otros artículos similares publicados en España. Asimismo, se presenta un análisis exhaustivo de los fármacos más frecuentemente utilizados en las diferentes ondas, mostrando unos resultados novedosos con respecto a lo publicado hasta el momento en nuestro país. No obstante, también cuenta con una serie de limitaciones. En primer lugar, al tratarse de un estudio observacional retrospectivo basado en el registro electrónico en las historias clínicas, parte de la información puede no estar disponible. Asimismo, dado el tipo de estudio realizado, el cual carece de una selección aleatoria de pacientes, asumimos que la incertidumbre es mayor a la que reflejan los intervalos de confianza al 95%. En segundo lugar, no se contemplaron los síntomas del paciente ni hallazgos radiológicos o de laboratorio, así como las complicaciones derivadas de la infección, que podría haber ayudado a la caracterización de los pacientes. Con respecto a los tratamientos iniciados, se recogieron los principios activos, pero no sus dosis ni su momento de inicio, lo que claramente puede modificar la evolución de la enfermedad. En cuanto a la estadística utilizada, parece conveniente señalar las posibles limitaciones o peligros interpretativos del valor de p, especialmente en escenarios como el de este estudio, donde no pueden asegurarse supuestos asumidos por las técnicas estadísticas como el muestreo aleatorizado simple, entre muchos otros31–33. Por ello, invitamos a interpretar con cautela estos y otros resultados obtenidos con estadística frecuentista. Por último, la validez externa del estudio queda limitada al incluir datos solamente de un centro hospitalario y aplicado a un periodo específico de pandemia, si bien nuestro estudio abarca un periodo de tiempo superior a la mayoría de estudios previos que incluyen menos ondas pandémicas.
La optimización de los tratamientos disponibles, su indicación y momento de inicio, un mayor conocimiento de los factores de riesgo de la enfermedad, el indudable beneficio de la vacunación masiva y la disminución de la severidad de las nuevas variantes ha permitido mejorar sustancialmente el pronóstico de la enfermedad de los pacientes ingresados a lo largo de las ondas epidémicas sufridas. Los efectos beneficiosos de fármacos como remdesivir, que acorta días de hospitalización, y la dexametasona y el tocilizumab, que han demostrado disminución en la mortalidad, han hecho que se posicionen como pilares del tratamiento en la actualidad. Los hallazgos obtenidos permitirán en un futuro a los profesionales sanitarios identificar los principales de riesgo de mortalidad de los pacientes con infección por SARS-CoV-2, optimizando su manejo y tratamiento. Asimismo, constituye una herramienta para los gestores clínicos de cara a la implementación de nuevos planes estratégicos para una mejor coordinación de los procesos asistenciales, en el caso de futuros escenarios pandémicos.
Responsabilidades éticasEl presente estudio fue aprobado por el Comité de Ética de la Investigación con Medicamentos (CEIM) del Hospital General Universitario Gregorio Marañón y se llevó a cabo en conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki).
FinanciaciónLos autores declaran no haber recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.