La situación económica hace necesario optimizar los recursos ajustando el gasto farmacéutico. La citicolina constituyó (datos de 2011) el 10° principio activo en cuanto a mayor importe facturado. Tiene aprobada su indicación en ictus (fase aguda y subaguda) y en traumatismo craneoencefálico, no en deterioro cognitivo asociado a la edad, aunque se presume su uso mayoritario para esta indicación.
ObjetivosEvaluar las condiciones de uso de la citicolina en el Área de Salud de Tenerife, con el propósito de detectar desviaciones respecto a las indicaciones recogidas en la Ficha Técnica y a la pauta de prescripción, haciendo énfasis en el análisis de su uso en demencias donde no tiene actualmente indicación ni hay evidencias que la sustenten.
MétodoEstudio observacional transversal de prescripción-indicación. Muestra de 680pacientes segmentados por hospital de referencia (error+5%; p=0,5; IC: 0,95), a partir de los 4.036 con alguna receta de citicolina facturada durante agosto-octubre de 2011 (obtenido del programa de facturación de recetas, Farmacanarias).
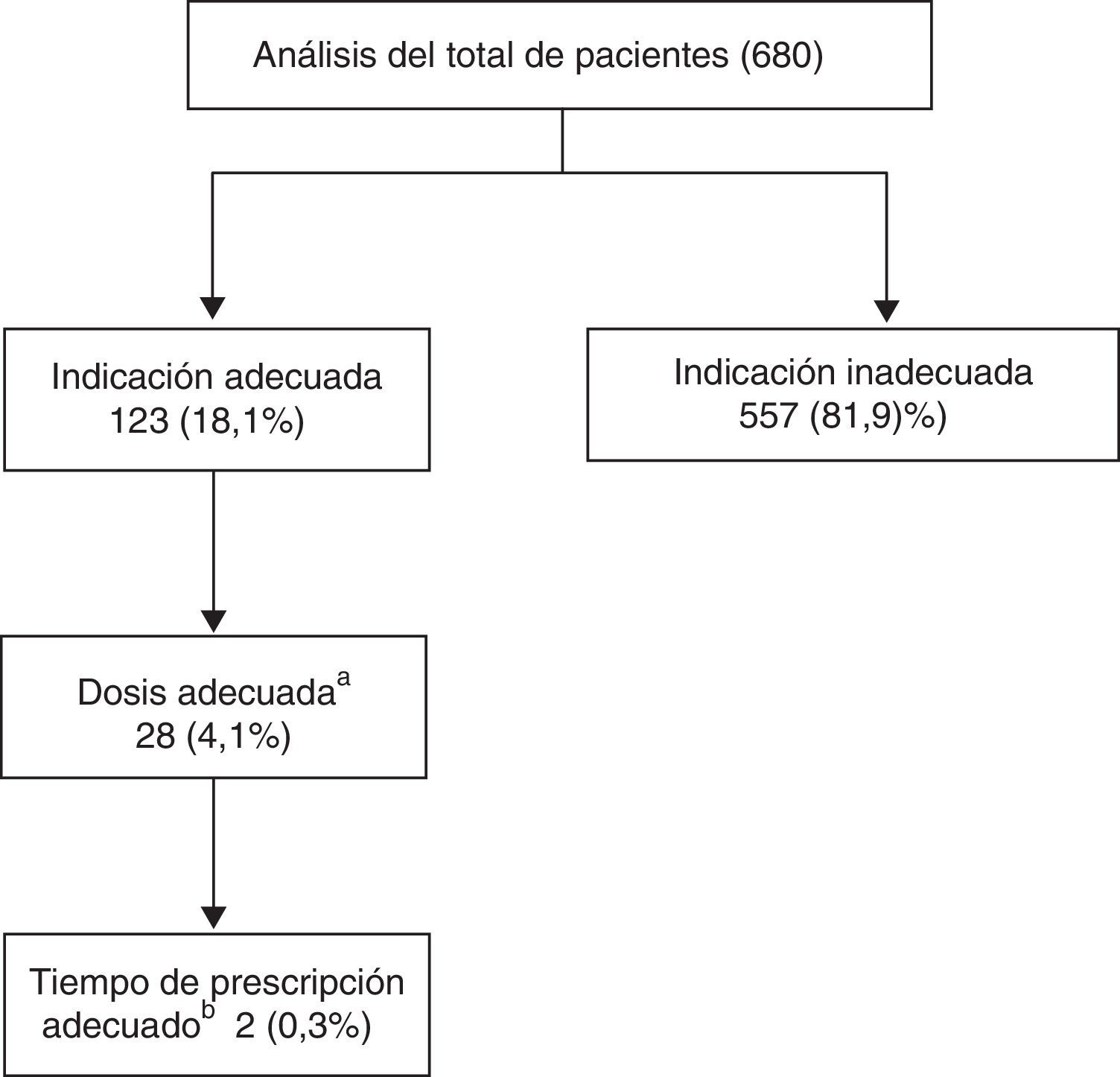
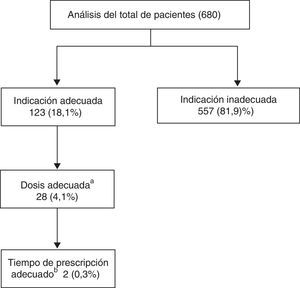
ResultadosSe encontró que 123pacientes (18,1%) presentaron una indicación adecuada. Al incluir la pauta de prescripción, 28pacientes (4,1%) presentan indicación y dosis adecuadas, y en solo 2pacientes (0,2%) se halló indicación, dosis y duración adecuadas.
Conclusiones«La prescripción-indicación correcta» de citicolina es inadecuada en la práctica totalidad de los pacientes en estudio. Es necesario tomar medidas de impacto a corto y largo plazo con el objetivo de optimizar la prescripción, que mejoraría la seguridad del paciente, reduciendo posibles interacciones y la aparición de posibles efectos adversos, y la eficiencia, promoviendo un importante ahorro económico.
The economic situation has made it necessary to optimize resources by adjusting the pharmaceutical expenditure. Citicoline was (2011) the 10th drug by rank of billed amount. Its approved indications are stroke (acute and sub-acute) and head injury, but not cognitive decline associated with age, the presumed indication for most of its use.
ObjectivesTo assess the conditions of use of citicoline in the Health Area of Tenerife, in order to detect deviations from the indications of use as stipulated in the prescribing information sheet and the pattern of prescription, with emphasis on the analysis of its use in dementia where currently it has no indication or evidence to support it.
MethodCross-sectional study of prescription-indication. A 680patient sample, segmented by reference hospital (error±5%; CI: 0.95%; P=0.5) was taken from the 4036patients with a prescription of citicoline billed during august-october 2011 (obtained from the prescription database program, Farmacanarias).
ResultsWe found that 123patients (18.1%) had an appropriate indication. By including the prescription regimen, 28patients (4.1%) had adequate indication and dose levels, and in only 2patients (0.2%) an appropriate indication, dosage and duration were found.
Conclusions“The correct prescription-indication” of citicoline is inappropiate in almost all patients studied. Impact actions are needed in order to optimize prescription, improve patient safety by reducing potential interactions, and the occurrence of adverse effects, and improve efficiency by promoting savings.
La citicolina (citidina 5’-difosfocolina) es un psicoestimulante, neuroprotector y nootrópico. Dentro de sus propiedades farmacológicas cabe destacar que es un intermediario en la síntesis de fosfatidilcolina a partir de la colina, que estimula la biosíntesis de fosfolípidos a nivel de la membrana neuronal, que posee propiedades antiedema y que puede atenuar la progresión del daño isquémico celular al suprimir la liberación de ácidos grasos libres.
Solo está comercializada en algunos países de la Unión Europea, entre ellos España. Sin embargo en muchos otros (Reino Unido, Alemania, Irlanda, Bélgica, Holanda, Luxemburgo o Suecia) no lo está, y tampoco existe un sustituto terapéutico. Tampoco está comercializada en Estados Unidos1.
Actualmente está incluida dentro de los fármacos de utilidad terapéutica baja2 (UTB). El consumo en nuestra comunidad autónoma es muy importante. Así, en 2011 fue el 10° principio activo en cuanto a mayor importe facturado a través de receta médica del Sistema Nacional de Salud. Concretamente, supuso 6.632.104,12€3.
En el Área de Salud de Tenerife, en 2011 se consumieron 2.534.791,25dosis diarias definidas (DDD) de citicolina (400mg), con un importe facturado de 2.854.047,84€ y un gasto final en dicha área de 2.701.524,15€ (una vez descontada la aportación del paciente). El 87% de las DDD dispensadas correspondieron a citicolina de 1.000mg, el 11,47% a citicolina de 500mg y el 0,94% a citicolina de 100mg3.
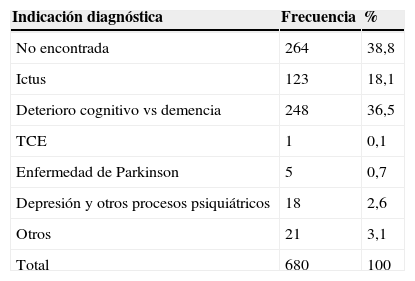
Las indicaciones terapéuticas de los productos comercializados en nuestro país, según la Ficha Técnica (FT), son: «trastornos neurológicos y cognitivos asociados a los accidentes cerebrovasculares en fase aguda y subaguda y a traumatismos craneales»4. No tiene indicación aprobada para el manejo de los trastornos cognitivos asociados a las demencias, si bien, probablemente además de en el ictus, se haya venido usando mayoritariamente para esta indicación.
En relación con su papel en el ictus, la evidencia disponible a fecha de inicio del trabajo avala que podría presentar un discreto efecto beneficioso sobre la recuperación neurológica (no en cuanto a mortalidad) a los 3meses cuando se administra en las primeras 24h y durante 6semanas en ictus moderado y grave, siendo la única dosis que muestra eficacia la de 2.000mg/día5-15. En espera de nuevos estudios que confirmen este beneficio, algunas guías actuales de práctica clínica16,17 no recogen esta indicación, aunque sí aparece una mención a su posible beneficio en la guía SIGN-10818.
El papel del fármaco tras un traumatismo craneal que recoge la FT aparece recogido en algunos estudios19-21.
En cuanto a los trabajos disponibles en deterioro cognitivo y demencias, cabe mencionar algunos estudios22-25 y una revisión sistemática Cochrane26 que incluye 14ECA hasta 2004. En dicha revisión se analiza la eficacia de la citicolina en el deterioro cognitivo de distinto grado. Parece evidenciarse un cierto beneficio en la memoria, conducta e impresión de cambio global a medio y corto plazo (no de la atención) sobre todo en pacientes con déficit cognitivos asociados a trastornos cerebrovasculares. Sin embargo, estos estudios presentan muchas limitaciones referentes al tiempo de duración de los mismos (salvo un ECA, el resto inferior a 3meses), dosis empleadas, vías de administración, criterios de inclusión y metodología. El único ensayo a 12meses no demostró beneficio de la citicolina vía oral en el manejo de la demencia vascular (DV). Por otra parte, no hay estudios disponibles que evalúen la citicolina en la enfermedad de Alzheimer u otras demencias. En la Guía de Práctica Clínica del Sistema Nacional de Salud no se recomienda el uso de citicolina en el tratamiento de la DV.
El presente estudio se plantea por el importe facturado de citicolina en nuestra comunidad autónoma (importante impacto económico) y por la percepción de una sobreutilización de la misma en condiciones de poca efectividad y eficiencia. Ello implicaría un gasto farmacéutico injustificado, además de posibles problemas de seguridad en determinados pacientes como puedan ser los polimedicados, que haría necesario valorar medidas correctoras, tanto a nivel formativo (elaboración y difusión de información terapéutica sobre uso de UTB) como regulador (medidas restrictivas como justificantes y visado), medidas pertinentes a fin de optimizar los recursos ante cualquier escenario económico, pero especialmente en el actual.
Se pretende evaluar:
- 1.
Las condiciones de uso de citicolina en nuestra Área de Salud.
- 2.
Detectar posibles desviaciones respecto a las indicaciones de uso recogidas en su FT, haciendo hincapié en el análisis de su uso en las demencias donde no tiene actualmente la indicación en FT ni hay evidencia que sustente dicha utilización.
Como objetivo específico se establece evaluar la adecuación de la prescripción-indicación de los pacientes tratados con citicolina en nuestra Área de Salud, desagregando el análisis por origen de la prescripción: atención primaria (AP) o atención especializada (AE); ámbito de actividad del prescriptor: público o privado, y centro hospitalario de referencia del paciente.
Material y métodosEl estudio se circunscribe al Área de Salud de Tenerife, que abarca la isla en su totalidad, con una población adscrita de 814.055usuarios, de los cuales el 14,9% superan los 65años y que en tan solo 6años, de acuerdo con una proyección del Instituto Canario de Estadística, pasarán a representar el 16,9%.
El diseño es observacional transversal de prescripción-indicación27-32, a partir de los 4.036pacientes con alguna receta de citicolina facturada en el Área de Salud, durante agosto-octubre de 2011 (obtenido del programa de facturación de recetas del SCS, Farmacanarias). Se selecciona una muestra de 680pacientes, 336 con centro de referencia Hospital Universitario Nuestra Señora de la Candelaria (HUNSC) y 344 con centro de referencia Hospital Universitario de Canarias (HUC) (muestra para poblaciones finitas con un mismo hospital de referencia: error±5%; p=0,5; IC: 0,95). Para lograr una mejor representatividad, la selección de pacientes se realizó del listado obtenido del programa Farmacanarias (que los muestra ordenados alfabéticamente), y luego se reagruparon por zonas básicas de salud y por cupo médico; la aleatorización se hizo eligiendo al primer paciente de cada cupo médico que aparece en dicho listado y al segundo que aparece, alternativamente de un cupo sí y de otro no, para evitar sesgos de selección por la elección del prescriptor. Se desecharon los pacientes que habían fallecido entre la obtención del listado y el día de la observación y se sustituyeron por el paciente inmediatamente siguiente en el listado.
En el estudio se recogieron, usando las bases de datos de la Historia Clínica Electrónica Drago-AP, las siguientes variables independientes:
- 1.
Relacionadas con el paciente:
- -
Edad.
- -
Sexo.
- 2.
Relacionadas con el prescriptor:
- -
Zona básica de salud.
- -
Inicio de la prescripción de citicolina. Se extrajo del Módulo de Prescripción de Drago-AP y de la revisión del histórico de visitas.
- -
Fecha de cierre, en caso de estar la prescripción cerrada el día de la observación.
- -
Código diagnóstico CIE al que se vinculó dicha prescripción. Cuando no se pudo relacionar claramente la prescripción con un motivo concreto, se asignó el 0.
- -
Indicación adecuada: se tomaron los códigos asociados al ictus y al traumatismo craneoencefálico (TCE).
- -
Dosis día, en miligramos.
- -
Prescripción aguda o indefinida: según dicho registro.
- -
Prescripción inducida por otros niveles de atención: según las hojas de seguimiento de las sucesivas visitas y/o peticiones de derivación a especializada. Solo se consideran inducidas si hay constancia clara en las historias. Si no, se asumían como no inducidas pese a que parte de ellas hubieran podido serlo.
- -
Especialidad médico inductor, neurólogo u otro especialista.
- -
Ámbito de trabajo del médico inductor, medicina pública o privada.
- -
Registro de la inducción en el apartado que para tal fin hay en el Módulo de Prescripción de Drago-AP y código inductor: centro de atención especializada (CAE) o privado.
- -
Petición de derivación a AE, en caso de registro de la inducción, bien por CAE o privado. Se extrajo conjuntamente del histórico de derivaciones a AE y del histórico de visitas.
- -
El criterio utilizado de prescripción-indicación correcta fue la indicación adecuada según la FT, dosis ≥2.000mg/día (dosis que se había mostrado eficaz en los trabajos publicados en pacientes con ictus)4-15 y duración de tratamiento ≤90días (según el beneficio en ictus cuando se utiliza en fase aguda y subaguda; es decir, inicio en las primeras 24h y durante 6semanas). Se decidió prolongar este período hasta los 90días, por ser este el ciclo o período máximo de autorización del Plan de Tratamiento de Drago-AP.
El análisis de resultados se ha realizado con el programa PASW Stadistics 18, utilizando medidas básicas de estadística exploratoria, en coherencia con los objetivos.
ResultadosLa edad media de los pacientes fue de 77años, y el porcentaje de mujeres, del 65,4%. En la indicación para ictus la edad media fue de 75años, con el 55% de mujeres, y para deterioro cognitivo y/o demencia, de 79años, con el 64,5% de mujeres. Con respecto a la pauta de tratamiento reflejada en la historia clínica, el 99,1% de los pacientes tenían prescrita citicolina como medicación indefinida. En la tabla 1 se presenta la distribución por indicación diagnóstica.
En el primer paso del análisis, para todos los pacientes del estudio se diferenció entre pacientes con y sin indicación adecuada, resultando 123 (18,1%) con indicación adecuada. A continuación, los pacientes con indicación adecuada se dividieron entre los que tenían o no prescrita una dosis ≥2.000mg/día, reduciéndose el número de pacientes con indicación y dosis adecuada a 28 (4,1%). Estos últimos se dividieron atendiendo a si tenían o no un tiempo de prescripción ≤90días, de manera que finalmente 2 (0,3%) pacientes del total de analizados cumplían la condición de indicación, dosis y tiempo de prescripción adecuados (fig. 1).
En el análisis que se hizo por subgrupos, los pacientes en los que no constó que hubiera inducción de tratamiento por AE fueron 484 (71,2% del total). De estos, 39 (8,1%) tenían una adecuada prescripción-indicación, y de ellos 5 (1%), una dosis de tratamiento ≥2.000mg/día. De los tratamientos pautados directamente por el médico de familia, uno (0,2%) cumplía la condición de indicación, dosis y tiempo de prescripción adecuados.
Los pacientes con prescripción inducida por especializada fueron 194 (28,5% del total). Hubo 2pérdidas, que correspondieron a pacientes en los que no se registró si la prescripción fue inducida o no (0,3% del total). De los 194pacientes, 84 (43,3%) tenían una adecuada prescripción-indicación, y de estos, 23 (11,9%) tenían una dosis de tratamiento ≥2.000mg/día. De los tratamientos pautados por AE, uno (0,5%) cumplía la condición de indicación, dosis y tiempo de prescripción adecuados.
En las tablas 2 y 3 se muestran, respectivamente, las prescripciones realizadas por neurología y las inducidas por especializada y ámbito de procedencia de esta (público, privado).
También se analizó si los pacientes cuya prescripción fue inducida por AE tenían el registro en el apartado correspondiente de Drago-AP. De los 194pacientes en los que la prescripción se verificó como claramente inducida por AE, solo en 50 (25,8%) se constató este registro.
Por otra parte, de los 484pacientes en los que la prescripción fue iniciada por el médico de familia, hubo 41 (8,5%) en los que se registró la inducción sin serlo. Y de ellos, en 10 (24,4%) se indicó además una especialidad inductora.
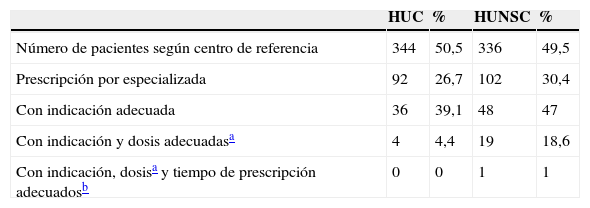
Finalmente, también se efectuó un análisis según los hospitales de referencia del Área de Salud de Tenerife al que pertenecían los pacientes (tabla 4).
Prescripción según centro hospitalario de referencia
| HUC | % | HUNSC | % | |
|---|---|---|---|---|
| Número de pacientes según centro de referencia | 344 | 50,5 | 336 | 49,5 |
| Prescripción por especializada | 92 | 26,7 | 102 | 30,4 |
| Con indicación adecuada | 36 | 39,1 | 48 | 47 |
| Con indicación y dosis adecuadasa | 4 | 4,4 | 19 | 18,6 |
| Con indicación, dosisa y tiempo de prescripción adecuadosb | 0 | 0 | 1 | 1 |
HUC: Hospital Universitario de Canarias; HUNSC: Hospital Universitario Nuestra Señora de la Candelaria.
Analizando los resultados por profesionales, se concluye que este fármaco se prescribe mayoritariamente en AP (71,2%), y que el grado de adecuación de la prescripción-indicación es bastante bajo (8,1%), siendo empleado en un perfil de paciente mujer con una media de 78años y con un diagnóstico de demencia o deterioro cognitivo.
Cuando la prescripción se realiza desde AE (28,5%), dicho grado de adecuación se eleva hasta el 43,3%, pudiendo estar relacionado con que los pacientes que atienden sean más seleccionados. No obstante, este dato empeora cuando se verifican dosis y duración de tratamiento, de manera que solo un paciente alcanzó todos los requisitos de adecuación (el otro paciente del estudio procedía de AP). Al mismo tiempo, el grado de adecuación de la indicación por neurología (origen mayoritario de las prescripciones iniciadas en AE: el 94,3% de ellas) se elevó hasta el 44,8%, empeorando hasta el 12% cuando se tenía en cuenta también una dosis ≥2.000mg/día.
Muchos de los tratamientos iniciados tanto en AP como en AE-neurología se registraron en la historia como medicación de uso indefinido, y en ausencia de un seguimiento óptimo del paciente se perpetuaron en el tiempo, manteniéndose muchos de ellos por meses y años hasta el momento de la observación.
Se pudo constatar la procedencia real de la prescripción desde AE (prescripción inducida) en 194pacientes (el 28,5% del total de pacientes). Sin embargo, solo se registró en el Módulo de Prescripción de Drago-AP en el 25,7% de ellos. Por tanto, habría que insistir en mejorar los registros en Drago-AP, pues ello mejoraría la calidad y la rapidez en la asistencia sucesiva que se da a los pacientes. Además, es importante señalar que no se pudo confirmar la percepción y la queja habitual que tiene el médico de AP de que casi todos los tratamientos son iniciados por AE.
Finalmente, pensando en un uso oportunista de esta funcionalidad de la historia clínica (atribuir a AE una prescripción registrando la inducción cuando realmente no es así), se encontró que en el 8,5% había registro de inducción sin que se pudiera confirmar.
Partiendo de la base de la validez de citicolina para las indicaciones que recoge su FT, este estudio pone de manifiesto que se está utilizando fuera de indicación en la mayoría de los pacientes. Solo en 2pacientes (0,3%) el tratamiento pudo considerarse adecuado según el criterio descrito como «prescripción-indicación correcta».
Teniendo en cuenta el volumen de prescripción inadecuada encontrado y extrapolando estos resultados a toda la comunidad autónoma, de haberse evitado esta, el impacto económico en términos de ahorro hubiese sido relevante (6.632.104,12€ importe facturado en 2011)3.
Creemos que es prioritario tomar medidas en relación con la utilización de este medicamento. Las más rápidas y de mayor alcance son las que implican un control por parte de la administración (visado, financiación selectiva…). Las que tienen que ver con informar a los profesionales son más lentas y de menor alcance. La ausencia de una prescripción-indicación correcta de citicolina, unido a la magnitud de la ineficiencia que evidencia este estudio, recomienda comenzar de inmediato por las primeras medidas señaladas. Aunque las que están a nuestro alcance y que se pretenden poner en marcha son las segundas, cuya ejecución y resultados pueden ser objeto de un desarrollo futuro.
Además, estudios recientes publicados en The Lancet33 y en The Journal of the American Medical Association (JAMA)34 cuestionan también el papel de la citicolina en el manejo del ictus en fase aguda y subaguda o tras un traumatismo craneal, respectivamente, que son las únicas indicaciones terapéuticas autorizadas por la Agencia Española de Medicamentos y Productos Sanitarios. Esto, unido a que en nuestro estudio prácticamente todas las prescripciones adecuadas, según el criterio establecido eran para ictus (solo se encontró un paciente con indicación para TCE), apoya la necesidad de analizar rigurosamente su situación actual de financiación a cargo del Sistema Público de Salud.
ConclusionesLa prescripción-indicación de la citicolina en AP en el Área de Salud de Tenerife es inadecuada en la práctica totalidad de los pacientes en estudio, cuando se contemplan conjuntamente la indicación y la pauta de tratamiento.
Analizados los resultados de acuerdo con el criterio de «prescripción-indicación correcta» que hemos utilizado, el resultado final, con independencia del origen de la prescripción, es de ineficiencia y de riesgo para la seguridad de determinados pacientes (polimedicados) al quedar pautada la citicolina como medicación indefinida.
Los resultados de este estudio ponen en evidencia la necesidad de tomar medidas de impacto con carácter prioritario a corto y largo plazo, con el objetivo de optimizar la prescripción de este principio activo evitando la actual situación de ineficiencia y, en consecuencia, promoviendo un importante ahorro económico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.