Se presenta el caso de un varón de 70años parcialmente dependiente para las actividades básicas de la vida diaria, con antecedentes personales de poliomielitis, ictus parcial de circulación anterior en 2017 y enfermedad de Crohn. Presentó el último ingreso en marzo de 2020 en el servicio de Digestivo por proctalgia y aumento de reactantes de fase aguda, donde fue diagnosticado de osteomielitis de sacro pautándose metronidazol y ciprofloxacino durante 6semanas.
La familia solicitó valoración domiciliaria a Atención Primaria por encontrarlo desorientado, con disartria y sensación de inestabilidad de 4días de evolución, sin otros síntomas.
En la exploración realizada por su médico de Atención Primaria en domicilio se objetivó palidez mucocutánea, sequedad de mucosas, cifras tensionales 100/70mmHg, saturación de oxígeno del 98% y temperatura de 36,5°C. En la exploración neurológica destacaban disartria y dismetría en la maniobra dedo-nariz. Marcha y Romberg no valorables. Sin otras alteraciones.
Debido a estos hallazgos, se decidió la derivación a Urgencias Hospitalarias. Durante su estancia en dicho servicio se solicitó analítica completa, en la que destacaron hemoglobina de 11,3g/dl, leucocitos 15.341mil/mm3 (13,48mil/mm3 neutrófilos), plaquetas 316.000μL y fibrinógeno 705mg/dl; el resto de los valores se encontraban dentro de parámetros normales.
Se solicitó además electrocardiograma y radiografía de tórax, siendo normales. Por último, se solicitó tomografía computarizada (TC) de cráneo destacando lesiones isquémicas crónicas córtico-subcorticales en región parietal posterior y frontal derechas, así como lesiones hipodensas en sustancia blanca periventricular y subcortical de ambos hemisferios cerebrales, de probable etiología isquémica degenerativa crónica. Se observaron también varios infartos lacunares crónicos en regiones talámicas y capsulo-ganglionares bilaterales, no objetivándose hallazgos valorables en fosa posterior.
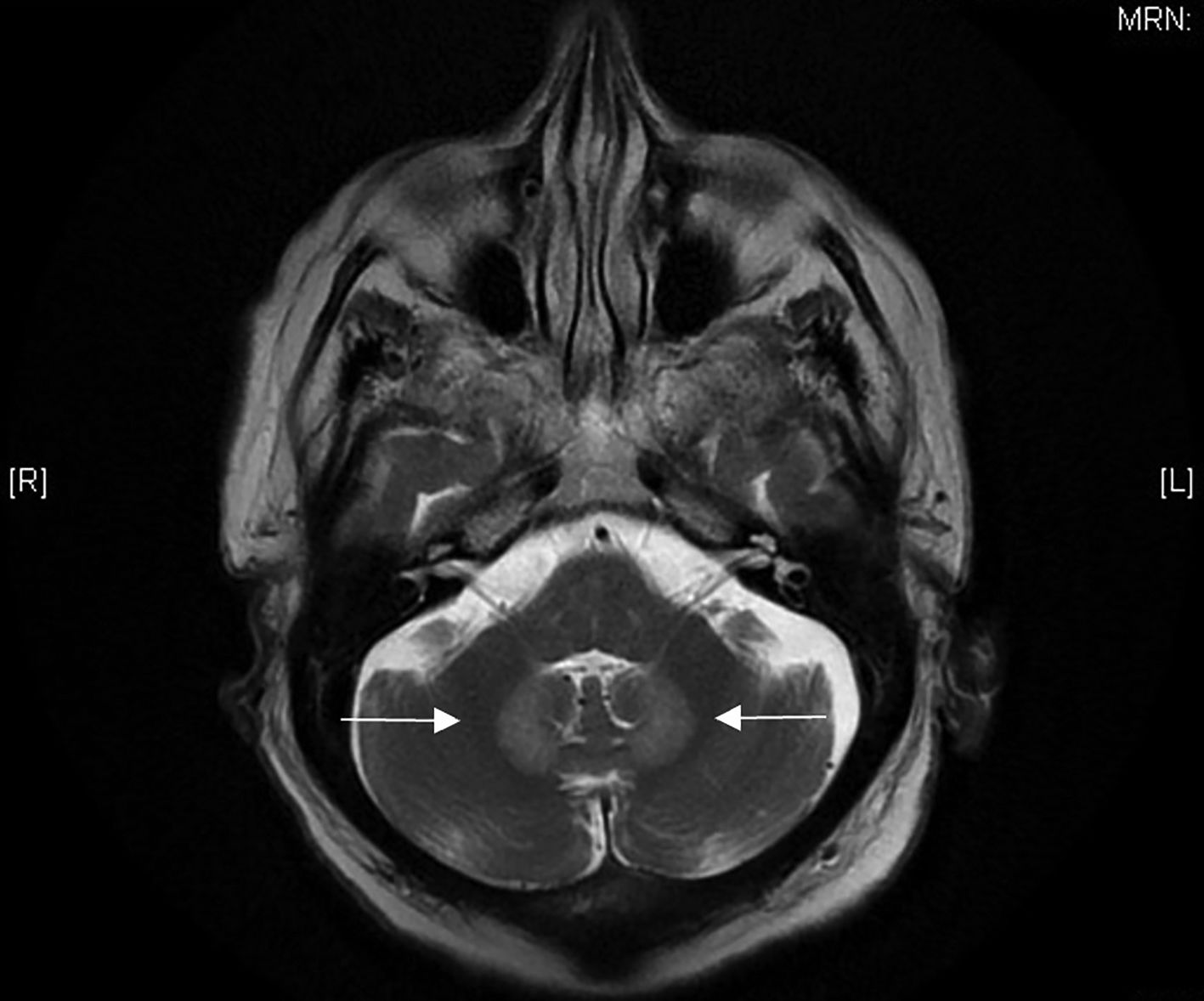
Dados los resultados de las pruebas complementarias y la clínica del paciente, se decidió ingreso en el servicio de Medicina Interna, donde se solicitó RMN craneal destacando como hallazgo en fosa posterior un aumento difuso de señal en la secuencia T2 y FLAIR de ambos núcleos dentados, de tipo simétrico, sin efecto masa (fig. 1). Estos hallazgos eran de tipo inespecífico, pero podrían estar en relación con el tratamiento con metronidazol.
La evolución del paciente fue favorable tras la retirada de la antibioterapia con metronidazol, presentando mejoría progresiva de la disartria, así como una desaparición completa de la sensación de inestabilidad.
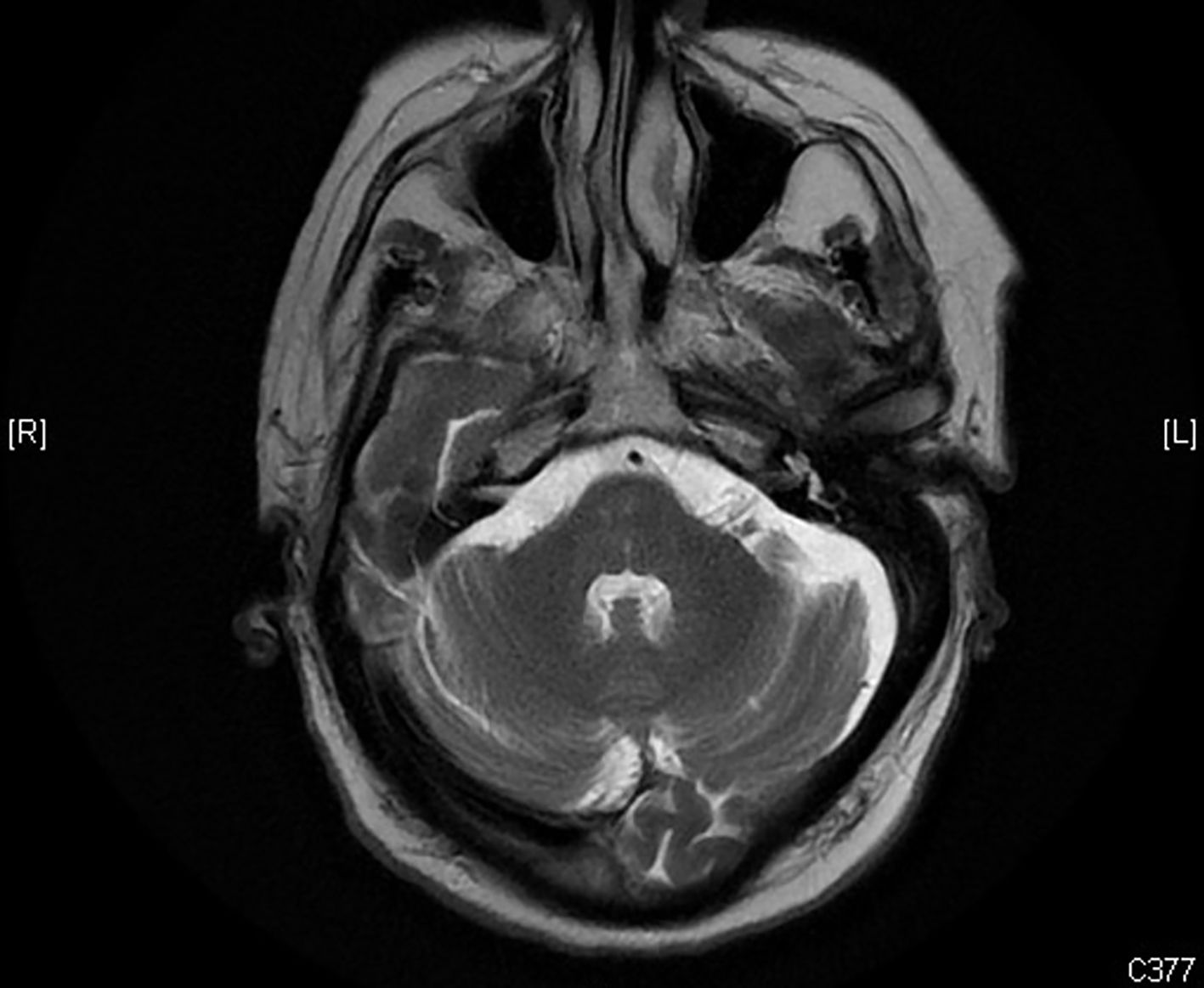
Tras 10días de ingreso se repitió la RMN craneal habiéndose normalizado, y habiendo desaparecido los hallazgos previamente descritos en ambos núcleos dentados (fig. 2).
El metronidazol es un antibiótico que se emplea de forma habitual en la práctica clínica diaria, siendo sus indicaciones sobre todo para infecciones producidas por anaerobios y protozoos1. Los efectos adversos comunes tras su uso suelen ser bien tolerados e incluyen alteraciones gastrointestinales y sequedad de boca. Por el contrario, las alteraciones neurológicas no son habituales, incluyéndose en este grupo la neuropatía periférica, cefalea, discinesias, síncope y confusión2.
Se han descrito algunos casos sobre toxicidad cerebelosa tras la toma prolongada de metronidazol1–4.
La sintomatología más común que presentaban los pacientes recogidos en la bibliografía consultada era disartria y ataxia. Nuestro paciente también presentaba disartria, así como sensación de inestabilidad y dismetría en la maniobra dedo-nariz, aunque no se pudo explorar la marcha dada su situación basal de dependencia.
La mayoría de los autores coinciden en los hallazgos descritos en la RMN craneal, evidenciándose un aumento de intensidad de tipo simétrica en los núcleos dentados cerebelosos en las secuencias T2 y FLAIR1,4–8. Aunque también pueden evidenciarse alteraciones en el esplenio del cuerpo calloso5, la sustancia gris periacueductal y el tronco encefálico7.
El mecanismo exacto por el que el metronidazol produce neurotoxicidad no es claramente conocido. Se han propuesto diferentes hipótesis al respecto. Por un lado, es sabido que este antibiótico atraviesa fácilmente la barrera hematoencefálica alcanzando altas concentraciones en el sistema nervioso central9. Además, ciertos metabolitos intermedios de este fármaco pueden unirse al propio ARN o ADN de las células del sistema nervioso10. El metronidazol produce también la oxidación de algunos derivados de las catecolaminas, como la noradrenalina y la dopamina, dando lugar a radicales libres que aumentan a su vez el contenido de agua pudiendo provocar edema cerebral10.
Al igual que en el caso presentado, numerosos autores describen una evolución favorable de los pacientes, tanto en la clínica como en las pruebas complementarias (RMN) tras la retirada del fármaco1–8.
Este caso destaca un efecto adverso raro y muy incapacitante de un medicamento comúnmente utilizado en la práctica clínica. Es por ello que, ante cualquier paciente que presente una clínica de inicio reciente y antecedente de exposición a fármacos, se ha de plantear como diagnóstico diferencial una toxicidad por dicho medicamento.
El médico de Atención Primaria posee un papel clave, ya que es quien tiene un mayor conocimiento sobre los pacientes adscritos a su cupo. A su vez, los propios pacientes tienen mayor accesibilidad a él.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticasEn cumplimiento de los principios éticos para la investigación médica en humanos, recogidos en la declaración de Helsinki de la Asociación Médica Mundial, se realizan las siguientes consideraciones:
- 1.
Se ha contado con el consentimiento del paciente.
- 2.
Se han seguido los protocolos de los centros de trabajo sobre tratamiento de la Información de los pacientes.
Los autores declaran no tener ningún conflicto de intereses.