El laboratorio de Andrología está en pleno proceso de evolución. En los últimos años se están desarrollando nuevos biomarcadores que ayudan a realizar un diagnóstico más preciso, pero ahora es necesario verificar su utilidad para determinar su potencial y su posible incorporación en la rutina diaria. En este sentido, cabe decir que hoy por hoy no hay una prueba diagnóstica única y que debido entre otras cosas a la complejidad intrínseca de las células espermáticas, tenemos que recurrir a diferentes estudios para aproximarnos a un diagnóstico certero. En este trabajo se hace un repaso de distintas pruebas diagnósticas disponibles e introducimos el uso del microscopía de alta magnificación para el análisis vacuolar de los espermatozoides (MSOME), comparando esta información con otras determinaciones clásicas como la concentración, movilidad y morfología, así como con el índice de fragmentación del ADN.
Material y métodosSe trata de un estudio observacional retrospectivo donde se consideran un total de 357 pacientes a los que se les realiza las siguiente pruebas diagnósticas: un seminograma completo, un test de alta magnificaión (MSOME) y un test de fragmentación del ADN. Se realiza estudio estadístico de correlación de los diferentes parámetros.
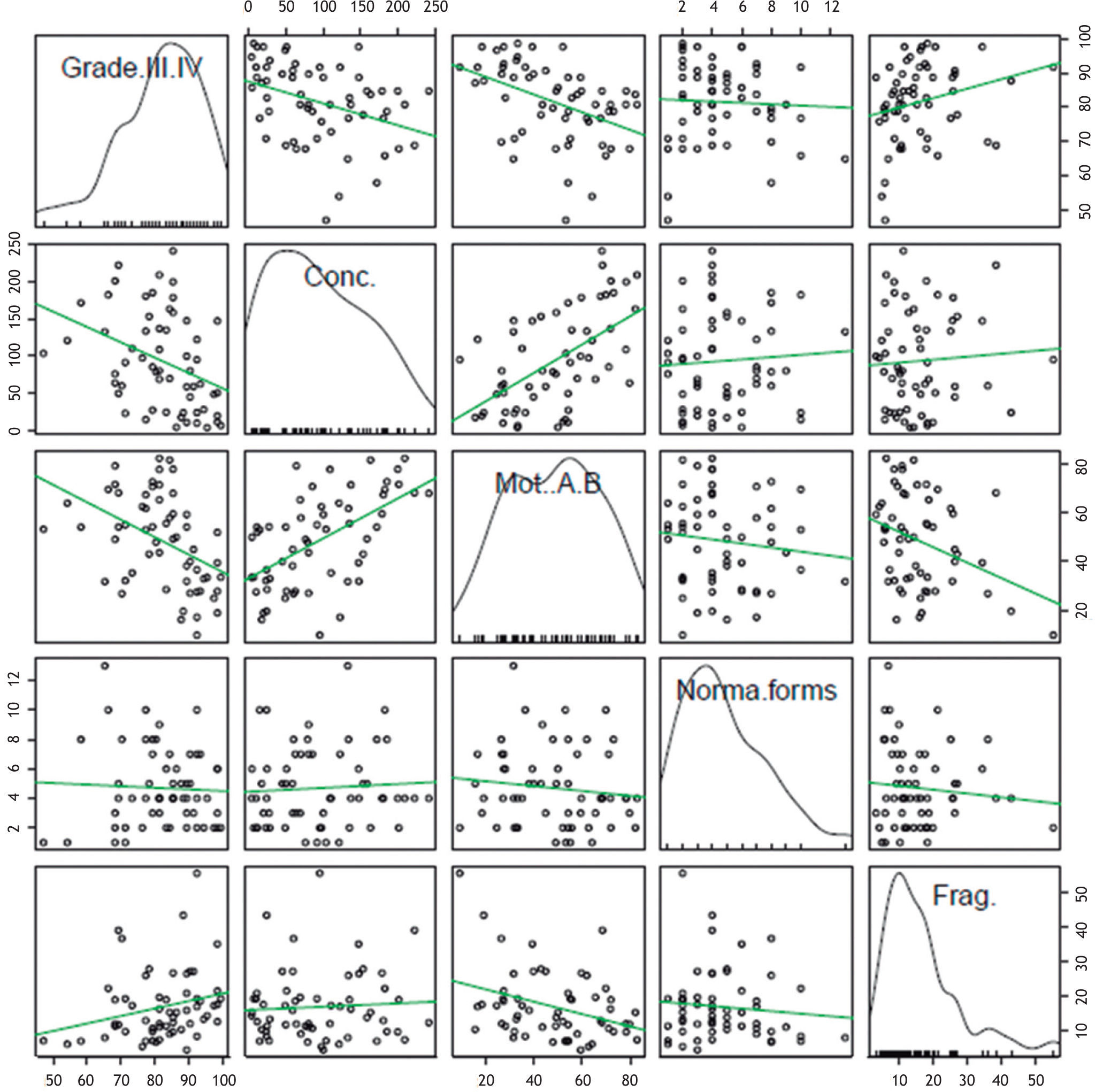
ResultadosSe observa una correlación negativa entre el grado de vacuolización y la concentración, movilidad progresiva y las formas normales. Hay una correlación positiva con el porcentaje de fragmentación del ADN. En todos los casos la correlación es estadísticamente significativa.
DiscusiónAunque el grado de correlación no es demasiado alto, la determinación morfológica de alta magnificación ofrece información adicional in vivo mucho más objetiva que un estudio de morfología tradicional. Esta determinación puede resultar muy útil a la hora de recomendar la técnica de la IMSI para las parejas que lo necesiten, y es un test candidato a ser incluido en la rutina de laboratorio de cara a mejorar el diagnóstico del varón.
The Andrology Laboratory is in a process of continuing development. In recent years new biomarkers and sperm selection techniques are starting to be developed in order to make a more accurate diagnosis and to find an explanation for male fertility problems. The usefulness of these techniques now needs to be validated to determine their potential and possible incorporation into daily routine. Due to the inherent complexity of sperm cells, there is no single diagnostic test, thus different tests have to be used to reach an accurate diagnosis. This paper presents a review of different diagnostic tests and introduces the use of high-magnification microscopy for vacuolar analysis of sperm (MSOME), comparing this information with other classical determinations, such as concentration, motility and morphology, as well as the DNA fragmentation index.
Material and methodsA retrospective observational study was conducted on a total of 357 patients on whom the following diagnostic tests were performed: a full semen analysis, a high magnification test, and a DNA fragmentation test. Statistical correlation analysis was performed on the different parameters.
ResultsA negative correlation between the degree of vacuolization and concentration, progressive motility and normal forms is observed. There is a positive correlation between the percentage of DNA fragmentation and the degree of vacuolization. In all cases, the correlation is statistically significant.
DiscussionAlthough correlations appear to be moderate, morphological identification by high magnification provides additional and much more objective information than a traditional morphology. This determination can be useful prior to an Intracytoplasmic Morphologically Selected Sperm Injection (IMSI) technique, and it is a perfect tool to be considered for inclusion in the Andrology Laboratory, in order to improve the diagnosis in males.
El análisis convencional del semen basado en la determinación de la concentración, movilidad y morfología sigue siendo la prueba diagnóstica inicial en el estudio del varón infértil. Sin embargo, frecuentemente nos encontramos con la necesidad de ampliar el estudio del varón, ya sea por baja fecundación, embriones no evolutivos, fallos de implantación, abortos de repetición o sospecha de factor masculino.
Hasta hace poco, la posibilidad de realizar ICSI hacía que la importancia del gameto masculino pasara a un segundo plano, perdiendo en muchos casos la importancia que en realidad tiene esta célula.
En este sentido, los laboratorios de Andrología han ido incorporando nuevas técnicas diagnósticas, nuevos biomarcadores espermáticos que proporcionan información suficiente para orientar a la pareja a una técnica determinada con el objetivo de conseguir embarazo de la manera más rápida y eficaz1.
Pero, si queremos tener un buen diagnóstico del varón, ¿qué podemos hacer?: para empezar es necesario que el laboratorio de Andrología ponga a punto las últimas técnicas de diagnóstico disponibles, o al menos, las que estén a su alcance. Aunque también es importante informar correctamente a los clínicos para que conozcan dichas técnicas, desarrollen los procedimientos de trabajo adecuados, y soliciten las pruebas a sus pacientes.
¿Cuáles son algunas de las pruebas adicionales actualmente disponibles para mejorar el diagnóstico del varón infértil?
Estudio de la calidad del ADN espermáticoMediante distintas técnicas como, TUNEL, SCSA, Comet y SCD, se puede determinar el grado de fragmentación del ADN espermático. Este parámetro resulta ser muy predictivo2, y cuando este parámetro está alterado, el paciente tiene un alto riesgo de infertilidad3,4. Este test ya se está implantando en la rutina de los centros de reproducción asistida, ya que parece ser un buen biomarcador de infertilidad masculina.
Test de estrés oxidativoLa presencia de moléculas reactivas al oxígeno (ROS) se relaciona directamente con el estrés oxidativo, la degradación celular y por tanto, la disminución en la calidad del ADN celular. Parece lógico pensar, que si somos capaces de detectar un exceso de estrés oxidativo en una muestra seminal, seamos capaces de diagnosticar una posible disfunción celular compatible con un factor masculino5.
Test de alta magnificación para el examen morfológico de orgánulos en espermatozoides móvilesAunque el uso de este equipo está orientado a la realización de la IMSI (intracytoplasmic morphologically selected sperm injection) también podemos utilizarlo como herramienta diagnóstica6,7, sobre todo en fallos previos de FIV/ICSI8,9. Con este microscopio la imagen puede magnificarse a más de 6000× de forma que se puede valorar minuciosamente cada espermatozoide y considerar la presencia de vacuolas en relación a su número y tamaño. Hay publicados en la literatura diferentes criterios de clasificación10,11 que permiten determinar el porcentaje de espermatozoides aptos para realizar una IMSI en función de la presencia vacuolar. Según algunos autores, los espermatozoides con demasiadas vacuolas tienen menos posibilidades de generar embriones capaces de llegar hasta estado de blastocisto12,13 o como recientemente se ha publicado, que la presencia de vacuolas se correlaciona con un empaquetamiento defectuoso de la cromatina14,15. Realizando una magnificación previa en un seminograma antes del tratamiento, sabremos hasta qué punto es necesario hacer una IMSI, e incluso si merece la pena o no dependiendo de los parámetros seminales16, pero según la literatura, las principales indicaciones donde la técnica parece más eficiente sería en pacientes teratozoospérmicos, elevada fragmentación del ADN o con fallos de implantación8,9,15,17.
Test del hialuronatoEl ácido hialurónico está presente en la matriz extracelular del cúmulo del ovocito, y los espermatozoides maduros expresan receptores al hialuronato que permiten la unión de las células y su posterior fertilización. Existen dispositivos para poder analizar el porcentaje de espermatozoides maduros presentes en una muestra, así como métodos de selección para poder realizar la ICSI de una manera más fisiológica utilizando medios ricos en hialuronato (SpermSlow o las placas de PICSI, Origio MidAtlantic Devices, UK), permitiendo realizar la selección de espermatozoides maduros18.
En este trabajo se realiza una valoración del test de alta magnificación y se correlacionará con parámetros seminales y con el índice de fragmentación del ADN. Una elevada vacuolización de los espermatozoides o la fragmentación del ADN son predictores del fracaso del ciclo de fecundación in vitro (FIV). Sabemos el efecto negativo que tiene la vacuolización espermática y la fragmentación del ADN sobre la calidad embrionaria y la tasa de embriones no evolutivos19–21. Sin embargo, se necesitan estudios que correlacionen estas técnicas y se valore la repercusión que realmente pueden tener.
Por lo tanto, la pregunta que nos hacemos en este trabajo es: ¿cómo se correlaciona el índice de vacuolización con los parámetros seminales y con el porcentaje de fragmentación?
Material y métodosPacientesSe consideran 357 pacientes que acuden al centro para tratamiento de FIV desde el año 2010. Como parte del estudio diagnóstico previo, al varón se le realizan las siguientes pruebas: seminograma completo, test de alta magnificación (MSOME) y test de fragmentación del ADN espermático mediante la técnica SCD (Sperm Chromatin Dispersion).
Se determinan los parámetros principales del seminograma siguiendo la normativa OMS. La valoración de la concentración y movilidad progresiva se realiza mediante el sistema CASA MII, y la morfología mediante tinción con Diff-Quik a 100× y siguiendo criterios estrictos de Kruger.
La magnificación de espermatozoides se realiza mediante un microscopio invertido LEICA AM 6000 (Leica Microsystems, Wetzlar, Germany), equipado con óptica Nomarski y un sistema digital que alcanza hasta 13.000 aumentos. La observación se realiza a 6.500 aumentos y se cuentan un mínimo de 100 células.
La observación de los espermatozoides se realiza sobre una placa con fondo de vidrio (WillCo-dishTM, WillCo Wells BV) en la que se deposita una gota de polivinilpirrolidona (PVP clinical grade, Origio, Denmark) de 2 μl. El PVP ayudará a disminuir la velocidad de movimiento de los espermatozoides facilitando su observación. Puede disminuirse su concentración para evitar posibles efectos tóxicos. En esta gota se introduce 1 μl de la muestra de espermatozoides y se cubre con aceite mineral estéril (Origio, Denmark). La observación se realiza con el objetivo HCX PL FL 100×/1.30 Oil 0.17/D, con aceite de inmersión.
Para poder utilizar esta herramienta con fines diagnósticos, es necesario estandarizar los criterios a la hora de evaluar la presencia vacuolar en la cabeza del espermatozoide. Varios autores proponen métodos de clasificación, aunque actualmente no hay un criterio lo suficientemente establecido13,22,23. La clasificación utilizada en nuestro caso y publicada por Vanderzwalmen et al.13, agrupa a los espermatozoides en cuatro grados: grado I, ausencia de vacuolas; grado II, dos vacuolas pequeñas como máximo, que no llegan a ocupar más del 4% de la superficie de la cabeza; grado III, más de dos vacuolas pequeñas o una vacuola grande; grado IV, grandes vacuolas junto con formas anormales de la cabeza u otras anormalidades. En los resultados consideraremos a los espermatozoides más vacuolados como la suma de los grados III y IV.
El test de fragmentación del ADN espermático se realizó mediante la técnica SCD según Fernández et al.24, con el kit HaloSperm (Halotech DNA, Madrid, España). Se contó un mínimo de 300 células y se establece el límite de fragmentación a partir del 30%.
Se realiza un estudio de correlación de los diferentes parámetros mediante el coeficiente de correlación de Pearson. Los datos se analizan con el programa estadístico R, versión 2.14.1 (www.r-project.org).
ResultadosEl análisis descriptivo de las variables nos indica las siguientes medias y desviaciones estándar: concentración espermática 78,0 ± 63,3 mill/mL, movilidad progresiva 47,8 ± 20,5%, formas normales 6,8 ± 4,4%, vacuolización grado III + IV 79,9 ± 13,1% e índice de fragmentación del ADN 18,6 ± 10,8%.
Tras realizar la correlación con cada uno de los parámetros analizados se ha representado una matriz de dispersión de todos los datos con las respectivas rectas de correlación (fig. 1).
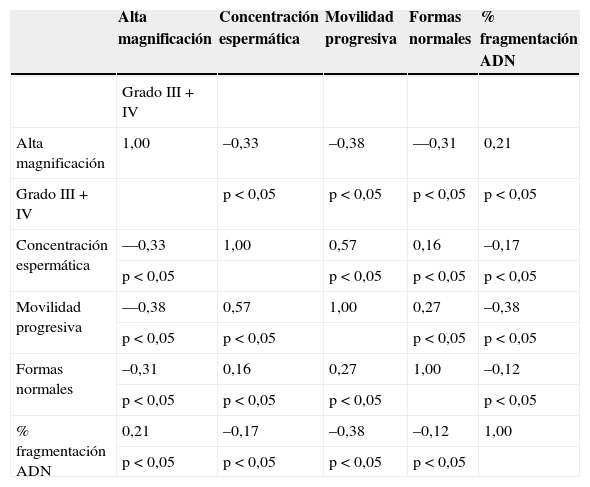
En la tabla 1 aparecen los coeficientes de correlación de Pearson, así como los valores p referentes a la significancia estadística, estableciéndose como estadísticamente significativos p < 0,05.
Coeficientes de correlación de Pearson y sus correspondientes p valores de significancia estadística.
| Alta magnificación | Concentración espermática | Movilidad progresiva | Formas normales | % fragmentación ADN | |
|---|---|---|---|---|---|
| Grado III + IV | |||||
| Alta magnificación | 1,00 | –0,33 | –0,38 | —0,31 | 0,21 |
| Grado III + IV | p < 0,05 | p < 0,05 | p < 0,05 | p < 0,05 | |
| Concentración espermática | —0,33 | 1,00 | 0,57 | 0,16 | –0,17 |
| p < 0,05 | p < 0,05 | p < 0,05 | p < 0,05 | ||
| Movilidad progresiva | —0,38 | 0,57 | 1,00 | 0,27 | –0,38 |
| p < 0,05 | p < 0,05 | p < 0,05 | p < 0,05 | ||
| Formas normales | –0,31 | 0,16 | 0,27 | 1,00 | –0,12 |
| p < 0,05 | p < 0,05 | p < 0,05 | p < 0,05 | ||
| % fragmentación ADN | 0,21 | –0,17 | –0,38 | –0,12 | 1,00 |
| p < 0,05 | p < 0,05 | p < 0,05 | p < 0,05 |
Se observa que la presencia de espermatozoides con grados III + IV de vacuolización tiene una correlación negativa con la concentración, movilidad progresiva y las formas normales, y hay una correlación positiva con el porcentaje de fragmentación de ADN. En todos los casos se obtuvo una correlación estadísticamente significativa. Así, estos resultados demuestran que hay una relación entre cada una de las variables analizadas en la población estudiada. No obstante, el grado de correlación es bajo-moderado, y el parámetro que menos se correlaciona con el grado de vacuolización III + IV es el índice de fragmentación del ADN (r=0,21; p<0,05).
DiscusiónEn este trabajo se observan diferencias estadísticamente significativas en todas las correlaciones realizadas, aunque encontramos que las correlaciones son bajas-moderadas. Esto es habitual cuando se trabaja con un número de muestras elevado, donde estos coeficientes pequeños pueden darnos información útil o pistas para pensar por qué no encontramos una relación con una correlación mayor. En nuestro caso, consideramos que los sujetos incluidos en el estudio acuden para la realización de un ciclo de FIV, y que en muchos casos existe un factor masculino. Por ello, nos encontramos con una muestra bastante homogénea que puede explicar el hecho de que el grado de correlación no sea más alto.
Dado que la técnica de alta magnificación constituye una herramienta adicional dentro de la medicina reproductiva, empieza a constatarse que puede aportar valor en decisiones diagnósticas. Una determinación morfológica por MSOME resulta ser mucho más objetiva que la valoración morfológica habitual en pacientes que acuden a FIV. Y aunque no está bien establecido el método de clasificación, en la mayoría de laboratorios se utilizan criterios similares para clasificar claramente a los espermatozoides normales, lo que la convierte en una herramienta objetiva.
La presencia vacuolar se relaciona directamente con un posible daño en el ADN espermático, ya sea produciendo su desnaturalización y/o fragmentación, provocando un efecto negativo en el desarrollo embrionario15,22, ya que la estabilidad de la cromatina puede influir directamente en el desarrollo embrionario. Aunque está descrito que una buena calidad ovocitaria puede reparar la fragmentación del ADN espermático25, no siempre vamos a poder trabajar con ovocitos de mujeres jóvenes. Si el ovocito no es capaz de reparar el daño en el ADN espermático, se favorece la aparición de mutaciones durante el desarrollo embrionario, posiblemente debido a errores en la replicación del ADN, o en su transcripción, que incluso puede contribuir a la aparición de enfermedades en futuras generaciones en caso de que se consiga un embarazo evolutivo26.
También cabe destacar que hay un efecto paterno tardío en los embriones, ya que la presencia de grandes vacuolas en los espermatozoides se relaciona con un mayor impacto en el desarrollo embrionario a partir del día tres de cultivo. Es justo en este momento cuando el contenido del ADN paterno inicia su contribución al desarrollo embrionario13,27.
Esta situación podría tener una explicación a nivel genético tal y como hace sospechar el hecho de detectar una correlación inversa cuando se compara aneuploidias espermáticas y espermatozoides con formas normales en general28–30, y también a nivel de la fragmentación del ADN31,32. En este sentido, se ha observado una mejor función mitocondrial y estado de la cromatina cuando hay ausencia de vacuolas nucleares33.
MSOME se postula como una técnica con criterios más estrictos para la clasificación morfológica de los espermatozoides, que al tratarse de una visualización in vivo, el propio movimiento de los espermatozoides facilita la visualización de las vacuolas. Así, la presencia de vacuolas en la cabeza del espermatozoide se postula como el criterio ultramorfológico con mayor factor predictivo en la calidad del espermatozoide a la hora de realizar una ICSI. A pesar de todo, todavía hay cierta controversia acerca de la naturaleza de las vacuolas observadas por MSOME. Hay autores que sugieren que tienen un origen acrosómico y otros que tienen origen en el núcleo, o incluso que el origen es mixto34.
Otros estudios comparan los datos morfológicos recogidos mediante criterios habituales como son los criterios estrictos de Kruger con los obtenidos después de un estudio de alta magnificación o MSOME. Todos demuestran diferencias estadísticamente significativas cuando se compara los porcentajes de formas normales obtenidos16,35.
Sin embargo, hay una división muy definida en la comunidad científica en relación sobre la utilidad de la IMSI8,36. Hay publicados numerosos trabajos que demuestran que no hay las suficientes evidencias científicas para realizar la IMSI17,37,38, aunque también podemos encontrar trabajos demostrando que la IMSI mejora significativamente la tasa de fecundación, la tasa de embriones de mejor calidad, la tasa de embarazo e implantación, así como la disminución de abortos8,9,11,13,27,31,39–42. Seguramente, es necesario seguir evaluando la técnica y considerar que debe ser indicada sólo a un grupo concreto de pacientes.
Los tratamientos de reproducción asistida van encaminados a mejorar los protocolos de estimulación, el cultivo embrionario, la selección de gametos y de embriones, la obtención de embarazos únicos, evolutivos, con el nacimiento de un niño sano en casa. Se intenta minimizar las gestaciones múltiples transfiriendo pocos embriones, pero también se desea tener altas tasas de embarazo. Por todo ello, es fácil pensar que se necesita tener las herramientas suficientes como para poder seleccionar los mejores gametos que originen embriones de buena calidad con un alto potencial de implantación. Ya no sólo es el ovocito el gameto principal para la obtención de buenos embriones, se sabe que el espermatozoide contribuye mucho más de lo que se pensaba, no sólo con ADN si no también con ARNm que codifica proteínas necesarias para el desarrollo temprano del embrión43.
En conclusión, la magnificación espermática se puede definir como una nueva prueba diagnóstica en la que es necesario mayor consenso a la hora de establecer criterios de clasificación según el grado de vacuolización y el límite de normalidad estándar, pero que ofrece información valiosa de cara a poder orientar el tipo de tratamiento reproductivo aconsejado a los pacientes. Da una información precisa de las posibilidades de realizar una IMSI, al poder evaluar previamente el grado de vacuolización, y resulta evidente cómo la magnificación se correlaciona con los parámetros básicos del seminograma y con la fragmentación del ADN, postulándose como técnica de elección en aquellos pacientes con elevada fragmentación. Si podemos seleccionar espermatozoides menos vacuolados, estamos dando más posibilidades de seleccionar un espermatozoide con una fragmentación del ADN menor y contribuir así a mejorar los resultados tras una IMSI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Dr. Antonio Miñarro (Dpt. Estadística, UB) su colaboración en la realización del estudio estadístico. Este trabajo no hubiera sido posible sin la colaboración del personal técnico del Laboratorio de Andrología del centro CIRH.