Desde el comienzo de la utilización de forma rutinaria de las técnicas de reproducción asistida humana, la necesidad de optimizar los resultados en los laboratorios ha ido aumentando. El establecimiento de indicadores y estándares de calidad ha pasado a ser un pilar fundamental para lograr este objetivo. Por esta razón, se han publicado en 2016 textos de referencia como el cuaderno de Indicadores de Calidad del Laboratorio de Embriología elaborado por el Grupo de Interés de Calidad de ASEBIR (GICa-ASEBIR) y, más recientemente, el Manual de Buena Práctica Clínica en Reproducción Asistida del grupo de interés de ética y buenas prácticas de la SEF (MBP-SEF). Creemos útil determinar qué indicadores y cuáles tienen en común estos dos documentos. Hemos clasificados los indicadores según dos variables. En primer lugar, según el tipo (efectividad y seguridad), y en segundo lugar, según coincidencia entre ambos documentos: similares (presentes en ambos documentos y similar definición), discrepantes (presentes en ambos documentos pero definición discordantes) y únicos (solo se describen en uno de los dos documentos). Al analizar ambos textos, hemos visto que 8 indicadores de efectividad son similares y 3 discrepantes. También se ha encontrado un indicador de seguridad discrepante, dos indicadores fueron únicos en el documento del GICa-ASEBIR y cinco en el MBP-SEF. En base a estos resultados, vemos grandes diferencias en los indicadores de calidad propuestos y creemos necesaria una mayor estandarización.
Since the use of assisted reproduction techniques became routine, needs have changed in the quest to optimise laboratory results, and the establishment of quality indicators and standards is now of fundamental importance. For this reason, various reference texts have been published in 2016, such as the Embryology Laboratory Indicator Quality Guidelines issued by the ASEBIR Quality Interest Group (GICa-ASEBIR) and, more recently, the Handbook of Good Clinical Practice in Assisted Reproduction issued by the SEF Ethics and Good Practices interest group (MBP-SEF). We believe it would be useful to scrutinise these indicators and determine which ones are common to the two documents. To do so, we have classified the indicators according to two variables. Firstly, by type (effectiveness and safety) and secondly, by degree of coincidence: similar (present in both documents and similarly defined); discrepant (present in both documents but with discordant definitions); and unique (only described in one of the two documents). Our analysis of the two texts shows that eight indicators of effectiveness are similar and three are discrepant. In addition, one safety indicator was found to be discrepant, two indicators were unique to the GICa-ASEBIR document and five were unique to the MBP-SEF. These results highlight the presence of significant differences in the quality indicators proposed and the need, in our opinion, for greater standardisation.
El constante aumento de las técnicas de reproducción asistida (TRA) se ha basado en parte en la mejora tecnológica, en la mejora continua en protocolos y recursos humanos, y en la búsqueda perseverante de la excelencia de los laboratorios. Por esto último, se ha hecho especialmente necesario prestar atención a la calidad, tanto a su gestión como a su puesta en práctica. Con este fin, ya se han elaborado documentos de referencia en el ámbito del laboratorio de reproducción, como la Norma UNE 179007 (2013)7, fruto del consenso entre las sociedades científicas principales de esta área asistencial, centros de reproducción humana asistida, expertos y autoridades. Otros documentos publicados en este sentido son la guía de Buenas Prácticas en el Laboratorio de FIV publicada por ESHRE Guideline Group on Good Practice in IVF Labs (ESHRE) (De los Santos et al., 2016) y el cuaderno de Indicadores de Calidad del Laboratorio de Embriología elaborado por el Grupo de Interés de Calidad de ASEBIR (GICa-ASEBIR) (Castilla et al., 2016). La reciente publicación del Manual de Buena Práctica Clínica en Reproducción Asistida del Grupo de Interés de Ética y Buenas Prácticas de la SEF (MBP-SEF) (Manual, 2016) recomienda, al igual que el documento comentado del GICa-ASEBIR, la utilización de indicadores de calidad. En este estudio, y con el objetivo de facilitar la labor de los profesionales a la hora de utilizar los indicadores de calidad como herramienta de trabajo, nos proponemos comparar los indicadores de calidad de laboratorio de RA propuestos en estos dos documentos del GICa-ASEBIR y la MBP-SEF.
Material y métodosLos indicadores del GICa-ASEBIR son 14, que desglosados por técnica resultan 43. Los indicadores del MBP-SEF relacionados con el laboratorio son 26, que desglosados por técnica son 54. Aparte, el MBP-SEF describe 31 indicadores no relacionados con el laboratorio que no son objeto de análisis. Aunque en el MBP-SEF muchos indicadores, que podrían ser comunes a varias técnicas, son solo citados en una, se consideran aplicables a técnicas afines a efectos de este estudio. Los indicadores se clasificaron como: similares (presentes en ambos documentos y similar definición), discrepantes (presentes en ambos documentos pero definiciones discordantes) y únicos (solo se describen en uno de los dos documentos).
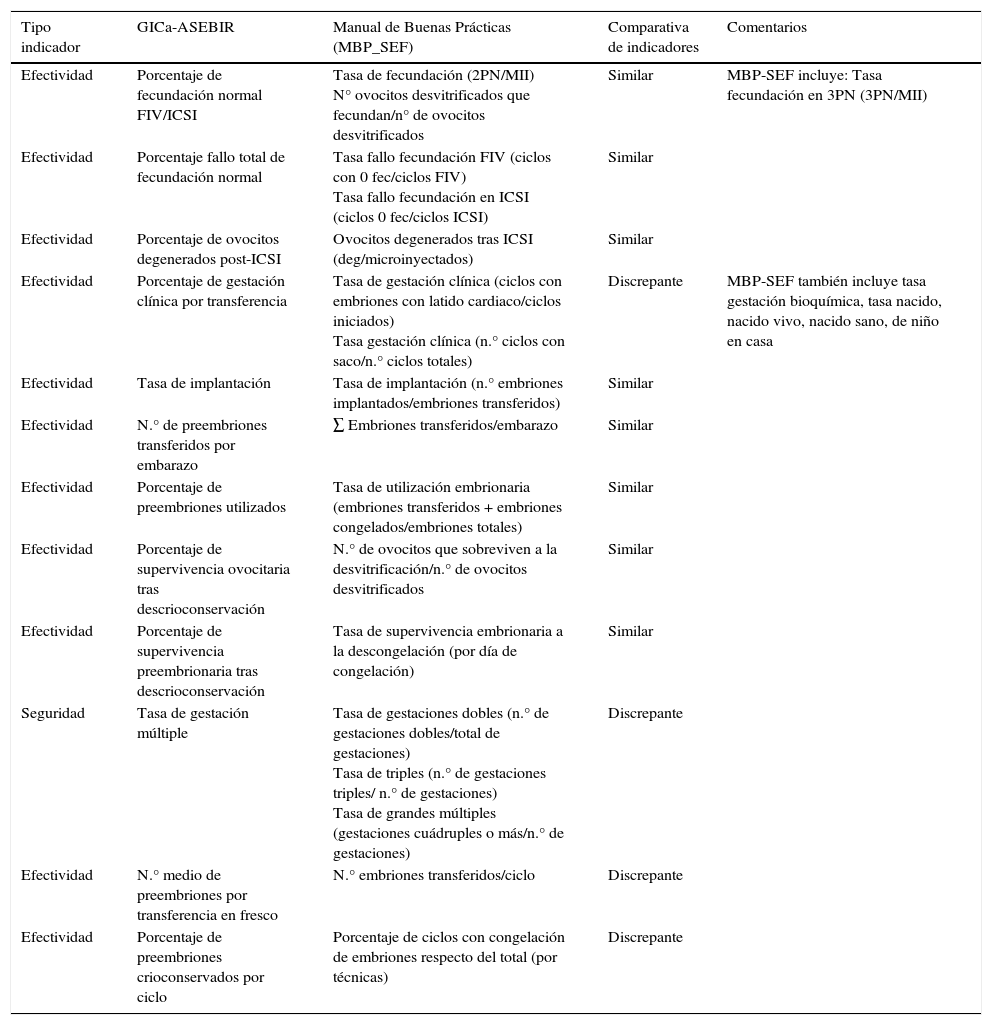
ResultadosIndicadores de efectividadLos dos documentos analizados incluyen como indicadores la tasa de fecundación normal (2 pronúcleos) y el porcentaje de ovocitos degenerados post-ICSI. Ambos describen también el indicador de calidad porcentaje de ciclos con fallo total de fecundación; sin embargo, el MBP-SEF sitúa en el numerador de dicho indicador «ciclos con 0 fecundados» y el GICa-ASEBIR «ciclos con 0 ovocitos con fecundación normal». Solo el MBP-SEF incluye el indicador tasa de ovocitos fecundados con 3 pronúcleos (tabla 1).
Comparativa entre los indicadores de calidad (similares y discrepantes) entre el Manual de Buenas Prácticas (MBP-SEF) y los del GICa-ASEBIR
| Tipo indicador | GICa-ASEBIR | Manual de Buenas Prácticas (MBP_SEF) | Comparativa de indicadores | Comentarios |
|---|---|---|---|---|
| Efectividad | Porcentaje de fecundación normal FIV/ICSI | Tasa de fecundación (2PN/MII) N° ovocitos desvitrificados que fecundan/n° de ovocitos desvitrificados | Similar | MBP-SEF incluye: Tasa fecundación en 3PN (3PN/MII) |
| Efectividad | Porcentaje fallo total de fecundación normal | Tasa fallo fecundación FIV (ciclos con 0 fec/ciclos FIV) Tasa fallo fecundación en ICSI (ciclos 0 fec/ciclos ICSI) | Similar | |
| Efectividad | Porcentaje de ovocitos degenerados post-ICSI | Ovocitos degenerados tras ICSI (deg/microinyectados) | Similar | |
| Efectividad | Porcentaje de gestación clínica por transferencia | Tasa de gestación clínica (ciclos con embriones con latido cardiaco/ciclos iniciados) Tasa gestación clínica (n.° ciclos con saco/n.° ciclos totales) | Discrepante | MBP-SEF también incluye tasa gestación bioquímica, tasa nacido, nacido vivo, nacido sano, de niño en casa |
| Efectividad | Tasa de implantación | Tasa de implantación (n.° embriones implantados/embriones transferidos) | Similar | |
| Efectividad | N.° de preembriones transferidos por embarazo | ∑ Embriones transferidos/embarazo | Similar | |
| Efectividad | Porcentaje de preembriones utilizados | Tasa de utilización embrionaria (embriones transferidos + embriones congelados/embriones totales) | Similar | |
| Efectividad | Porcentaje de supervivencia ovocitaria tras descrioconservación | N.° de ovocitos que sobreviven a la desvitrificación/n.° de ovocitos desvitrificados | Similar | |
| Efectividad | Porcentaje de supervivencia preembrionaria tras descrioconservación | Tasa de supervivencia embrionaria a la descongelación (por día de congelación) | Similar | |
| Seguridad | Tasa de gestación múltiple | Tasa de gestaciones dobles (n.° de gestaciones dobles/total de gestaciones) Tasa de triples (n.° de gestaciones triples/ n.° de gestaciones) Tasa de grandes múltiples (gestaciones cuádruples o más/n.° de gestaciones) | Discrepante | |
| Efectividad | N.° medio de preembriones por transferencia en fresco | N.° embriones transferidos/ciclo | Discrepante | |
| Efectividad | Porcentaje de preembriones crioconservados por ciclo | Porcentaje de ciclos con congelación de embriones respecto del total (por técnicas) | Discrepante |
EL MBP-SEF define de 7 maneras diferentes el resultado de una TRA: gestación bioquímica, clínica (visualización de saco o saco con latido cardiaco), nacido, nacido vivo, nacido vivo sano o niño en casa. Sin embargo, el GICa-ASEBIR solo utiliza la de gestación clínica como presencia de saco embrionario. Del mismo modo, el denominador utilizado en MBP-SEF puede ser o ciclo o transferencias, y en el GICa-ASEBIR, solo transferencias. El MBP-SEF define la tasa de aborto (número de abortos/gestaciones) como indicador; sin embargo, el GICa-ASEBIR no incluye este indicador.
Otros indicadores de efectividad son similares en ambas técnicas, como tasa de implantación, número de preembriones transferidos por embarazo y porcentaje de preembriones utilizados. Sin embargo, el número de embriones transferidos se define de manera diferente: número de embriones transferidos por ciclo en el MBP-SEF y número medio de preembriones por transferencia en el GICa-ASEBIR (tabla 1).
En cuanto a indicadores de efectividad del programa de criopreservación, ambos documentos coinciden en utilizar la tasa de supervivencia de ovocitos y embriones, no así en la de espermatozoides, que solo es descrita por el GICa-ASEBIR. Sin embargo, sí existe una gran diferencia a la hora de intentar definir la utilización de criopreservación embrionaria, ya que el MBP-SEF se decanta por el porcentaje de ciclos con congelación de embriones respecto del total de ciclos, y el GICa-ASEBIR por el porcentaje de preembriones crioconservados del total de embriones. Es de destacar la terminología diferente al referirse al almacenamiento de embriones sobrantes (congelación en MBP-SEF o crioconservación en el GICa-ASEBIR).
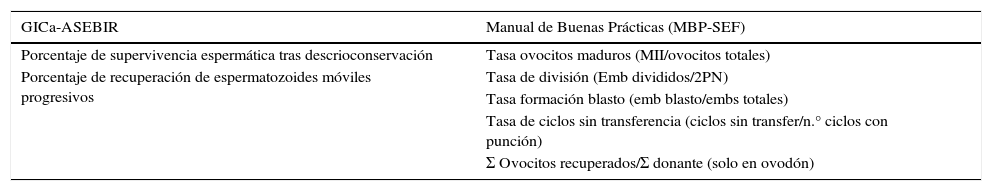
Los indicadores de efectividad que solo son incluidos en un documento son en el MBP-SEF: tasa de ovocitos maduros, tasa de división embrionaria, tasa de formación de blastocisto, tasa de ciclos sin transferencia, media de ovocitos recuperados por donante y ovocitos desvitrificados por ovocitos vitrificados (en ovocitos de donante). Y en el documento del GICa-ASEBIR: porcentaje de supervivencia espermática tras descrioconservación y porcentaje de recuperación de espermatozoides móviles (tabla 2).
Indicadores de calidad únicos en el MBP-SEF o GICa-ASEBIR
| GICa-ASEBIR | Manual de Buenas Prácticas (MBP-SEF) |
|---|---|
| Porcentaje de supervivencia espermática tras descrioconservación | Tasa ovocitos maduros (MII/ovocitos totales) |
| Porcentaje de recuperación de espermatozoides móviles progresivos | Tasa de división (Emb divididos/2PN) |
| Tasa formación blasto (emb blasto/embs totales) | |
| Tasa de ciclos sin transferencia (ciclos sin transfer/n.° ciclos con punción) | |
| Σ Ovocitos recuperados/Σ donante (solo en ovodón) |
Los dos documentos analizados presentan la tasa de gestación múltiple como indicador de seguridad. Sin embargo, el MBP-SEF desglosa en dobles, triples y grandes múltiples (superior a tres). La tasa de aborto solo es incluida en el MBP-SEF, y se define como número de abortos por gestaciones.
Estándares de calidadSolo se establece un estándar de calidad en el MBP-SEF en supervivencia tras descongelación para ovocitos y embriones, siendo este del 80-90%. En cuanto a estos indicadores, el estándar del GICa-ASEBIR contempla de forma independiente ovocitos y embriones, y diferencia si son ovocitos propios o donados. Los estándares de supervivencia ovocitaria con ovocitos propios son 91,1% óptimo, 75,2% deseable, 35,9% mínimo, y con ovocitos donados, 89,8% óptimo, 80,0% deseable, 52,4% mínimo. Los de supervivencia de preembriones procedentes de ovocitos propios son 84,5% óptimo, 60,8% deseable, 45,7% mínimo, y los procedentes de ovocitos donados 88,0% óptimo, 66,8% deseable, 52,0% mínimo. Además, determina que en el caso de tratarse de blastocistos la supervivencia en cada caso debe ser un 15% superior a la observada en embriones.
DiscusiónLos indicadores de efectividad de las TRA que podemos encontrar en la literatura presentan una alta heterogeneidad. Así, recientemente Wilkinson et al. (2016), tras analizar 142 ensayos clínicos, encontraron más de 800 maneras de expresar el resultado de las TRA. Como demuestran nuestros resultados, esta heterogeneidad se encuentra presente en el MBP-SEF, al contrario que en los indicadores del GICa-ASEBIR. Creemos que es fundamental tener indicadores no solo concretos y objetivos, sino también eficientes, es decir, que el esfuerzo en conseguirlo esté equilibrado con su utilidad. Y este puede ser el caso de los indicadores de resultado de las TRA que comentamos. Aunque el punto final de un tratamiento en reproducción asistida suele ser un embarazo evolutivo, este no garantiza el nacimiento de un niño (Min et al., 2004). Por esto muchos autores, como Land y Evers (2003), han propuesto que la tasa de nacido vivo sea la medida primaria en los ensayos clínicos de TRA. No obstante, como demostraron Nyboe Andersen et al. (2009), datos como aborto y nacido vivo son para centros y registros difíciles de conseguir, lo que en cierta manera hace que indicadores ideales (tasa de aborto, tasa nacido vivo) se conviertan en indicadores no válidos, pues dependen de factores no controlados por los centros, como la voluntad de la paciente de reportar el resultado de la gestación, muchas veces controlados fuera de las clínicas de reproducción. Ante este problema, Clarke et al. (2010) demostraron, analizando 67 revisiones sistemáticas, una relación directa entre tasa de embarazo clínico y tasa de nacido vivo (una diferencia entre ambas tasas del 5,5% en valor absoluto y del 10% en valor relativo), dejando en evidencia que la eficacia de un tratamiento en RA basado en embarazo clínico o nacido vivo es comparable. Además, actualmente se considera como indicador de calidad de efectividad ideal aquel que recoja la tasa de gestación acumulada, es decir, las gestaciones obtenidas tras transferencia con embriones frescos y con embriones crioconservados obtenidos en una punción (McLernon et al., 2016), y ninguno de los dos documentos comenta este aspecto. No obstante, la dificultad de obtener este indicador con todos los embriones generados en un ciclo es muy alta, pues obligaría a esperar a la descrioconservación de todos los embriones obtenidos, lo que demoraría su cálculo y disminuiría su utilidad como indicador clínico.
En cuanto al denominador a utilizar para un indicador de calidad de efectividad de FIV (ciclos, punciones o transferencias), creemos que debe ser la transferencia como propone el GICa-ASEBIR, pues los otros dos generarían indicadores de calidad no válidos al verse influidos por la políticas de congelación de cada centro, tipo «freeze-all» (De Geyter et al., 2016). Esto mismo sucedería si utilizáramos como indicador de utilización de criopreservación embrionaria el propuesto por el MBP-SEF (porcentaje de ciclos con congelación de embriones respecto del total de ciclos) en vez del descrito por ASEBIR (porcentaje de preembriones crioconservados del total de embriones).
Creemos importante destacar, además de la alta heterogeneidad de los indicadores de efectividad de las TRA en el MBP-SEF, que entre estos se propone la tasa de gestación bioquímica por ciclo como un indicador válido. En nuestra opinión, consideramos este indicador carente de objetividad, como se demuestra en un estudio para determinar si una única medición temprana de la hCG puede discriminar entre embarazos bioquímicos o clínicos (Charles et al., 2012). La determinación de hCG es totalmente subjetiva dependiendo del día de la realización y la técnica empleada. Estos hallazgos invalidarían su uso como indicador de calidad.
En relación con la valoración de la fecundación, el MBP-SEF resalta la valoración de las fecundaciones anómalas en tres pronúcleos en la técnica de FIV con ovocitos propios. Consideramos que, tal y como opinan otros autores (Scott, 2003), la valoración de la fecundación se debe referir a la presencia de dos pronúcleos, y no es relevante destacar las fecundaciones anómalas, y más específicamente la de tres pronúcleos que da lugar a embriones triploides (Joergensen et al., 2015). Aunque para la valoración individual de la pareja es relevante, no lo es para la evaluación de la calidad del laboratorio de reproducción. De la misma manera, y dado que el destino de los cigotos de 1PN se deja a criterio del embriólogo según el cuaderno de embriología de Criterios de Valoración Ovocitaria y Embrionaria elaborado por ASEBIR (2015), no creemos adecuado su uso como indicador de calidad global del laboratorio.
Publicaciones posteriores no tienen en cuenta si las fecundaciones anómalas constan de uno, tres o más pronúcleos (Petersen et al., 2016), y dan importancia únicamente a las fecundaciones correctas y que muestran dos pronúcleos. De la misma manera, el Registro Nacional de Actividad-Registro de la SEF tampoco solicita a los centros participantes el dato de las fecundaciones anómalas, en ninguna de sus variantes, ni en ninguna de las técnicas registradas, por lo que no creemos que la medición de la fecundación en 3PN sea de utilidad clínica, debiéndose utilizar solo como indicador de fecundación la aparición de 2PN.
Por otro lado, la discrepancia observada en el único estándar publicado por el MBP-SEF y los estándares del GICa-ASEBIR se debe a la metodología utilizada (basada en consenso para el MBP-SEF; y basada en el estado del arte para el GICa-ASEBIR), por lo que creemos necesario un consenso nacional para establecer las especificaciones de calidad de cualquier indicador, como han realizado en el ámbito del laboratorio clínico diferentes sociedades científicas españolas (Buño et al., 2008). Como sabemos, los indicadores de calidad se pueden calcular de distintas maneras, y entre ellas está la basada en el estado del arte de las técnicas. El uso del estado del arte ha sido propuesto por muchos grupos, entre ellos la Sociedad Francesa de Biología Clínica (Vassault et al., 1999) y la Asociación Española de Farmacéuticos Analistas (AEFA) (Calafell et al., 2002). El estado del arte, como se evidencia de las Pruebas de Aptitud o de los Programas de Evaluación Externa de la Calidad, ha sido defendido ampliamente como especificación de la calidad, particularmente cuando las prestaciones alcanzadas por los mejores laboratorios, típicamente el mejor 20%, se toma como valor diana. El estado del arte hace referencia al nivel más alto de desarrollo conseguido en un momento dado sobre cualquier aparato, técnica o campo científico. El concepto subyacente es que, si uno de cada cinco laboratorios puede conseguir este nivel de calidad, entonces la tecnología y la metodología son suficientes para que todos los laboratorios puedan conseguir el mismo nivel de prestación analítica. En el GICa-ASEBIR, para establecer las Especificaciones de Calidad basadas en el estado del arte se utilizan los datos anuales del Registro Nacional de actividad-Registro SEF (Zamora et al., 2014; Prados et al., 2014).
Con respecto a los términos utilizados en la definición de almacenamiento en N2 líquido de los embriones, creemos necesaria una homogenización de la terminología empleada y recomendamos seguir lo referido en la única norma aprobada por la Asociación Española de Normalización y Certificación (AENOR) en el ámbito de la reproducción asistida (Norma UNE 179007, 2013), utilizando el término «crioconservación» de embriones.
Por último, no tiene sentido hablar de número medio de embriones transferidos por ciclo, debe ser por transferencia, puesto que, de lo contrario, las malas respondedoras o fallos de fecundación hacen que el indicador se vea afectado por problemas que no tienen nada que ver con la política de transferencia embrionaria del laboratorio, es decir, hablar de número medio de embriones transferidos por ciclo resta valor a dicho indicador.
En conclusión, nuestro estudio pone de manifiesto grandes discrepancias entre los dos documentos analizados. Parece necesaria una estandarización de los indicadores de calidad de los procesos del LRHA que permita evaluar concretamente las distintas actividades (ejemplo: estimulación ovárica, punción ovárica, laboratorio). Esta estandarización debería estar en línea con los documentos de calidad del laboratorio de reproducción humana asistida de entidades certificadoras nacionales como la UNE 179007 (2013).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaTodos los autores contribuyeron a la concepción y diseño del estudio, al análisis e interpretación de los datos, a la redacción del artículo, a la revisión crítica de los contenidos, y dieron su aprobación final a la versión que se publicará.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.