La hormona antimulleriana (HAM) es considerada un marcador bioquímico de gran utilidad en el campo de la reproducción asistida. En este estudio validamos el método de medición de la HAM (ECLIA Roche Diagnostics) para muestras de líquidos foliculares. El objetivo principal es definir su aplicación como marcador predictivo de reserva y respuesta a la estimulación ovárica controlada, tanto en muestras séricas como en muestras de líquido folicular, y además calcular el punto de corte para el diagnóstico de la baja respuesta ovárica en nuestra población.
Material y métodosCuantificamos niveles de hormona folículo estimulante (FSH), estradiol y HAM sérica en el día 3 del ciclo de 100 pacientes sometidas a técnicas de reproducción asistida y determinamos la concentración de HAM en el líquido folicular aspirado durante la punción ovárica. Además se registra recuento de folículos antrales en condiciones basales y el número de ovocitos captados tras dicho tratamiento. Todas estas pacientes cumplen criterios de inclusión para técnicas de FIV/ICSI según la guía de reproducción asistida del Servicio Andaluz de Salud.
ResultadosSe detectaron correlaciones positivas entre HAM (tanto sérica como folicular) y el RFA (r=0,69 y r=0,83, respectivamente) y también con la respuesta ovárica (r=0,62 y 0,87, respectivamente) con p<0,01. Para la FSH la correlación fue negativa y con valores r=–0,31 y r=–0,19, respectivamente con p<0,05. El punto de corte calculado mediante curva ROC (área bajo la curva) para la detección de la baja respuesta ovárica (<5 ovocitos recuperados) fue de 0,83 en caso de HAM sérica y de 0,81 para concentraciones de HAM folicular.
ConclusionesValidamos el método ECLIA de Roche Diagnostics para la cuantificación de HAM en muestras de líquidos foliculares. Confirmamos que la concentración de HAM, tanto sérica como folicular, es mejor predictor de reserva ovárica y de respuesta ovárica que la FSH, y establecemos los puntos de corte en nuestra población para la detección de mujeres con bajas expectativas de respuesta, y por tanto con baja probabilidad de éxito reproductivo, y aquellas con altas respuestas, con la finalidad de realizar una prevención del síndrome de hiperestimulación ovárica.
The anti-Mullerian hormone (AMH) is considered an extremely useful biochemical marker in the field of Assisted Reproduction. This study evaluates the method for the determination of AMH (ECLIA Roche Diagnostics) in follicular fluid specimens. The main objective is to determine its use as a predictive marker of reserve and response to controlled ovarian stimulation, in serum and follicular fluid, as well as the cut-off point for diagnosis of low ovarian response in our population.
Material and methodsThe levels of follicle-stimulating hormone (FSH), oestradiol, and serum AMH were determined on day 3 of the cycle in 100 patients being submitted to assisted reproduction techniques, together with the concentration of AMH in follicular fluid aspirated during the ovarian puncture. A count was also made of antral follicles under baseline conditions and the number of oocytes retrieved after treatment. All these patients complied with the inclusion criteria for IVF/ICSI techniques as per the guidelines for Assisted Reproduction of the Andalusian Health Service.
ResultsPositive relationships were detected between AMH (both serum and follicular) and the antral follicle count [AFC] (r=0.69 and r=0.83, respectively), as well as ovarian response (r=0.62 and 0.87, respectively) with P<.01. The correlation was negative for FSH with values of r=0.31 and r=0.19, respectively with P<.05. The cut-off point calculated using the area under the curve (ROC) for the detection of low ovarian response (<5 oocytes retrieved) was 0.83 for serum AMH and 0.81 for concentrations of follicular AMH.
ConclusionsThe ECLIA method by Roche Diagnostics for the quantitation of AMH in follicular fluid specimens is considered validated. The AMH concentration in either serum or follicular fluids is shown to be a better predictor of ovarian reserve and ovarian response than FSH, and the cut-off points established in our population for the detection of women with low response expectations, and therefore low probability of reproductive success, and those with high responses, in order to prevent ovarian hyperstimulation syndrome.
El ovario humano adquiere su capacidad funcional durante el desarrollo embrionario, como parte de un evento determinado crono-genéticamente, es decir, las mujeres tienen un número finito de folículos primordiales que constituyen la reserva ovárica y van disminuyendo de manera paulatina a lo largo de la vida reproductiva. Esta pérdida en la capacidad reproductiva se manifiesta clínicamente con la disminución de folículos antrales, tanto en cantidad como en calidad, disminuyendo así las posibilidades de conseguir embarazo y aumentando las de abortos espontáneos. La reducción de esta reserva folicular conlleva irreversiblemente un aumento de casos de infertilidad en la población general y a la necesidad de recurrir a técnicas de reproducción asistida (TRA) para satisfacer el deseo de gestar en estas mujeres (Pellicer et al., 1995). Desde hace décadas el patrón de referencia para determinar la reserva ovárica es el recuento de folículos antrales (RFA) en el día 3 del ciclo (D+3), aunque existen otros marcadores clínicos como la edad y marcadores bioquímicos como los niveles de hormona folículo estimulante (FSH) y estradiol en el día 2 o 3 del ciclo menstrual, con probada utilidad para evaluar de forma indirecta dicha reserva ovárica. En los últimos años la hormona antimulleriana (HAM) ha irrumpido en el campo de la reproducción asistida como un posible marcador de funcionalidad folicular, independientemente de la fase del ciclo menstrual en que se mida y con una reproducibilidad interobservador mucho mejor que otros marcadores utilizados previamente (Barad et al., 2009).
La hormona antimulleriana es una glucoproteína que pertenece a la familia del factor de crecimiento transformante β, es producida por las células de Sertoli y en el desarrollo embrionario es responsable de la regresión de los conductos paramesonéfricos. En la mujer es sintetizada por las células de la granulosa de los folículos primordiales, alcanzando su máxima expresión en folículos preantrales y antrales de pequeño tamaño (<6mm), siendo un modulador permisivo de la foliculogénesis y esteroidogénesis ovárica (Ficicioglu et al., 2006). Además de su valor para la detección de mujeres con baja reserva ovárica (Delgado-García et al., 2015; Broer et al., 2009; Van Rooij et al., 2002), existen múltiples estudios que demuestran su utilidad como indicador de protocolos de estimulación ovárica específicos, marcador de riesgo de complicaciones derivados de estos tratamientos como el síndrome de hiperestimulación ovárica (Lee et al., 2008; Ocal et al., 2011; Fanchin et al., 2003), o como factor predictivo de éxito de estas técnicas reproductivas (Reichman et al., 2014; Tal et al., 2015), entre muchas otras.
El objetivo de este estudio retrospectivo es valorar, por un lado, la relación existente entre los niveles de HAM detectados en suero y en el líquido folicular el día de la punción ovárica con la recuperación ovocitaria conseguida tras la misma, y por otro lado, comparar la utilidad de marcadores bioquímicos como la FSH, la HAM sérica y la HAM folicular como predictores de reserva ovárica con respecto al recuento de folículos antrales realizado en la consulta de reproducción asistida. Además, validamos el reactivo HAM de Roche Diagnostics para su utilización en muestras de líquido folicular y calculamos puntos de corte de la HAM sérica y en líquido folicular para el diagnóstico de baja respuesta ovárica.
Material y métodosPacientesPara llevar a cabo nuestro estudio hemos recogido suero y líquido folicular de 100 pacientes que acudieron a la unidad de reproducción asistida de nuestro hospital desde marzo a julio de 2015 para someterse a técnicas de reproducción asistida avanzada (IVF, ICSI) después de un primer ciclo de estimulación ovárica controlada. La extracción sanguínea para la medición de marcadores bioquímicos se realiza en condiciones basales (D+3), mientras que el líquido folicular se obtiene el día de la punción ovárica. El recuento de folículos antrales se realiza por 2 observadores expertos, mediante ecografía vaginal con el ecógrafo TOSHIBA APLIO X6 y sonda transvaginal TOSHIBA STV-GMHZ.
La edad de las pacientes oscila entre 24-40 años (media de 34 años), un 35% de ellas confiesan que son fumadoras habituales y un 33% tiene un IMC (peso en kg/altura en m2) por encima del ideal (≥25).
Protocolo de actuaciónFrenación ováricaEn nuestra unidad disponemos de 2 protocolos de frenación ovárica:
- -
Protocolo largo: en el que utilizamos análogo agonista de la GnRH (Procrin, Abbvie, España). Se introduce desde día 19-20 del ciclo previo.
- -
Protocolo corto: en el que se administra análogo antagonista de la GnRH (Orgalutran, MSD, España). Se introduce cuando se observa un folículo de 13-14mm o la concentración sérica de estradiol es ≥500pg/ml.
En ambos casos, después de confirmar la frenación ovárica mediante ecografía vaginal (ausencia de folículos>10mm de diámetro) y medición de estradiol sérico (<50pg/ml) se pauta tratamiento de estimulación ovárica con FSH recombinante (Puregon, MSD, España) y hormona de gonadotrofina menopáusica humana (Menopur, Ferrin, España).
El ajuste de dosis se realiza a criterio facultativo, según la edad de la paciente, el recuento de folículos antrales, los niveles de FSH y de estradiol basales, la causa de la esterilidad y los ciclos de estimulación previos. Durante el seguimiento de la paciente se programa la punción ovárica cuando los folículos observados ecográficamente tienen un diámetro superior a 18mm, y se indica como inductor de la ovulación la administración de 6.500UI de hCG (Ovitrelle, Serono, España) 36horas previas a dicha punción.
Las mujeres son clasificadas según la respuesta obtenida a la estimulación ovárica en 3 grupos: baja respuesta (<5 ovocitos recuperados), respuesta moderada (entre 5-12), alta respuesta (>12 ovocitos recuperados). Estas últimas tienen incrementado el riesgo de desarrollar síndrome de hiperestimulación ovárica, como complicación iatrogénica secundaria al tratamiento de estimulación.
Análisis bioquímicosHormona antimullerianaSe realizó extracción sanguínea a la totalidad de las pacientes incluidas en el estudio. Después de centrifugar la muestra a 3.500rpm durante 10minutos, se alicuotó el suero y se almacenó a –20°C hasta su procesamiento.
Los líquidos procedentes de la punción son trasladados inmediatamente al laboratorio. Tras realizar la captación ovocitaria son centrifugados, recogiéndose a continuación una muestra representativa (0,5ml de cada tubo obtenido en la punción) para la formación del pool de líquido folicular de cada paciente. Los folículos puncionados van desde 14mm hasta 22mm de diámetro, y al igual que en el caso anterior estos pools son almacenados a –20°C hasta realizar las determinaciones correspondientes.
Todas las muestras son procesadas por duplicado mediante técnica de electroquimioluminiscencia (ECLIA), con el autoanalizador cobas 6000 (módulo e601) y usando el kit HAM de Roche Diagnostics (n.° de referencia 06331076-190, n.°lote: 172089-01).
Hormona folículo estimulante y estradiol en sueroLos niveles de FSH y estradiol son medidos mediante técnica de electroquimioluminiscencia (ECLIA) usando los kits FSH (n.° de referencia 11775863-122, n.° lote:18198301) y estradiol gen.3 (n.° de referencia 06656021-190, n.° lote 17399803) en el analizador modular e170 de Roche Diagnostics.
Estudio estadístico- -
Evaluación preliminar de validación del reactivo HAM de Roche Diagnostics para la determinación de dicha hormona en muestras de líquido folicular, según protocolo NCCLS documento EP10, incluyendo estudio de imprecisión, linealidad y correlación entre los niveles de HAM en líquido folicular y HAM en suero.
- -
Mediante el test de de Kolmogorov-Smirnov llegamos a la conclusión de que no podemos asumir la normalidad de la población para las variables en estudio, por lo que todo el análisis estadístico se va a basar en la aplicación de test no paramétricos.
- -
Para el estudio descriptivo de las variables (Edad, FSH, estradiol, RFA, HAM sérica y HAM folicular) en la población se utiliza la mediana, valor intercuartílico y valor mínimo y máximo.
- -
Para analizar la correlación entre los valores de HAM en líquido folicular y valores de HAM en suero se realiza un estudio de regresión lineal con intervalo de predicción al 95%, calculando coeficiente de correlación y recta de regresión.
- -
Posteriormente calculamos el coeficiente de correlación Rho-Spearman para conocer el grado de asociación entre el recuento de folículos antrales, considerado marcador gold standard de reserva ovárica y los diversos marcadores bioquímicos de reserva ovárica disponibles (HAM en suero, HAM en líquido y FSH).
- -
Además realizamos análisis de los valores de HAM tanto sérica como folicular, en relación con la respuesta ovárica de las pacientes: baja respuesta (n=31), respuesta moderada (n=36) y alta respuesta (n=33). Aplicamos test Kruskal-Wallis para detectar si existen diferencias significativas entre los niveles de HAM sérica y HAM folicular según la respuesta ovárica a la estimulación (baja, moderada o alta). Consideramos que existen diferencias significativas cuando p<0,01.
- -
Por último, mediante la realización de receiver operating characteristic curve, calculamos puntos de corte de HAM folicular, HAM sérica y FSH para la detección de pacientes con baja respuesta ovárica. Además comparamos la potencia diagnóstica de la HAM sérica y HAM folicular como marcadores de baja reserva mediante cálculo de sensibilidad, especificidad, tasa de falsos positivos y tasa de falsos negativos.
Todo el análisis estadístico se ha realizado mediante programa informático SPSS 15.0.
Consideraciones éticasEl estudio se llevó a cabo de acuerdo a las recomendaciones para estudios de investigación hecha en seres humanos y siguiendo las normas de buena práctica clínica y la Declaración de Helsinki, revisada en Tokio, Venecia, Hong-Kong, Sudáfrica y Edimburgo (2000) y en la actual legislación española en materia de estudios observacionales.
Las pacientes incluidas en el estudio firmaron consentimiento informado aprobado por el comité de ética de nuestro hospital.
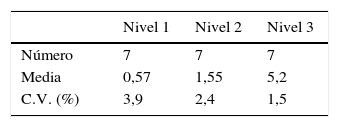
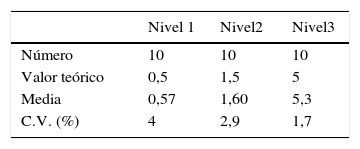
ResultadosEstudio de imprecisiónIntraserialLa imprecisión intraserial se obtuvo a partir de 21 muestras de 3 especímenes de líquido folicular valoradas para HAM (nivel 1: 0,5ng/ml, nivel 2:1,5ng/ml y nivel 3: 5ng/ml) en 3 series consecutivas. Los resultados se muestran en la tabla 1.
InterserialLa imprecisión interserial se obtuvo a partir de 30 muestras de 3 especímenes de líquido folicular con concentraciones diferentes de HAM (nivel 1: 0,5ng/ml, nivel 2: 1,5ng/ml y nivel 3: 5ng/ml) en 10 días consecutivos. Los resultados se muestran en la tabla 2.
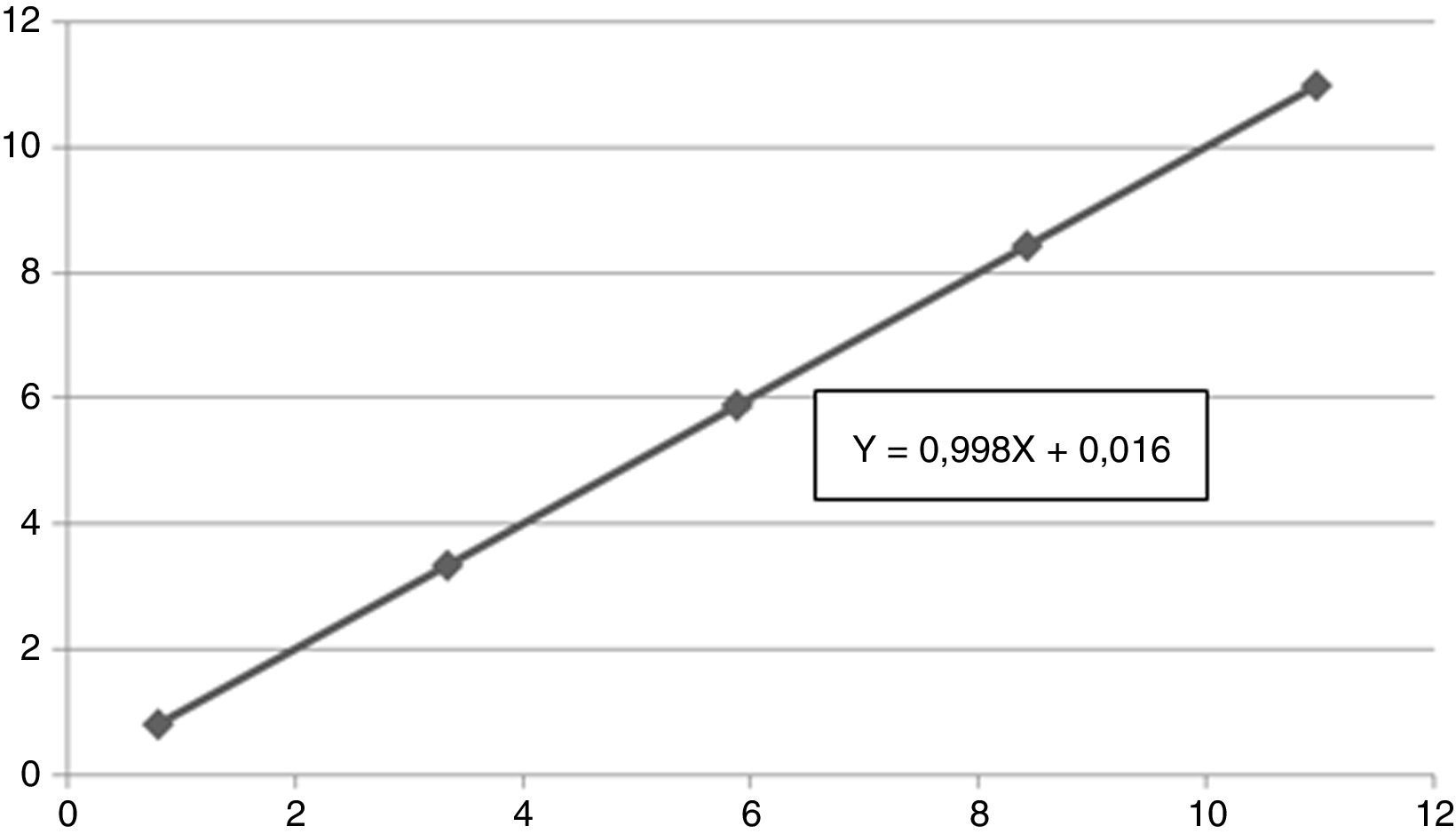
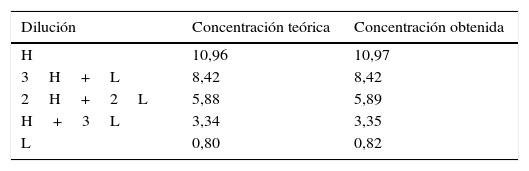
Estudio de linealidadPara el estudio de linealidad se ha utilizado 2 muestras de líquido folicular de 2 pacientes sometidas a punción folicular a las que se les determinó HAM en dicho espécimen. Una de ellas con concentración elevada (H) 10,96ng/ml y la otra con valores bajos (L) 0,80ng/ml. Las proporciones de la mezcla de ambas muestras fueron: H, 3H+L, 2H+2L, H+3L,L. Las muestras se analizaron por duplicado y se tomó la media. Los resultados se muestran a continuación, en la tabla 3, junto a la figura 1 de linealidad:
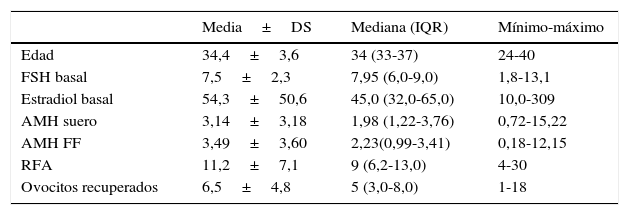
La mediana observada de HAM en líquido folicular es de 2,23 (Pellicer et al., 1995; Delgado-García et al., 2015) mientras que la mediana de HAM en el suero de dichas pacientes fue de 1,98 (Pellicer et al., 1995; Barad et al., 2009; Ficicioglu et al., 2006; Ocal et al., 2011). Es evidente que el valor en las muestras de líquido es superior que en suero, pero sin significación estadística (p>0,05). El resto de estudio descriptivo realizado en nuestra población de estudio queda reflejado en la tabla 4.
Estadísticos descriptivos de la población de estudio
| Media±DS | Mediana (IQR) | Mínimo-máximo | |
|---|---|---|---|
| Edad | 34,4±3,6 | 34 (33-37) | 24-40 |
| FSH basal | 7,5±2,3 | 7,95 (6,0-9,0) | 1,8-13,1 |
| Estradiol basal | 54,3±50,6 | 45,0 (32,0-65,0) | 10,0-309 |
| AMH suero | 3,14±3,18 | 1,98 (1,22-3,76) | 0,72-15,22 |
| AMH FF | 3,49±3,60 | 2,23(0,99-3,41) | 0,18-12,15 |
| RFA | 11,2±7,1 | 9 (6,2-13,0) | 4-30 |
| Ovocitos recuperados | 6,5±4,8 | 5 (3,0-8,0) | 1-18 |
AMH: hormona antimulleriana; DS: desviación típica; FF: líquido folicular; FSH: hormona folículo estimulante; IQR: rango intercuartílico; RFA: recuento de folículos antrales.
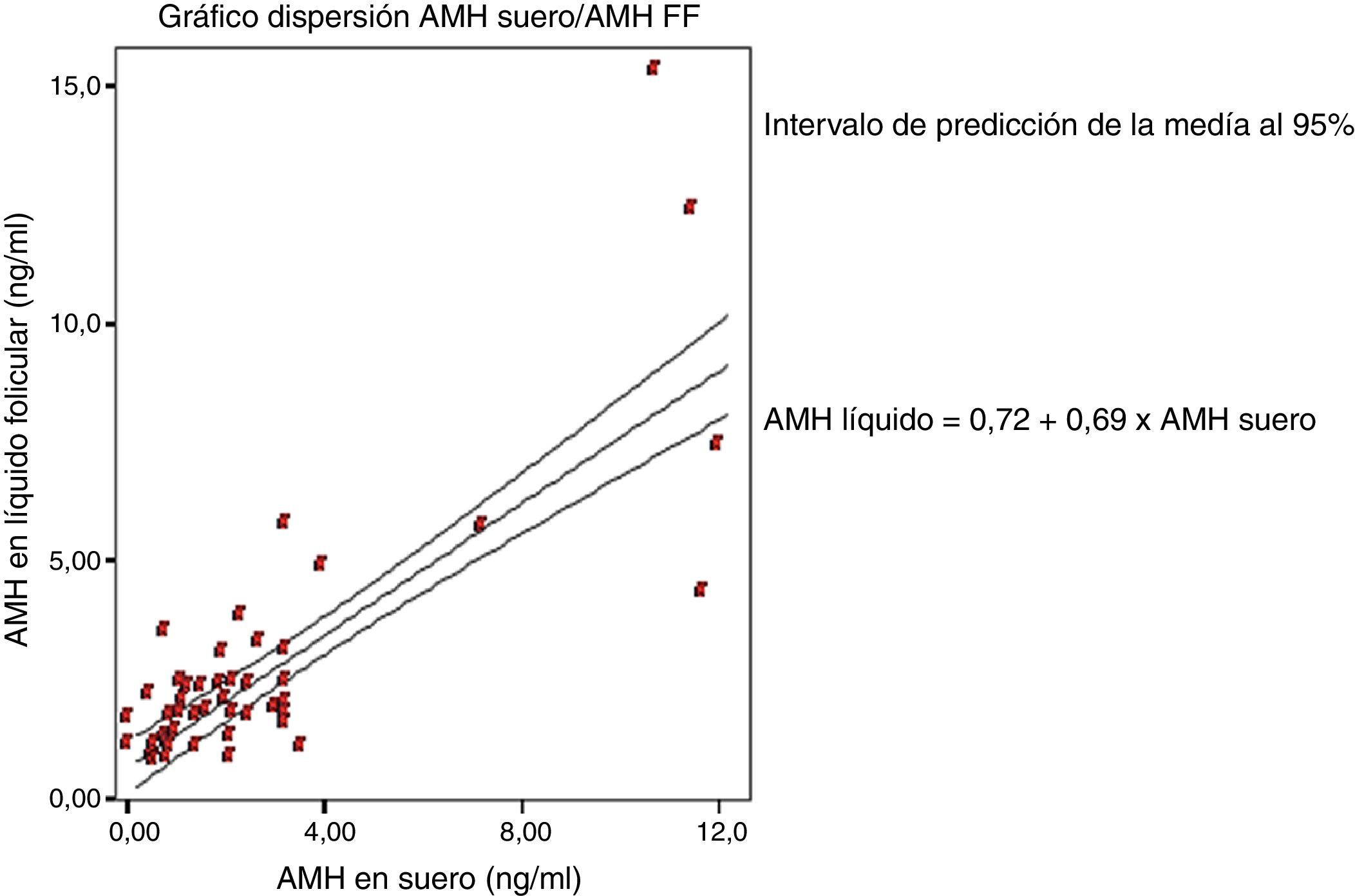
En el diagrama de dispersión (fig. 2) podemos observar la correlación positiva existente entre los niveles de HAM folicular y HAM sérica, con un coeficiente de correlación de 0,785 y una fórmula de la recta de regresión y=0,71+0,89x (siendo y el valor de HAM folicular y x el valor de HAM en suero).
Evaluación de la utilidad de diversos marcadores bioquímicos y del recuento de folículos antrales en la valoración de la reserva ovárica y en la recuperación ovocitaria tras estimulación ovárica controladaPara conocer la utilidad de la FSH, la HAM sérica y la HAM folicular como marcadores de reserva ovárica realizamos estudio de correlación (Rho-Spearman) con respecto al recuento de folículos antrales realizado en la consulta de reproducción asistida cuando se valora la indicación en estas pacientes de técnicas de reproducción asistida avanzada (FIV/ICSI). Detectamos correlaciones positivas en el caso de HAM folicular (r=0,83) y HAM sérica (r=0,69), mientras que para la hormona FSH la correlación es de valor negativo (r=–0,31), todas ellas con significación estadística (p<0,01).
Posteriormente, realizamos el mismo análisis estadístico pero con respecto al número de ovocitos recuperados tras la punción ovárica, para así valorar la utilidad real de dichos marcadores como predictores de respuesta ovárica en ciclos FIV/ICSI. Al igual que en el caso anterior, las correlaciones detectadas son positivas tanto para HAM folicular (r=0,87) como HAM sérica (r=0,62) con significación estadística (p<0,01), mientras que para la FSH es negativa (r=–0,19, p<0,05).
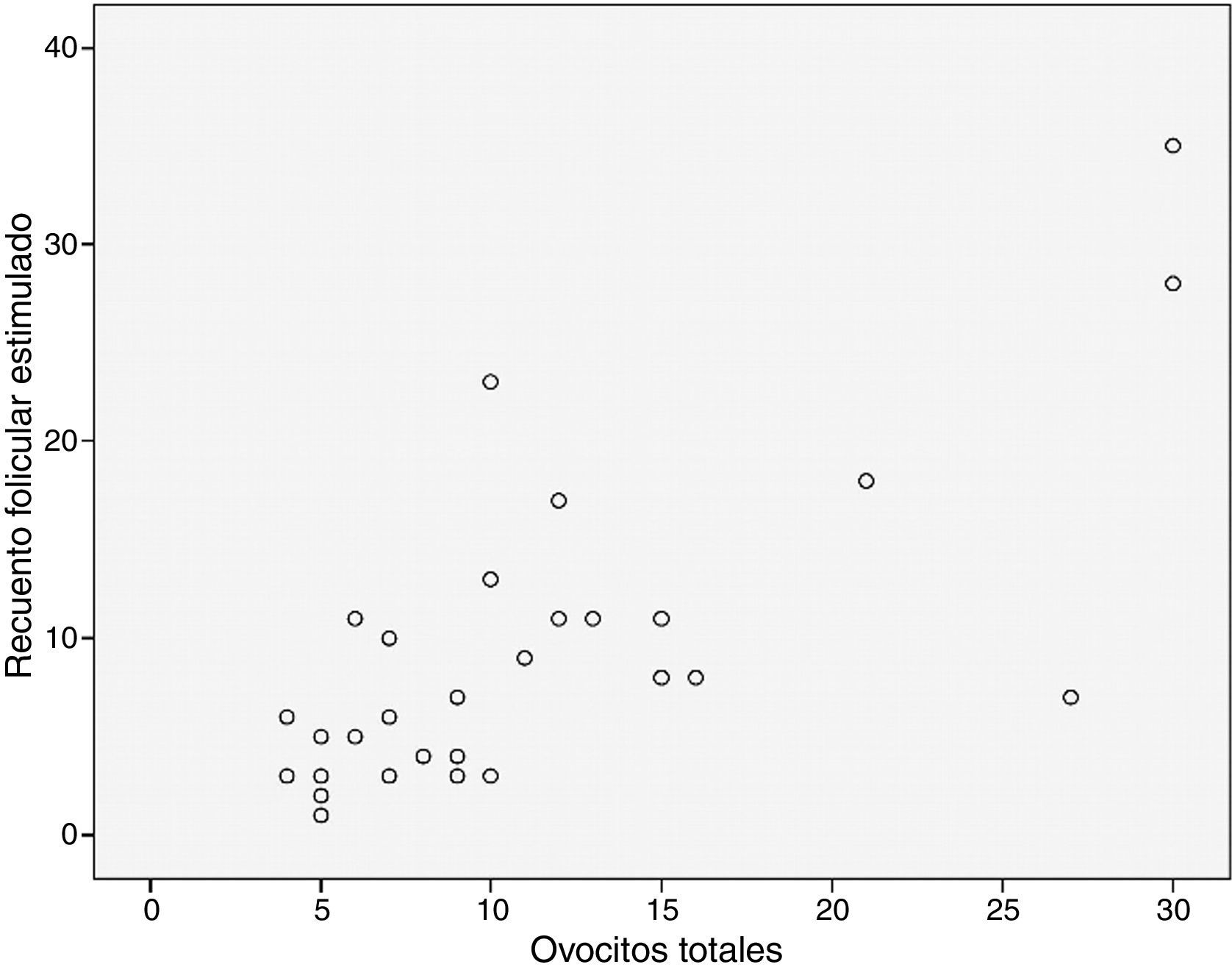
Además, en nuestra población de estudio hemos realizado un estudio de correlación (Rho-Spearman) para comprobar la relación ente el RFA y la recuperación de ovocitos tras la estimulación ovárica. En el diagrama de dispersión (fig. 3) podemos observar la correlación positiva existente entre ambas variables, con un coeficiente de correlación de 0,755, con significación estadística (p<0,01).
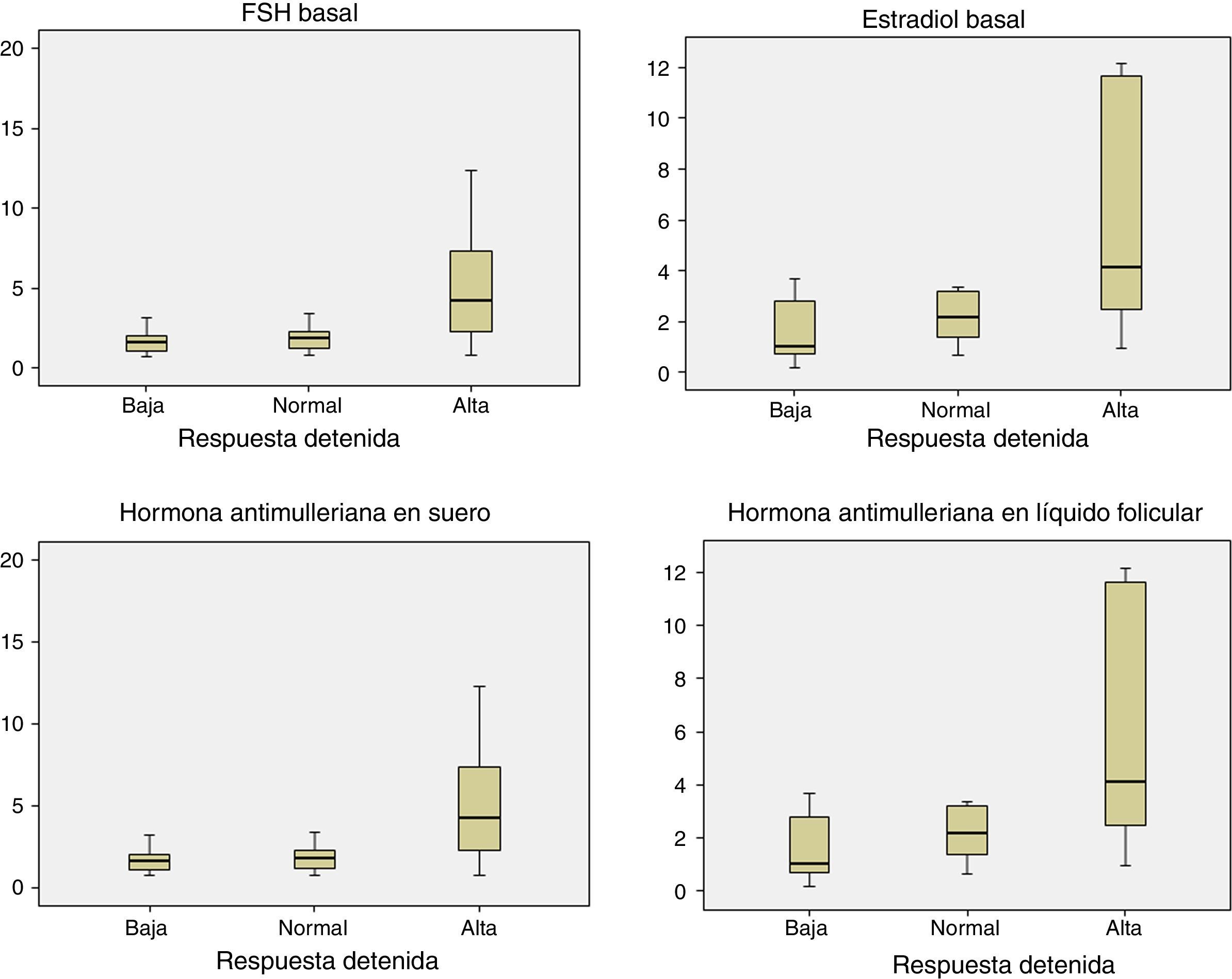
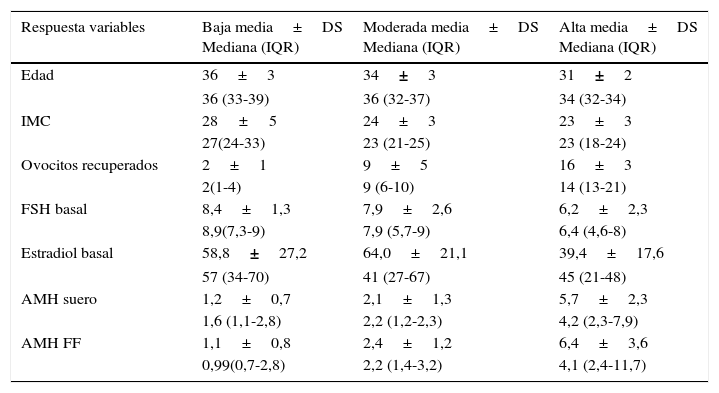
Puntos de corte de hormona folículo estimulante, estradiol, hormona antimulleriana sérica y hormona antimulleriana folicular observados en nuestra población de estudio en relación con la respuesta ováricaEn la tabla 5 se presentan las características clínicas de los 3 grupos de mujeres estudiadas: baja respondedoras (<5 ovocitos recuperados), respondedoras moderadas (entre 5-12 ovocitos) y altas respondedoras (>12 ovocitos recuperados), así como el análisis descriptivo (media y desviación estándar, mediana y rango intercuartílico) de los niveles de FSH, estradiol, HAM sérica y HAM folicular observados. Se realiza representación gráfica de las variables analíticas mediante diagrama de cajas (fig. 4).
Estadísticos descriptivos de la población de estudio según la respuesta ovárica obtenida
| Respuesta variables | Baja media±DS Mediana (IQR) | Moderada media±DS Mediana (IQR) | Alta media±DS Mediana (IQR) |
|---|---|---|---|
| Edad | 36±3 | 34±3 | 31±2 |
| 36 (33-39) | 36 (32-37) | 34 (32-34) | |
| IMC | 28±5 | 24±3 | 23±3 |
| 27(24-33) | 23 (21-25) | 23 (18-24) | |
| Ovocitos recuperados | 2±1 | 9±5 | 16±3 |
| 2(1-4) | 9 (6-10) | 14 (13-21) | |
| FSH basal | 8,4±1,3 | 7,9±2,6 | 6,2±2,3 |
| 8,9(7,3-9) | 7,9 (5,7-9) | 6,4 (4,6-8) | |
| Estradiol basal | 58,8±27,2 | 64,0±21,1 | 39,4±17,6 |
| 57 (34-70) | 41 (27-67) | 45 (21-48) | |
| AMH suero | 1,2±0,7 | 2,1±1,3 | 5,7±2,3 |
| 1,6 (1,1-2,8) | 2,2 (1,2-2,3) | 4,2 (2,3-7,9) | |
| AMH FF | 1,1±0,8 | 2,4±1,2 | 6,4±3,6 |
| 0,99(0,7-2,8) | 2,2 (1,4-3,2) | 4,1 (2,4-11,7) |
AMH: hormona antimulleriana; DS: desviación típica; FF: líquido folicular; FSH: hormona folículo estimulante; IQR: rango intercuartílico; IMC: índice de masa corporal.
Seguidamente realizamos análisis de Kruskal-Wallis, detectándose para las variables IMC (p<0,01), ovocitos recuperados (p<0,01), FSH (p<0,01), HAM sérica (p<0,01) y HAM folicular (p<0,01), diferencias significativas entre los 3 grupos definidos. En el caso del estradiol basal dicha diferencia no es significativa (p=0,48).
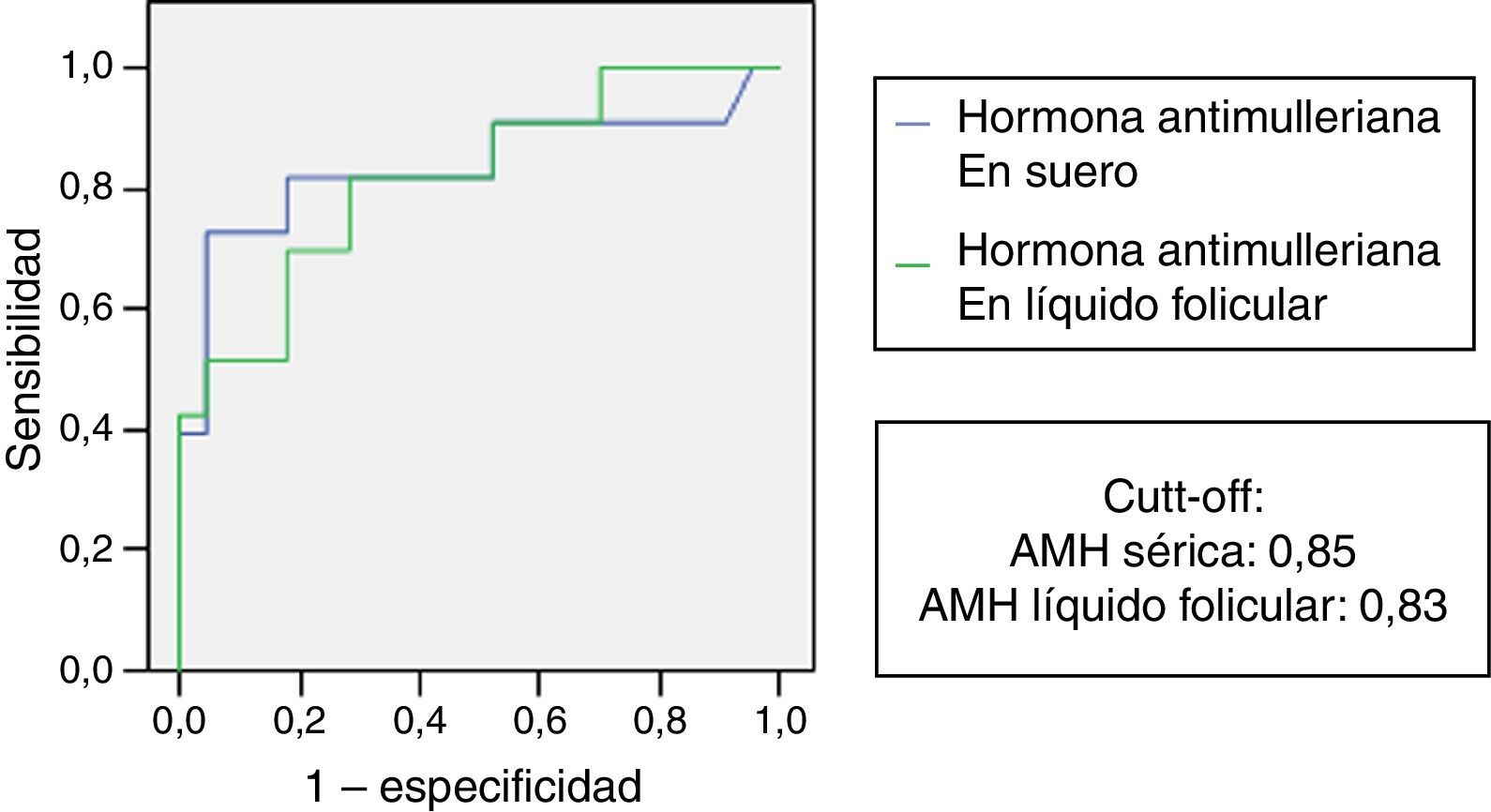
Cálculo de puntos de corte de hormona folículo estimulante, hormona antimulleriana sérica y hormona antimulleriana folicular para detectar mujeres con baja respuesta ováricaPara calcular cut-off de FSH, HAM sérica y HAM en líquido folicular en el grupo de mujeres con baja respuesta a la estimulación ovárica, realizamos estudio de receiver operating characteristic curve y análisis de área bajo la curva (fig. 5). En nuestro grupo de estudio encontramos que el punto de corte para la HAM sérica (basada en la mejor sensibilidad y mejor especificidad) es de 0,83ng/ml, y para HAM folicular de 0,81ng/ml, con áreas bajo la curva de 0,84 y 0,82, respectivamente. En el caso de la FSH el área bajo la curva detectada es de 0,308, lo que refleja poco valor discriminatorio como prueba diagnóstica de baja reserva ovárica.
En la tabla 6 se indica valores cut-off de HAM sérica y folicular para predecir baja respuesta junto a la sensibilidad, especificidad y área bajo la curva detectadas.
Niveles cut-off de AMH en suero y en líquido folicular para la detección de bajas respondedoras
| AMH | ROC | Sensibilidad (%) | Especificidad (%) | Cut-off (ng/ml) | p |
|---|---|---|---|---|---|
| Suero | 0,84 | 82% | 79% | 0,83 | <0,01 |
| FF | 0,82 | 80% | 77% | 0,81 | <0,01 |
AMH: hormona antimulleriana; FF: líquido folicular; valor p: significación estadística.
La medición de HAM intrafolicular supone un marcador bioquímico interesante como indicador del control autocrino y paracrino en estadios iniciales del desarrollo folicular, reflejando en definitiva la capacidad de diferenciación y selección folicular hacia un ovocito maduro tanto desde el punto de vista nuclear como citoplasmático (Weenen et al., 2004; Da Silva et al., 2010; Hu et al., 2014). Por ello, la medición en líquido folicular podría utilizarse como marcador predictivo de reserva ovárica tras la realización de un ciclo de estimulación con punción ovárica, calidad ovocitaria y/o embrionaria y de tasa de implantación. Nuestro estudio nos ha permitido conocer las cantidades reales de HAM presentes en el líquido folicular de nuestras pacientes, poniendo de manifiesto la similitud de estos con respecto a los observados en sangre, aunque de manera global presentan cifras más elevadas pero sin significación estadística (1,98 vs 2,23). Este hecho pone de manifiesto que dicha hormona es producida por folículos preantrales y antrales pequeños (<6mm) en crecimiento debido a la estimulación ovárica controlada utilizada en estos tratamientos, pero que su medición en líquido folicular no aporta ningún valor sobreañadido a su medición en suero como marcador predictivo de reserva ovárica.
El análisis realizado para validar la utilización de este reactivo en muestras de líquido folicular demuestra que el estudio de imprecisión intraserial e interserial a distintas concentraciones se mantuvo inferior al 5% de coeficiente de variación propuesto para estas técnicas inmunológicas, se obtuvo una linealidad satisfactoria entre los valores teóricos y los obtenidos experimentalmente (pendiente: 0,998, ordenada: 0,016 y r=0,999) y las concentraciones observadas en este tipo de espécimen presentan una buena correlación con las detectadas en suero de las mismas pacientes, con un valor r=0,785 y, por tanto, como reflejan otros estudios previos, sus valores en este espécimen podrían ser útiles como marcadores predictivos de reserva ovárica y recuperación ovocitaria tras ciclo FIV/ICSI (Fanchin et al., 2007).
Desde hace décadas se conoce la importancia de realizar una correcta valoración de la reserva ovárica de las mujeres que van a ser candidatas a someterse a técnicas de reproducción asistida avanzada (FIV/ICSI), ya que en gran medida es un punto crucial como factor pronóstico de éxito reproductivo. Clásicamente el RFA en el día 3 del ciclo ovárico se ha considerado como la prueba gold standard, aunque posteriormente se han ido utilizando otros marcadores demográficos como la edad, marcadores bioquímicos como la FSH y el estradiol sérico medido en condiciones basales o más recientemente la HAM en sangre. Nuestro estudio confirma, al igual que otras publicaciones previas, la buena correlación existente entre el RFA y los valores de HAM sérica (Franchin et al., 2003; Feyerreisen et al., 2006), detectando que es aún mejor si dicha medición se realiza en las muestras foliculares (0,69 vs 0,83), mientras que para la FSH en suero detecta una correlación negativa, es decir, a mayores valores de FSH peor reserva ovárica, pero con un valor de correlación r mucho más débil (–0,31), llegando por tanto a la conclusión que de la determinación de HAM es actualmente el mejor marcador disponible para valorar la reserva ovárica femenina (Kunt et al., 2011). Si además evaluamos el comportamiento de dichos marcadores en relación con la recuperación ovárica observamos valores de correlación buenos, tanto para el RFA como para la HAM sérica y para la HAM folicular, siendo también mayor en este último caso (0,755, 0.62 vs 0,87). Para la FSH dicha asociación es muy pobre, incluso más débil que cuando se relaciona con el RFA (–0,19). Por tanto también confirmamos su utilidad como predictor de respuesta cuantitativa en ciclos FIV/ICSI, como ya se ha descrito en otros estudios previos (Tolikas et al., 2011; Nelson et al., 2015).
Por otra parte es conocido que la respuesta ovárica a la estimulación está influenciada por otros factores como la edad, el peso, el hábito tabáquico, etc. (Wright et al., 2006; Waylen et al., 2009; Fedorcsak et al., 2004; Lintsen et al., 2005). En nuestro estudio se evidencia el aumento en la edad y en el IMC de aquellas mujeres catalogadas como bajas respondedoras, además de presentar unos puntos de corte de FSH y estradiol séricos más altos y de HAM tanto en sangre como en líquido folicular más bajos, reflejo de la presencia de baja reserva ovárica. Todos ellos presentan significación estadística excepto para el estradiol sérico. También hay que destacar los puntos de corte de HAM detectadas en el grupo de altas respondedoras, con valores medios de 5,7 vs 6,4 en sangre y líquido folicular respectivamente, corroborando como se recogen en diversas publicaciones su indicación de medición en mujeres altas respondedoras para conocer el riesgo a priori de desarrollar síndrome de hiperestimulación ovárica, una de las complicaciones más temidas en reproducción asistida (Lee et al., 2008).
Otro punto crítico actualmente en la medicina reproductiva es la detección de mujeres con baja capacidad de respuesta ovárica tras la administración de gonadotropinas exógenas. Estas constituyen un grupo especial a tener en cuenta, con peor pronóstico reproductivo y con necesidad en muchas ocasiones de recurrir a otras técnicas de reproducción como la ovodonación para conseguir un embarazo clínico. La definición de «pobre respuesta» es un ítem controvertido, adquiriendo la HAM un papel importante en este sentido, ya que existen múltiples investigaciones que han observado su más que aceptable sensibilidad y especificidad como marcador para la detección de dichas pacientes con mala respuesta (Tarlatzis et al., 2003; Salmassi et al., 2015; Honnma et al., 2012). Nuestro estudio presenta un punto de corte de HAM en suero y líquido folicular dentro del rango propuesto por la Sociedad Europea de Reproducción Humana y Embriología (0,5-1,1ng/ml)(Ferraretti et al., 2011). Así, para un punto de corte de 0,83ng/ml en suero y 0,81ng/ml en líquido folicular la sensibilidad observada es de un 82% vs 80% y la especificidad de un 79% vs 77% (área bajo la curva de 0,84 vs 0,82). En definitiva podemos afirmar que, utilizando estos valores como puntos de corte, podemos predecir aquellas pacientes que van a presentar una mala respuesta a la estimulación, anticiparnos en el diagnóstico y mejorar la eficiencia de nuestra práctica clínica, disminuyendo el gasto en la medicación, el estrés emocional de la paciente y el número de ciclos de estimulación ovárica cancelados. La HAM se considera el mejor marcador bioquímico de reserva ovárica y el mejor predictor de respuesta tras dicha estimulación (Cupisti et al., 2012).
ConclusionesLa HAM es un parámetro bioquímico que presenta alta sensibilidad y especificidad como marcador predictivo de respuesta a la estimulación ovárica, sin que existan diferencias significativas cuando dicha medición se realiza en muestras de líquido folicular. Su determinación es una herramienta útil para valorar la reserva ovárica de la mujer, detectar aquellas con bajas expectativas de respuesta o con riesgo de síndrome de hiperestimulación ovárica, siempre que se utilicen unos puntos de corte adecuados al tipo de muestra analizada (suero o líquido folicular) y acorde a nuestra población de estudio, pero sin que la medición en muestras de líquido folicular aporte un valor sobreañadido a la medición sérica.
Los estudios existentes sobre la utilidad real de las concentraciones de HAM en líquido folicular son muy limitados. En este sentido, se nos abre un amplio campo de investigación, valorando si la medición en este espécimen sería útil en medicina reproductiva como marcador predictivo de madurez ovocitaria, calidad embrionaria, éxito reproductivo, complicaciones durante el embarazo, etc.
Por otro lado, queda demostrada la validación clínica del reactivo HAM de Roche Diagnostics para la medición de este analito en muestras de líquido folicular, con un estudio de imprecisión, linealidad y coeficiente de correlación más que aceptable con respecto a los niveles de HAM en sangre.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.