La quimioterapia es el pilar fundamental del tratamiento del cáncer, pero induce la anormal activación de los folículos primordiales que permanecen quiescentes en el ovario desde el nacimiento, produciendo así insuficiencia ovárica precoz y esterilidad, como consecuencia del consumo incesante de la reserva ovárica. Existen tratamientos, todavía experimentales, que han demostrado evitar el consumo de folículos primordiales quiescentes y prevenir así la pérdida de folículos durante el tratamiento quimioterápico. Su uso ha sido probado en ensayos experimentales, pero faltan estudios que demuestren su aplicabilidad en humanos. En este trabajo se presentan diferentes fármacos en cotratamiento con la quimioterapia capaces de preservar la fertilidad, que actúan sobre la vía de activación del folículo primordial.
Chemotherapy is the main treatment in cancer; nevertheless it induces the abnormal activation of primordial follicles that remain quiescent in the ovaries since birth, thus producing early ovarian failure due to the incessant consumption of the ovarian reserve. Some experimental treatments have recently demonstrated how to avoid the primordial follicle consumption, and prevent the loss of follicles during chemotherapy treatment. Although its use has been tested in experimental and controlled studies, more scientific evidence is necessary to demonstrate its applicability in humans. In this review, different drugs in co-treatment with chemotherapy able to preserve fertility in animal models are presented, acting on the primordial follicle activation pathway.
La quimioterapia es uno de los pilares fundamentales en el tratamiento del cáncer, pero puede dañar diferentes órganos, dependiendo de la edad y el sexo del paciente y de la dosis (Letourneau et al., 2012).
Los agentes quimioterápicos inhiben la proliferación celular e inducen la activación de los folículos primordiales, que permanecen quiescentes en el ovario desde el nacimiento (Morgan et al., 2012), y producen insuficiencia ovárica precoz y esterilidad, como consecuencia del consumo incesante de la reserva ovárica. Dicha insuficiencia ovárica precoz resulta en un aumento de la morbilidad debido a la pérdida de masa ósea, disfunción cognitiva, disfunción sexual, enfermedad cardiovascular y esterilidad. Es, por tanto, de especial interés preservar la fertilidad en mujeres con cáncer para mantener su calidad de vida tras su superación (Rodriguez-Wallberg y Oktay, 2014).
Existen tratamientos experimentales que han demostrado que evitan el consumo de folículos primordiales quiescentes y previenen la pérdida de folículos durante el tratamiento quimioterápico en modelos animales (Kim, 2006).
En este trabajo se presentan, en primer lugar, las vías de señalización intracelular de la foliculogénesis, concretamente, la activación del folículo primordial; en segundo lugar, cómo y en qué puntos afecta negativamente la ciclofosfamida a esta vía molecula y, por último, se presentan varios fármacos experimentales que en cotratamiento con la ciclofosfamida pueden evitar la hiperactivación de folículos primordiales y, de este modo, preservan la reserva ovárica.
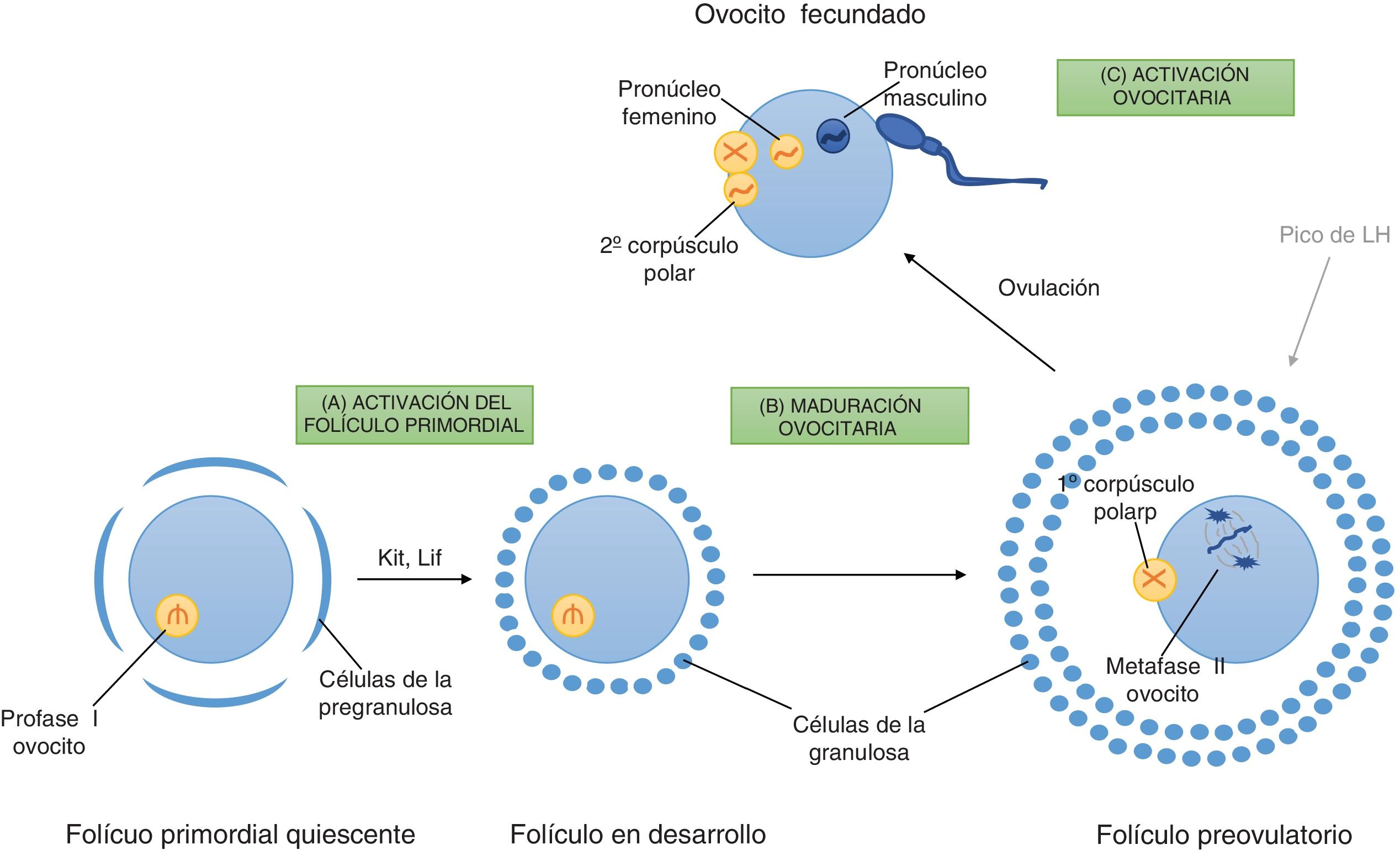
Señalización intracelular en la foliculogénesisLas mujeres poseen en sus ovarios un pool de folículos primordiales desde el nacimiento que darán lugar a ovocitos maduros capaces de ser fecundados durante su edad fértil. La mayoría de estos folículos primordiales permanece en estado de quiescencia y solo un grupo pequeño son reclutados en cada ciclo menstrual para que inicien su desarrollo y maduración. La activación del folículo primordial, la maduración del ovocito y su activación representan los 3 pilares esenciales de la fertilidad de la mujer y el desarrollo embrionario (Sobinoff et al., 2013).
Activación del folículo primordialUna vez se produce la activación del folículo primordial, este inicia un crecimiento unidireccional e irreversible, que culmina en la ovulación o, lo que es más frecuente, en atresia.
Factores extrínsecos en la activación del folículo primordialA diferencia de los últimos estadios del desarrollo folicular, la activación del folículo primordial es independiente del estímulo de las gonadotropinas, lo que indica que su regulación proviene de la señal intrafolicular entre el ovocito y las células de la granulosa (Sobinoff et al., 2013). La comunicación entre el folículo primordial y las células de la granulosa, así como la comunicación extracelular entre otros folículos primordiales en desarrollo, está estrictamente regulada por múltiples factores de crecimiento. Existen 2 factores de crecimiento de interés en la activación de los folículos primordiales: Kit ligand y leukaemia inhibitory factor (Lif) (fig. 1).
Kit Ligand es expresado por las células de la granulosa de los folículos primordiales e interacciona con su receptor Kit situado en la membrada plasmática del folículo primordial para estimular la vía de señalización del conjunto intra-celular phosphoinositide 3-kinase (Pi3k)/Akt y, de este modo, promover la supervivencia y activación del folículo primordial.
Lif es expresado por las células de la pregranulosa de los folículos primordiales, cuya función también es la de regular la activación de los folículos primordiales mediante señalización paracrina y autocrina. Lif mediante la señal janus kinase (Jak) estimula la activación de las células de la granulosa.
De modo que estas 2 vías de señalización, Kit Ligand y Lif, interactúan mutuamente para la activación de los folículos primordiales: Lif, mediante la activación de las células de la granulosa, promueve la expresión del receptor Kit en ellas.
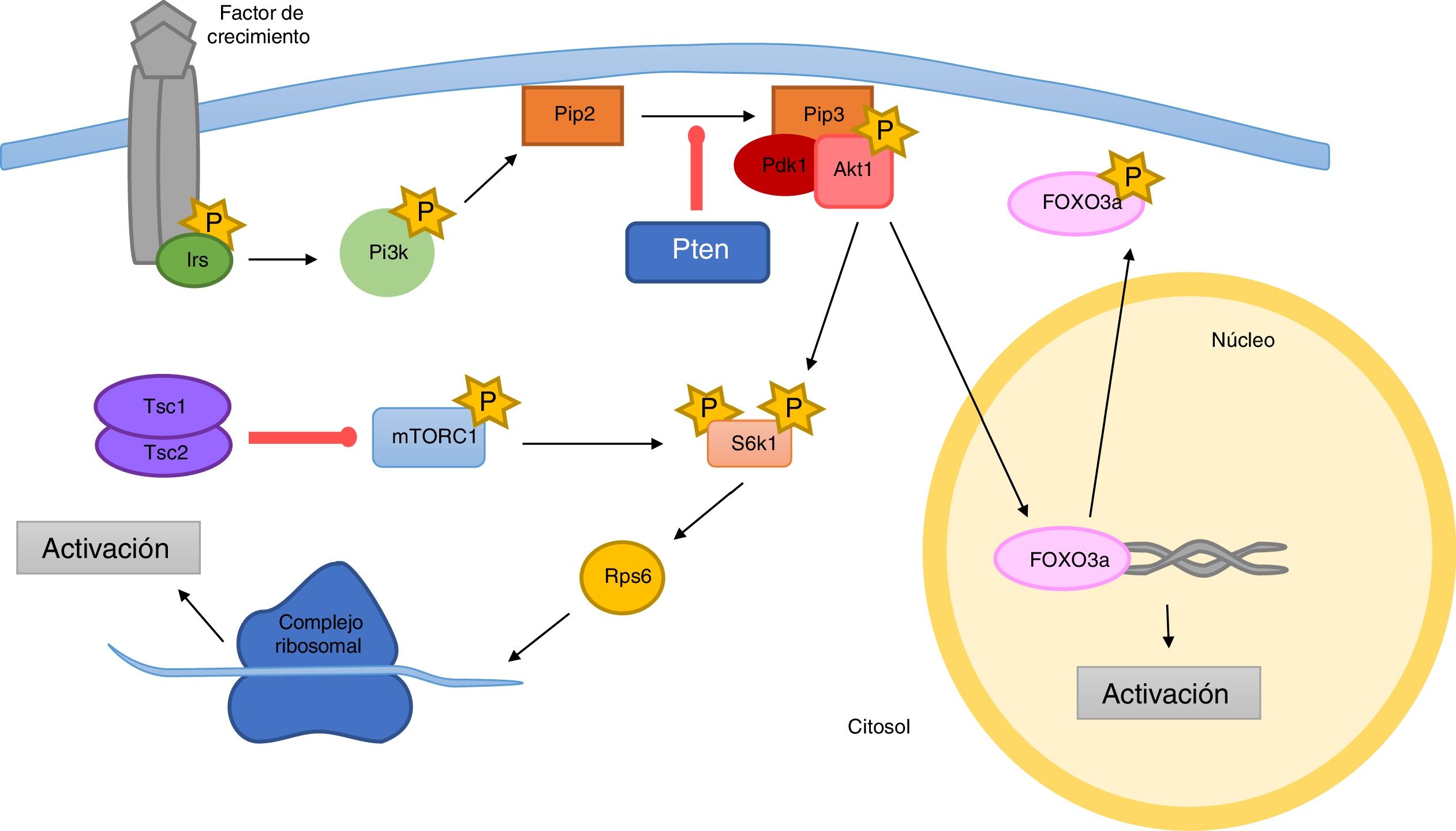
Factores intrínsecos en la activación del folículo primordialLa principal vía de señalización en la activación del folículo primordial es Pi3k/Akt, cuya función se basa en el mantenimiento de la proliferación y supervivencia celular (Sobinoff et al., 2013). La importancia de esta vía de señalización recae al final de la cascada, en la que se activa la transcripción del factor Forkhead box O3a (Foxo3a), que es el máximo regulador y supresor del reclutamiento de folículos primordiales (fig. 2).
Phosphatase and tensin homoleg (Pten) es un regulador negativo de la señal de Pi3k, cuya deleción específica resulta en la hiperactivación de Akt (Jagarlamudi et al., 2009) y, por consiguiente, la hiperfosforilación también de Foxo3a y su exportación nuclear, que culmina en la activación global de folículos primordiales y fallo ovárico prematuro (Adhikari et al., 2012).
La pyruvate dehydrogenase kinasa isoenzyme I (Pdk1) es una protein-cinasa dependiente de Pi3k, que se une a Pi3k-generated 3,4,5-triphosphate (Pip3) para coactivar Akt fosforilándolo es su residuo T308 (Reddy et al., 2009). Se ha visto que la deleción específica de Pdk1 en el ovocito disminuye el exceso de activación del folículo primordial producido por la deleción de Pten; la activación de Akt y Foxo3a está reducida en ovocitos con déficit de PdkI. Por tanto, parece que Pdk1 tiene un papel esencial en la activación de los folículos primordiales.
Paralelamente, Pdk1 también produce la fosforilación y activación de ribosomal protein S6 kinase polypeptide I (S6K1). S6K1 fosforila y activa la serine/threonine-protein (rpS6), cuya función se basa en la translocación proteica y biogénesis ribosomal durante el crecimiento celular. Tanto la activación de S6k1 como la de rpS6 están hiperestimuladas en los ovocitos Pten-deficientes y, por el contrario, se ven reducidas cuando Pdk1 está abolida. En el ovocito, rpS6 tiene un papel importante en el mantenimiento de la supervivencia del folículo primordial y el desarrollo folicular.
S6k1 también actúa bajo órdenes de la cascada de activación de mTOR (Sobinoff et al., 2013). El principal componente de esta vía es el conjunto serine/threonine kinase (mTORC1), cuya función es promover la proliferación celular, el crecimiento celular y la progresión del ciclo celular en respuesta a factores de crecimiento y estado nutricional. mTORC1 es regulado mediante su fosforilación. Existe un complejo de heterodímeros constituido por 2 moléculas proteicas, tuberous sclerosis protein I (Tsc1) y tuberous sclerosis protein 2 (Tsc2), que inhibe la actividad de mTORC1 (Adhikari et al., 2010). Tsc2 es fosforilado en su residuo S939 por pAkt1 como parte de la cascada de señalización de Pi3k/Akt1, resultando su secuestro por Tsc1 para permitir la activación de mTOR. El déficit de Tsc1 en los folículos primordiales da lugar a un gasto prematuro del pool de folículos primordiales debido a la no frenación de mTORC1 y la consiguiente activación permanente de S6K1 y, seguidamente, de rpS6. La disregulación de mTORC1 acelera la activación de folículos primordiales.
A modo de resumen, se sabe que ambas vías de señalización, Pi3k/Akt y mTOR, trabajan sinérgicamente para promover la activación folicular a través de una única combinación de mecanismos de señalización intracelular en el ovocito. Estas vías de señalización son activadas por diferentes ligandos y supeditadas a múltiples estímulos paracrinos y autocrinos.
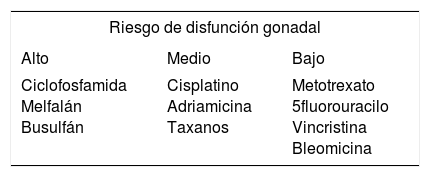
Tratamiento quimioterápico y gonadotoxicidadEl tratamiento quimioterápico en mujeres premenopáusicas está asociado a un aumento de riesgo de fallo ovárico prematuro (FOP) debido a la extensa pérdida de folículos primordiales y a la disminución de la reserva ovárica (Morgan et al., 2012). Determinados regímenes quimioterápicos son considerados de mayor riesgo gonadotóxico que otros: se sabe que los agentes alquilantes como la ciclofosfamida son los que producen mayor toxicidad gonadal (Meirow et al., 2010, tabla 1).
La edad de la paciente en el momento del tratamiento es determinante: cuanto mayor sea la paciente, mayor es la incidencia de FOP, que ocurre durante el tratamiento o inmediatamente después. Mientras que el tratamiento quimioterápico produce daño folicular a todas las edades, la diferencia entre pacientes mayores y jóvenes recae en el hecho de que las primeras tienen una reserva menor de folículos primordiales al inicio del tratamiento que las pacientes más jóvenes.
Clínicamente, la administración de quimioterapia puede tener 2 efectos distintos sobre la función ovárica: un efecto inmediato y otro a largo plazo (Morgan et al., 2012). El efecto inmediato ocurre durante el tratamiento y es aquel que induce amenorrea temporal, secundaria al cese del crecimiento de los folículos en el ovario. Sin embargo, dado que puede existir un pool suficiente de folículos primordiales en el ovario, una vez finalizado el tratamiento quimioterápico estos pueden reiniciar su activación y crecimiento, con la consiguiente reanudación de los ciclos menstruales. Por el contrario, en aquellos casos en los que se produce la pérdida casi completa del pool de folículos primordiales durante el tratamiento quimioterápico, puede aparecer FOP como efecto a largo plazo, tras finalizar el tratamiento.
Desde el punto de vista hormonal, la determinación de hormona antimülleriana (HAM) previa al inicio del tratamiento puede ayudar a predecir en qué medida se verá perjudicada la funcionalidad del ovario. La HAM es producida por las células de la granulosa de los folículos ya activados (folículos preantrales y antrales) y, al mismo tiempo, tiene un papel regulador negativo sobre la proporción de folículos primordiales que serán activados en cada ciclo. Es decir, cuanto menor sea la HAM, mayor número de folículos primordiales serán activados. Es importante destacar que el valor de HAM desciende rápidamente durante el tratamiento quimioterápico debido a la acción tóxica que ejerce la quimioterapia sobre los folículos en crecimiento; por lo que este efecto genera, además, una mayor activación de folículos primordiales y la pérdida importante del pool de estos folículos primordiales.
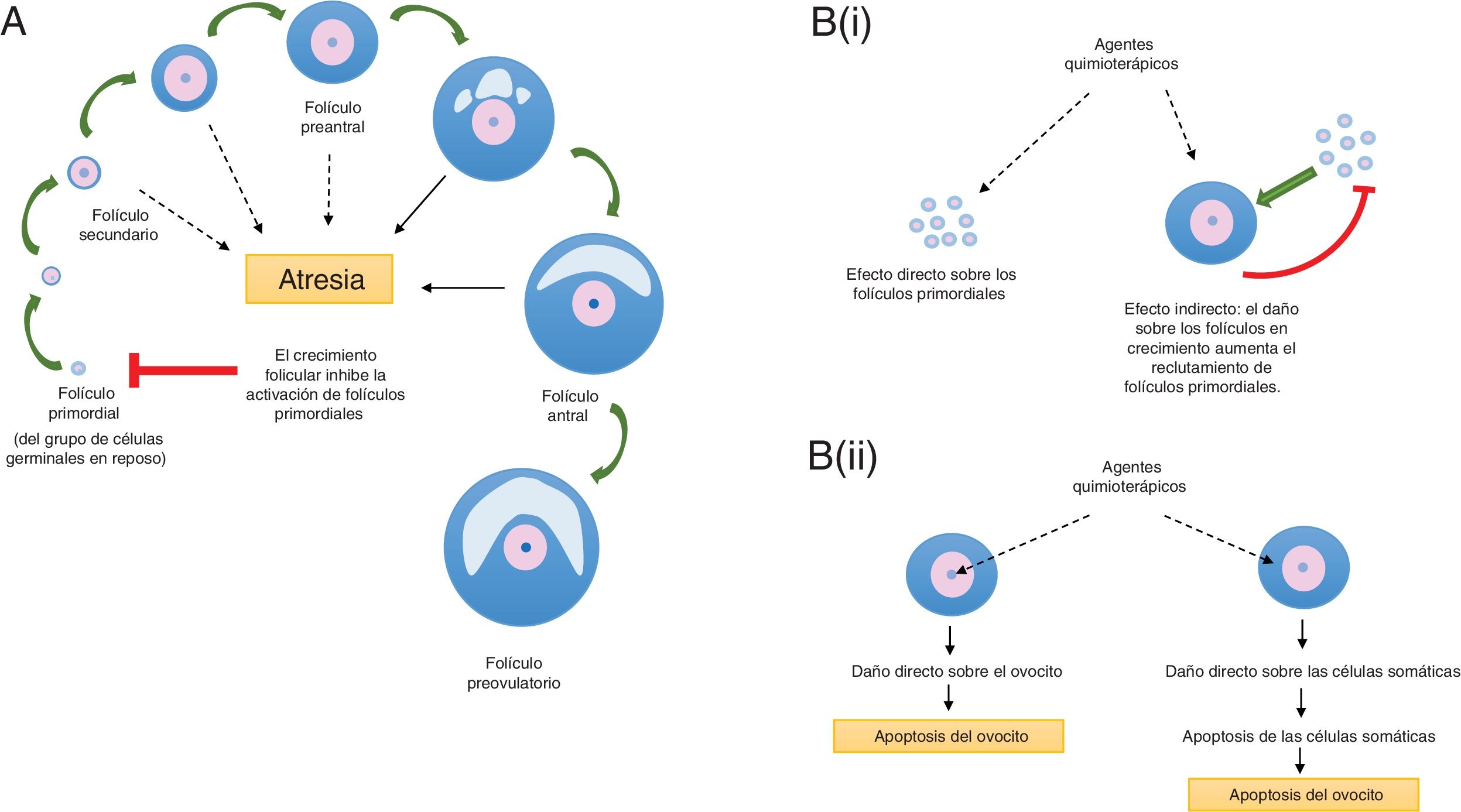
Respecto al desarrollo folicular, se conoce que la proporción de folículos primordiales que restan en reposo en el ovario depende de la presencia/ausencia de folículos en crecimiento. Tras la activación del folículo primordial, este inicia un crecimiento unidireccional e irreversible, que culmina en ovulación o, lo que es más frecuente, en atresia. Los agentes quimioterápicos pueden dañar directamente el pool de folículos primordiales que resta en el ovario o los folículos en crecimiento de ese momento. Dado que los folículos en crecimiento inhiben el reclutamiento de folículos primordiales, una pérdida aguda de folículos en crecimiento dará lugar a un aumento de activación de folículos primordiales y, por tanto, la pérdida o disminución de la reserva ovárica. Además, los agentes quimioterápicos pueden producir la muerte directa del ovocito (Bar-Joseph et al., 2010) o bien de las células somáticas que conforman el folículo de las que depende este último para su supervivencia y desarrollo, lo que da lugar a la muerte del ovocito (Morgan et al., 2012) (fig. 3).
A) Estadios del desarrollo folicular. B.i) Los agentes quimioterápicos pueden ejercer un daño directo sobre el pool de folículos primordiales o sobre los folículos en crecimiento. B.ii) Sobre los folículos en crecimiento, pueden producir la apoptosis directa del ovocito, o bien, de las células somáticas que conforman el folículo y en consecuencia, del ovocito.
La pérdida de folículos primordiales inducida por la ciclofosfamida no es solo debida al mecanismo de apoptosis sobre los folículos en crecimiento. Estudios con ratones han demostrado un incremento de la activación folicular durante el tratamiento con ciclofosfamida, a través de la activación directa de la vía de señalización Pi3k/PTEN/Akt (Meirow et al., 1999). El estudio proteico en los ovarios de ratonas adultas 24 h después del tratamiento con ciclofosfamida demostró cambios en la fosforilación de las proteínas encargadas de activar la vía de señalización (Akt, mTOR y rpS6) y de la proteína FOXO3a inactivando, de este modo, su función supresora. El aumento en la fosforilación de cada una de estas proteínas está asociado con la activación de la vía de señalización Pi3k/PTEN/Akt descrita previamente y que estimula el reclutamiento, la activación y el crecimiento de los folículos primordiales.
Además de tener un efecto directo sobre la activación de los folículos primordiales, la ciclofosfamida también tiene un efecto sobre los folículos que están en crecimiento, induciendo su apoptosis celular. Dada esta pérdida de feedback negativo sobre el pool de folículos primordiales que se mantienen en reposo, se acelera la activación de los folículos primordiales que entran en crecimiento.
El resultado final pues, deriva en un aumento de folículos primordiales reclutados, que son activados, estimulados para su desarrollo y que finalmente terminan en muerte celular por los efectos directos e indirectos de la ciclofosfamida.
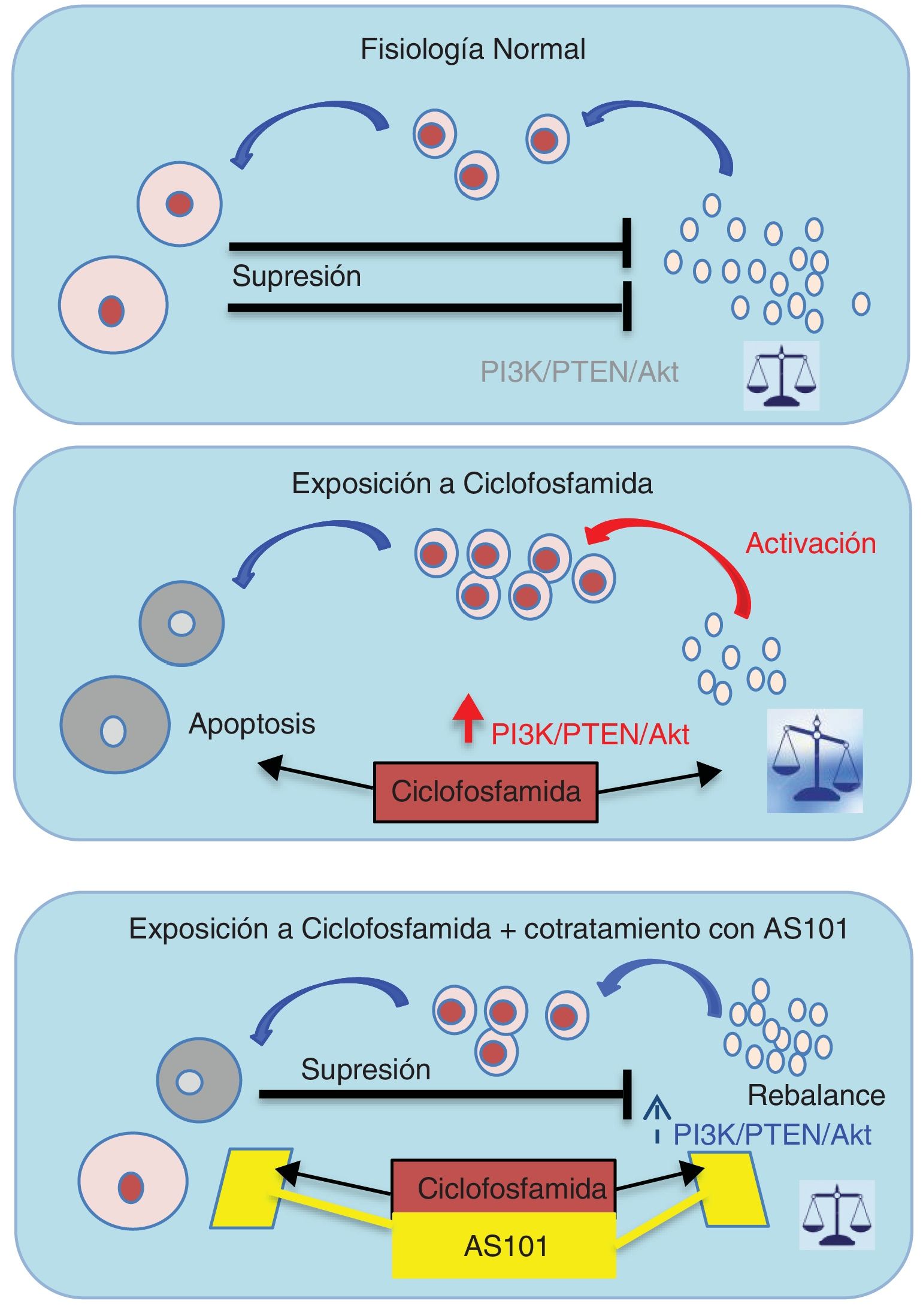
Fármacos que evitan el fallo ovárico prematuro en modelos animalesAS101El amonio tricloro dioxoetileno telurato (AS101) reduce la pérdida folicular inducida por ciclofosfamida. El AS101 es un inmunomodulador con efecto antitumoral que, en estudios con ratones (Di Emidio et al., 2017), inhibe la fosforilación y activación de la vía PI3K/PTEN/AKT, así como la fosforilación de FOXO3a, inducidas por la ciclofosfamida en los folículos primordiales. Además, también tiene un efecto protector en el crecimiento de folículos en estadios más avanzados (Kalich-Philosoph et al., 2013) (fig. 4).
La administración de AS101 conjuntamente con ciclofosfamida previene la activación de los folículos primordiales a través de la vía de señalización Pi3k/Akt, además de reducir la apoptosis en los folículos en crecimiento. De modo que se restaura el efecto inhibitorio sobre los folículos primordiales, devolviendo el equilibrio en el ovario.
Kalechman et al. describen el impacto del cotratamiento de AS101 con ciclofosfamida con relación a la pérdida folicular; ratonas adultas fueron tratadas con AS101 (10μg por ratón) en días alternos, empezando el tratamiento una semana antes de iniciar la ciclofosfamida y terminándolo una semana después de finalizarla (Kalechman et al., 1991). Se objetivó que AS101 redujo significativamente la pérdida de folículos primordiales en ratonas tratadas con ciclofosfamida a diferentes dosis. Además, la concentración de HAM se mantuvo igual en aquellas que se habían cotratado con AS101 y se redujo significativamente en aquellas ratonas que habían sido tratadas solo con ciclofosfamida.
Por otro lado, se estudió si AS101 interfería en el efecto antitumoral de la ciclofosfamida: se testó su efecto in vitro en líneas de células cancerígenas. Se examinaron 2 líneas celulares humanas de cáncer de mama, hormonosensible y triple negativo, puesto que la ciclofosfamida se usa comúnmente para su tratamiento (Lacroix y Leclercq, 2004). Curiosamente, se observó que el cotratamiento con AS101 incrementaba la sensibilidad celular por la ciclofosfamida y que se producía un efecto sinérgico al combinar ambos fármacos.
Por tanto, la coadministración de AS101 con ciclofosfamida en ratones ha demostrado que presenta un efecto protector en el ovario y, por consiguiente, la preservación de la fertilidad, sin interferir negativamente en el efecto antitumoral de la ciclofosfamida.
CrocetinaLa crocetina es un producto natural derivado del carotenoide con evidencia mostrada de función protectora ovárica, ya que reduce el estrés oxidativo generado por la ciclofosfamida en las células.
En la revisión de Di Emilio et al., se describe la capacidad de crocetina en el cotatamiento con ciclofosfamida para preservar la fertilidad y, a su vez, evitar el aumento de estrés oxidativo producido por la ciclofosfamida (Sobinoff et al., 2013). Para evaluar el potencial efecto atenuador de la crocetina contra la toxicidad producida por la ciclofosfamida, se administró, en ratonas adultas, una dosis diaria de 100mg/kg de crocetina durante 15 días previos a la administración de 100mg/kg de ciclofosfamida. Otro grupo fue tratado con AS101 (10μg por ratón), cuyo efecto protector en el ovario ya era conocido, en días alternos durante 15 días previos al inicio del tratamiento con ciclofosfamida (Di Emidio et al., 2017). Se cuantificó el número de folículos restantes en los ovarios una semana después de finalizar la administración de ciclofosfamida y se observó que el grupo de ratonas que había recibido crocetina además de ciclofosfamida tenía un número mayor de folículos primordiales que el grupo que solo había recibido ciclofosfamida, sin encontrar diferencias significativas en el grupo control que no había recibido tratamiento alguno. Además, la cuantificación de folículos primordiales reveló que el efecto de la crocetina era similar al de AS101.
Con el objetivo de confirmar que tanto crocetina como AS101 están asociados a preservación de fertilidad, ratonas de cada grupo fueron apareadas en 3 rondas. Los resultados de este estudio (Di Emidio et al., 2017) muestran que no se pudieron obtener crías de los ratones tratados exclusivamente con ciclofosfamida, ya que no resultaron embarazadas después de una semana de apareamiento en jaulas con los machos. Por el contrario, las tratadas con ciclofosfamida y crocetina o AS101 se embarazaron después de todas las rondas de apareamiento y presentaron tamaños de camadas sin diferencias significativas respecto al grupo control.
Con el objetivo de encontrar el mecanismo molecular mediante el cual tiene efecto la crocetina, se midió el nivel de expresión proteica en cada grupo. Se observó que la ciclofosfamida aumentaba la activación de AKT fosforilada (pAKT) a través de la activación de PI3K y que inactivaba FOXO3a (pFOXO3a) mediante su fosforilación producida por pAKT. Por el contrario, en el grupo de cotratamiento con crocetina y AS101 resultó en una reducción de ambos pAKT y pFOXO3a. Sin embargo, se observó que el efecto de crocetina era más pronunciado que el de AS101 y similar al del grupo control (sin tratamiento).
Se demostró también que se produce un estrés oxidativo secundario a la administración de ciclofosfamida, objetivado por el aumento de la proteína SIRT1 y su precursor HuR después de su administración. El estrés oxidativo tiene un efecto tóxico en el ovario, produciendo una reducción significativa de la proliferación de las células de la granulosa. La administración de crocetina asociada a la ciclofosfamida evitó el aumento de SIRT1 inducido por esta última: estos ratones presentaron una expresión de nivel de SIRT1 equivalente al de los ratones del grupo control. El grupo que recibió AS101 asociado a ciclofosfamida presentó una reducción del nivel de SIRT1 respecto el grupo tratado exclusivamente con ciclofosfamida, pero estos niveles no fueron tan buenos como los conseguidos con crocetina o los del grupo de ratones sin tratamiento.
Con el objetivo de seguir estudiando el papel de crocetina y AS101 como efecto protector frente al estrés oxidativo generado por la ciclofosfamida, se estudiaron otros marcadores mitocondriales: SIRT3, SOD2 y PCGalpha (Di Emidio et al., 2017). Igual que lo que se observó con SIRT1, la expresión de SIRT3 también se eleva tras la administración de ciclofosfamida y el cotratamiento con crocetina previene el aumento de su expresión, aunque no de forma tan marcada como en los grupos control. Por otro lado, ciclofosfamida produce un descenso significativo de la expresión de SOD2 y ambos cotratamientos con crocetina y AS101 atenúan este efecto, aunque los niveles de SOD2 son más bajos que los observados en el grupo control. También se observó que los niveles de PCGalpha eran más bajos en los ratones tratados exclusivamente con ciclofosfamida que en el grupo control; mientras que crocetina y AS101 inducen un aumento 3 veces superior del nivel de PCGalpha, comparando con el grupo control.
MelatoninaLa melatonina (N-acetil-5-metoxitriptamina) es una molécula segregada por la glándula pineal y otros tejidos como el ovario y la placenta (Venegas et al., 2012). Esta molécula es lipofílica y actúa como antioxidante; está presente en muchos fluidos biológicos como el líquido sinovial, líquido amniótico, líquido cefalorraquídeo, saliva, bilis y leche materna. Los niveles de melatonina y su producción van decreciendo gradualmente con la edad y su estado es muy importante, ya que se relaciona con la pérdida de calidad de vida en la edad anciana y la aparición de determinadas enfermedades.
Además, la melatonina tiene un papel importante en el tratamiento adyuvante durante la quimioterapia (Jang et al., 2017). Muchos estudios han demostrado que el tratamiento con melatonina protege la depleción de las células germinales en las gónadas durante el tratamiento quimioterápico. Los receptores de la melatonina, MT1 y MT2, están presentes en los ovocitos y en las células de la granulosa y es a través de estos como se lleva a cabo el efecto protector folicular. En 2016, Jang et al. demostraron que el efecto regulador y protector de la melatonina se producía a través de la supresión de la activación de la vía PI3K/AKT/FOXO3a en el tratamiento con cisplatino (Jang et al., 2016), en ovarios de ratones.
El tratamiento con cisplatino induce la activación de la vía PI3K/AKT/FOXO3a a través de la fosoforilación de la cascada, dando lugar a la activación de los folículos primordiales quiescentes. Sin embargo, la melatonina inhibe la activación originada por el cisplatino mediante la inducción de la actividad PTEN y la inhibición de la fosforilación de FOXOa, lo que resulta en la expresión de p27Kip1, que inhibe CDK, estos últimos responsables del mantenimiento de los folículos primordiales.
RapamicinaLa rapamicina es un potente inhibidor de mTOR1. La rapamicina se une a la proteína intracelular FK506 que está unida, a su vez, a la proteína 12 (FKBP12) y, el complejo rapamicina-FKBP12, se une a su receptor, situado en mTOR1. Esta unión produce una inhibición de la acción de la serina/treonin-cinasa de mTOR1, que resulta en la inhibición de la actividad mTOR1. El complejo rapamicina-FKBP12 no puede interaccionar con el receptor en mTOR2; por ello, mTOR2 es resistente al tratamiento con rapamicina (Laplante y Sabatini, 2012).
Zhou et al. demuestran la capacidad de rapamicina de evitar la hiperactivación del pool de folículos primordiales inducida por ciclofosfamida a través de la vía PI3K/Akt/mTOR en ratonas(Zhou et al., 2017). La concentración de HAM es un indicador indirecto de la reserva ovárica; en este estudio se observó que el valor de HAM estaba significativamente reducido en el grupo de tratamiento únicamente con ciclofosfamida respecto el nivel de HAM normal en el grupo de cotratamiento de ciclofosfamida y rapamicina (Zhou et al., 2017). También se observó que rapamicina evita la hiperactivación de rps6 inducida por ciclofosfamida, mediante Western blot: en el grupo ciclofosfamida+rapamicina los niveles de rps6 fosforilado en los ovocitos estaban suprimidos por la inhibición a mTOR de rapamicina, respecto al grupo de tratamiento con solo ciclofosfamida (Zhou et al., 2017).
La rapamicina es muy poco hidrosoluble, lo que limita su uso clínico. Por este motivo se están estudiando análogos solubles de rapamicina como temsirolimus, everolimus y ridaforolimus (Hajjar et al., 2013).
El everolimus es un fármaco ya aprobado y utilizado en pacientes posmenopáusicas con recidiva de cáncer de mama con receptores de estrógenos positivos y HER2/neu negativo, resistentes al tamoxifeno.
La inhibición del complejo mTOR1 por el fármaco clínicamente aprobado everolimus o la inhibición de mTOR1/2 con el fármaco experimental INK128 como tratamiento adyuvante a la ciclofosfamida han demostrado, en ratones, que preservan la reserva ovárica, el recuento de folículos primordiales, los niveles de HAM y la fertilidad (Goldman et al., 2017).
Goldman et al. demostraron que la administración diaria de inhibidores de mTOR que logran de 2 a 4 veces la atenuación de la actividad mTOR pueden mantener los folículos primordiales durante el tratamiento quimioterápico, mantener los niveles de HAM normales y preservar la fertilidad (Goldman et al., 2017).
ConclusiónLa respuesta adaptativa del ovario al tratamiento quimioterápico consiste en un aumento del estrés oxidativo y daño mitocondrial que desemboca en un incremento del reclutamiento y activación incesantes de folículos primordiales. Este consumo inagotable de folículos primordiales conlleva un fallo ovárico precoz que produce un aumento de la morbilidad en la paciente debido a la pérdida de masa ósea, disfunción cognitiva, disfunción sexual y enfermedad cardiovascular. La preservación de la fertilidad en mujeres con cáncer es, por tanto, esencial para mantener su calidad de vida tras su superación.
Aunque todavía no hay estudios en humanos, esta revisión bibliográfica muestra la evidencia que existe en la actualidad sobre diferentes tratamientos médicos coadyuvantes al tratamiento quimioterápico capaces de preservar la fertilidad en modelos animales. Cabe destacar que estos fármacos no son tratamientos instaurados ni accesibles en la actualidad, por lo que deben considerarse siempre como experimentales: estimulamos desde aquí a seguir investigando sobre ellos y su aplicación en humanos.
Conflicto de interesesLa autora declara no tener conflicto de intereses.