Los varones infértiles presentan una mayor proporción de espermatozoides apoptóticos en el eyaculado, lo que puede provocar un impacto negativo en los resultados de las técnicas de reproducción asistida (TRA). Una adecuada selección espermática que eliminara los espermatozoides apoptóticos podría mejorar los resultados. El objetivo del estudio es valorar si se puede mejorar las tasas de embarazo clínico y de niño nacido vivo en inseminación intrauterina (IUI) a través de la eliminación de los espermatozoides apoptóticos de la muestra de semen mediante la combinación de los gradientes de densidad (GD) y la técnica Magnetic Activated Cell Sorting (MACS).
Se realizó un estudio observacional prospectivo analítico de 566 ciclos de IUI realizados a 326 parejas, de junio de 2012 a marzo de 2014, en el Servicio de Medicina de la Reproducción de Salud de la Mujer Dexeus comparando un grupo estudio (MACS) y un grupo control (no MACS). La preparación de la muestra de semen en ambos grupos fue mediante GD, y en el grupo MACS la fracción poscapacitación fue procesada mediante las columnas de anexinaV.
Las tasas de embarazo y de niño nacido vivo obtenidas en el grupo MACS fueron del 16,2 y del 12,9%, respectivamente, versus el 17,7 y el 15,3% en el grupo no MACS, sin que existan diferencias estadísticamente significativas entre ellas.
Nuestros resultados sugieren que en IUI el uso de MACS cuando no existe una indicación clínica concreta no mejora los resultados de gestación ni de niño nacido vivo. No puede descartarse la posible utilidad de las columnas de anexina V en otras técnicas y/o para indicaciones específicas. Son necesarios estudios prospectivos aleatorizados para poder determinar la ventaja de aplicar la técnica MACS en TRA.
Infertile men show a higher proportion of apoptotic spermatozoa in ejaculate, and have a negative impact on the assisted reproduction techniques (ART) results. An adequate sperm selection which eliminates the apoptotic spermatozoa could improve the results. The objective of the study was to evaluate the effect of eliminating apoptotic spermatozoa in the ejaculate by density gradient (DG) and Magnetic Activated Cell Sorting (MACS) processing of sperm on the pregnancy rate (PR) and new born rate (NBR) after intrauterine insemination (IUI).
A prospective observational and analytical study was performed on 566 cycles of IUI in 326 couples, from June 2012 to March 2014 in the Reproductive Medicine Service of Dexeus Women's Health comparing a study group (MACS) and a control group (Non-MACS). The preparation of the semen sample in both groups was by DG, and in the MACS group, the post capacitation fraction was processed using annexin V columns.
The PR and NBR obtained in MACS group were 16.2% and 12.9%, respectively versus 17.7% and 15.3% in Non-MACS group. No significant differences were observed.
Our results suggest that MACS used in IUI without a clinical indication does not improve the results in either the pregnancy rate or new born rate. The use of annexin V columns in other techniques, or specific indications cannot be ruled out. Further prospective randomised studies are needed in order to determine the advantages of MACS in ART.
La inseminación artificial es una técnica de reproducción asistida (TRA) que se indica en casos de patología cervical, endometriosis moderada, esterilidad masculina leve o esterilidad de origen desconocido. En España representa el 20,3% de los ciclos de TRA realizados (Registro SEF, 2013). Las tasas de gestación de esta técnica (14,7%) son significativamente inferiores a las que se obtienen mediante fecundación in vitro (FIV) con ovocitos propios (36,3%) o con ovocitos de donante (55,9%), aunque debido a su baja complejidad, al menor coste y al ser menos invasiva, se indica como primera opción en aquellos casos en que las características de la paciente y la causa de esterilidad no lo contraindican.
Los resultados de la inseminación intrauterina (IUI) pueden verse ampliamente influidos por la calidad espermática. La calidad espermática es uno de los factores que ayuda a determinar el éxito de la reproducción asistida (Ombelet et al., 2003). Si bien la evaluación de la calidad espermática previa a una TRA se ha venido evaluando tradicionalmente mediante un seminograma básico con recuento de la concentración, movilidad, vitalidad y morfología espermática, hoy en día existen otras técnicas diagnósticas que permiten ampliar la evaluación de las muestras espermáticas, como el fluorescence in-situ hybridization (FISH) de espermatozoides (Blanco et al., 1996; Egozcue et al., 1997) y la fragmentación del ADN espermático (Evenson et al., 1999).
Para una correcta fecundación se requiere que la membrana plasmática del espermatozoide tenga integridad y capacidad funcional normal (Flesch y Gadella, 2000). Se ha descrito que en el eyaculado de varones infértiles la membrana plasmática de los espermatozoides se encuentra con mayor frecuencia alterada a pesar de que los parámetros espermáticos básicos permanezcan dentro de los valores de referencia (Glander y Schaller, 1999; Duru et al., 2001). Alteraciones de membrana se han relacionado con espermatozoides que han entrado en un proceso de muerte celular programada, lo cual podría ser parcialmente responsable de las bajas tasas de fecundación e implantación encontradas en los correspondientes ciclos de reproducción asistida (Said et al., 2005a).
Durante la espermatogénesis, la apoptosis tiene lugar de manera natural como mecanismo para mantener el número de células germinales a las que las células de Sertoli dan soporte, así como para eliminar la producción de células anormales. Este mecanismo puede llegar a reducir hasta en un 75% el número de espermatozoides presentes en el eyaculado. Fallos en la eliminación de espermatozoides anormales podrían ser la causa de la presencia de estos espermatozoides en el eyaculado.
Existen distintos marcadores de los procesos de apoptosis, como la presencia de caspasas activadas, las alteraciones en el potencial de membrana mitocondrial y el aumento de la fragmentación del ADN. La externalización del fosfolípido de membrana, fosfatidilserina (PS), el cual está presente en la capa interna de la membrana plasmática del espermatozoide cuando esta está intacta, puede considerarse también como un marcador apoptótico (Vermes et al., 1995). Se cree que la presencia de marcadores apoptóticos en una muestra de eyaculado podría indicar la existencia de errores en la eliminación de células que han iniciado el proceso normal de apoptosis durante la espermatogénesis (Glander y Schaller, 1999; Weng et al., 2002; Passch et al., 2003, 2004).
La anexina V es una proteína con elevada afinidad para la PS en presencia de Ca+2, y además no tiene la capacidad de atravesar la membrana plasmática. Estas propiedades son de gran utilidad para seleccionar espermatozoides no apoptóticos, ya que la anexinaV solo se puede unir a aquellos que hayan externalizado la PS y que, por tanto, presenten marcadores apoptóticos.
Se ha descrito que la técnica de separación magnética por columnas de anexinaV, Magnetic Activated Cell Sorting (MACS) (Milteny et al., 1990), aplicada a muestras espermáticas, permite eliminar los espermatozoides apoptóticos del eyaculado (Grunewald et al., 2001). El fundamento de esta técnica se basa en la capacidad de separar poblaciones celulares distintas tras incubar las muestras con proteínas específicas o anticuerpos conjugados con micropartículas magnetizadas y someterlas a columnas con un campo magnético. Las células a eliminar quedan retenidas en la columna, unidas a las micropartículas mediante uniones antígeno-anticuerpo, mientras que el otro tipo celular se recupera por elución a la salida de la columna.
Tanto los análisis seminales básicos como las técnicas habituales de preparación espermática para TRA (gradientes de densidad [GD] y Swim up) no pueden distinguir ni separar los espermatozoides apoptóticos, ya que únicamente se basan en la concentración y la movilidad de los espermatozoides y no discriminan a nivel molecular. Hay estudios en los que se observa una correlación negativa entre la apoptosis y la vitalidad y la movilidad espermáticas (Said et al., 2005a; Chen et al., 2006; Aziz et al., 2007). La utilización de micropartículas magnetizadas y conjugadas con anexinaV (MACS) en la preparación de las muestras seminales para una TRA pretende posicionarse como una técnica de elección a la hora de preparar las muestras seminales eliminando los espermatozoides apoptóticos y, en consecuencia, incrementando no solo su capacidad fecundante sino también mejorando la calidad embrionaria y el potencial implantatorio (Dirican et al., 2008; Lee et al., 2010).
El objetivo de este estudio es demostrar si la preparación de las muestras de semen mediante MACS después de la centrifugación con GD mejora los resultados de nuestro programa de IUI en pacientes con normozoospermia o astenozoospermia moderada de acuerdo a los criterios de la OMS (WHO, 2010), con el fin de optimizar las tasas de embarazo clínico y niño nacido de esta técnica.
Material y métodosSe realizó un estudio observacional prospectivo analítico de 566 ciclos de IUI realizados a 326 parejas, durante el periodo de junio del 2012 a marzo del 2014, en el Servicio de Medicina de la Reproducción de Salud de la Mujer Dexeus. Los ciclos de IUI se realizaron bajo estimulación hormonal con gonadotropinas a dosis variables según las particularidades de cada caso, y el factor de esterilidad femenino fue principalmente tubárico, ovulatorio y endometriosis. Se asignaron al grupo MACS durante los días laborables, mientras que en días festivos la preparación de la muestra de semen se realizó de manera convencional (grupo control, no MACS). Las muestras de semen de ambos grupos se obtuvieron por masturbación, y una vez licuadas se procedió a la capacitación espermática según protocolo normalizado de trabajo del propio centro. La preparación de la muestra de semen en ambos grupos fue mediante GD. Se centrifugó con GD del 80 y del 40% (Puresperm® 100, Puresperm®Buffer, Nidacon, Suecia) durante 20-30min a 1.200rpm. Se recuperó el pellet y se lavó con 5ml de medio de lavado PureSperm®Wash (Nidacon, Suecia) durante 10min a 1.200rpm en el grupo no MACS, y con 5ml de buffer MACS®, también durante 10min a 1.200rpm, en el grupo MACS.
En el grupo NO MACS, la fracción final de espermatozoides poscapacitación fue la utilizada para inseminar.
En el grupo MACS la fracción poscapacitada fue incubada a temperatura ambiente con 100μl de anexinaV conjugada con micropartículas de hierro (MACS GMP AnnexinV Reagent) más 200μl de buffer (MACS GMP AnnexinV Binding Buffer) durante 15min (MACS® GMP, Milteny Biotec, Alemania; Milteny et al., 1990). Pasado este tiempo, se aplicó un campo magnético a los espermatozoides incubados pasándolos por una columna de anexinaV. Para la recuperación de los espermatozoides no apoptóticos (fracción anexinaV-negativa) la columna fue lavada con 500μl de buffer (MACS GMP AnnexinV Binding Buffer). La suspensión recuperada se centrifugó 5min a 1.200rpm y el pellet se resuspendió en el medio de inseminación (PureSperm®Wash, Nidacon). La suspensión recuperada y lavada fue la que se utilizó para la inseminación. La calidad seminal el día de la inseminación se valoró de acuerdo a los criterios de la OMS (WHO, 2010). Un recuento total de espermatozoides post GD<105 se aplicó como criterio de exclusión para el estudio.
El análisis de βHCG en orina para determinación de embarazo se realizó a los 15días postinseminación. Se consideró embarazo clínico cuando se confirmó con ecografía la presencia de un saco gestacional con latido cardíaco.
Para el estudio estadístico, las variables cualitativas o nominales se compararon mediante el test Chi-cuadrado o el test exacto de Fischer, y las variables continuas se compararon mediante la U de Mann-Whitney.
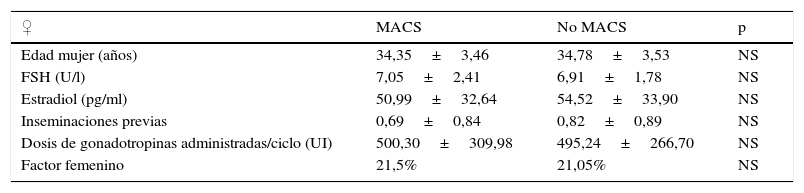
ResultadosSe analizaron 566 ciclos de inseminación artificial realizados a 326 pacientes, de los cuales 357 fueron del grupo MACS (63,1%) y 209 del grupo no MACS (36,9%). No existieron diferencias estadísticamente significativas en la edad media del varón ni en la concentración de espermatozoides móviles antes de la selección espermática entre los grupos MACS y no MACS (tabla 1).
Características de la mujer y del varón del grupo MACS y no MACS
| ♀ | MACS | No MACS | p |
|---|---|---|---|
| Edad mujer (años) | 34,35±3,46 | 34,78±3,53 | NS |
| FSH (U/l) | 7,05±2,41 | 6,91±1,78 | NS |
| Estradiol (pg/ml) | 50,99±32,64 | 54,52±33,90 | NS |
| Inseminaciones previas | 0,69±0,84 | 0,82±0,89 | NS |
| Dosis de gonadotropinas administradas/ciclo (UI) | 500,30±309,98 | 495,24±266,70 | NS |
| Factor femenino | 21,5% | 21,05% | NS |
| ♂ | MACS | No MACS | |
|---|---|---|---|
| Edad varón (años) | 36,32±4,34 | 36,61±4,50 | NS |
| Concentración espermatozoides móviles (106/ml) | 90,82±118,63 | 70,10±76,12 | NS |
Valores presentados en media±desviación estándar.
NS: p<0,05.
Tampoco existían diferencias estadísticamente significativas entre ambos grupos en la edad media de la mujer, FSH y 17β-estradiol basal, ciclos previos realizados, dosis de gonadotropinas administradas, ni en el porcentaje de factor de esterilidad femenino (tabla 1).
Tras la preparación no se encontraron diferencias estadísticamente significativas en el número de espermatozoides con movilidad progresiva en la suspensión espermática utilizada para la inseminación, siendo esta de 28,61×106±30,97 en el grupo MACS y de 32,08×106±48,11 en el grupo no MACS.
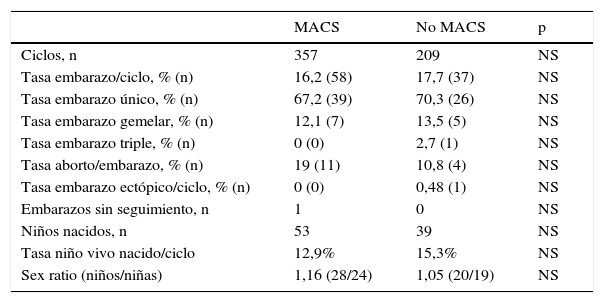
Las tasas de embarazo clínico y de niño nacido vivo obtenidas en el grupo MACS fueron del 16,2 y del 12,9%, respectivamente, versus el 17,7 y el 15,3% en el grupo no MACS, sin diferencias estadísticamente significativas entre ellas (tabla 2).
Resultados obtenidos tras inseminación intrauterina en el grupo MACS y no MACS
| MACS | No MACS | p | |
|---|---|---|---|
| Ciclos, n | 357 | 209 | NS |
| Tasa embarazo/ciclo, % (n) | 16,2 (58) | 17,7 (37) | NS |
| Tasa embarazo único, % (n) | 67,2 (39) | 70,3 (26) | NS |
| Tasa embarazo gemelar, % (n) | 12,1 (7) | 13,5 (5) | NS |
| Tasa embarazo triple, % (n) | 0 (0) | 2,7 (1) | NS |
| Tasa aborto/embarazo, % (n) | 19 (11) | 10,8 (4) | NS |
| Tasa embarazo ectópico/ciclo, % (n) | 0 (0) | 0,48 (1) | NS |
| Embarazos sin seguimiento, n | 1 | 0 | NS |
| Niños nacidos, n | 53 | 39 | NS |
| Tasa niño vivo nacido/ciclo | 12,9% | 15,3% | NS |
| Sex ratio (niños/niñas) | 1,16 (28/24) | 1,05 (20/19) | NS |
NS: p<0,05.
Las tasas de gestación y de recién nacido vivo por ciclo obtenidas en este trabajo tras IUI (16,9 y 14,1%) fueron similares a las reportadas por el Registro Nacional de la SEF correspondiente al año 2013 (12,6 y 7,7%) y a la tasa de recién nacido vivo del último registro disponible de la ESHRE referente al año 2010 (8,9%) (Kupka et al., 2014).
No se observaron diferencias estadísticamente significativas entre la tasa de embarazo y la de nacido vivo al comparar ciclos de IUI del grupo MACS y no MACS (16,2 y 12,9% versus 17,7 y 15,3%, respectivamente).
Estudios previos utilizando la metodología MACS en la preparación de muestras para TRA refieren una disminución en los niveles de marcadores apoptóticos, mejor movilidad, porcentaje de formas normales, funcionalidad espermática y capacidad fecundante (Said et al., 2006, 2008; De Vantéry Arrighi et al., 2009), así como una mayor tasa de división embrionaria y de embarazo al combinar MACS y FIV/ICSI (Dirican et al., 2008; Rawe et al., 2010; Álvarez Sedó et al., 2010). Sin embargo, algunos autores, como Grunewald et al. (2008), han reportado que en pacientes con oligoastenoteratozoospermia y astenoteratozoospermia la movilidad espermática disminuye cuando se aplica la metodología MACS debido al incremento de centrifugaciones que hay que realizar comparado con la preparación mediante GD únicamente.
Rawe et al. (2010) reportaron un caso de niño nacido tras MACS e inyección intracitoplasmática de espermatozoides (intracytoplasmic sperm injection [ICSI]) tras fallos repetidos de IUI e ICSI en pacientes con fragmentación del ADN espermático elevada. Igualmente, Polak de Fried y Denaday (2010) reportaron 2 casos más de nacimientos tras MACS e ICSI, uno de ellos en una pareja con factor masculino (varicocele tratado quirúrgicamente y actividad caspasa elevada) con fallos repetidos de IUI e ICSI.
En el metaanálisis realizado por Gil et al. (2013) se observa que las tasas de implantación y aborto no varían entre los grupos que utilizaron la técnica MACS en TRA y los controles, pero sí se observa un aumento en la tasa de embarazo.
Hay autores que reportan que esta técnica es un método eficiente para disminuir la fragmentación del ADN espermático (Rawe et al., 2009, 2010; Nadalini et al., 2014). Recientemente, Vendrell et al. (2014) encontraron que la combinación de GD y MACS reduce la tasa de aneuploidía y de fragmentación del ADN espermático en pacientes normozoospérmicos con ciclos previos fallidos de FIV y con resultados de FISH y fragmentación del ADN espermático alterados.
La mayoría de estudios se han realizado en ciclos de FIV ICSI, y los resultados publicados hasta el momento parecen apuntar hacia una ventaja en la aplicación clínica de la técnica MACS.
En el caso de los ciclos de IUI, el trabajo publicado por Lee et al. (2010) muestra que la combinación de GD y MACS elimina espermatozoides apoptóticos mejorando la calidad espermática, y los autores concluyen que esta técnica podría ser beneficiosa para las IUI en parejas con infertilidad idiopática. Por otra parte, nuestro trabajo no confirma tampoco los resultados preliminares de Khalid y Qureshi, 2011, que reportan una mayor tasa de embarazo en IUI después de eliminar los espermatozoides apoptóticos del eyaculado. Romany et al. (2010) también observaron una mejoría en sus resultados preliminares tras MACS en ciclos de IUI, aunque sin diferencias estadísticamente significativas. Es importante destacar que ninguno de estos 2 grupos ha confirmado posteriormente la ventaja del uso de la metodología MACS en IUI mediante la publicación de los resultados finales en un artículo científico.
A pesar de estos casos puntuales, no se ha publicado hasta el momento ninguna serie amplia que demuestre la utilidad de MACS para los casos de apoptosis o fragmentación del ADN.
En relación con la metodología empleada en nuestro estudio, el orden en que se han realizado las técnicas de selección espermática podría ser un factor que haya podido influir en los resultados. Tavalaee et al. (2012) reportaron que la mejor combinación para eliminar los espermatozoides apoptóticos sería MACS y GD en vez de GD y MACS. Estos autores indican que no solo observan que en la fracción final hay una menor actividad caspasa, sino que de esta manera se estaría eliminado los espermatozoides con externalización de la PS debido a la apoptosis y no a la capacitación espermática o reacción acrosómica, seleccionando espermatozoides con mejor morfología y eliminando alguna posible micropartícula de hierro que no se hubiera quedado retenida en la columna, aumentando así la seguridad en el proceso. En este sentido, estos resultados apoyarían los obtenidos por Dirican et al., 2008, donde ya aplicaron la combinación de MACS antes de los GD obteniendo una mayor tasa de embriones evolutivos y embarazo con respecto al uso único de GD en pacientes con factor masculino que realizaron un ciclo de ICSI.
A la vista de nuestros resultados, la aplicación indiscriminada de la metodología MACS después de los GD en los ciclos de IUI no parece mejorar los resultados. Sin embargo, y según trabajos realizados por otros autores, esta metodología podría tener un impacto positivo en los casos de altos niveles de fragmentación del ADN espermático (Rawe, 2013), aneuploidías (Vendrell et al., 2014) y criopreservación de semen, donde se observa un aumento en la cantidad de espermatozoides apoptóticos que, a su vez, disminuye la tasa de éxito de las TRA (Said et al., 2005b).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.