Determinar la validez prospectiva del Test Your Memory (TYM) y su sensibilidad al cambio de estado cognitivo.
Tipo de estudioLongitudinal prospectivo.
MétodosSe siguió a 71 enfermos con síntomas cognitivos subjetivos y 48 con defecto cognitivo leve durante un periodo de tiempo medio de 35,2±15 meses. Los sujetos no tenían demencia ni depresión al comienzo del seguimiento y a todos se le administró al menos dos veces el TYM. Se aplicó un criterio psicométrico para determinar la existencia de defecto cognitivo (≤ 1,5 puntos z en al menos un dominio cognitivo) y la escala Disability Assessment for Dementia para asegurar la indemnidad funcional. El criterio de empeoramiento fue el cambio de estadio en la Escala de Deterioro Global.
ResultadosSesenta y un enfermos se mantuvieron cognitivamente estables y 58 empeoraron. No hubo diferencia entre ambos grupos con respecto al sexo, el nivel de instrucción, el estadio inicial de la GDS o la puntuación en el primer TYM. Los sujetos que empeoraron tenían más edad. El TYM aumentó un promedio de 0,04 puntos por mes en los pacientes estables o que mejoraron (IC95% -0,01 a 0,08) y disminuyó una media de 0,14 puntos por mes en los que empeoraron (IC95% -0,19 a -0,09). De los sujetos que empeoraron, en los que tenían defecto cognitivo leve la disminución de la puntuación del TYM fue más abrupta que en aquellos con síntomas cognitivos subjetivos.
ConclusionesEL TYM carece de validez prospectiva pero es sensible al cambio de estado cognitivo.
To determine the prospective validity of Test Your Memory (TYM) and its sensitivity to change in cognitive state.
MethodsThis longitudinal prospective study followed 71 patients with subjective cognitive symptoms and 48 with mild cognitive impairment for a mean time period of 35.2±15 months. Subjects did not have dementia or depression at the beginning of follow-up and each participant was given the TYM at least two times. A psychometric threshold was established to determine presence of a cognitive deficit (z-score≤1.5 on at least one cognitive domain) and the Disability Assessment for Dementia scale was used to ensure full functional ability. The criterion for deterioration was a change in the stage on the Global Deterioration Scale.
ResultsSixty-one patients remained cognitively stable and 58 worsened. There were no differences between them with respect to sex, educational attainment, the initial stage on the GDS, or the score on the first TYM. Subjects who worsened were older than those who did not. The TYM increased an average of 0.04 points per month in patients who remained stable or improved (95% CI, -0.01 to 0.08) and decreased an average of 0.14 points per month in those whose condition worsened (95% CI, -0.19 to -0.09). Subjects with mild cognitive impairment who worsened displayed a sharper loss of TYM points than did subjects with subjective cognitive symptoms.
ConclusionsWhile the TYM lacks prospective validity, it is sensitive to changes in cognitive state.
La frecuencia de síntomas cognitivos subjetivos (SCS) en sujetos mayores de 60 años es elevada y esos síntomas suponen mayor probabilidad de progresar a defecto cognitivo o demencia1–3. Además, en algunos estudios se ha observado una asociación entre determinados síntomas cognitivos y el rendimiento en pruebas cognitivas4,5, pero no en todos6. En realidad, las quejas subjetivas pueden tener un significado equívoco e indicar tanto una sobrestimación (pacientes con depresión) como una subestimación de las dificultades reales (pacientes anosognósicos)7–9, de modo que se ha propuesto eliminar de los criterios diagnósticos de defecto cognitivo leve (DCL) el síntoma de pérdida subjetiva, o bien reformularlo en términos del acuerdo entre el sujeto y un informador adecuado para evitar confusiones respecto a su verdadera naturaleza7,10. Por otra parte la tasa de incidencia anual de DCL en sujetos mayores de 65 años se sitúa en el 5 a 8%11 y ha sido relacionada con la edad y la existencia de factores de riesgo vascular12. Respecto a la progresión de DCL a demencia, la tasa de conversión puede alcanzar el 10% anual13. En sujetos que tienen impedimento cognitivo objetivo, además de SCS, es más probable que se produzca una involución cognitiva14. Sin embargo la utilización de indicadores neuropsicológicos para predecir la transformación del DCL a demencia no arroja resultados satisfactorios15, aunque acaso podrían mejorarse incluyendo en el algoritmo una combinación de marcadores cognitivos, de imagen y bioquímicos13,16. Por otro lado, hasta la cuarta parte de los pacientes que cumplen criterios de DCL en la primera evaluación mejoran durante el seguimiento y entonces su riesgo de empeorar no es mayor que el de los sujetos sin impedimento cognitivo17. A partir de datos extraídos en el estudio multicéntrico longitudinal The Alzheimer's Disease Neuroimaging Initiative se ha desarrollado un índice combinado, fácilmente calculable, que predice la conversión de DCL a demencia de tipo Alzheimer18. Sin embargo este índice está integrado por algunos indicadores de pérdida funcional por lo que es posible que estemos ante un algoritmo intrínsecamente viciado, es decir se aplica una norma predictiva que incluye criterios de la demencia que se quiere predecir y que son incompatibles con un DCL.
En el plano práctico, en los enfermos que acuden a una consulta neurológica por sintomatología sugerente de disfunción cognitiva, además de que es necesario comprobar la correspondencia objetiva de los síntomas, hay que predecir si evolucionarán hacia el empeoramiento, la mejoría o bien se mantendrán estables. Ciertamente la respuesta depende de la patología que motivó la consulta, pero muchos de estos enfermos no tienen un diagnóstico establecido y se les catalogará como casos de SCS o bien de DCL sin déficit funcional aparente. Completados los procedimientos evaluativos iniciales la pregunta de qué futuro espera al sujeto sigue en pie en la mayor parte de los casos. Se requiere por tanto disponer de indicadores clínicos u otros biomarcadores que ayuden a predecir el futuro con algún grado de certidumbre19. Puesto que en algunos estudios se ha observado que determinadas pruebas cognitivas breves o test neuropsicológicos facilitan la predicción de involución cognitiva en sujetos con o sin DCL16,18,20, hemos querido comprobar si el Test Your Memory (TYM)21 puede ayudar a cumplir este objetivo, es decir si está dotado de validez prospectiva en sujetos sin demencia ni depresión y también si es sensible al cambio de estado cognitivo.
Sujetos, material y métodosSujetos y procedimientoSe recolectaron sujetos que acudieron a una consulta neurológica general por sintomatología que podría sugerir la existencia de un defecto cognitivo y en los que no se alcanzó un diagnóstico de demencia o depresión en la primera evaluación. Aunque no se recogieron de forma estructurada, los síntomas más frecuentes fueron recuerdos evanescentes, no encontrar sus pertenencias en el domicilio, dificultades para seguir una conversación o comprender instrucciones, rememorar listas de compra, recordar hechos recientes, acudir a citas previstas, o presentar episodios inopinados de desubicación en lugares relativamente conocidos. A este respecto, como viene siendo habitual en los criterios más recientes de DCL10, se ha considerado que son SCS los expresados tanto por los pacientes como por sus allegados bien informados. En nuestra consulta proponemos a los sujetos con quejas cognitivas un seguimiento prolongado, incluso aunque no se confirme inicialmente la existencia de defecto alguno. Se justifica esto porque las quejas cognitivas subjetivas pueden preceder varios años a su constatación objetiva1,22. Estos sujetos son evaluados desde el punto de vista neurocognitivo. Además de realizar una historia y exploración neurológica, la valoración de las funciones superiores se completa con la administración de pruebas neuropsicométricas formales que se repiten cada 1 o 2 años y que, agrupadas por dominios cognitivos, incluyen al menos las siguientes: atención (retención de dígitos directos e inversos23), lenguaje (fluidez verbal semántica (animales/min24) y test de vocabulario de Boston25), aprendizaje y memoria verbal episódica (test de recuerdo libre y selectivamente facilitado de Grober-Buschke26: recuerdo libre inmediato [suma de los intentos 1 a 3], recuerdo inmediato con claves de categoría [suma de los intentos 1 a 3], recuerdo libre diferido y recuerdo diferido con pistas categóricas), funcionamiento ejecutivo (fluidez verbal fonológica (palabras por «p»/min)24, test del trazo A y B23, y tiempo de copia de la figura de Rey26), y habilidades visuoespaciales (precisión en la copia y reproducción de memoria, a los tres minutos, de la figura de Rey26). Las puntuaciones z resultantes de las pruebas neurocognitivas se promediaron para obtener un valor representativo de cada uno de los dominios. Para evitar que los valores extremos observados en alguna prueba influyeran excesivamente en el cálculo de dominios, determinamos adscribir valores mínimos y máximos de -3 y +3 puntos z respectivamente a las puntuaciones z que quedaran fuera de ese intervalo. Dependiendo del síntoma y las características de los enfermos se pueden administrar otras pruebas adicionales que no se incluyen en el cálculo de dominios. Se administra también a los sujetos la versión de 15 ítems de la escala de depresión geriátrica de Yesavage27, y a los familiares o convivientes las encuestas Neuropsychiatric Inventory Questionnaire28 y Disability Assessment for Dementia29 que, desde finales de 2013, se presentó en una versión validada en español30. Además, a 88 sujetos se les administró dos veces el TYM, a 27 tres veces, a 3 cuatro veces y 5 veces a un enfermo, para definir la evolución de este parámetro a lo largo del tiempo.
La determinación de la existencia de defecto cognitivo se atuvo exclusivamente a criterios neuropsicométricos (≤ -1,5 DE en al menos un dominio cognitivo.) La normalidad funcional se determinó mediante entrevista con la familia o conviviente (s) habitual (es) y se confirmó por una puntuación superior al 92% en la escala Disability Assessment for Dementia30.
El criterio de empeoramiento fue el cambio en el estado durante el seguimiento en la Escala Global de Deterioro (GDS)31: GDS 2 → GDS 3 o superior, o bien GDS 3 → GDS 4 o superior. Se descartó a los sujetos con trastornos que les impedían rellenar el TYM (p.e. mala agudeza visual o temblor invalidante), los que tenían alteraciones cerebrales focales o un índice de isquemia de Hachinski mayor de 332, los sujetos con historia de traumatismo craneoencefálico severo, los polimedicados (siete o más fármacos activos, excluidos vitaminas, oligoelementos, elementos traza, elementos esenciales y productos de parafarmacia) y a los pacientes con enfermedades psiquiátricas o somáticas sistémicas que pudieran afectar a su capacidad cognitiva. A este respecto, no se incluyeron enfermos que tuvieran un índice de comorbilidad geriátrico superior a una clase II33.
Al final del procedimiento de selección y clasificación los sujetos quedaron integrados en uno de dos grupos mutuamente excluyentes: con SCS o con DCL, es decir con SCS, sin correlato con pruebas objetivas (síntomas descritos por el paciente, observables por un allegado bien informado o ambas cosas), en estadio 2 de la GDS31, o bien como afectados de DCL10, en estadio 3 de la GDS.
Análisis estadísticoEn las pruebas de hipótesis se utilizaron técnicas de análisis bivariadas, atenidas al nivel de medida y la distribución de las variables consideradas. Los análisis multivariados emprendidos no mejoraron las conclusiones de las obtenidas con el análisis bivariado por lo que, en beneficio de la claridad y la parsimonia, no se presentan. No fue posible efectuar un análisis de supervivencia porque la periodicidad de las consultas de seguimiento fue irregular y la detracción de sujetos, de causa muchas veces desconocida, elevada. En los cálculos se emplearon como una variable ordinal los valores del TYM corregidos por los años de escolarización21. Se asumió un riesgo alfa bilateral de 0,05. Los análisis se realizaron con el paquete estadístico MedCal 14.12.0™.
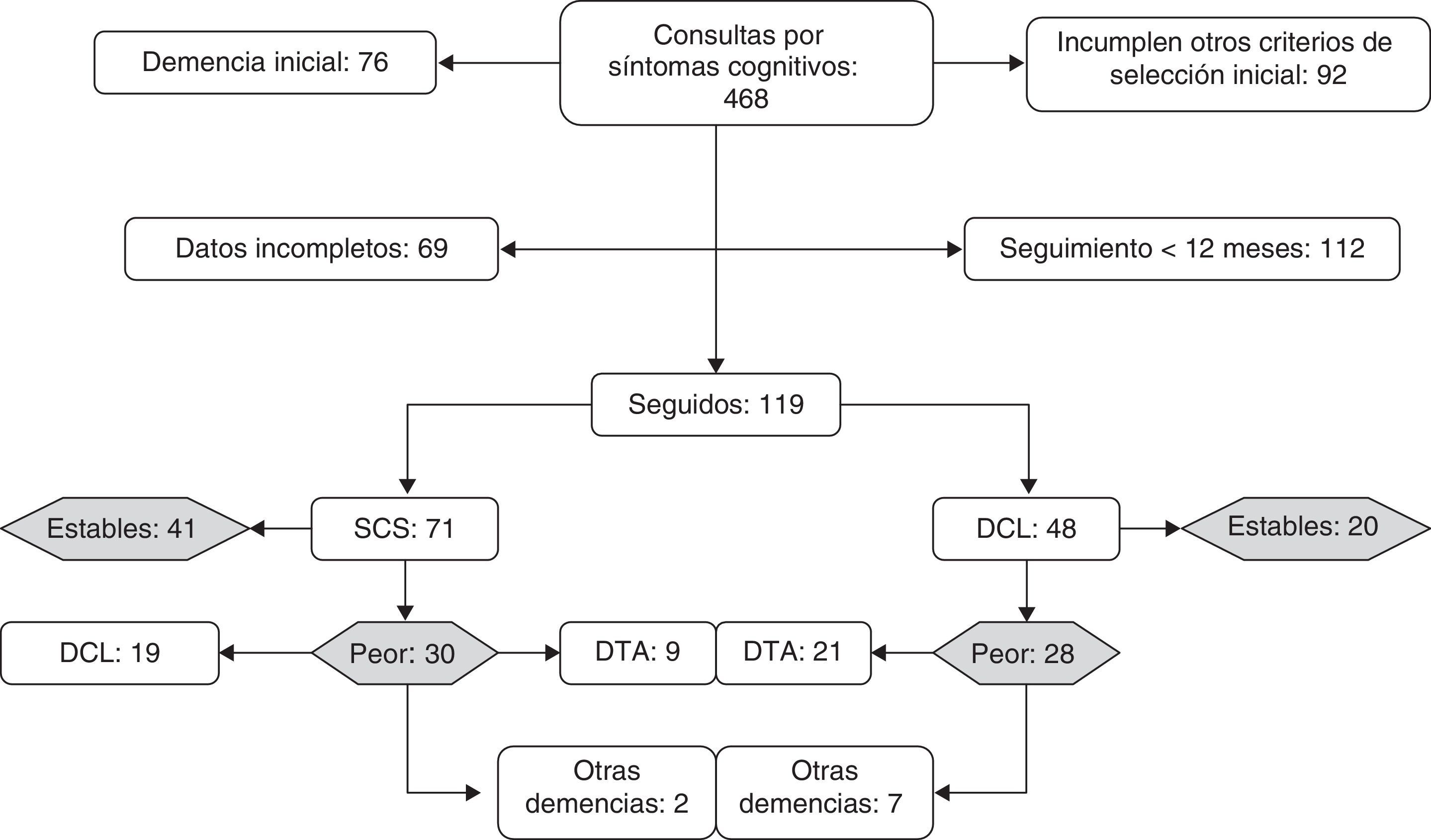
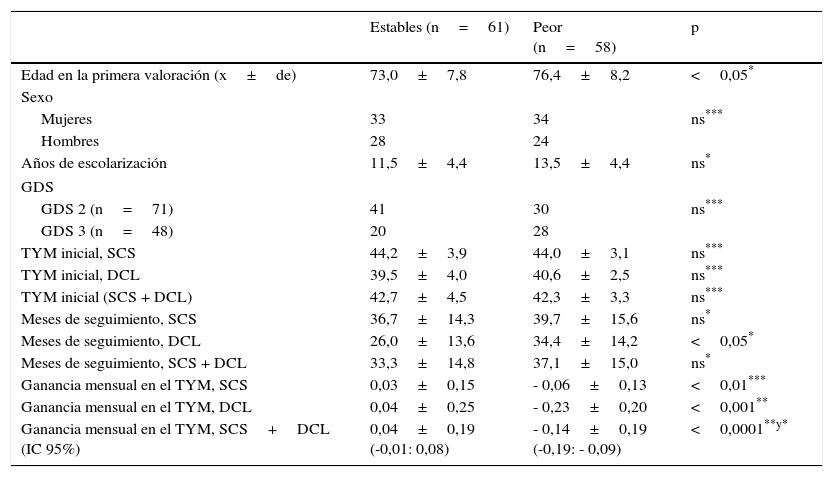
ResultadosSe siguió a 119 enfermos (71 en estadio GDS 2 y 48 en GDS 3) durante un tiempo variable de 12 a 60 meses desde la primera consulta (x=35,2 meses±15,0.) Durante el seguimiento 61 sujetos se mantuvieron cognitivamente estables o mejoraron y 58 empeoraron (fig. 1). Para el conjunto de sujetos no observamos diferencias entre los que empeoraron y los que no lo hicieron con respecto al sexo, los años de escolarización, el valor inicial del TYM, corregido por nivel de instrucción y los meses de seguimiento. Los pacientes que empeoraron tenían más edad en la primera evaluación que los que no lo hicieron (tabla 1).
Comparación entre los enfermos estables y los que empeoraron
| Estables (n=61) | Peor (n=58) | p | |
|---|---|---|---|
| Edad en la primera valoración (x±de) | 73,0±7,8 | 76,4±8,2 | <0,05* |
| Sexo | |||
| Mujeres | 33 | 34 | ns*** |
| Hombres | 28 | 24 | |
| Años de escolarización | 11,5±4,4 | 13,5±4,4 | ns* |
| GDS | |||
| GDS 2 (n=71) | 41 | 30 | ns*** |
| GDS 3 (n=48) | 20 | 28 | |
| TYM inicial, SCS | 44,2±3,9 | 44,0±3,1 | ns*** |
| TYM inicial, DCL | 39,5±4,0 | 40,6±2,5 | ns*** |
| TYM inicial (SCS + DCL) | 42,7±4,5 | 42,3±3,3 | ns*** |
| Meses de seguimiento, SCS | 36,7±14,3 | 39,7±15,6 | ns* |
| Meses de seguimiento, DCL | 26,0±13,6 | 34,4±14,2 | <0,05* |
| Meses de seguimiento, SCS + DCL | 33,3±14,8 | 37,1±15,0 | ns* |
| Ganancia mensual en el TYM, SCS | 0,03±0,15 | - 0,06±0,13 | <0,01*** |
| Ganancia mensual en el TYM, DCL | 0,04±0,25 | - 0,23±0,20 | <0,001** |
| Ganancia mensual en el TYM, SCS+DCL (IC 95%) | 0,04±0,19 (-0,01: 0,08) | - 0,14±0,19 (-0,19: - 0,09) | <0,0001**y* |
GDS: Escala de Deterioro Global; TYM: Test Your Memory; SCS: sujetos con síntomas cognitivos subjetivos; DCL: sujetos con defecto cognitivo leve
p: significación estadística
Por subgrupos, los sujetos con SCS fueron seguidos durante más tiempo (prueba t de Student, p<0,05) y tenían una puntuación en el TYM claramente superior (44,2±3,6) que aquellos con DCL (40,2±3,2) (test de Mann-Withney, p<0,0001.) Aunque el 58% de los sujetos con GDS 3 inicial empeoró y solo lo hizo el 42% de los que tenían un estadio GDS 2, la asociación no alcanzó significación estadística (χ2 2,96, gl 1, p>0,05.) De los veintiocho enfermos en estadio GDS 3 inicial que empeoraron veintiuno lo hicieron a demencia de tipo Alzheimer, mientras que de los treinta enfermos en estadio GDS 2 inicial que empeoraron diecinueve cumplieron criterios de DCL al final del seguimiento y nueve de demencia tipo Alzheimer (fig. 1). Tampoco en el análisis por subgrupos la puntuación inicial del TYM difirió entre los que empeoraron y los que se mantuvieron estables (tabla 1).
Con respecto a la variación habida en el TYM a lo largo del seguimiento, los sujetos cognitivamente estables tuvieron una ganancia media ligeramente positiva, mientras que los que empeoraron perdieron un promedio de 0,14 puntos de TYM por mes, siendo la caída más abrupta en los sujetos que tenían inicialmente un DCL (tabla 1).
DiscusiónEntre las limitaciones de este estudio longitudinal hay que mencionar en primer lugar que los pacientes incluidos habían acudido a una única consulta de neurología general, por lo que desconocemos las características de la población teórica a la que podrían representar, los mecanismos de auto- y heteroselección de sujetos y cómo pueden variar las cosas algunas calles, distritos o provincias más allá, es decir, nuestros hallazgos no son generalizables sensu stricto. Por otra parte, los sujetos seleccionados acudieron porque estaban concernidos, ellos o sus allegados, por la aparición de síntomas cognitivos, por lo que no se incluyó a sujetos sin quejas cognitivas, se constatara o no la existencia de un defecto cognitivo objetivo. Un aspecto discutible de este estudio es nuestra técnica de clasificar a los sujetos. Es habitual que se clasifique utilizando casi exclusivamente la información obtenida mediante anamnesis y encuestas. Pero puesto que ni los enfermos ni el evaluador fueron cegados en ningún momento durante el seguimiento, hemos preferido emplear un sistema cuantitativo que en nuestro entorno de trabajo tiene menos riesgo de incurrir en sesgos de interpretación. Reconocemos que esta técnica puede definir grupos de sujetos que no sean comparables a los obtenidos con criterios menos estrictos como han observado Ganguli et al.34. Entre los métodos psicométricos de clasificación la definición del procedimiento y la elección de los puntos de corte aplicados en las pruebas son otros aspectos conflictivos. Algunos investigadores consideran que el estudio psicométrico refleja anormalidad si al menos una prueba tiene una puntuación inferior al punto de corte elegido, otros utilizan el mismo criterio pero aplicado a cada dominio cognitivo35, lo que viene a ser lo mismo. El principal problema de este procedimiento es que no se hace ajuste alguno para comparaciones múltiples. En otras palabras, la probabilidad de observar un resultado anormal por puro azar es mayor cuantas más pruebas se administren. Nosotros decidimos emplear el criterio más conservador utilizado en el estudio MYHAT34. Agrupadas las pruebas por dominios, promediamos los resultados de las mismas en cada dominio y consideramos que era probable que hubiera déficit en un dominio cognitivo si el promedio de los valores de las pruebas de ese dominio estaba por debajo del punto de corte. Con este procedimiento, algunos sujetos tenían valores bajos en una prueba que eran compensados con los valores normales o elevados en otras, pero creemos que eso es aproximadamente equivalente a ajustar por múltiples comparaciones y obviamos el hecho de que un sujeto fracase en una sola prueba por motivos espurios. Además, hemos evitado adscribir valores extremos (inferiores o superiores a 3 puntos z) para que ninguna prueba influya indebidamente en el conjunto del dominio. Pensamos que este sistema es metodológicamente adecuado. Respecto a la elección del punto de corte para definir anormalidad probabilística en una prueba, dependiendo del punto de corte elegido los grupos resultantes son muy diferentes35. Nuestra decisión de situarlo en ≤ 1,5 puntos z es suficientemente inclusiva. Este criterio es prácticamente idéntico al que se observó que genera agrupamientos relacionados de forma significativa con el genotipo APOE y el grado de atrofia temporal medial en el Florida Alzheimer's Disease Research Center35.
En este estudio longitudinal la puntuación del TYM en la primera evaluación no predijo la evolución durante los tres años siguientes en los sujetos con SCS ni en los que tenían un DCL, por lo que se puede afirmar que el TYM carece de validez prospectiva. El elevado porcentaje de empeoramiento observado en nuestra serie (casi un 17% por año), puede deberse a una selección negativa, típica de una consulta especializada o a un mayor tiempo de evolución de los sujetos que llegan a estas consultas, pero sugiere en todo caso que los síntomas cognitivos y el DCL, una vez descartada la presencia de depresión, tienen en general un significado pronóstico ominoso, la misma conclusión a la que se ha llegado en otros estudios1. En un estudio poblacional transversal se observó que el número de síntomas cognitivos predecían peores rendimientos en las pruebas y que no todas las quejas de tipo cognitivo son equipotenciales con respecto a su contrapartida objetiva. En el estudio mencionado, ciertos síntomas como la dificultad para seguir el hilo de una conversación o para ubicarse en un entorno familiar fueron indicadores más seguros que otros (p.e. recuerdos evanescentes) de la existencia de un déficit cognitivo4. Es plausible que en los sujetos con mayor número de síntomas, en particular si son de cierta forma, se pueda predecir empeoramiento con mayor seguridad. Nosotros no hemos recogido de forma estructurada la cualidad de los síntomas referidos por lo que no podemos obtener conclusiones al respecto. En el estudio de cohorte de la Universidad de Kentucky la mitad de los sujetos tuvieron SCS que fue aparejada a una odds ratio de 2,8, con respecto a los sujetos asintomáticos, de desarrollar DCL o demencia1.
Sea como fuere, cerca de la mitad de los sujetos con SCS empeorarán al igual que en torno al 60% de los que presentan inicialmente un DCL, y se puede apostar a que uno de cada dos pacientes que se presentan en nuestra consulta con estos problemas van a empeorar en los próximos tres años, aunque el TYM no nos ayuda nada a mejorar esta predicción. Si el paciente supera los 75 años entonces las probabilidades juegan en su contra. Otros investigadores han encontrado que el sexo femenino, algunos factores de riesgo vascular, o los rendimientos en determinadas pruebas objetivas predicen la involución cognitiva. A juzgar por las pendientes de caída en la puntuación TYM, de entre los sujetos que empeoraron los descensos en las puntuaciones fueron más suaves en los que tenían SCS (una pérdida media aproximada de un punto por año) que en los que tenían inicialmente un DCL (cerca de tres puntos por año), mientras la ganancia fue similar en los sujetos con SCS y con DCL que se mantuvieron estables o mejoraron. En aquellos con DCL la pendiente de pérdida es bastante pronunciada. Esto concuerda con lo observado por Jhonson et al.36 en los sujetos que empeoraron hasta que se alcanzó un diagnóstico de enfermedad de Alzheimer. En estos sujetos tras un periodo prolongado de declive lento en los rendimientos se produce una caída rápida que conduce a la pérdida funcional. En cualquier caso, nuestros hallazgos parecen sugerir que aunque el TYM carece de validez prospectiva, es un instrumento hasta cierto punto sensible al cambio de estado cognitivo. Pero ha de reconocerse que su calibración es deficiente, como hemos puesto de manifiesto recientemente37.
FinanciaciónEste estudio no ha sido financiado por ninguna institución pública o privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.