Las mutaciones en el gen LRRK2 se han relacionado tradicionalmente con un fenotipo benigno de la enfermedad de Parkinson (EP). En la fase avanzada, se ha descrito una respuesta favorable a la estimulación cerebral profunda (ECP).
MétodosRetrospectivamente, hemos analizado las características clínicas y la evolución de 14 pacientes con EP debida a mutaciones en LRRK2 (EP-LRRK2), 13 en G2019S y uno en I1371 V. Nueve de ellos, en fase avanzada, tuvieron una evolución media de 7, 2 años hasta alcanzarla.
ResultadosSiete pacientes fueron intervenidos de ECP subtalámica bilateral y dos recibieron tratamiento con una terapia de infusión. Los pacientes portadores de la mutación G2019S mostraron una excelente respuesta a la ECP, con una mejoría a los seis meses superior al 80% en la Unified Parkinson's disease rating scale (UPDRS II y UPDRS III). Esta respuesta se ha mantenido en el tiempo. El paciente con la mutación I1371 V mostraba un fenotipo grave de la enfermedad y su respuesta a la ECP ha sido moderada. Los pacientes con EP-LRRK2 en fase avanzada mostraron una afectación cognitiva predominantemente frontal con un deterioro significativo del lenguaje.
ConclusionesEn nuestros pacientes con EP-LRRK2 hemos observado un fenotipo con una evolución más rápida a la fase avanzada de la enfermedad. Recalcamos la idoneidad de la ECP subtalámica en estos casos.
LRRK2 mutations have traditionally been associated with a benign phenotype of Parkinson's disease (PD). Favourable responses to deep brain stimulation (DBS) are reported in the advanced phase.
MethodsWe performed a retrospective analysis of the clinical characteristics and progression of 13 patients with LRRK2-associated PD (13 with G2019S and one with I1371 V). Nine patients were in the advanced phase, with a mean progression time of 7.2 years before reaching this phase.
ResultsSeven patients underwent bilateral subthalamic DBS implantation, and two received infusion treatment. Patients with mutation G2019S responded excellently to DBS, with Unified Parkinson's disease rating scale (UPDRS) II and III scores improving by 80% at six months. This response was sustained over time. The patient with mutation I1371 V had a severe phenotype of the disease, and presented a moderate response to DBS. Patients with advanced LRRK2-associated PD showed predominantly frontal cognitive involvement, with significant language impairment.
ConclusionsIn these patients, progression was faster in the advanced stage of the disease. We emphasise the suitability of subthalamic DBS in the management of these patients.
PARK8 es la causa monogénica más común de la enfermedad de Parkinson (EP) familiar; está causada por mutaciones en el gen leucine-rich repeated kinase-2 (LRRK2), localizado en el locus 12p12. La proteína codificada, dardarina, actúa presumiblemente como una cinasa citoplasmática en la fosforilación de proteínas. Además, se relaciona íntimamente con el transporte vesicular y de membrana y el recambio de proteínas, incluida la vía de degradación por lisosomas1.
Se han descrito varias mutaciones con cambio de sentido o sin sentido, pero solo siete se han relacionado fehacientemente con la patogenia de la EP. Se cree que la mutación G2019S origina una ganancia de función en la actividad cinasa, ya que los portadores homocigotos no presentan una enfermedad más grave que los heterocigotos2. Esta mutación es la más frecuente en el mundo y es causa de más de un 6% de la EP familiar; se ha encontrado también en la EP esporádica pero es menos frecuente3,4. La penetrancia es variable y depende de la edad. Se ha observado una alta variabilidad en los hallazgos neuropatológicos, con acúmulo clásico de cuerpos de Lewy (CL) en la mayoría de ocasiones, pero también degeneración nígrica sin CL, CL difusos, ovillos neurofibrilares positivos para tau e inclusiones citoplasmáticas gliales positivas para alfa-sinucleína o ubicuitina5.
Generalmente, se acepta que el fenotipo EP-LRRK2 es indistinguible de la EP idiopática. Algunos estudios han señalado que podría tratarse de una variante con un curso relativamente benigno y de progresión lenta6,7. El fenotipo EP-LRRK2 es, habitualmente, de inicio tardío y tremórico, con una buena respuesta dopaminérgica y leves complicaciones motoras8. Los portadores parecen tener una menor tasa de deterioro cognitivo en comparación con la EP idiopática6,9,10. Sin embargo, la mutación R1441C, original del País Vasco, da lugar a fluctuaciones motoras y sintomatología axial con mayor frecuencia que las demás mutaciones o la EP idiopática11.
La estimulación cerebral profunda (ECP) es una de las terapias avanzadas que permite manejar las complicaciones motoras de la EP. La evidencia científica más reciente apoya que los pacientes con EP-LRRK2, especialmente los portadores de G2019S, tienen buenos resultados tras la estimulación subtalámica y son buenos candidatos para esta terapia12.
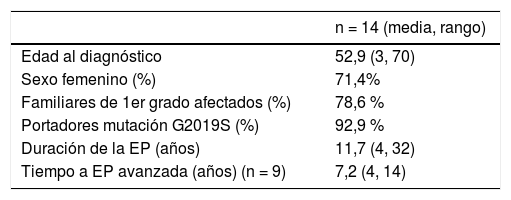
Pacientes y métodosEste es un estudio retrospectivo y observacional realizado con un registro consecutivo y prospectivo de pacientes con EP que fueron evaluados por la Unidad de Trastornos del Movimiento del Hospital Clínico Universitario de Santiago de Compostela. El estudio se realizó de conformidad con la Declaración de Helsinki de la Asociación Médica Mundial y fue aprobado por el Comité de Ética en Investigación de Santiago (código de identificación del proyecto 2017/350). Basado en las buenas prácticas clínicas, solicitamos un estudio genético en aquellos pacientes con un debut joven de la enfermedad (< 50 años), como parte de un estudio genético en aquellos casos de EP familiar y en casos de familiares de primer grado afectados. Hemos identificado un total de 14 pacientes portadores de una mutación en el gen LRRK2 y todos ellos tienen el diagnóstico clínico de EP. Las características basales de todos los pacientes EP-LRRK2 se muestran en la tabla 1 del estudio.
Características basales de los pacientes con EP-LRRK2
| n = 14 (media, rango) | |
|---|---|
| Edad al diagnóstico | 52,9 (3, 70) |
| Sexo femenino (%) | 71,4% |
| Familiares de 1er grado afectados (%) | 78,6 % |
| Portadores mutación G2019S (%) | 92,9 % |
| Duración de la EP (años) | 11,7 (4, 32) |
| Tiempo a EP avanzada (años) (n = 9) | 7,2 (4, 14) |
La mutación detectada en todos los casos, excepto en uno, fue G2019S, en la cual una glicida resulta reemplazada por una serina en el exón 41. En un paciente identificamos la mutación I1371 V, en la cual una valina es sustituida por una isoleucina en el exón 29, previamente descrita como patogénica. No hemos encontrado en ningún caso la mutación R1441G, la más frecuente en el País Vasco y regiones vecinas. Esto es, seguramente, debido a factores geográficos que determinan un aislamiento relativo de esta región con respecto al norte de España y apoya la existencia de un gradiente geográfico para esta mutación13.
Consideramos, como fase avanzada de la EP, una condición en la cual la primera línea de tratamiento ya no proporciona un control global adecuado de la enfermedad. A la hora de evaluar una terapia avanzada, todos los pacientes realizaron una evaluación neuropsicológica, excepto uno. El estado cognitivo global se midió por la Mattis Dementia Rating Scale (MDRS). La memoria se evaluó usando el Test de Aprendizaje Verbal España-Complutense (TAVEC)14, con subescalas para el recuerdo inmediato (TAVEC RI), recuerdo libre a corto plazo (TAVEC RLCP), recuerdo libre a largo plazo (TAVEC RLLP) y memoria de recuperación (TAVEC REC). La Frontal Assessment Battery (FAB) y la Torre de Hanói de cuatro piezas se emplearon para valorar las funciones ejecutivas. La memoria de trabajo se midió por el test de dígitos de la Wechsler Adult Intelligence Scale (WAIS-digits). Se realizaron pruebas de fluencia verbal en clave fonética «p» y categórica «animal». Se realizó el Boston Naming Test (BNT) para evaluar el lenguaje. La Yesavage Depression Scale (YDS) se completó para detectar estados de depresión.
ResultadosDe los 14 casos, nueve de ellos se encuentran en una fase avanzada de la enfermedad. Actualmente, todos los pacientes están tratados con una terapia avanzada. Recomendamos, en primer lugar, la ECP para la EP avanzada, pero dos de los pacientes no cumplieron los criterios necesarios.
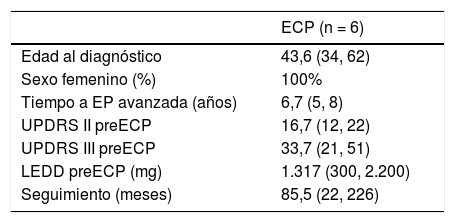
Estimulación cerebral profunda en los casos portadores de G2019SSeis pacientes fueron intervenidos de ECP subtalámica bilateral (tabla 2). La edad media al diagnóstico fue de 43,6 años (rango de 34 a 62 años) y la duración de la enfermedad antes de la fase avanzada fue de 6,7 años (de cinco a ocho). El seguimiento es muy heterogéneo y bastante largo en varios casos, con una media de 85,5 meses (de 22 a 226).
Características basales de los portadores de G2019S intervenidos
| ECP (n = 6) | |
|---|---|
| Edad al diagnóstico | 43,6 (34, 62) |
| Sexo femenino (%) | 100% |
| Tiempo a EP avanzada (años) | 6,7 (5, 8) |
| UPDRS II preECP | 16,7 (12, 22) |
| UPDRS III preECP | 33,7 (21, 51) |
| LEDD preECP (mg) | 1.317 (300, 2.200) |
| Seguimiento (meses) | 85,5 (22, 226) |
LEDD: Dosis diaria equivalente de L-Dopa; UPDRS II y III: subescalas de las actividades diarias de la Unified Parkinson's Disease Rating Scale.
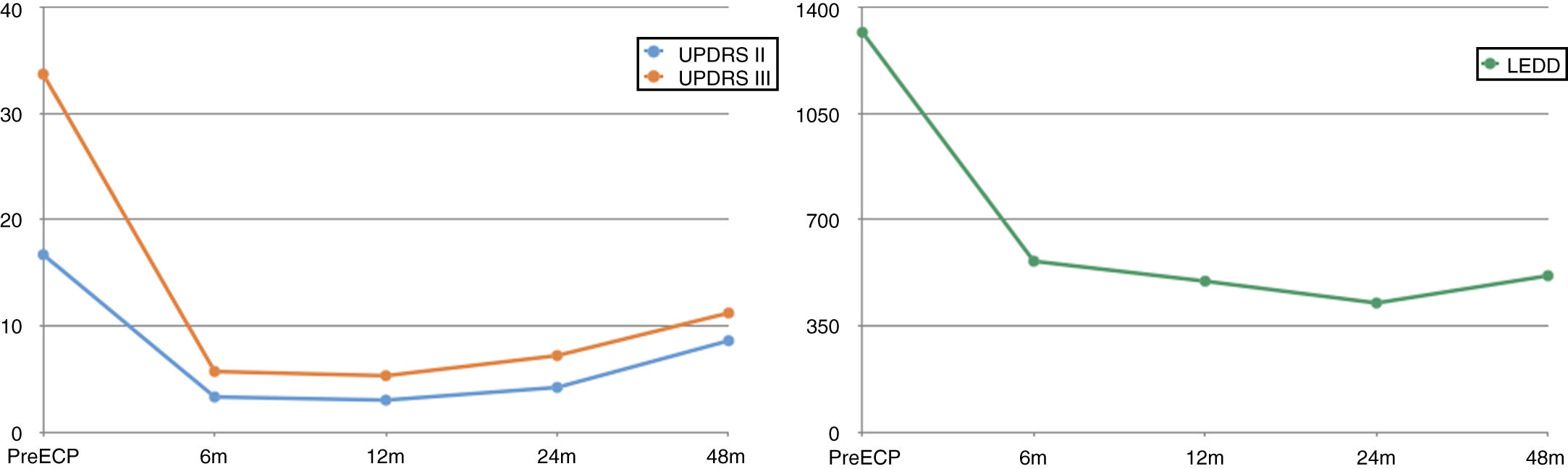
Tras la cirugía, la respuesta fue espectacular (fig. 1). La reducción a los seis meses en la UPDRS II (on medicación / on estimulación) y en la parte III (off medicación / on estimulación) fue del 80 y 83%, respectivamente, en relación con la última evaluación en off de medicación (16,7 a 3,3 y 33,7 a 5,7). La dosis diaria equivalente de L-Dopa (LEDD) se redujo a más de la mitad (1.317 mg a 563 mg).
Seguimiento de los pacientes portadores de G2019S intervenidos.
LEDD: Dosis Diaria Equivalente de L-Dopa; m: meses; UPDRS II: subescala de las actividades diarias de la Unified Parkinson's disease rating scale; UPDRS III: subescala motora de la Unified Parkinson's Disease Rating Scale.
Esta respuesta se ha mantenido en los primeros años tras la cirugía. Cinco casos acumulan más de cuatro años de seguimiento y, pese a un inevitable empeoramiento, la mejoría se ha mantenido razonablemente estable (48% en la UPDRS II y 66% en la UPDRS III). A los 48 meses, la LEDD media es incluso menor, 515 mg, lo que refleja el buen control clínico con la ECP.
En general, la evolución a largo plazo ha sido satisfactoria, pese a que, actualmente, alguno de los casos presenta complicaciones asociadas con el curso de la EP (tabla 3). Un buen ejemplo es el caso uno, operada hace 19 años. Se trataba de una paciente con discinesias graves a la cual se le propuso una palidotomía inicialmente, pero la inminente aparición de la ECP retrasó su intervención hasta el año 2000. Todavía mantiene una buena respuesta de los síntomas dopaminérgicos, pero presenta síntomas no dopaminérgicos (trastorno de la marcha y postura e hipotensión ortostática). El caso tres mostró una buena respuesta a la ECP al inicio, sin embargo, su respuesta actual está limitada por posturas distónicas en miembros inferiores, pese a ser reintervenida.
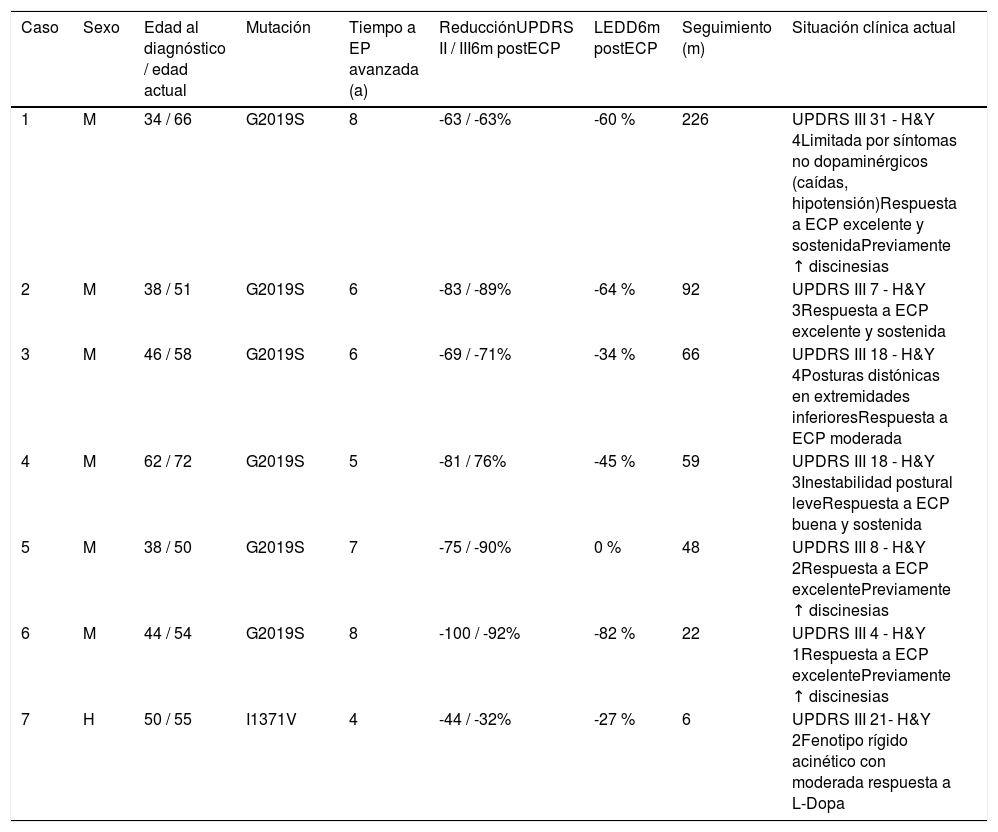
Situación clínica actual de los pacientes con EP-LRRK2 intervenidos
| Caso | Sexo | Edad al diagnóstico / edad actual | Mutación | Tiempo a EP avanzada (a) | ReducciónUPDRS II / III6m postECP | LEDD6m postECP | Seguimiento (m) | Situación clínica actual |
|---|---|---|---|---|---|---|---|---|
| 1 | M | 34 / 66 | G2019S | 8 | -63 / -63% | -60 % | 226 | UPDRS III 31 - H&Y 4Limitada por síntomas no dopaminérgicos (caídas, hipotensión)Respuesta a ECP excelente y sostenidaPreviamente ↑ discinesias |
| 2 | M | 38 / 51 | G2019S | 6 | -83 / -89% | -64 % | 92 | UPDRS III 7 - H&Y 3Respuesta a ECP excelente y sostenida |
| 3 | M | 46 / 58 | G2019S | 6 | -69 / -71% | -34 % | 66 | UPDRS III 18 - H&Y 4Posturas distónicas en extremidades inferioresRespuesta a ECP moderada |
| 4 | M | 62 / 72 | G2019S | 5 | -81 / 76% | -45 % | 59 | UPDRS III 18 - H&Y 3Inestabilidad postural leveRespuesta a ECP buena y sostenida |
| 5 | M | 38 / 50 | G2019S | 7 | -75 / -90% | 0 % | 48 | UPDRS III 8 - H&Y 2Respuesta a ECP excelentePreviamente ↑ discinesias |
| 6 | M | 44 / 54 | G2019S | 8 | -100 / -92% | -82 % | 22 | UPDRS III 4 - H&Y 1Respuesta a ECP excelentePreviamente ↑ discinesias |
| 7 | H | 50 / 55 | I1371V | 4 | -44 / -32% | -27 % | 6 | UPDRS III 21- H&Y 2Fenotipo rígido acinético con moderada respuesta a L-Dopa |
H: hombre; H&Y: Escala Hoehn and Yahr; LEDD: Dosis diaria equivalente de L-Dopa; m: meses; M: mujer; UPDRS II: subescala de las actividades diarias de la Unified Parkinson's Disease Rating Scale; UPDRS III: subescala motora de la Unified Parkinson's Disease Rating Scale.
El paciente con la mutación I1371 V tiene una evolución especialmente agresiva (caso siete) (tabla 3). Fue diagnosticado a los 50 años, con un síndrome rígido acinético, pérdida del olfato y gusto, y movimientos bruscos durante el sueño. Progresó a una fase avanzada en cuatro años con altas dosis de medicación y una moderada respuesta. Pese a haber mejorado, este paciente tiene el peor resultado a los seis meses del tratamiento de todos los pacientes intervenidos. La reducción en la UPDRS II y UPDRS III fue menor que en otros casos (44 y 32%), así como la reducción de la LEDD (27%).
Terapias de infusiónDos casos de EP-LRRK2 en estado avanzado no cumplieron criterios para ECP y se les propuso tratamiento con una terapia de infusión.
Una paciente de 77 años inició tratamiento con apomorfina en infusión continua subcutánea (APO) tras 14 años de evolución. La paciente lleva seis años con esta terapia y muestra una respuesta sostenida sin efectos adversos importantes. Pese a su edad avanzada, la terapia con APO es de 23 horas y un total de 120 mg por día.
Al otro paciente se le propuso, inicialmente, para ECP después de siete años de evolución, pero se objetivó un deterioro cognitivo de perfil amnésico y una alteración significativa del lenguaje. Se indicó tratamiento con infusión continua de levodopa/carbidopa intrayeyunal (DUO) y tras 16 meses muestra una respuesta adecuada. La LEDD empleada actualmente es relativamente alta (1.700 mg) y bien tolerada.
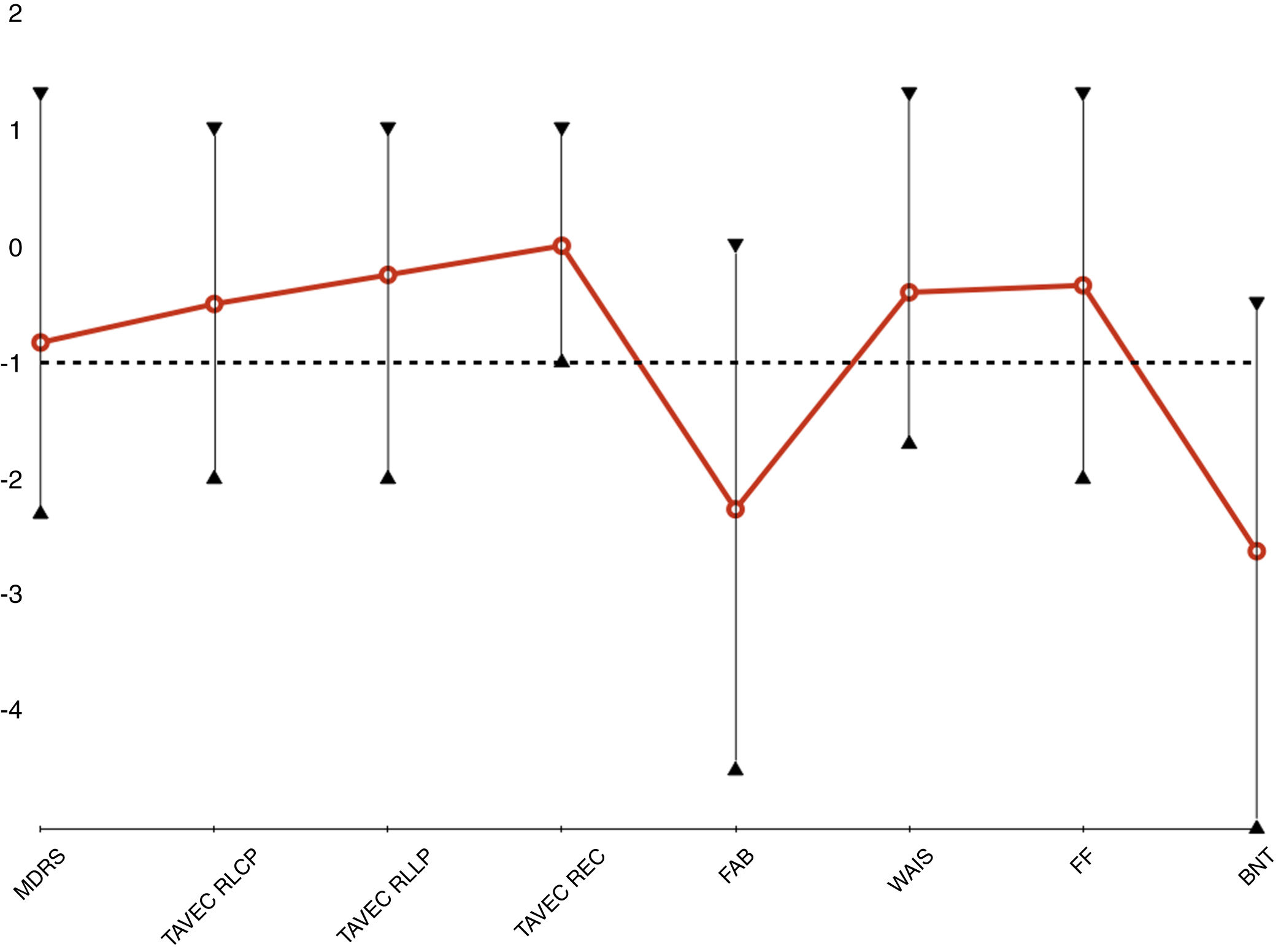
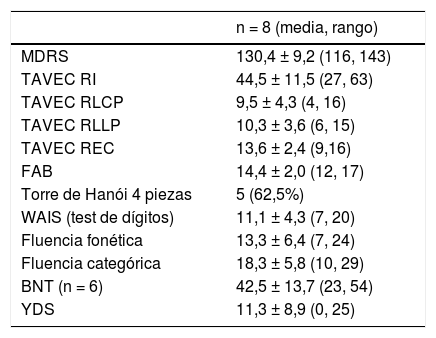
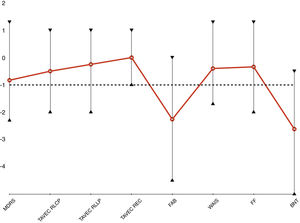
Evaluación neuropsicológicaOcho pacientes completaron la evaluación. Del caso uno no disponemos de la evaluación, pues fue intervenida hace ya más de 19 años. La tabla 4 muestra las puntuaciones medias en las pruebas realizadas. La fig. 2 representa el perfil neuropsicológico ajustado al nivel educativo y a la edad para cada paciente, basado en la desviación estándar para la prueba con una distribución normal de la población (Z-score). Se considera el resultado de un test normal si el resultado es mayor que -1 desviaciones típicas.
Evaluación neuropsicológica de los pacientes con EP-LRKK2 en fase avanzada
| n = 8 (media, rango) | |
|---|---|
| MDRS | 130,4 ± 9,2 (116, 143) |
| TAVEC RI | 44,5 ± 11,5 (27, 63) |
| TAVEC RLCP | 9,5 ± 4,3 (4, 16) |
| TAVEC RLLP | 10,3 ± 3,6 (6, 15) |
| TAVEC REC | 13,6 ± 2,4 (9,16) |
| FAB | 14,4 ± 2,0 (12, 17) |
| Torre de Hanói 4 piezas | 5 (62,5%) |
| WAIS (test de dígitos) | 11,1 ± 4,3 (7, 20) |
| Fluencia fonética | 13,3 ± 6,4 (7, 24) |
| Fluencia categórica | 18,3 ± 5,8 (10, 29) |
| BNT (n = 6) | 42,5 ± 13,7 (23, 54) |
| YDS | 11,3 ± 8,9 (0, 25) |
BNT: Boston naming test; FAB: Frontal assessment battery; MDRS: Mattis Dementia Rating Scale; REC: memoria de recuperación; RI: recuerdo inmediato; RLCP: recuerdo a corto plazo; RLLP: recuerdo a largo plazo; TAVEC: Test de aprendizaje verbal España-Complutense; WAIS: Wechsler Adult Intelligence Scale; YDS: Yesavage Depression Scale.
Perfil neuropiscológico de los pacientes EP-LRRK2 en fase avanzada.
BNT: Boston Naming Test; FAB: Frontal Assessment Battery; MDRS: Mattis Dementia Rating Scale; PF: phonetic fluency; REC: memoria de recuperación; RLCP: recuerdo a corto plazo; RLLP: recuerdo a largo plazo; TAVEC: Test de aprendizaje verbal España-Complutense; WAIS: Wechsler Adult Intelligence Scale.
La cognición global en nuestra muestra fue normal, la MDRS media fue 130,4 ± 9,2 puntos. Los pacientes mostraron una disfunción cognitiva predominantemente frontal con una memoria relativamente preservada. Las puntuaciones más bajas fueron obtenidas en la FAB (14,4 ± 2,0, Z = -2,26 ± 1,53). Otras tareas frontales, como la memoria de trabajo medida por la WAIS-Digits (11,1 ± 4,3, Z = -0,44 ± 1,08) o la fluencia fonética (13,3 ± 6,4, Z = -0,34 ± 1,02) obtuvieron una puntuación normal. La TAVEC RLCP (9,5 ± 4,3, Z = -0,50 ± 0,93) y la TAVEC RLLP (10,3 ± 3,6, Z = -0,25 ± 1,04), pese a ser bajas, están en un rango normal así como la TAVEC REC (13,6 ± 2,4, Z = 0,0 ± 0,76). Hemos encontrado una considerable afectación del lenguaje medida por el BNT (42,5 ±13,7, Z = -2,62 ± 1,99).
A tener en cuenta, el paciente en terapia con DUO tuvo las puntuaciones más bajas en las pruebas MDRS, TAVEC y BNT, pero no en las pruebas para tareas frontales, siendo la principal razón por la que se descartó la ECP subtalámica en su caso.
No hemos identificado trastornos depresivos graves y solo tres pacientes alcanzaron puntuaciones de depresión en la YDS. Un caso padeció de un trastorno del control de impulsos (gambling) que se controló reduciendo la dosis de agonista dopaminérgico, especialmente cuando se realizó la ECP (caso seis).
DiscusiónGlobalmente hemos observado que nuestros pacientes con mutaciones en el gen LRRK2, la mayor parte portadores de la mutación G2019S, alcanzaron la fase avanzada de la EP de una manera relativamente precoz. Los nueve pacientes en fase avanzada llegaron a esta con una media de 7,2 años de evolución. En el caso de los pacientes intervenidos, la evolución fue incluso más corta (6,7 años). De los cinco pacientes que no se encuentran en la fase avanzada, únicamente uno de ellos tiene una evolución superior a los 10 años.
Esta progresión hacia la fase avanzada de la EP es marcadamente más rápida que lo publicado en las series más recientes. En el estudio Euroinf-215, la terapia avanzada se inicia con una media superior a los 10 años de evolución en el caso de la ECP y superior a los 13 años en las terapias de infusión. En este estudio, la evaluación motora en on (medida por las escalas UPDRS III y Hoehn and Yahr) antes del inicio de una terapia avanzada fue de 24,1 ± 11,3 y 2,5 para los pacientes intervenidos, 29,2 ± 11,0 y 3,0 para los pacientes con APO y 29,9 ± 12,2 y 3,0 para los pacientes con DUO. En nuestra opinión estos datos revelan una bien avanzada fase de la enfermedad. En estas series, concretamente algunos pacientes inician la terapia de infusión con una puntuación de cuatro en la escala de Hoehn and Yahr lo que significa la presencia de síntomas axiales prominentes.
En un estudio prospectivo, que compara pacientes con EP-LRRK2 y EP idiopática intervenidos, los autores observan que el grupo EP-LRRK2 desarrolla más complicaciones relacionadas con la L-Dopa y tiene significativamente una «luna de miel» más corta (3,8 ± 1,7 y 5,4 ± 2,6 años, respectivamente)16. En otro estudio, de una gran cohorte argelina donde las mutaciones en LRRK2 alcanzan casi el 40% de los casos de EP, los pacientes con EP-LRRK2 muestran un perfil clínico similar a la EP idiopática, pese a que son más proclives a desarrollar fluctuaciones motoras y discinesias17. Estos dos hechos van en concordancia con nuestra observación ya que sugieren que la fase avanzada de la enfermedad podría ocurrir más tempranamente.
El resultado de la ECP se relaciona con factores derivados principalmente de la selección del paciente y de la técnica quirúrgica. La edad, una buena respuesta a la L-Dopa y la ausencia de un deterioro cognitivo significativo y de síntomas axiales refractarios son las claves para el mejor pronóstico. La correcta colocación del electrodo en la diana seleccionada, los parámetros de estimulación y los ajustes en el tratamiento tras la cirugía son indispensables para un buen resultado. Las formas monogénicas de la EP se asocian con determinados fenotipos clínicos, pero se conoce poco la forma en la que estos factores genéticos determinan el resultado de la ECP. Casi todos los pacientes con EP-LRRK2 tuvieron una marcada mejoría (mayor del 50%) o satisfactoria respuesta (mejoría entre el 30 y 50%) después de la ECP subtalámica a corto (dos años) y medio plazo (entre dos y seis años), excepto en el caso de la mutación R1441G12. En la mutación G2019S, la más conocida, cuando los portadores se han comparado con los controles, no se observaron diferencias significativas en la evaluación motora, en la reducción de LEDD, en la evaluación cognitiva ni en los trastornos neuropsiquiátricos18–21. Sayad et al.16 publicaron un mejor resultado motor tras la ECP para pacientes con EP-LRRK2 en comparación con pacientes con EP controles, pero una explicación razonable es que el grupo de control no alcanzó la mejoría habitual. Lo que observamos en nuestros pacientes después de la ECP es consistente con lo que se sabe hasta la fecha. En nuestro conocimiento, el caso uno es el paciente con EP-LRRK2 intervenido con el seguimiento más largo.
Las referencias al fenotipo clínico asociado con la mutación I1371 V son escasas. Esta mutación se ha probado como patogénica en la EP familiar, presentándose como una EP clásica22,23. Un estudio post-mortem identificó hallazgos clásicos de EP en un paciente con parkinsonismo de inicio tardío y deterioro cognitivo24 y otro reveló una degeneración olivipontocerebelosa en un caso con diagnóstico clínico de atrofia multisistema25. Hasta donde sabemos, nuestro caso es el primero en el que se realiza una ECP.
Belarbi et al.26 hicieron un estudio con una extensa valoración neuropsicológica y neuropsiquiátrica de pacientes con EP-LRRK2. No encontraron diferencias estadísticamente significativas con respecto a los no portadores. Los resultados en la evaluación neuropsicológica se expresaron como el porcentaje de pacientes con resultados anormales y eso dificulta la comparación con nuestros resultados. El número de pacientes con resultados anormales en las pruebas de memoria, FAB y fluidez verbal fue mayor en pacientes con EP-LRRK2. Nuestra evaluación neuropsicológica muestra que los pacientes con EP-LRRK2 tienen un perfil cognitivo global característico de la EP moderada - avanzada, con una afectación predominantemente frontal sin un deterioro de la memoria relevante, excepto para la afectación del lenguaje que hemos identificado. No tenemos ningún argumento ni hemos encontrado datos similares en la literatura. El BNT solo fue realizado en seis pacientes, lo que limita extrapolar conclusiones. Será interesante comparar estos datos con pacientes con EP idiopática en fase avanzada que se someten a ECP o evaluar el compromiso del lenguaje en pacientes con EP-LRRK2 en fase inicial.
Nuestros datos son limitados. En primer lugar, el análisis es retrospectivo y la muestra posee una gran heterogeneidad. No obstante, identificamos como la principal limitación que los estudios genéticos son llevados a cabo generalmente en pacientes jóvenes que, a su vez, son los que más frecuentemente desarrollan complicaciones motoras de la enfermedad y, por tanto, serán los candidatos a una terapia avanzada, especialmente la ECP. Este hecho puede reducir la detección de casos con una evolución más benigna en nuestra cohorte. No podemos confirmar una mayor prevalencia de EP en fase avanzada en pacientes EP-LRRK2 debido a este sesgo.
Como conclusión, en un contexto de un creciente interés por las formas monogénicas de la EP, en la búsqueda de subtipos clínicos específicos de la enfermedad y tratamientos dirigidos contra mecanismos patogénicos concretos, resaltamos que una evolución más agresiva de la EP puede ocurrir en las mutaciones del gen LRRK2. Sin embargo, nuestros pacientes tienen una respuesta buena a las terapias avanzadas, especialmente a la ECP. En nuestra opinión, esto puede reflejar una condición más puramente motora de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.