Los ictus son una causa importante de morbimortalidad en la población actual. Cada vez, a los ictus, se les han ido atribuyendo nuevos factores de riesgo. Últimamente está aumentando el interés de los trastornos del sueño y su influencia tanto como factor de riesgo y pronóstico en los ictus.
DesarrolloEn este trabajo se exponen los cambios de la arquitectura del sueño y de la actividad cerebral en los pacientes con ictus, además de la interacción existente entre los ictus y los diferentes trastornos del sueño, así como los resultados de estas interacciones que modifican el transcurso de la enfermedad. Se enumeran los posibles tratamientos descritos hasta la actualidad, ya que un correcto tratamiento de estos trastornos del sueño no sólo puede mejorar la calidad de vida y disminuir las secuelas, sino mejorar las expectativas de vida de estos pacientes.
ConclusionesLos trastornos del sueño se están consolidando como una entidad asociada a los ictus, que en ocasiones puede ser un factor precursor, pero que también puede interferir en la evolución y en la recuperación posterior del ictus. Con este artículo pretendemos realizar una revisión exhaustiva de lo que se ha descrito hasta la actualidad en relación con los ictus, con el sueño y las alteraciones del mismo.
In the current population, strokes are one of the most important causes of morbidity and mortality, to which new risk factors are increasingly being attributed. Of late, there is increased interest in the relationship between sleep disorders and strokes as regards risk and prognosis.
DevelopmentThis article presents the changes in sleep architecture and brain activity in stroke patients, as well as the interaction between stroke and sleep disorders, including those which may also influence the outcome and recovery from strokes. The different treatments discussed in the literature are also reviewed, as correct treatment of such sleep disorders may not only improve quality of life and reduce after-effects, but can also increase life expectancy.
ConclusionsSleep disorders are becoming increasingly associated with stroke. In addition to being a risk factor, they can also interfere in the outcome and recovery of stroke patients.
This article aims to present an exhaustive and current review on strokes and their relationship with sleep alterations and sleep disorders.
Los ictus, con una incidencia anual del 2 al 18/1.000 habitantes, constituyen la segunda causa de muerte en el mundo1, y es la primera de discapacidad en el adulto2. Además, los ictus tienen un riesgo de recurrencia del 13-14% durante el primer año, manteniéndose en un 6% anual3.
Por todo ello, es importante tanto el conocimiento y el control de los diferentes factores de riesgo que pueden favorecer la aparición de nuevos ictus, como su recurrencia. Los principales factores de riesgo de los ictus confirmados en la actualidad son: fibrilación auricular, una edad superior a los 65 años, hipertensión arterial, cardiopatías, estenosis carotídea asintomática, historia de accidente isquémico transitorio, abuso de alcohol, fumar, diabetes mellitus e hipercolesterolemia. Sin embargo, estos factores de riesgo sólo pueden explicar el 50% de los ictus. En los últimos años se han propuesto nuevos factores de riesgo, como son: los marcadores inflamatorios, infecciones, homocisteína y los trastornos respiratorios durante el sueño (TRDS).
En los últimos 15 años ha aumentado el interés sobre la relación de los trastornos del sueño y los ictus. Estudios recientes han demostrado que los trastornos de sueño (TS), tanto como los TRDS, el insomnio, las hipersomnias, las parasomnias, los trastornos del ritmo circadiano y los movimientos periódicos de las piernas pueden tener un papel importante en el pronóstico de las funciones neurológicas y psiquiátricas y, por lo tanto, en el pronóstico de los ictus.
De los TS los más estudiados han sido los TRDS debido a su asociación con las enfermedades cardiovasculares4–6 y cerebrovasculares7–10. Además, los TRDS aumentan el riesgo de incidencia, recurrencia y de mortalidad de los ictus11,12.
Este trabajo pretende hacer una revisión exhaustiva de las alteraciones de la arquitectura del sueño y de los diferentes TS descritos hasta la actualidad, como causa y/o consecuencia de un ictus, de su impacto en el pronóstico y de sus posibilidades terapéuticas.
Ictus y sus alteraciones en la arquitectura del sueñoLa arquitectura del sueño se define como la estructura de los diferentes estadios de sueño mientras el paciente duerme. Se dividen en: sueño NOREM (N1, N2, N3) y sueño REM, los cuales se van alternando en el transcurso de la noche en ciclos de 90 minutos13.
Las lesiones en el sistema nervioso central (SNC), ya sean focales o difusas, pueden desestructurar esta arquitectura.
En los pacientes con ictus es dificultosa tanto la interpretación de la actividad cerebral en el electroencefalograma (EEG), como de la lectura de las fases del sueño en la polisomnografía (PSG). Por este motivo, es importante conocer las posibles alteraciones en la señal que se pueden encontrar, para así evitar al máximo los errores en la interpretación y no confundir lentificaciones de la actividad cerebral o grafoelementos patológicos secundarios a las lesiones vasculares con actividad y/o grafoelementos fisiológicos del sueño y viceversa.
Es, por tanto, importante poder valorar correctamente estos cambios de actividad de forma correcta, ya que existen estudios que confirman que los cambios de la actividad cerebral y del sueño durante un ictus se han relacionado con el pronóstico evolutivo del paciente14–17.
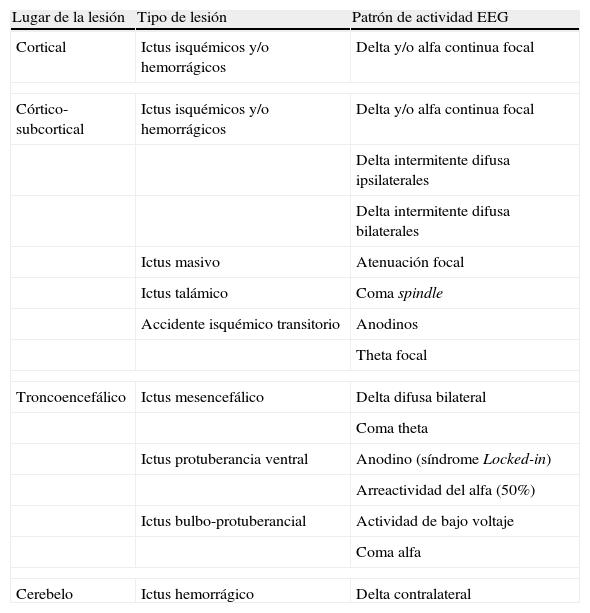
Alteraciones en la actividad cerebralLos ictus presentan diferentes patrones en el EEG en función de su localización. Los córtico-subcorticales presentan, habitualmente, una disfunción neuronal focal, con una actividad delta focal (1-4Hz), a veces acompañada de actividad más rápida alfa (tabla 1)18,19. Los subcorticales pueden mostrar disfunciones neuronales difusas con brotes intermitentes delta ipsi o bilaterales16. Por su parte, los infartos talámicos y troncoencefálicos pueden cursar con patrones de EEG patológicos (coma alfa, coma spindle, coma theta), mientras que los infartos pequeños o los localizados en la cápsula interna pueden cursar con EEG anodinos o con una sutil actividad theta focal16. Por otra parte, el infarto agudo masivo presenta un patrón de atenuación focal de la actividad cerebral sin actividad delta asociada20.
Lesiones vasculares agudas y su correlación electroencefalográfica
| Lugar de la lesión | Tipo de lesión | Patrón de actividad EEG |
| Cortical | Ictus isquémicos y/o hemorrágicos | Delta y/o alfa continua focal |
| Córtico-subcortical | Ictus isquémicos y/o hemorrágicos | Delta y/o alfa continua focal |
| Delta intermitente difusa ipsilaterales | ||
| Delta intermitente difusa bilaterales | ||
| Ictus masivo | Atenuación focal | |
| Ictus talámico | Coma spindle | |
| Accidente isquémico transitorio | Anodinos | |
| Theta focal | ||
| Troncoencefálico | Ictus mesencefálico | Delta difusa bilateral |
| Coma theta | ||
| Ictus protuberancia ventral | Anodino (síndrome Locked-in) | |
| Arreactividad del alfa (50%) | ||
| Ictus bulbo-protuberancial | Actividad de bajo voltaje | |
| Coma alfa | ||
| Cerebelo | Ictus hemorrágico | Delta contralateral |
No debemos olvidar que los ictus son procesos dinámicos, con mejorías o empeoramientos, pudiendo aparecer además complicaciones como: ictus recurrentes (34%), crisis epilépticas (1,8-15%), edema cerebral, hemorragias intracerebrales y efectos adversos de los tratamientos (10%). Durante estas complicaciones el EEG presenta cambios significativos en la actividad cerebral16. Estos cambios, tanto en morfología como en frecuencia de la señal EEG, se han correlacionado con cambios en el flujo cerebral y la extensión del daño cerebral14.
Las crisis epilépticas vasculares ocurren en un 70-80% en las primeras 24 horas tras el ictus. El estatus convulsivo se ha descrito en un 2-9% y el estatus no convulsivo se ha descrito hasta en un 27% de los pacientes con ictus16.
La preservación de la actividad cerebral de base y la ausencia de ondas delta, la presencia de ondas theta y beta o de brotes de ondas theta-delta intermitente después de sufrir un ictus son indicativos de buen pronóstico. En cambio, el aumento de la actividad delta, disminución de la actividad alfa o beta en el hemisferio afectado como la lentificación de la actividad cerebral se asocian con un peor pronóstico evolutivo14–17.
Alteraciones en la macroestructura y en la microestructura del sueñoLas lesiones tras un ictus pueden alterar la arquitectura de sueño (tabla 2).
Alteraciones de la macroestrucutura y microestructura del sueño según la localización del ictus
| Lugar de la lesión | Cambios en la macroestrucrura | Cambios en la microestructura |
| Supratentorial | ||
| Infratentorial | ||
| Paramedianos bilaterales del tegmento pontino | < | Pueden estar ausentes los complejos K, los husos de sueño y las puntas de vértex |
| Puente ventrotegmental | < | |
| Tegmento pontino (síndrome Locked-in) | No alteraciones | No alteraciones |
| Pontomesencefálico | < | |
| Núcleo del rafe | < | |
| Infarto tálamo paramediano | Ausencia SWS, REM preservado, SOREM | |
| Protuberancia baja | Ausencia SWS, REM preservado, SOREM o | |
| Tegmento mesencefálico | >REM | |
| Unión pontobulbar | >REM | |
| Mesencefálicos | >>NOREM y REM | |
NOREM: sueño no REM; SOREM: sueño REM al inicio del sueño; SWS: sueño lento profundo; TTS: tiempo total de sueño; >: mayor;<: menor.
Los ictus supratentoriales se han relacionado con reducción del sueño NOREM, del tiempo total de sueño y de la eficiencia de sueño21. La reducción de husos de sueño puede ser ipsilateral y/o bilateral después de un ictus unilateral22–25, aunque estos cambios no siempre se producen22,26–28. Los husos de sueño, los complejos K y las ondas lentas de sueño lento profundo están reducidos en el ictus talámico paramediano bilateral, con un aumento sostenido del estadio N1, demostrando así una incapacidad para estar completamente despierto29–31.
El sueño REM puede presentar una reducción transitoria del sueño en los primeros días después de un ictus supratentorial, aunque puede ser permanente tras un ictus hemisférico de mal pronóstico24,27,32,33. Las ondas de sierra típicas del REM pueden estar disminuidas tras un ictus hemisférico27.
Los ictus occipitales asociados a ceguera cortical se han relacionado con una reducción de sueño REM34.
Los cambios en la arquitectura del sueño después de un ictus no tienen valor localizador, aunque algunos trabajos sugieren que los ictus derechos disminuyen el REM y la densidad REM, mientras que los izquierdos reducen el estadio N32.
Los ictus infratentoriales se han relacionado con una reducción del sueño NOREM y especialmente del REM. Lesiones cercanas al tegmento pontino (síndorme locked-in) o lesiones unilaterales de esta región no producen alteraciones de la arquitectura del sueño35,36. Ocasionalmente, el sueño REM y NOREM pueden afectarse selectivamente. Los ictus de la unión pontomesencefálica y del núcleo del rafe pueden disminuir la cantidad de sueño NOREM pero preservando la cantidad de sueño REM37. El ictus talámico paramediano y de la protuberancia baja se han asociado con ausencia de sueño lento profundo con preservación del sueño REM y aparición de REM en el inicio del sueño, pero los ictus de la protuberancia baja pueden disminuir selectivamente el sueño REM35,36,38–41. Los ictus del tegmento mesencefálico y de la unión pontobulbar pueden dar aumento del sueño REM. Los infartos mesencefálicos pueden producir un aumento de sueño NOREM y REM42.
Se ha descrito que la ausencia de REM tras un ictus infratentorial puede persistir durante años, sin la manifestación de alteraciones cognitivas ni conductuales43.
Algunos trabajos encuentran que ictus infratentoriales también pueden alterar la microestrucura del sueño NOREM, donde los husos de sueño, los complejos K y las puntas de vértex del sueño pueden estar ausentes35,36,40.
Existen trabajos que observan que los pacientes con ictus y TRDS asociado muestran un aumento del porcentaje del tiempo total de sueño durante la vigilia de estadio N1 y del número de microdespertares, y una disminución de la eficiencia de sueño y el tratamiento con CPAP revierte estas alteraciones44,45.
De entre las alteraciones de las arquitectura de sueño que se han relacionado con un factor pronóstico desfavorable en pacientes con ictus destacan: la baja eficiencia de sueño, el aumento de la vigilia intrasueño, la disminución de la duración de estadio N2, la disminución de husos de sueño, complejos K y el aumento de sueño lento profundo22,23,27. También se ha descrito que el sueño fragmentado se ha relacionado con aumento del riesgo de ictus11.
El pronóstico funcional desfavorable de estos pacientes podría explicarse por el rol que tiene el sueño en la plasticidad neuronal, la síntesis de proteínas y su papel protector, reduciendo la actividad neurotóxica y la demanda metabólica46.
Ictus y su relación con los trastornos del sueñoEl ciclo vigilia-sueño y las diferentes fases de sueño están regulados por una compleja interacción de múltiples mecanismos situados en el troncoencéfalo, el hipotálamo, el área preóptica y el tálamo42, por lo que es lógico suponer que lesiones focales encefálicas pueden dar como consecuencia TS.
Un elevado porcentaje de pacientes (20-63%) que han sufrido un ictus presentan TS ya sea en forma de hipersomnia, insomnio, parasomnias trastornos del ritmo circadiano, movimientos periódicos de las piernas y/o alteraciones respiratorias durante el sueño47.
Algunos estudios han sugerido que la somnolencia diurna y un sueño prolongado pueden ser un factor de riesgo independiente para sufrir un ictus48,49. También se ha sugerido que la presencia de TS en pacientes con ictus se ha relacionado con un peor pronóstico evolutivo y aumento de la mortalidad47.
En los pacientes con ictus agudo no hay que olvidar que además de por las lesiones propias, los TS pueden producirse por factores externos durante el ingreso, como son: el ruido, la luz, la monitorización, la ansiedad, la depresión y/o las complicaciones de la enfermedad, tales como alteraciones cardíacas, infecciones, crisis epilépticas, fiebre y la propia medicación, que pueden alterar la calidad del sueño.
Ictus e hipersomniaLa hipersomnia se define como un aumento de la somnolencia diurna y/o un incremento de las necesidades diarias de sueño. La prevalencia de ésta, en pacientes con ictus, varía desde el 1,1 al 27%50,51.
La mayoría de las hipersomnias centrales secundarias a ictus son debidas a una disminución del umbral de activación por afectación del sistema reticular ascendente (SRA). Las lesiones que producen mayor clínica de hipersomnia son las talámicas bilaterales, las tálamo-mesencefálicas, protuberancia superior y las de la región pontomedular medial, es decir, en la zona donde se localizan las fibras del SRA. En las lesiones corticales y subcorticales, a excepción del tálamo, el sistema activador está menos afectado debido a que las proyecciones del SAR están más dispersas, a no ser que lesiones muy extensas puedan llegar a comprimir el tronco cerebral superior por edema. Durante el sueño los microdespertares cerebrales parecen estar más afectados en lesiones mediales, mientras que los microdespertares motores lo están en lesiones más laterales52. Áreas que ocasionalmente producen hipersomnia son: el estriado, el tegmento pontino, el bulbo raquídeo y los hemisferios cerebrales. Lesiones en los hemisferios cerebrales, únicamente cursan con hipersomnia si son de grandes dimensiones, más si se afecta el hemisferio izquierdo que el derecho y más en la región anterior que en la posterior22.
El caso de hipersomnia más severa secundaria a ictus se produce tras el infarto talámico paramedial. Los pacientes suelen presentar un estado de estupor brusco, pero con respuesta normal a estímulos, asociado a un déficit de atención y memoria. La hipersomnia puede ir mejorando en los 12 meses posteriores al infarto, aunque los déficits cognitivos pueden persistir31,53.
Se han descrito hipersomnias con registro de PSG de 24 horas de duración en pacientes con infartos del tálamo, hipotálamo, mesencéfalo y protuberancia31,41.
Los ictus también pueden reproducir entidades propias de las hipersomnias de origen central, como son: la narcolepsia con cataplejía y el síndrome de Kleine-Levien. La narcolepsia se ha descrito en lesiones de hipoxia cerebral y en infartos diencefálicos bilaterales54,55. El síndrome de Kleine-Levin (hipersomnia con hiperfagia) se ha descrito en pacientes con infartos cerebrales múltiples56.
Debido a la alta relación de los ictus con los TRDS no hay que olvidar que la hipersomnia podría ser secundaria al problema respiratorio, y no por la propia lesión del SNC51,57–59, si bien los paciente con ictus y TRDS manifiestan hipersomnia en un grado menor que aquellos pacientes que únicamente presentan TRDS60.
Es importante diferenciar bien la hipersomnia del simple aumento de la demanda de sueño, la somnolencia por encefalopatía (grado de alerta) o de la fatiga. La fatiga es la sensación física de cansancio, carencia de energía, con gran sensación de sueño, pero con una cantidad de un sueño normal o incluso disminuido. Un estudio encuentra que la fatiga está presente en un 46% de los pacientes con ictus, y aunque la hipersomnia puede mejorar con el transcurso de los primeros meses, la fatiga persiste en la fase crónica61. Es muy difícil relacionar la fatiga con el ictus, ya que se puede superponer con la clínica de los trastornos del ánimo, secuelas neurológicas, secuelas neuropsicológicas, secundarios al ictus e incluso a los propios TS.
El tratamiento de las hipersomnias postictus es frecuentemente inefectivo. Algunos pacientes con infartos talámicos han mejorado con anfetaminas, modafinil, metilfenidato y levodopa, mientras que otros con ictus mesencefálicos han mejorado con modafinil62. Dos autores han objetivado una progresión favorable en la rehabilitación aguda del ictus y del estado de alerta con la aplicación de metilfenidato o levodopa durante 3 semanas63,64.
Pacientes con síntomas de depresión asociada han mejorado con antidepresivos estimulantes.
Ictus e insomnioEl insomnio se define como la dificultad de iniciar y/o mantener el sueño y/o despertar precoz asociado al día siguiente con consecuencias físicas y psíquicas, como fatiga, alteración de la concentración e irritabilidad.
El insomnio es una queja frecuente en los pacientes con ictus, que afecta del 20 al 56% de los pacientes50,65,66. Un estudio de Leppavuori et al50 objetiva que el 56% de los pacientes con ictus se quejan de insomnio y de ellos el 37% cumplen los criterios de insomnio definidos en el DSM-IV. También observa que el 38,6% ya presentaba insomnio antes del ictus y en un 18,1% es una nueva manifestación después del ictus.
Existen evidencias suficientes para confirmar que el insomnio en un 50% de los pacientes con ictus es consecuencia de los TRDS, tanto de características obstructivas como centrales y de la hipoventilación10,59,67–69.
Los ictus que cursan con insomnio son los talámicos y troncoencefálicos (tálamo-mesencefálicos, pontomesencefálico y del tegmento pontino largo), provocando una inversión del ciclo vigilia-sueño con insomnio, agitación nocturna e hipersomnia diurna47.
En la fase aguda de los ictus puede ocurrir insomnio de forma muy frecuente ya sea por los factores externos del ingreso como por las complicaciones de la propia enfermedad, la monitorización y la administración de medicación.
El tratamiento del insomnio en pacientes con ictus debería consistir desde un inicio en la aplicación de medidas higiénicas sencillas, tales como aislar al paciente del ruido y la luz durante la noche y/o aumentar la exposición solar durante el día, que proporcionaría un ambiente propicio para regular el ritmo vigilia-sueño.
En cuanto al tratamiento farmacológico podría utilizarse benzodiacepinas, zolpidem o antidepresivos sedativos, si bien los efectos secundarios de sedación y alteración neurocognitiva podrían incrementar los síntomas neurológicos70.
Ictus y parasomniasLas parasomnias se definen principalmente como una actividad motora o sensorial que ocurre durante el sueño, tanto en la fase REM como NOREM.
Se han descrito casos de ictus en el tegmento pontino que se han asociado a trastornos de la conducta en sueño REM (TCSR)71,72.
Lesiones en el tegmento pontino, mesencéfalo o tálamo paramediano pueden desencadenar alucinaciones visuales, sobre todo al anochecer o al inicio del sueño47.
Los ictus en el tálamo, en el lóbulo temporal, parietal y occipital pueden aumentar los sueños, pesadillas y/o el síndrome de confusión sueño-realidad73.
El tratamiento del TCSR se puede realizar con clonazepam (0,5-2mg) una hora antes de ir a dormir47.
Ictus y trastornos de movimientos periódicos de las piernas durante el sueñoLos movimientos periódicos de las piernas durante el sueño (MPP) pueden aumentar o disminuir después de un ictus unilateral y pueden persistir después de un ictus de la medula espinal74,75.
Lee et al76 describen la presencia del síndrome de piernas inquietas (SPI) de novo en un 12% de los pacientes que han sufrido un ictus. El SPI se ha descrito principalmente en lesiones de la protuberancia, tálamo, ganglios de la base y la corona radiata. Dos tercios de los pacientes con SPI tras un ictus refieren síntomas de forma bilateral, mientras que un tercio de ellos refieren síntomas en el lado contralateral al ictus.
El SPI y MPP asociado a ictus se puede tratar con agonistas dopaminérgicos. Es importante recordar que el tratamiento con antidepresivos, neurolépticos, metoclopramida y litio pueden agravar dichas entidades47.
Ictus y ritmo circadianoLos ritmos circadianos o biológicos son oscilaciones de las variables biológicas en intervalos regulares de tiempo. Los trastornos del ritmo circadiano del sueño se caracterizan por una incapacidad para dormir, debida al desajuste entre el marcapasos cerebral que controla el ritmo circadiano del sueño de la persona y el horario de sueño-vigilia deseado o necesario, normal en el medio en que se desenvuelve la persona.
Durante el sueño, el sueño NOREM y el sueño REM se van repitiendo cíclicamente durante la noche. En el sueño NOREM, la actividad simpática disminuye, mientras que la actividad parasimpática tiende a predominar, con lo que se produce una reducción de la frecuencia cardíaca, de la presión arterial y del gasto cardíaco, así como la frecuencia respiratoria. La caída de la presión arterial nocturna es un fenómeno normal que cuando se ve alterado se ha asociado con un mayor riesgo de ictus77. El sueño REM se caracteriza por la variabilidad en la actividad de los sistemas, tanto parasimpático como simpático, con oscilaciones fásicas y picos que tienen como resultado un incremento neto del tono parasimpático y una menor influencia simpática. Durante el sueño REM la frecuencia cardíaca y la presión arterial son variables, mientras que aumentan los flujos sanguíneos corticales y espinales.
Los niveles de catecolaminas en plasma aumentan desde las 6 a.m. hasta la tarde. Durante el mismo período la frecuencia cardíaca y la presión arterial aumentan. La actividad fibrinolítica disminuye por la mañana78, mientras que aumenta la agregabilidad plaquetaria79. Estos fenómenos han sido vinculados a la mayor morbilidad vascular durante las horas de la mañana.
Los ictus, los infartos de miocardio y la muerte súbita suelen aparecer en la mayoría de los casos durante la mañana (entre las 6 a.m. y las 12 p.m.), particularmente en la primera hora después de despertar y sin existir diferencias en el ritmo circadiano entre el primer episodio y las recurrencias.
Las variaciones circadianas de los ictus, presentan una curva con un doble pico durante el día (6 a.m.-12 p.m. y 6 p.m-7 p.m.), pero con un gran predominio del primer pico80–82. Los diferentes porcentajes de los subtipos de ictus al despertar comparados con el resto del día son: 66% isquémicos y 34% hemorrágicos83.
La mayor parte de los ictus isquémicos ocurren al despertar y suelen ser de tipo embólico, pero entre el 20 y el 40% de los ictus isquémicos ocurren durante la noche, sobre todo al inicio del sueño y con un predominio del tipo aterotrombótico y lacunar82–86.
Los ictus hemorrágicos raramente ocurren durante la noche (10%) y sobre todo se producen por la mañana85,86.
De ello se deduce que el sueño puede tener un efecto protector frente a los ictus y que el despertar puede tener un efecto activador, pero a la vez el sueño promueve los infartos isquémicos y protege de los hemorrágicos. Una explicación podría ser porque la presión arterial durante el sueño tiende a disminuir un 10-20% y al despertar sube de forma brusca, además de acompañarse de una mayor actividad simpática. Las bajas presiones durante la noche podrían explicar el origen de los ictus isquémicos87, mientras que los aumentos de las presiones al despertar podrían explicar el origen de los ictus hemorrágicos y su baja frecuencia durante el sueño80.
Otro estudio relaciona estos infartos nocturnos con alteraciones respiratorias durante el sueño88. Los pacientes con obesidad y/o con TRDS podrían promover la aparición de ictus durante el sueño al anular el efecto protector del sueño1, por lo que se concluye que el sueño podría estar implicado en la etiopatogenia de un subgrupo importante de los ictus.
La causa del segundo pico de la tarde no está aclarada y es raramente comentada. Hay estudios que lo han relacionado con la hora de la siesta como desencadenante80, aunque existen otros estudios con resultados más pobres, probablemente debidos a las diferencias culturales y sociales entre los países89,90.
Los ictus no sólo se han relacionado con cambios del ritmo circadiano, sino que también pueden alterar el ritmo circadiano, como por ejemplo infartos que alteran la secreción de hormona de crecimiento y melatonina e infartos de la ínsula en el hemisferio derecho. Estos últimos pueden alterar las variaciones circadianas autonómicas y contribuir a un aumento de la morbimortalidad postinfarto42.
Un estudio sugiere que en la fase aguda del ictus los pacientes que presenten una alteración del ritmo circadiano se asocian a un peor pronóstico evolutivo91. Otros estudios sugieren que las alteraciones circadianas de la presión arterial predicen la severidad y el pronóstico del ictus y no están asociadas a la severidad de los TRDS83,92.
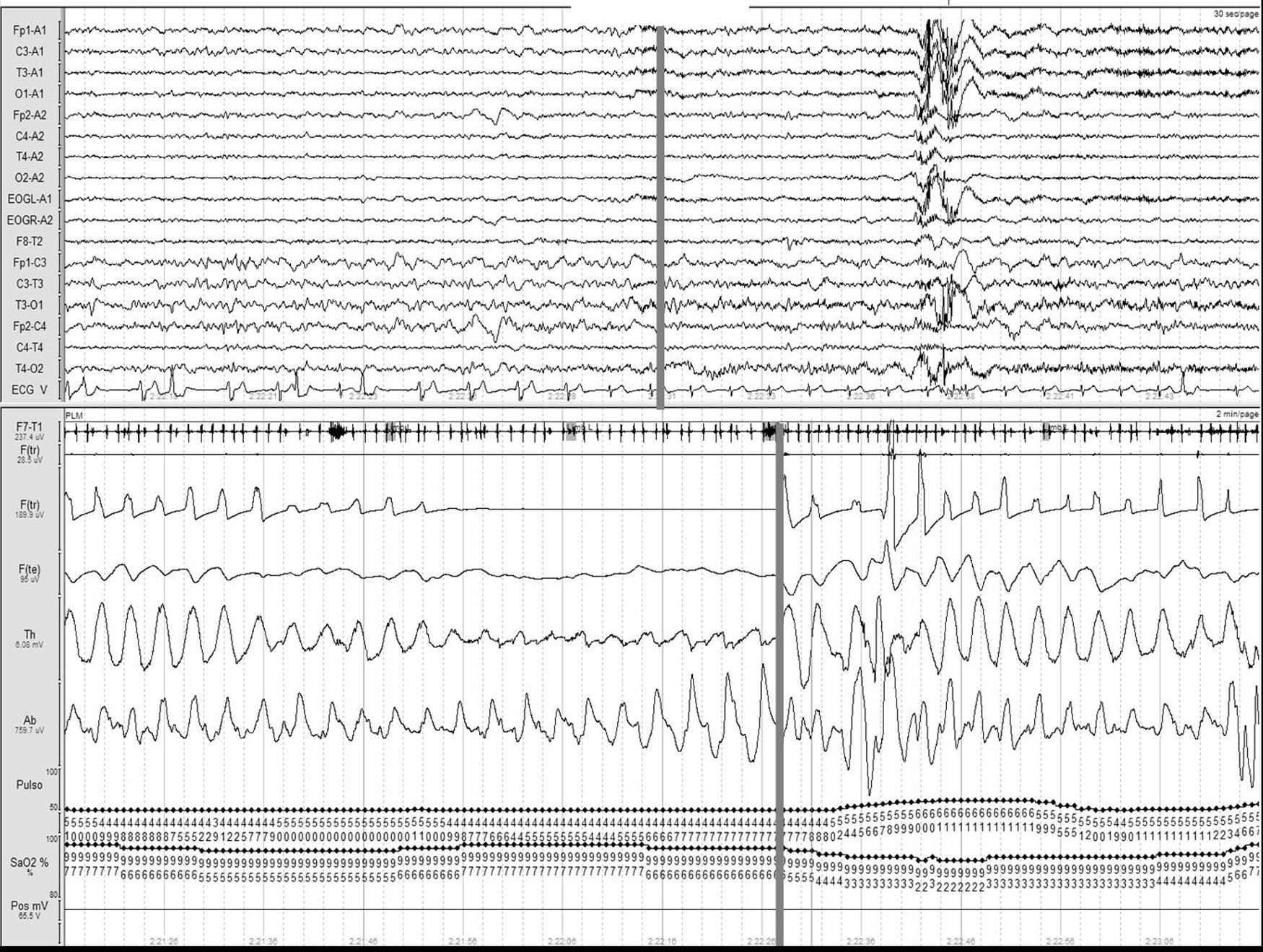
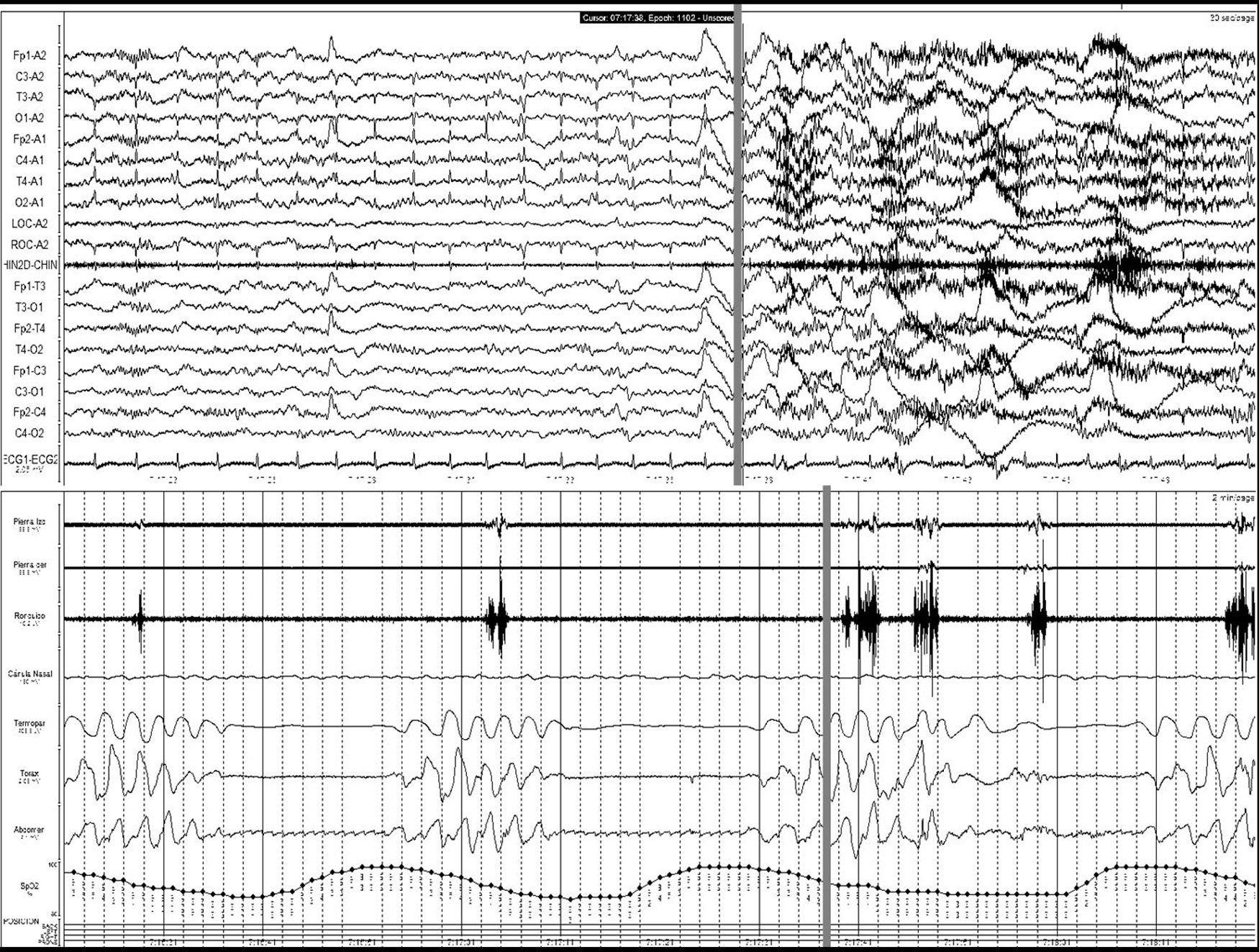
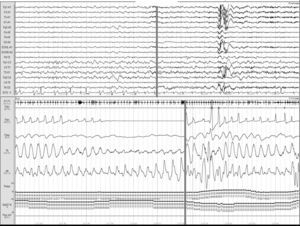
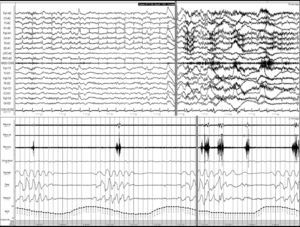
Ictus y los trastornos respiratorios durante el sueñoLos TRDS engloban en la actualidad el síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) (fig. 1), el síndrome de apnea-hipopnea central del sueño (SAHCS) (fig. 2) y el síndrome de hipoventilación-hipoxemia durante el sueño (SHS). Los TRDS han demostrado ser un factor de riesgo de enfermedades cardiovasculares5,6,9,10,93–98, a la vez que aumentan la morbimortalidad del paciente8,59,68,99–102.
Apnea obstructiva. Registro polisomnográfico realizado dentro de las primeras 24 horas de un paciente que ingresa con una hemorragia intracerebral en los ganglios basales, en el que se objetivan frecuentes apneas obstructivas. La línea gris relaciona el evento respiratorio con el inicio de un microdespertar en la señal de EEG.
Apnea central. Registro polisomnográfico realizado dentro de las primeras 24 horas de un paciente que ingresa con una hemorragia en los ganglios basales, en el que se objetivan frecuentes apneas centrales. La línea gris relaciona el evento respiratorio con el inicio de un microdespertar en la señal de EEG. (La señal de ronquido presenta artefacto de difusión del movimiento de las pienas).
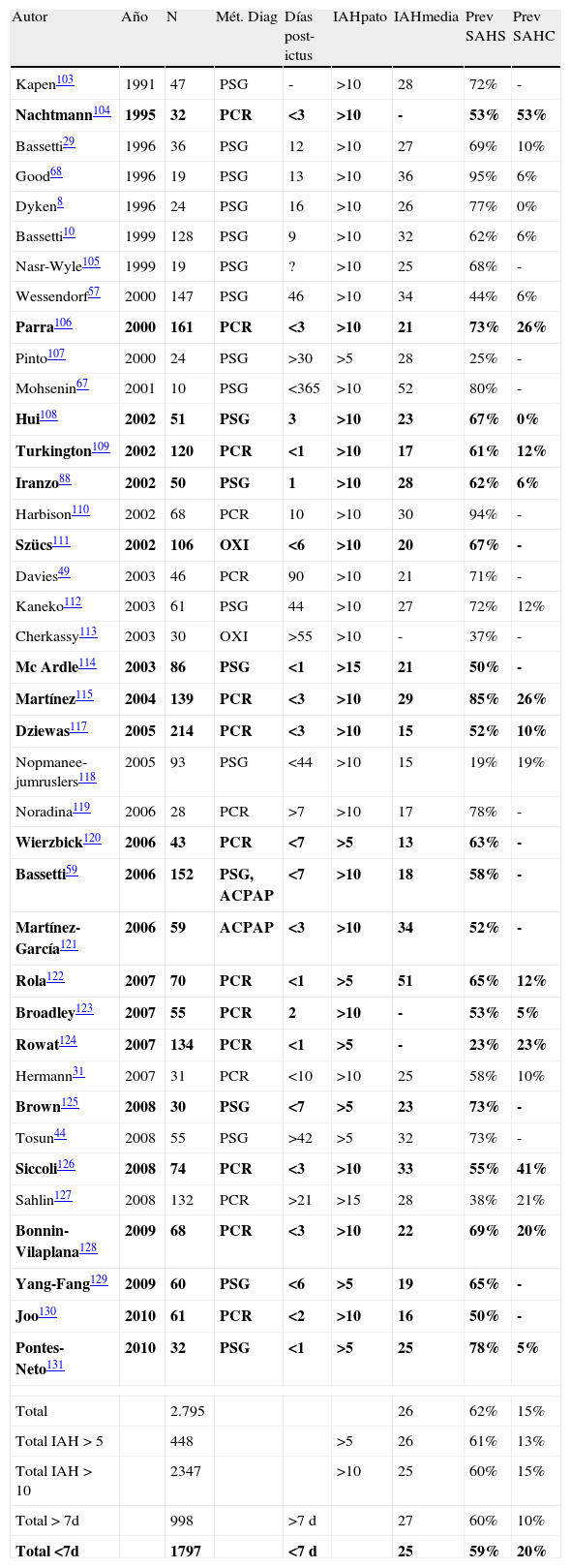
Los trabajos realizados hasta la actualidad han demostrado una prevalencia del 62% de los TRDS en los pacientes que han sufrido un ictus (tabla 3)8,10,29,31,44,49,57,59,67,68,88,103–131, sugiriendo una estrecha relación de los TRDS como factor precipitante de los AVC. Aunque no hay que olvidar que los ictus también pueden ser la causa de los TRDS95,124,132,133.
Estudios publicados hasta la actualidad sobre los ictus y su relación con los trastornos respiratorios del sueño
| Autor | Año | N | Mét. Diag | Días post-ictus | IAHpato | IAHmedia | Prev SAHS | Prev SAHC |
| Kapen103 | 1991 | 47 | PSG | - | >10 | 28 | 72% | - |
| Nachtmann104 | 1995 | 32 | PCR | <3 | >10 | - | 53% | 53% |
| Bassetti29 | 1996 | 36 | PSG | 12 | >10 | 27 | 69% | 10% |
| Good68 | 1996 | 19 | PSG | 13 | >10 | 36 | 95% | 6% |
| Dyken8 | 1996 | 24 | PSG | 16 | >10 | 26 | 77% | 0% |
| Bassetti10 | 1999 | 128 | PSG | 9 | >10 | 32 | 62% | 6% |
| Nasr-Wyle105 | 1999 | 19 | PSG | ? | >10 | 25 | 68% | - |
| Wessendorf57 | 2000 | 147 | PSG | 46 | >10 | 34 | 44% | 6% |
| Parra106 | 2000 | 161 | PCR | <3 | >10 | 21 | 73% | 26% |
| Pinto107 | 2000 | 24 | PSG | >30 | >5 | 28 | 25% | - |
| Mohsenin67 | 2001 | 10 | PSG | <365 | >10 | 52 | 80% | - |
| Hui108 | 2002 | 51 | PSG | 3 | >10 | 23 | 67% | 0% |
| Turkington109 | 2002 | 120 | PCR | <1 | >10 | 17 | 61% | 12% |
| Iranzo88 | 2002 | 50 | PSG | 1 | >10 | 28 | 62% | 6% |
| Harbison110 | 2002 | 68 | PCR | 10 | >10 | 30 | 94% | - |
| Szücs111 | 2002 | 106 | OXI | <6 | >10 | 20 | 67% | - |
| Davies49 | 2003 | 46 | PCR | 90 | >10 | 21 | 71% | - |
| Kaneko112 | 2003 | 61 | PSG | 44 | >10 | 27 | 72% | 12% |
| Cherkassy113 | 2003 | 30 | OXI | >55 | >10 | - | 37% | - |
| Mc Ardle114 | 2003 | 86 | PSG | <1 | >15 | 21 | 50% | - |
| Martínez115 | 2004 | 139 | PCR | <3 | >10 | 29 | 85% | 26% |
| Dziewas117 | 2005 | 214 | PCR | <3 | >10 | 15 | 52% | 10% |
| Nopmanee-jumruslers118 | 2005 | 93 | PSG | <44 | >10 | 15 | 19% | 19% |
| Noradina119 | 2006 | 28 | PCR | >7 | >10 | 17 | 78% | - |
| Wierzbick120 | 2006 | 43 | PCR | <7 | >5 | 13 | 63% | - |
| Bassetti59 | 2006 | 152 | PSG, ACPAP | <7 | >10 | 18 | 58% | - |
| Martínez-García121 | 2006 | 59 | ACPAP | <3 | >10 | 34 | 52% | - |
| Rola122 | 2007 | 70 | PCR | <1 | >5 | 51 | 65% | 12% |
| Broadley123 | 2007 | 55 | PCR | 2 | >10 | - | 53% | 5% |
| Rowat124 | 2007 | 134 | PCR | <1 | >5 | - | 23% | 23% |
| Hermann31 | 2007 | 31 | PCR | <10 | >10 | 25 | 58% | 10% |
| Brown125 | 2008 | 30 | PSG | <7 | >5 | 23 | 73% | - |
| Tosun44 | 2008 | 55 | PSG | >42 | >5 | 32 | 73% | - |
| Siccoli126 | 2008 | 74 | PCR | <3 | >10 | 33 | 55% | 41% |
| Sahlin127 | 2008 | 132 | PCR | >21 | >15 | 28 | 38% | 21% |
| Bonnin-Vilaplana128 | 2009 | 68 | PCR | <3 | >10 | 22 | 69% | 20% |
| Yang-Fang129 | 2009 | 60 | PSG | <6 | >5 | 19 | 65% | - |
| Joo130 | 2010 | 61 | PCR | <2 | >10 | 16 | 50% | - |
| Pontes-Neto131 | 2010 | 32 | PSG | <1 | >5 | 25 | 78% | 5% |
| Total | 2.795 | 26 | 62% | 15% | ||||
| Total IAH > 5 | 448 | >5 | 26 | 61% | 13% | |||
| Total IAH > 10 | 2347 | >10 | 25 | 60% | 15% | |||
| Total > 7d | 998 | >7 d | 27 | 60% | 10% | |||
| Total <7d | 1797 | <7 d | 25 | 59% | 20% | |||
ACPAP: AutoCPAP; IAH: índice de apneas-hipopnea; media: media del IAH de los pacientes; Métod Diag: método diagnóstico; N: número de casos; OXI: oximetría; Pato: punto de corte como valor de patológico; PCR: poligrafía cardiorrespiratoria; Prev: prevalencia SAHS (síndrome de apnea-hipopnea del sueño —obstructivo y central—); PSG: polisomnografía nocturna; SAHC: síndrome de apnea-hipopnea central del sueño; Total<7d: resultado de la media de todos los artículos con pacientes con ictus agudo realizado el estudio dentro de los primeros 7 días (marcados en negrita); Total >7d: resultado de la media de todos los artículos en pacientes con ictus con más estudios depspués de los 7 días de evolución del ictus; Total IAH > 10: resultado de las medias con un IAH superior a 10; Total IAH > 5: resultados de las medias con un IAH superior a 5; Total: resultado de la media de todos los artículos revisados.
Esta tabla muestra que la media de todos los registros de pacientes con ACV presentan en un 62% un síndrome de apnea hipopnea del sueño con predominio del carácter obstructivo, con un IAH medio de 26. No se encuentran diferencias en los resultados tanto con un punto del corte del IAH >5 como de un IAH>10. Si cogemos los registros que sólo admiten pacientes durante la primera semana del ACV vemos que el porcentaje y el IAH total casi se mantiene, pero presentan un mayor porcentaje de eventos respiratorios centrales.
El ronquido, la somnolencia diurna y las TRDS se han descrito que son un factor independiente para el desarrollo de ictus y están, a su vez, asociados a un incremento en la morbimortalidad en estos pacientes127,134,135.
Los estudios realizados hasta la actualidad confirman una relación directa entre el SAHOS, la somnolencia diurna136,137 y el índice de masa corporal (IMC) en la población general138,139. Pero estudios recientes en pacientes con ictus han constatado una ausencia de relación entre la somnolencia diurna y el IMC con la severidad del SAHOS51,57–59. Sólo un estudio encuentra en pacientes con ictus una relación con la somnolencia diurna y el riesgo de ictus (OR=3,1; IC 95%=1,6-6,1)49. Esto hace que los factores predictores de la enfermedad en la población general no sean tan útiles para detectar SAHOS en pacientes con ictus.
El ronquido, en diferentes estudios de casos y controles7,69,140–143, y uno prospectivo en mujeres144, ha demostrado ser un factor de riesgo para sufrir un ictus, pero también existen trabajos con resultados contradictorios49,145,146. La alta prevalencia del ronquido en la comunidad implicaría una asociación independiente, aunque débil, como factor de riesgo de ictus147.
Todos estos estudios presentan la limitación de que es difícil diferenciar si estas asociaciones son debidas propiamente al ronquido o a su asociación con el SAHOS, aunque la relación entre ronquido e ictus se hace particularmente fuerte cuando asociamos síntomas sugestivos de SAHOS (apneas objetivadas, hipersomnia y obesidad)7,143,146.
Numerosos estudios han sugerido el SAHOS como factor de riesgo independiente de ictus7,98,127,148–150. Cuatro estudios prospectivos60,97,116,151 y un estudio epidemiológico96 objetivan una incidencia mayor de ictus para un IAH patológico (tabla 4). Aunque estos estudios no permiten concluir que el SAHOS es factor de riesgo independiente de ictus, sí que lo sugieren fuertemente.
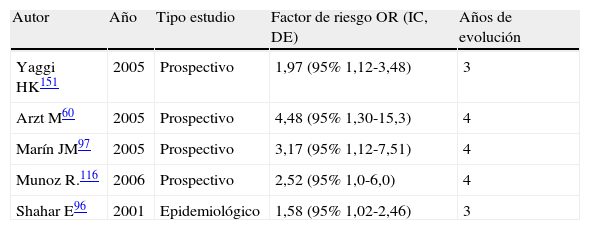
Factor de riesgo de ictus en pacientes que padecen de síndrome de apnea-hipopnea del sueño
| Autor | Año | Tipo estudio | Factor de riesgo OR (IC, DE) | Años de evolución |
| Yaggi HK151 | 2005 | Prospectivo | 1,97 (95% 1,12-3,48) | 3 |
| Arzt M60 | 2005 | Prospectivo | 4,48 (95% 1,30-15,3) | 4 |
| Marín JM97 | 2005 | Prospectivo | 3,17 (95% 1,12-7,51) | 4 |
| Munoz R.116 | 2006 | Prospectivo | 2,52 (95% 1,0-6,0) | 4 |
| Shahar E96 | 2001 | Epidemiológico | 1,58 (95% 1,02-2,46) | 3 |
DE: desviación estándar; IC: Intervalo de confianza; OR: Odds ratio.
Un trabajo reciente del The Sleep Heart Health Study152 objetivan en un estudio prostectivo de 8 años, una relación directa de la severidad del SAHOS con el riesgo de ictus. Encuentran que los hombres con un SAHOS moderado-severo tienen 3 veces más riesgo de tener un ictus y que el riesgo de ictus aumenta un 6% con cada unidad de aumento del IAH de 5 a 25. En las mujeres no se observa aumento de riesgo de ictus hasta que no se alcanza un umbral de IAH de 25.
Existen estudios que correlacionan la severidad del SAHOS con un aumento de la prevalencia de infartos lacunares10,150, aunque otro estudio de McArdle et al114 no encuentra dicha asociación.
El mecanismo por el cual se propone que el SAHOS es un factor de riesgo de ictus es incierto y seguramente multifactorial. Se han propuesto 3 premisas: a) el aumento de la presión intratorácica generada durante la apnea disminuye el flujo cerebral, lo cual de forma recurrente podría precipitar cambios isquémicos, sobre todo en los territorios frontera153–155; b) el SAHOS puede facilitar el riesgo de ictus porque existe una prevalencia en estos pacientes de tensión arterial elevada5, cardiopatía, foramen oval permeable156, alteración de la función endotelial, aterogénesis, cambios protrombóticos, estados proinflamatorios y aumento de la agregación plaquetaria42,157–159; y c) el SAHOS como causa desencadenante del ictus88.
El Instituto Nacional de Salud (NIH)160 en el último protocolo para la prevención de factores de riesgo de los ictus incluye al SAHOS como un factor de riesgo menos estudiado, aunque reconoce su prevalencia y su relación con la hipertensión como factor independiente de ictus y aconseja identificar aquellos pacientes con alta probabilidad de SAHOS para así aplicar un tratamiento correcto y, de esta forma, reducir el riesgo de un primer ictus.
Alteraciones respiratorias y trastornos respiratorios del sueño en la fase aguda del ictusDurante la fase aguda del ictus, es frecuente encontrar patrones respiratorios anómalos, ya sea por la localización de la propia lesión161 como por los TRDS previos al ictus133. Estos patrones respiratorios son más frecuentes en pacientes con alteración de la conciencia, déficit severos, durante el sueño y en pacientes con infartos medulares161. Lesiones ictales, tanto a nivel hemisférico como tronculares, que afectasen a los músculos respiratorios, tanto de la vía respiratoria alta, como intercostales y diafragma, pueden dar alteraciones respiratorias. Ictus del lóbulo frontal, ganglios de la base, o cápsula interna pueden provocar la respiración apráxica. Los ictus del tronco cerebral pueden producir diferentes patrones respiratorios como son: la hiperventilación neurogénica (mesencéfalo o protuberancia), respiración apnéustica (región posterior inferomedial de la protuberancia), respiración atáxica o de Biot, síndrome apnea central y síndrome Ondine (bulbo) y la aventilación (bulbo o medula superior). Ictus medulares a nivel de C1 pueden dañar tanto la respiración voluntaria (lesión posterior) como la automática (lesión anterior)42,133. Muchos de estos patrones respiratorios no tienen significado pronóstico, a excepción de la taquipnea con bajo CO2 que está asociado a mal pronóstico.
No hay que olvidar que durante la fase aguda del ictus hay que intubar a los pacientes cuando no se puede garantizar la permeabilidad de la vía aérea, exista edema de pulmón o la presencia de estatus162. La intubación suele ser más frecuente el ictus hemorrágico que en el isquémico y se ha relacionado con un aumento de la morbimortalidad de los pacientes163.
Estos patrones respiratorios descritos en la fase aguda del ictus son muy poco frecuentes en los trabajos realizados hasta la actualidad. Esto se explicaría, porque dichos estudios se han realizado en pacientes que suelen tener un cierto grado de alerta y no están inestables hemodinámicamente. Además, en los pacientes con lesiones importantes en el sistema nervioso central, sería imposible poder valorar el sueño, debido a que la actividad cerebral que observaríamos en el cerebro sería el de una encefalopatía, que no permitiría diferenciar la vigilia del sueño, ni diferenciar los distintos estadios, lo que a su vez, dificulta valorar las alteraciones respiratorias durante el sueño.
Estudios realizados durante la fase aguda de un episodio de ictus confirman que los pacientes presentan frecuentemente alteraciones respiratorias, con una prevalencia media del 59% (tabla 3, fig. 1), siendo el SAHOS el trastorno respiratorio predominante y con persistencia de dicha proporción durante la fase subaguda.
El SAHCS tiene una prevalencia del 20% en la fase aguda del ictus, sin embargo, esta proporción disminuye al 10% en la fase subaguda posictus (10%) (fig. 2 y tabla 3). La presentación del SAHCS es principalmente durante el sueño NOREM y suele desaparecer en la fase REM. Sólo en una minoría de los pacientes se presenta durante la vigilia104. Tradicionalmente se ha descrito que la respiración de Cheyne-Stokes se asocia a infartos tanto en lesiones bihemisféricas, como en lesiones hemisféricas unilaterales y de tronco cerebral124,132, insuficiencia cardíaca y alteración grave del nivel de conciencia, pero estas premisas no son siempre necesarias133. Parra et al106 concluyen que las alteraciones respiratorias centrales son infrecuentes en los accidentes isquémicos transitorios (AIT) y son más frecuentes en los infartos cerebrales, sobre todo de tipo hemorrágico.
Bonnin-Vilaplana et al128 encuentran que el 69% de los pacientes con AIT presentan alteraciones respiratorias (49% obstructivas y 20% centrales) con una OR 3,17 (IC 95%: 1,02-9,79). Harbison et al110 encuentran que los AIT tienen un índice de apnea-hipopnea superior al resto de infartos y que la severidad del SAHOS no se correlaciona con una mayor mortalidad a los 3 meses.
La alta prevalencia y la persistencia de las alteraciones respiratorias después del ictus, hacen suponer que el SAHOS es un factor desencadenante del ictus isquémico10,88,106,133.
En la mayoría de los trabajos realizados se han excluido los ictus hemorrágicos. Sólo hay tres estudios que incluyen los ictus hemorrágicos, sin encontrar diferencias significativas en la prevalencia de las alteraciones respiratorias si la comparamos con prevalencia la de los ictus isquémicos8,106,112. Sin embargo, Szucs et al111 encuentran que los TRDS en los ictus hemorrágicos en la fase subaguda mejoran más que en los isquémicos. Ponets-Neto et al131 encuentran que la severidad del SAHOS en los ictus hemorrágicos tiene una relación directa con el edema perihematoma.
Existen diferentes explicaciones neuronales, hemodinámicas e inflamatorias que justifican que los TRDS pueden desencadenar un ictus. Durante los eventos respiratorios se reduce la tensión arterial, la frecuencia cardíaca, el flujo cerebral o la oxigenación y al finalizar aumentan de forma brusca42,164–166. Todo ello conduce a una reducción de la velocidad de flujo cerebral de un 10-20% durante los eventos respiratorios167. Estos episodios repetidos podrían aumentar el daño de la zona de penumbra isquémica o favorecer la hemorragia.
El SAHOS también se ha relacionado con factores protrombóticos y proinflamatorios; una alteración de la función de la óxido nítrico sintetasa, alteración de las vías de la endotelina, incremento del factor VII protrombótico, aumento de la agregación plaquetaria, aumento de los niveles de leptina, aumento de la intolerancia a la glucosa, aumento de los niveles de fibrinógeno, proteína C-reactiva, citocinas y moléculas de adhesión y aumento del estrés oxidativo122,153,168–176.
Durante apneas prolongadas la embolización paradójica en pacientes con foramen oval es otro posible mecanismo de ictus177.
Los ictus podrían contribuir al aumento de los TRDS tras el mismo, debido a una mayor colapsabilidad de la vía aérea superior secundaria a una debilidad faríngea presente en un 30-50% de los ictus agudos109,121, y que se relaciona con una mejoría lineal de los TRDS tras una mejoría de la función deglutoria121.
A pesar de todos los estudios realizados hasta la actualidad no se ha podido relacionar la frecuencia, el tipo de TRDS, la gravedad de los TRDS ni la topografía de los ictus. Sólo un trabajo de Bonnin-Vilaplana et al128 encuentra que los AIT localizados en la cápsula interna y en la protuberancia en pacientes fumadores se asocia de forma significativa con los TRDS.
Trastornos respiratorios del sueño como factor pronóstico del ictusDiversos estudios sugieren que los TRDS alteran el pronóstico del ictus. El ronquido tiene un efecto adverso en la evolución del los pacientes con ictus142,178. Las apneas detectadas en la primera noche del infarto están asociadas con un empeoramiento neurológico precoz59,68,88,102,106,112,129, una recuperación más prolongada112, con una morbimortalidad elevada a largo plazo8,100,109,122 y con mayor riesgo de recurrencia de ictus117,179. Parra et al106 encuentran que el SAHOS, en pacientes con ictus, es un factor pronóstico de mortalidad independiente y que la mortalidad aumenta proporcionalmente al índice de apnea-hipopnea. Sin embargo, otro estudio tras 10 años de seguimiento, sugiere que el SAHOS no aumenta el riesgo de mortalidad en pacientes con ictus127.
Entre el 12 y el 43% de los pacientes con ictus empeoraron y el 87% lo hizo dentro de las primeras 48 horas106. Entre las principales causas se encuentra la hipotensión, las arritmias y la hipoxemia. Todavía no se ha demostrado, pero podrían formar parte de ellas los TRDS.
Como ya se ha mencionado con anterioridad, los pacientes posictus en la fase subaguda y crónica presentan una prevalencia de SAHOS del 60% (tabla 3), por lo que el potencial de rehabilitación óptima podría quedar entorpecido por la menor motivación y menor capacidad cognitiva. Además, la supervivencia podría verse comprometida por un mayor riesgo de ictus y muerte8,106.
Respuesta del tratamiento de los trastornos respiratorios durante el sueño en el pronóstico del ictusActualmente se están realizando esfuerzos para realizar una detección precoz de estos factores de riesgo y por tanto la aplicación terapéutica efectiva. Además no hay que olvidar que los supervivientes de un ictus tienen un mayor riesgo de sufrir una recurrencia, lo que aumenta la morbimortalidad de estos pacientes.
El SAHOS se ha sugerido como un factor de riesgo independiente de ictus modificable, con un mayor riesgo de muertes y de recurrencias113,180. El tratamiento del SAHOS con CPAP ha demostrado ser el más coste-efectivo181.
Actualmente, no existen trabajos aleatorizados que demuestren que el tratamiento del SAHOS con CPAP disminuye la incidencia de ictus y los estudios prospectivos que existen proporcionan una información incompleta y contradictoria100,182. Lo que sí que se ha demostrado es que el tratamiento del SAHOS disminuye la tensión arterial183, la cual es un factor de riesgo de ictus, por lo que es razonable pensar que el tratamiento del SAHOS también podría reducir el riesgo de ictus. Wessendorf et al45,184 demuestran que en los pacientes con ictus y SAHOS que tienen un tratamiento antihipertensivo correcto y CPAP se asocia a una disminución de la presión arterial nocturna. También describen que el tratamiento con CPAP en pacientes con ictus disminuye el fibrinógeno plasmático176. Otros autores observan que pacientes con SAHOS en tratamiento con CPAP mejora el flujo cerebral169 y se asocia a una menor recurrencia de fibrilación auricular146.
En los pacientes que han sufrido un ictus y presentan un SAHOS asociado el tratamiento con CPAP ha demostrado una disminución de la mortalidad a corto59 y a largo plazo185. Sin embargo, el cumplimiento del tratamiento de los TRDS con CPAP en pacientes con ictus se ha descrito que está en un 50-70% en la fase aguda del ictus, pero que la mitad de ellos tienen un cumplimiento a largo plazo45,59,100,186. Sólo existen dos trabajos en los que se realiza tratamiento con CPAP durante las primeras 24 horas del ictus. Uno obtiene un cumplimiento menor al descrito108 y el otro no consigue tolerancia por parte de los pacientes110.
El cumplimiento del tratamiento con CPAP en los pacientes con ictus puede verse interferido por la ausencia de síntomas después de la fase aguda del ictus por poca motivación, por intolerancia al CPAP o por otras alteraciones neurológicas como demencia, delirium, afasia, anosognosia, parálisis pseudobulbar y/o paresia.
Existe en la actualidad una relación bien establecida entre el SAHOS con la posición del paciente mientras duerme187,188. La posición de decúbito supino se ha asociado con un aumento de la colapsabilidad de la vía aérea superior189 y con un incremento de la frecuencia y duración de las apneas190. El tratamiento postural del SAHOS tanto lateral191,192 como de elevación de la cabecera de la cama193 se ha propuesto en la población general como tratamiento de segunda línea.
Un trabajo de Brown et al125 describe que los pacientes que ingresan en fase aguda por un ictus tienen durante el ingreso, debido a su mayor discapacidad, una mayor tendencia a estar en posición supina, además de que estos paciente con SAHOS asociado presentan un importante componente postural, sugiriendo que el tratamiento postural podría ser una opción terapéutica125.
Pacientes con ictus y alteraciones respiratorias centrales se beneficiarían de la oxigenoterapia104. Actualmente se está implantando la respiración servoadaptativa para el tratamiento de los trastornos respiratorios centrales194,195.
Los pacientes con hipoventilación central se beneficiarían de la ventilación mecánica y/o de la ventilación mecánica no invasiva47.
El tratamiento de las TRDS en pacientes en la fase subaguda del ictus ha demostrado ser efectivo, mejora el bienestar, el estado de ánimo y el sueño, sin diferencias en cuanto a la evolución del ictus45,58,196. Estos hallazgos son muy relevantes, ya que estos síntomas (dificultad de concentración, cansancio y depresión) históricamente se han asociado siempre con efectos secundarios del ictus, cuando de hecho podrían estar relacionados con los TRDS. Incluso, existen trabajos en los que han relacionado estos síntomas con un mal pronóstico evolutivo de la enfermedad197.
De estos trabajos podemos concluir que el CPAP es útil en el tratamiento del paciente con ictus, tanto en la fase aguda como en la subaguda, pero todavía queda pendiente mejorar y determinar su cumplimiento a largo plazo, decidir el momento de iniciar tratamiento e incluso el tipo de dispositivo más adecuado. También queda por demostrar si en la fase aguda del ictus, en los pacientes que tienen asociado un TRDS, la utilización de un soporte ventilatorio ajustado mejoraría la oxigenación y el flujo cerebral, lo que podría disminuir el área de penumbra.
ConclusiónLos ictus cerebrales producen daños en el sistema nervioso central, por lo que frecuentemente ocasionan tanto una alteración de la actividad cerebral como de la arquitectura del sueño, además de favorecer la aparición de nuevos trastornos del sueño o empeorar los ya preexistentes. Los trastornos del sueño asociados al ictus son de etiología a veces multifactorial, y con un gran potencial para entorpecer la recuperación posictus. Por este motivo, es de vital importancia identificar los trastornos de sueño subyacentes, porque la aplicación de un tratamiento adecuado podría disminuir las consecuencias de morbimortalidad en estos pacientes.
Los TRDS son de una alta prevalencia en los pacientes con ictus, por lo que sería conveniente un correcto despistaje durante el ingreso hospitalario102. Se debe sospechar sobre todo en pacientes de edad avanzada, sexo masculino, con antecedentes de ronquido y apneas presenciadas, factores de riesgo vascular e ictus que se ha iniciado durante la noche10,106.
Sería interesante poder diagnosticar de forma objetiva los TRDS en los pacientes con ictus lo antes posible, pero la dificultad de la ubicación y del estado del paciente hace que sea difícil la realización de estudios de PSG en la fase aguda del ictus. Los escasos estudios realizados recomiendan métodos simplificados, aunque todavía no está protocolizado ni el método ni la utilidad del diagnóstico precoz, puesto que aunque no se acercaría a la situación basal del paciente su tratamiento podría minimizar el daño neuronal y mejorar así el pronóstico.
A pesar de las nuevas posibilidades terapéuticas tras un ictus, actualmente el tratamiento más efectivo del ictus sigue siendo el preventivo. El tratamiento de los TS en los pacientes con ictus, a menudo infradiagnosticados en estos pacientes11,12, nos abre una nueva ventana terapéutica, pero a la vez, es un reto clínico y técnico y de los cuales se han realizado escasos trabajos. Todo ello nos facilitaría un mejor abordaje de la enfermedad y nos proporcionaría un mejor pronóstico y una mejor calidad de vida del paciente tras sufrir un ictus.