Estudiar la relación entre el metabolismo talámico y la situación neurológica en pacientes que han sufrido un traumatismo craneoencefálico (TCE).
Material y métodosSe incluyó a 19 pacientes que habían sufrido un TCE grave y 10 sujetos control. De los 19 pacientes, 6 presentaban un grado de alerta bajo (estado vegetativo o estado de mínima conciencia), mientras que 13 mostraban un grado de alerta normal. A todos los pacientes se les realizó una tomografía con emisión de positrones (PET) con 18-fluorodesoxiglucosa (18F-FDG) 459,4 ± 470,9 días después del TCE. Las imágenes de PET-FDG se normalizaron en intensidad, creándose posteriormente una plantilla metabólica del grupo entre todos los sujetos. El trazado talámico se generó automáticamente con una máscara de la región de interés. Se comparó el metabolismo talámico de los dos grupos de pacientes respecto al grupo control, para ello se utilizó un método de análisis basado en vóxel, con significación estadística, p < 0,05 corregido para múltiples comparaciones.
ResultadosLos pacientes con grado de alerta bajo mostraron menor metabolismo talámico (coordenadas MNI-Talairach, 12, -24, 18; T=4,1), con respecto a los sujetos control, que los pacientes con grado de alerta adecuado (14, -28, 6; T=5,5). Estas diferencias en el metabolismo fueron más acentuadas en las regiones internas del tálamo.
ConclusionesLa PET-FDG puede ser una herramienta útil para valorar la situación neurológica después de un TCE. El método utilizado permite una evaluación objetiva y cuantitativa de imágenes de PET-FDG para grupos de sujetos. Nuestros resultados confirman la vulnerabilidad del tálamo a sufrir los efectos de las fuerzas de aceleración-desaceleración generadas durante un TCE.
To study the relationship between thalamic metabolism and neurological outcome in patients who had sustained a traumatic brain injury (TBI).
MethodsNineteen patients who had sustained a severe TBI and ten control subjects were included in this study. Six of the 19 patients had a low level of consciousness (vegetative state or minimally conscious state), while thirteen showed normal consciousness. All patients underwent a PET with 18F-FDG, 459.4 ± 470.9 days after the TBI. The FDG-PET images were normalized in intensity, with a metabolic template being created from data derived from all subjects. The thalamic trace was generated automatically with a mask of the region of interest in order to evaluate its metabolism. A comparison between the two groups was carried out by a two sample voxel-based T-test, under the General Linear Model (GLM) framework.
ResultsPatients with low consciousness had lower thalamic metabolism (MNI-Talairach coordinates: 12, -24, 18; T=4.1) than patients with adequate awareness (14, -28, 6; T=5.5). Control subjects showed the greatest thalamic metabolism compared to both patients groups. These differences in metabolism were more pronounced in the internal regions of the thalamus.
ConclusionsThe applied method may be a useful ancillary tool to assess neurological outcomes after a TBI, since it permits an objective quantitative assessment of metabolic function for groups of subjects. Our results confirm the vulnerability of the thalamus to suffering the effects of the acceleration-deceleration forces generated during a TBI. It is hypothesized that patients with low thalamic metabolism represent a subset of subjects highly vulnerable to neurological and functional disability after TBI.
Los traumatismos craneoencefálicos (TCE) representan, dentro de la patología cerebral adquirida, el paradigma de heterogeneidad en cuanto a presentación clínica y neuropatología. La variedad de fuerzas dinámicas que se generan durante cada traumatismo, asociado a la distinta tolerancia elástica de los tejidos intracraneales, hace que cada paciente presente una única y compleja combinación de cambios clínicos que son la expresión de una amplia variabilidad de lesiones tisulares1. Establecer un pronóstico precoz y certero resulta especialmente relevante en los casos de alteración prolongada de la conciencia, como en los estados vegetativos o en los estados de mínima conciencia, dado el alto grado de dependencia futura que estas situaciones conllevan2,3.
En el caso de los TCE, debido a la peculiar diversidad de las lesiones postraumáticas, el clínico se enfrenta a un problema añadido, dado que las pruebas de neuroimagen estructural, que resultan de clara utilidad clínica en otras enfermedades neurológicas adquiridas, pueden ser poco útiles a la hora de establecer correlaciones anatomoclínicas4. A efectos prácticos, se asume que las fuerzas dinámicas generadas tras un TCE cerrado suelen producir lesiones focales contusivas por efecto golpe o golpe-contragolpe y/o lesiones difusas por fenómenos de aceleración-desaceleración o rotación del parénquima cerebral dentro de la estructura ósea del cráneo. Característicamente, mientras que lesiones focales resultan relativamente fáciles de identificar con las técnicas de neuroimagen convencional, las lesiones de daño axonal difuso (DAD), pueden pasar inadvertidas o ser visibles sólo de forma parcial y durante un tiempo limitado con técnicas de neuroimagen poco sensibles5–7. Lo interesante del caso es que estas lesiones tipo DAD, aún siendo más difíciles de visualizar, suelen tener una relación más directa con la recuperación final que la presencia y el volumen de lesiones cerebrales focales8.
Hoy se asume que la distribución de estas lesiones de DAD sigue un gradiente de profundidad dependiente de la intensidad de las fuerzas traumáticas ejercidas a nivel cefálico9,10. La afectación de estructuras profundas, como el tálamo, los ganglios basales o el tronco del encéfalo, resulta especialmente relevante, en tanto en cuanto estas zonas actúan de nodos de enlace entre las diferentes áreas cerebrales y a la vez asumen el papel de contacto entre las vías encargadas de mantener el grado de alerta, conciencia y atención11.
La diferente sensibilidad de las técnicas de neuroimagen estructural y funcional a la hora de detectar lesiones tras un TCE es un hecho conocido12–14. Esta diferencia a favor de las técnicas de neuroimagen funcional es especialmente notoria a la hora de detectar lesiones de DAD y, en particular, a la hora de detectar alteraciones de función en los núcleos profundos encargados de mantener el grado de alerta12,13,15. En este sentido, los estudios realizados hasta la fecha con tomografía por emisión de positrones (PET) en pacientes con TCE han demostrado un vínculo estrecho entre grado de conciencia y metabolismo talámico16. En los últimos años, el desarrollo de diversos métodos de análisis de imagen vóxel a vóxel han mejorado la precisión y la objetividad a la hora de detectar anomalías metabólicas entre grupos de pacientes con lesiones del sistema nervioso central. En concreto, en pacientes en estado vegetativo tras un TCE, dichos métodos han identificado una alteración específica del metabolismo en una amplia red corticosubcortical como expresión de un síndrome de desconexión que envuelve las vías corticotalamocorticales producido por lesiones tipo DAD17–19.
En el presente trabajo se introduce una adaptación del método de morfometría basada en vóxel (MBV)20,21, originariamente planteado para imágenes anatómicas de resonancia magnética (RM), para el análisis de imágenes PET. El objetivo principal de este trabajo es estudiar las diferencias en el metabolismo talámico de un grupo de pacientes con diferente evolución clínica después de sufrir un TCE, centrándose específicamente en el análisis del tálamo como estructura implicada en mantener el grado de conciencia y la conexión con el entorno. El método es similar en su concepción al de MBV, en el sentido de que se tiene una sola imagen volumétrica de cada paciente, a diferencia de los trabajos anteriormente citados16–18, en los que el estudio se realiza sobre imágenes obtenidas en varios instantes temporales para cada paciente. Nuestra hipótesis es que los pacientes con mayor hipometabolismo talámico representan un grupo de sujetos con mayor vulnerabilidad a presentar una discapacidad neurológica mayor después de sufrir un TCE.
Material y métodosPacientesLa muestra inicial estaba compuesta por 19 pacientes que habían sufrido un TCE severo (Glasgow ≤ 8 en cualquier momento durante las 48h posteriores al TCE) y se encontraban completando un programa de neurorrehabilitación en un centro especializado y 10 sujetos controles. Todos los participantes en el estudio dieron el consentimiento informado por escrito. En los pacientes con bajo grado de conciencia el consentimiento fue obtenido de un familiar o el tutor.
Los 19 pacientes se distribuyeron en dos grupos según su grado de alerta. En el grupo A (grado de alerta bajo) se incluyó a 6 pacientes varones con una media ± desviación estándar (DE) de edad de 33,1 ± 11,6 años, y que se encontraban en estado vegetativo (n = 3) o en estado de mínima conciencia (n = 3), según su puntuación en la Coma Recovery Scale y siguiendo los criterios de la Academia Americana de Neurología adaptados al protocolo clínico que se sigue en nuestro servicio22. El grupo B (grado de alerta adecuado) estaba compuesto por 10 varones y 3 mujeres con una edad de 27,3 ± 11,1 años y que habían superado el periodo de amnesia postraumática (APT) 112,6 ± 68,3 días después del TCE. Según los resultados de las pruebas de neuroimagen realizadas en la primera semana después del TCE (tomografía computarizada [TC] en 5 casos y RM en 14), 12 pacientes presentaron lesiones difusas según la clasificación de la Traumatic Coma Data Bank (TCDB)23 (TCDB II, n = 7, y TCDB III, n = 5) y 7, lesiones focales, de las cuales 3 precisaron evacuación quirúrgica. Tan sólo 1 paciente del grupo B presentaba lesiones focales con afección talámica identificables mediante pruebas de neuroimagen convencional. El grupo control estaba formado por 7 varones y 3 mujeres, familiares de los pacientes, con una media ± DE de edad de 45,6 ± 17,6 años y que voluntariamente decidieron participar en este estudio.
Adquisición de las imágenes PETA todos los sujetos se les realizó una PET con 18-fluorodesoxiglucosa (18F-FDG), una media de 459,4 ± 470,9 días después del TCE. Los pacientes estuvieron en ayunas 6h y permanecieron 30min en reposo previamente a la realización de la imagen. Se inyectaron 200-300MBq de 18F-FDG vía intravenosa y 30-60min después se realizó una adquisición 3D única durante 10min en tomógrafo PET (Advance®, General Electric Health-Care Technical Systems). La imagen se reconstruyó mediante algoritmo de retroproyección filtrada (filtro Hanning, cut off 4.8) y corrección de atenuación por contornos, obteniendo cortes de 4,5mm que se reorientaron siguiendo el eje orbitomeatal para obtener secuencias transversales, coronales y sagitales.
Análisis PET basado en vóxelSe realizó un análisis vóxel a vóxel de las imágenes a partir del software libre disponible para la comunidad científica Statistical Parametric Mapping (SPM; Wellcome Department of Cognitive Neurology; Institute of Neurology, Londres, Reino Unido), que funciona bajo el software MATLAB (The MathWorks, Natick, MA, Estados Unidos). Ya que la adquisición de imágenes consistía en una sola imagen volumétrica por sujeto, no se utilizó el método habitual de análisis basado en vóxel mediante SPM, sino que se partió de la implementación para comparación de imágenes anatómicas MBV.
Inicialmente, dado que la plantilla PET estándar del SPM2 fue originalmente construida usando imágenes (15)O-H(2)O PET, y que el uso de dicha plantilla, por ser de diferente trazador, podía llevar a interpretaciones inconsistentes del análisis estadístico24, se generó una plantilla propia que fuera representativa del grupo que se quería estudiar. De esta manera se disponía de una fuente de información fiable y cercana a la realidad de los datos del estudio y se evitaban los sesgos específicos que se derivarían de la utilización de una plantilla estándar. En el proceso de creación de la plantilla propia se utilizaron las imágenes de todos los individuos del estudio, tanto los sujetos controles como los pacientes. En caso contrario la plantilla presentaría desviaciones hacia un grupo determinado y los procesos de normalización obtendrían datos sesgados. En la creación de la plantilla propia intervinieron la plantilla PET del SPM2, las imágenes de los controles y las de los pacientes, todas ellas normalizadas en intensidad. La normalización en intensidad en cada volumen cerebral adquirido, antes de la creación de la plantilla, consistió en detectar el vóxel de máxima intensidad en la imagen volumétrica y dividir la intensidad de cada vóxel del volumen por la intensidad del máximo. De esta forma, se convirtieron los valores de intensidad, indicadores de metabolismo, en valores comparables entre sujetos. A continuación se realizó una normalización espacial inicial mediante una transformación afín de la plantilla PET del SPM y de las imágenes de nuestro estudio normalizadas en intensidad. El proceso comenzó por trasladar al mismo espacio, mediante transformaciones afines de 12 grados de libertad, cada una de las imágenes originales del estudio normalizadas en intensidad. Las imágenes obtenidas se promediaron a continuación, y se obtuvo una referencia que aglutinó información de todos los datos iniciales. Finalmente, la imagen promedio se suavizó con un filtro tridimensional gaussiano de 8 × 8 × 8mm. El uso de un filtro tridimensional de este tipo posibilitó que los valores de cada imagen siguieran una distribución que permitiera la estimación en campos gaussianos, permitiendo incrementar la validez de los posteriores análisis estadísticos25.
Finalmente, las imágenes originales normalizadas en intensidad fueron sometidas a una normalización no lineal (warping) para llevarlas al espacio de la plantilla propia. Tras esta última normalización espacial no lineal de cada imagen se hizo una selección de la región de interés (el tálamo). El trazado talámico se realizó automáticamente, y se generó una máscara de la región de interés mediante el atlas propuesto por Tzourio-Mazoyer et al26 que se superpuso sobre las imágenes a analizar con el software MRIcro (http://www.sph.sc.edu/comd/rorden/mricro.html).
Análisis estadísticoEl análisis estadístico de las imágenes se realizó en el marco del modelo lineal general (MLG), para ello se utilizó el software SPM. Se definió un modelo para la comparación, mediante el MLG, de los grupos (controles > grupo B, controles > grupo A y grupo B > grupo A). El ajuste del modelo consistió en estimar los parámetros para obtener la mejor aproximación de los datos al modelo. Se hizo una resolución del modelo mediante pruebas de la t de Student para dos muestras, que se aplicaron de manera independiente para cada vóxel utilizando contrastes (efectos de interés), con el objetivo de medir las interacciones y, por lo tanto, las posibles diferencias entre cada par de grupos (controles > grupo B, controles > grupo A y grupo B > grupo A). La significación estadística se estableció aplicando en cada caso una corrección para múltiples comparaciones con la técnica de ratio de falsos positivos (False Discovery Rate, FDR)27, que controla la proporción de falsos positivos en el estudio y que corrige los potenciales problemas de repetir un test estadístico en cientos de miles de vóxeles. De esta manera, se comparó el metabolismo talámico de los dos grupos de pacientes respecto al grupo control y entre los dos grupos de pacientes; como nivel de significación estadística se estableció p < 0,05.
La resolución de los modelos estadísticos se presentó en forma de mapas paramétricos de probabilidad, en los que la intensidad o brillo de cada vóxel se determinaba por el estadístico t correspondiente.
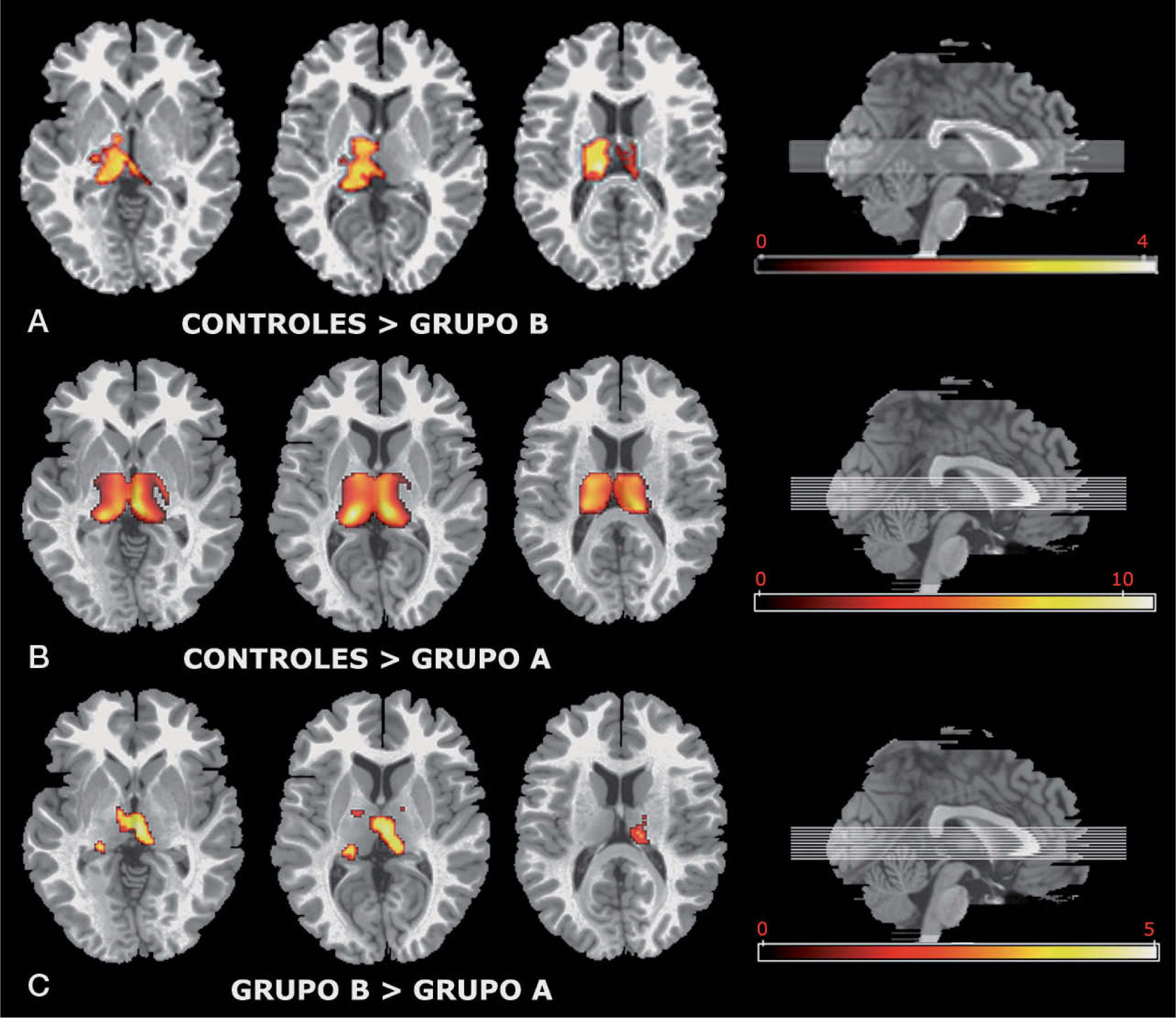
ResultadosSe encontraron diferencias significativas en el metabolismo talámico en los estudios comparativos entre los tres grupos realizados dos a dos. En el estudio que se realizó entre los pacientes del grupo B y los sujetos controles (fig. 1A), se observó que los pacientes del grupo B tenían menor metabolismo talámico que los controles. En el estudio que se realizó entre los pacientes del grupo A y los sujetos controles (fig. 1B), se observó que los pacientes del grupo A también tenían menor metabolismo talámico que los controles, y con una mayor diferencia que en el estudio comparativo anterior. En el estudio que se realizó entre los dos grupos de pacientes (fig. 1C), se observó que los pacientes con un grado de alerta bajo también tenían menor metabolismo talámico que los pacientes con un grado de alerta adecuado.
Imagen de tomografía por emisión de positrones. Mapa de diferencias estadísticamente significativas en la región de interés del tálamo. A: pacientes con un grado de alerta adecuado frente a sujetos sanos. B: pacientes con un grado de alerta bajo frente a sujetos sanos. C: pacientes con un grado de alerta bajo con respecto a pacientes con un grado de alerta adecuado.
El análisis realizado mostró menor metabolismo en el tálamo (región de interés estudiada) en el grupo A, seguido del grupo B, y en el grupo de sujetos controles se encontró el mayor metabolismo. Las diferencias encontradas en el metabolismo talámico fueron mucho mayores entre el grupo A y los sujetos controles que en las demás comparaciones. Esto se observó en todas las comparaciones mediante la prueba de la t de student (tabla 1). Cuanto mayor fue el valor del estadístico t de Student obtenido tras los tests aplicados de manera independiente a cada vóxel, más acentuada fue la diferencia en el metabolismo talámico. En la figura 1 se puede observar que cada vóxel significativo tiene un brillo que es proporcional a la diferencia entre ambos grupos (que se refleja en el valor t para ese vóxel). Los valores de la t de Student crecieron con el gradiente del tálamo, de forma que en las zonas más externas, el valor de la t de Student fue menor, mientras que en el centro del tálamo el valor fue mayor. Los mapas de resultados (fig. 1) muestran los valores de las pruebas t de Student aplicadas a cada vóxel del tálamo.
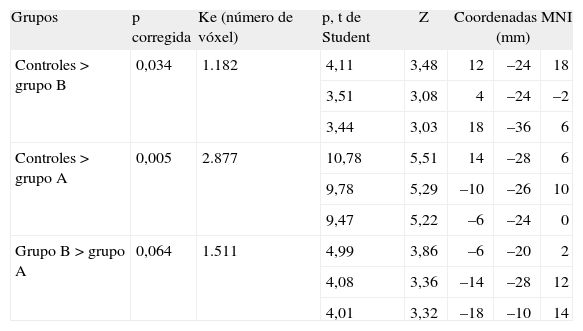
Representación de los estudios y los valores significativos
| Grupos | p corregida | Ke (número de vóxel) | p, t de Student | Z | Coordenadas MNI (mm) | ||
| Controles > grupo B | 0,034 | 1.182 | 4,11 | 3,48 | 12 | –24 | 18 |
| 3,51 | 3,08 | 4 | –24 | –2 | |||
| 3,44 | 3,03 | 18 | –36 | 6 | |||
| Controles > grupo A | 0,005 | 2.877 | 10,78 | 5,51 | 14 | –28 | 6 |
| 9,78 | 5,29 | –10 | –26 | 10 | |||
| 9,47 | 5,22 | –6 | –24 | 0 | |||
| Grupo B > grupo A | 0,064 | 1.511 | 4,99 | 3,86 | –6 | –20 | 2 |
| 4,08 | 3,36 | –14 | –28 | 12 | |||
| 4,01 | 3,32 | –18 | –10 | 14 | |||
Desde los primeros estudios de metabolismo cerebral en pacientes en estado vegetativo sabemos que los pacientes con bajo grado de conciencia muestran una reducción en el metabolismo cerebral general que puede alcanzar hasta el 40-50% de los valores de normalidad; incluso se aprecian descensos aún mayores en los pacientes en que esta situación se prolonga durante mucho tiempo28–31. El significado clínico de este valor aislado en la evaluación de los pacientes con bajo grado perceptivo se ha cuestionado ante la reciente aparición de estudios con nuevos métodos de análisis de imagen que han demostrado un metabolismo cerebral global en los límites de la normalidad en algunos de estos sujetos19. Algunos autores incluso han descrito mejoras en el grado de conciencia y alerta de muchos de estos pacientes, que no se ha acompañado de un incremento en los índices de consumo global de glucosa32,33. El desarrollo de nuevas técnicas de análisis de imagen, como la parcelación por regiones de interés26 y especialmente el desarrollo en estos últimos años de las técnicas de MBV, que evitan la subjetividad de la delimitación manual de cada ROI y permiten una mayor reproducibilidad20,34, ha permitido evitar medidas generales y analizar específicamente las estructuras que anatómicamente parecen más involucradas en el mantenimiento del grado de alerta y la conexión con el entorno. La descripción neuropatológica de las series de casos de pacientes en estado vegetativo ha demostrado que el tálamo, y especialmente las estructuras intralaminares y las proyecciones talamocorticales, es fundamental en el mantenimiento del grado de conciencia35,36. Confirmando esta teoría se ha demostrado un drástico incremento en el grado de interacción con el entorno en pacientes con baja situación perceptiva tras estimulación eléctrica cerebral en núcleos intralaminares talámicos38.
Los estudios de metabolismo cerebral realizados hasta la fecha en afecciones cerebrales postraumáticas apoyan esta asociación entre metabolismo talámico y grado de conciencia39. Concretamente, los estudios de MBV han descrito una disfunción de una amplia red que abarca corteza polimodal asociativa e incluye corteza bifrontal y parietotemporal y núcleos tálamicos18,19,40. Estos estudios han demostrado, a su vez, que la recuperación clínica de los estados de baja conciencia se asocia a una restauración funcional de las conexiones entre los núcleos intralaminares talámicos y la corteza prefrontal17,32. Todos estos estudios indican que en el caso de los TCE graves, en los que el sustrato neuropatológico básico son las lesiones de DAD, el proceso de pérdida y posterior recuperación de la conciencia y, obviamente, del resto de las habilidades perdidas tras el TCE debe interpretarse como un continuo, que no hace sino expresar la pérdida difusa y la posterior activación de la conectividad cerebral perdida. En este sentido, parece que el proceso clínico de recuperación de cada paciente va asociado, sobre todo, a la capacidad para reclutar circuitos neuronales cada vez más amplios, incluyendo áreas estructural y funcionalmente encargadas de manejar información más compleja, y no a la activación de una estructura anatómica concreta. En el caso del tálamo, dada la relevancia funcional de sus conexiones con el resto de las estructuras corticosubcorticales, su metabolismo, o en su defecto su hipometabolismo, debería interpretarse como señal de alarma, al ser un claro reflejo del grado de conectividad y, por lo tanto, de la funcionalidad de dichas redes. Las respuestas clínicas visibles de cada paciente, desde la fase de coma hasta los estados más avanzados de recuperación, no sería sino la expresión del grado de funcionalidad de dichas conexiones41.
Nuestros resultados confirman la vulnerabilidad del tálamo a sufrir los efectos negativos resultantes de las fuerzas que se generan tras un TCE9,17,18,32,35,36,39,40,42,43. Además, la mayor afectación talámica en los pacientes de nuestra muestra con peor situación funcional y la intensidad del hipometabolismo en los núcleos talámicos más profundos coinciden con lo esperado según la teoría del gradiente de profundidad, que propone que cuanto mayor es la intensidad del traumatismo mayor es la profundidad a la que aparecen las lesiones9. Nuestros resultados concuerdan con otros estudios que han demostrado un patrón de intensidad de afectación del tálamo directamente proporcional a la gravedad de la situación clínica resultante tras un TCE16–18,32,39,41.
Uno de los aspectos que se ha cuestionado en estudios previos es si el descenso metabólico observado en las estructuras subcorticales en este grupo de pacientes se debe a un efecto directo del propio TCE en el tálamo, un proceso de desaferentización por DAD sobre la sustancia blanca o un fenómeno por desconexión debido a una afectación directa del TCE sobre estructuras corticales con las que el tálamo está conectado16–19,32,39,41. Aunque la ausencia de lesiones estructurales en la gran mayoría de nuestros pacientes puede indicar que el hipometabolismo talámico aquí descrito se debe a un efecto de desconexión, no puede descartarse que la baja sensibilidad de la técnica de neuroimagen estructural empleada (TC en 5 casos) o la cronicidad de la muestra hayan dificultado la detección de lesiones focales directas, dada la transitoria visibilidad de las lesiones de DAD. Dado que en el presente estudio no se ha analizado el metabolismo de otras estructuras corticales con las que anatómica y funcionalmente establecen conexiones los núcleos talámicos, no podemos arrojar mayor evidencia a esta cuestión.
Nuestros resultados ponen de manifiesto la especial capacidad de las técnicas de neuroimagen funcional, en concreto de la PET, así como la utilidad de las técnicas de MBV, a la hora de detectar alteraciones funcionales aun en ausencia de lesiones estructurales. Concretamente, sólo uno de los pacientes de la muestra aquí estudiada presentaba lesiones identificables mediante TC en tálamo y, curiosamente, dicho paciente pertenecía al grupo con mejor grado de conciencia. La importancia pronóstica de las pruebas de neuroimagen en la enfermedad cerebral postraumática se conoce desde los estudios del TCDB y su clasificación de gravedad clínica en cuatro grados de afectación difusa y dos focales23. Con la aparición de las nuevas técnicas de neuroimagen funcional y el desarrollo de nuevos métodos de análisis, esta década esta viviendo una revolución en nuestra capacidad de examinar de forma no invasiva las estructuras cerebrales, ayudándonos a un mejor conocimiento del funcionamiento de nuestro cerebro. Nuestros resultados indican que las técnicas de neuroimagen funcional nos ofrecen una visión más precisa del grado de disfunción cerebral resultante tras un TCE, nos ofrecen una visión del funcionamiento residual cerebral y nos ayudan a entender posibles mecanismos fisiopatológicos que subyacen a muchos de los síntomas que presentan estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.