La parálisis braquial obstétrica (PBO) suele tener un pronóstico favorable; sin embargo, casi un tercio de los casos graves presentan secuelas permanentes que generan gran discapacidad. Valoramos la eficacia del tratamiento con infiltraciones ecoguiadas de toxina botulínica A (TB-A) y describimos el procedimiento.
Pacientes y métodosEstudio prospectivo, descriptivo, de los casos de PBO moderada-grave tratados entre enero del 2010 y diciembre del 2014. Recogimos datos demográficos, tipo de PBO y evolución. Valoramos eficacia con la escala de movimiento activo (EMA), Mallet Classification System y videofilmación.
ResultadosValoramos a 14.133 recién nacidos vivos, con 15 casos de PBO (1,06 por cada 1.000). El 40% casos graves (0,4/1000), nacidos de parto distócico, con APGAR < 5 y peso medio de 4.038 g. Edad media de inicio de infiltraciones 11,5 meses. El pronator teres, subescapularis, teres major, latissimus dorsi y/o pectoralis major fueron los más frecuentemente infiltrados. Mejoría progresiva hasta 3 niveles en EMA y una media de 19,5 puntos sobre 25 en la escala de Mallet a los 2 años en todos los casos de PBO que completaron el seguimiento (83%). Todos mejoraron funcionalidad y posturas anormales. Evitamos la cirugía en 3 pacientes y se retrasó en uno. Los efectos adversos del tratamiento fueron leves y autolimitados.
ConclusionesPor su seguridad y eficacia, parece razonable la utilización «off label» de TB-A como tratamiento adyuvante a las terapias físicas y/o tratamiento quirúrgico en las PBO moderadas-graves. La ecografía podría aumentar la eficacia y disminuir efectos adversos.
Obstetric brachial plexus palsy (OBPP) usually has a favourable prognosis. However, nearly one third of all severe cases have permanent sequelae causing a high level of disability. In this study, we explore the effectiveness of ultrasound-guided injection of botulinum toxin A (BoNT-A) and describe the procedure.
Patients and methodsWe designed a prospective, descriptive study including patients with moderate to severe OBPP who were treated between January 2010 and December 2014. We gathered demographic data, type of OBPP, and progression. Treatment effectiveness was assessed with the Active Movement Scale (AMS), the Mallet classification, and video recordings.
ResultsWe gathered a total of 14 133 newborns, 15 of whom had OBPP (1.6 per 1000 live births). Forty percent of the cases had severe OBPP (0.4/1000), a dystocic delivery, and APGAR scores < 5; mean weight was 4038g. Mean age at treatment onset was 11.5 months. The muscles most frequently receiving BoNT-A injections were the pronator teres, subscapularis, teres major, latissimus dorsi, and pectoralis major. All the patients who completed the follow-up period (83%) experienced progressive improvements: up to 3 points on the AMS and a mean score of 19.5 points out of 25 on the Mallet classification at 2 years. Treatment improved muscle function and abnormal posture in all cases. Surgery was avoided in 3 patients and delayed in one. Adverse events were mild and self-limited.
ConclusionsDue to its safety and effectiveness, BoNT-A may be used off-label as an adjuvant to physical therapy and/or surgery in moderate to severe OBPP. Ultrasound may increase effectiveness and reduce adverse effects.
La parálisis braquial obstétrica (PBO) es la neuropatía periférica neonatal más frecuente, con una incidencia variable según las series, que oscila entre 0,5-2 casos por cada 1.000 recién nacidos (RN) vivos en países desarrollados1-4.
El pronóstico depende de la gravedad y la extensión de la lesión de las raíces nerviosas. Afortunadamente, la mayoría de los casos consiguen una recuperación espontánea y completa en las primeras 6-8 semanas de vida, o al menos un rango de movimiento y fuerza cercano a la misma5. Sin embargo, existen casos graves con secuelas motoras permanentes que generan gran discapacidad y, por tanto, deben ser identificadas y tratadas de forma precoz.
La limitación funcional permanente ocurre aproximadamente en un tercio de las lesiones graves y afectan principalmente a los músculos implicados en la rotación externa y la abducción del hombro, la flexión del codo, la supinación del antebrazo y la extensión de la muñeca5-7. La debilidad de estos grupos musculares genera un desequilibrio de fuerzas en relación con los músculos sanos que conlleva a una importante limitación funcional del miembro afectado. Dejada a su evolución natural, la persistencia en el tiempo del disbalance muscular limitará el movimiento y la fuerza del miembro afectado, que con frecuencia conlleva el desarrollo de contracturas musculares y ocasionalmente deformidades óseas principalmente del hombro8.
Por ello es de gran importancia identificar de forma precoz los casos más graves y seguir un protocolo sistemático de actuación que permita limitar, en la medida de lo posible, la discapacidad permanente en los niños.
La toxina botulínica (TB) ha mostrado eficacia y seguridad en el tratamiento del disbalance muscular, las cocontracciones y las contracturas musculares, y podría ser utilizada en estos pacientes debilitando los músculos antagonistas sanos, con el objetivo de equilibrar las fuerzas y permitir el crecimiento de los músculos afectados, su fortalecimiento y la mejoría funcional mediante terapias físicas y ocupacional, facilitando el desarrollo de un adecuado patrón de movimiento mientras se produce, si es posible, la reinervación9-11.
El objetivo de este trabajo es describir nuestra experiencia en el tratamiento de la PBO con infiltraciones ecoguiadas de TBA (TB-A), describir el procedimiento y el protocolo de actuación.
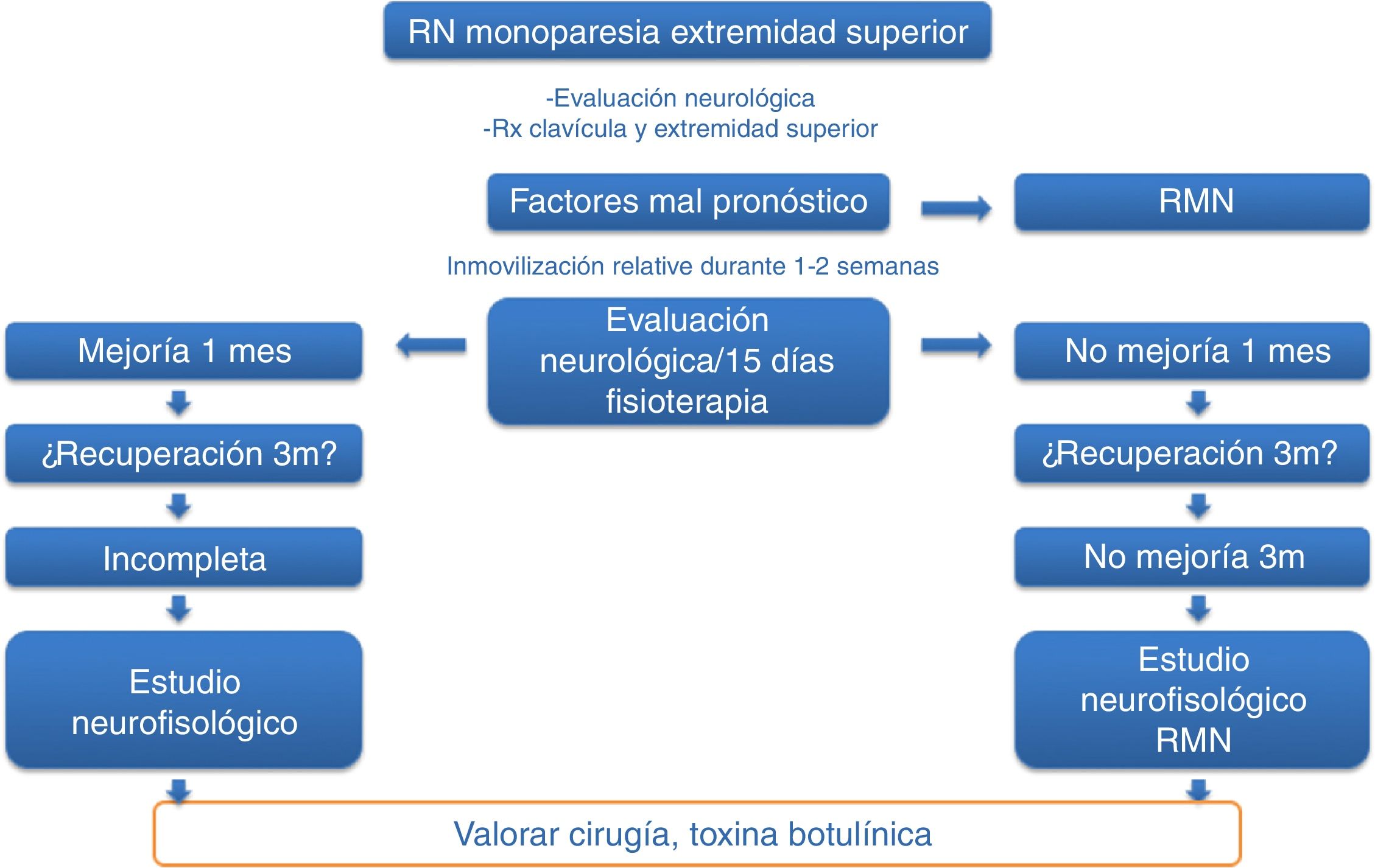
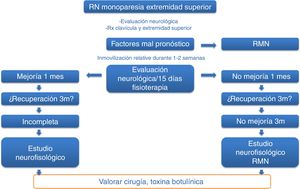
Pacientes y métodosEstudio prospectivo, descriptivo, no aleatorizado y abierto, sobre la seguridad y la utilidad del tratamiento con infiltraciones ecoguiadas de TB-A en los todos los casos de PBO moderada-grave nacidos, diagnosticados y tratados en nuestro centro durante el periodo comprendido entre enero del 2010 y diciembre del 2014. El protocolo de inclusión de los pacientes se realizó según una cronología de actuación previamente establecida (fig. 1), en el que se incluyó a todos los neonatos con monoparesia del miembro superior. Una vez diagnosticados de PBO, se programaron consultas periódicas para valorar la evolución clínica de los RN e incluir los candidatos, previo consentimiento informado de los padres, para las posibles infiltraciones con TB-A.
- –
PBO moderada-grave con mínima mejoría con terapias físicas.
- –
Recuperación de la contracción del bíceps a los 6-9 meses de vida.
- –
Desequilibrio de fuerzas entre músculos del hombro, codo, antebrazo o muñeca que condicionaran patrones de movimiento y/o posturas anómalas.
- –
Cocontracción bíceps-tríceps.
- –
Contracturas articulares (flexo de codo) en el miembro superior afectado.
- –
Aceptaran el compromiso de mantener fisioterapia y terapia ocupacional antes y después de las infiltraciones con TB-A.
Fueron excluidos los pacientes con PBO leve con recuperación completa en los primeros meses de vida y que no precisaron, por tanto, tratamiento con TB-A.
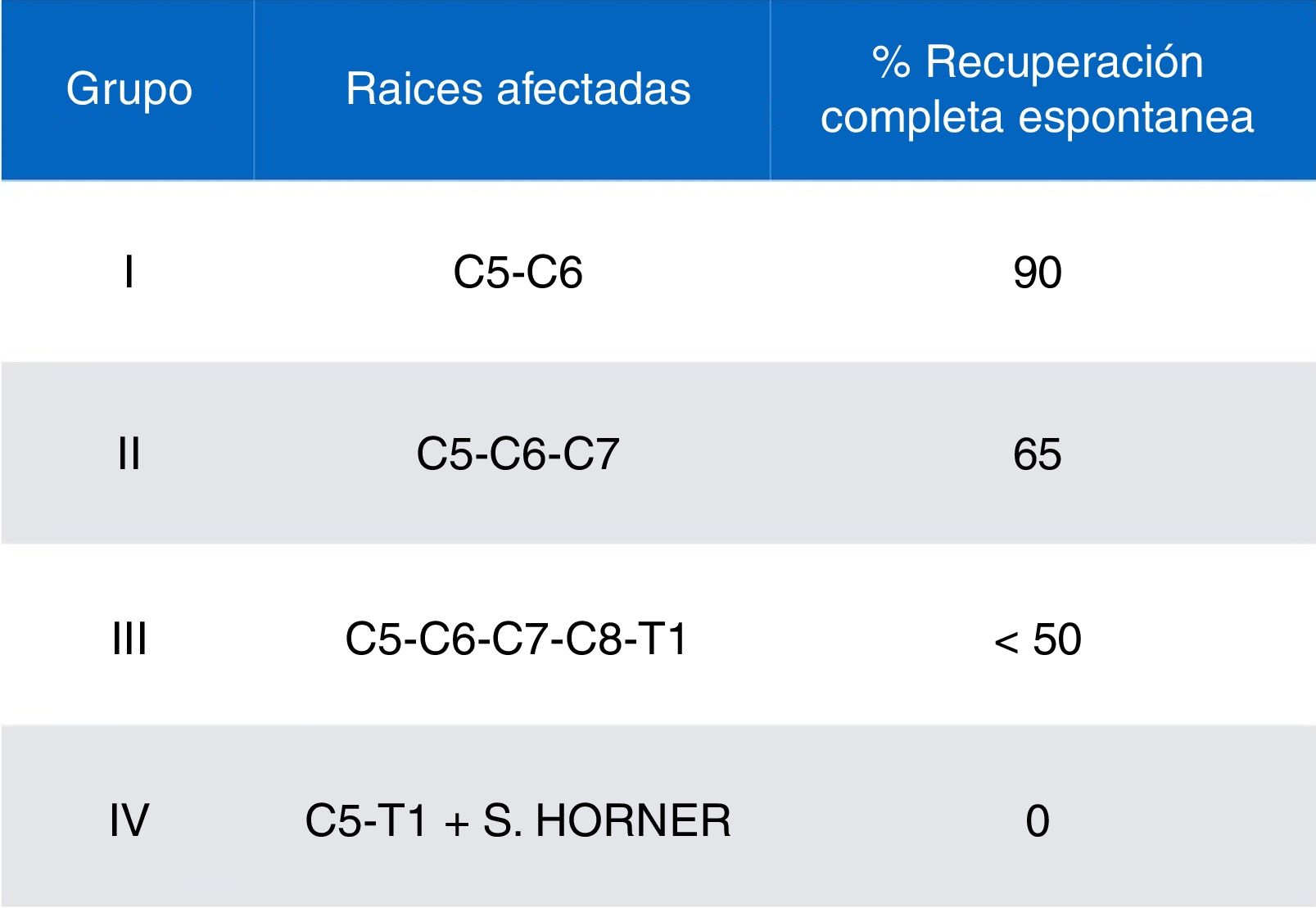
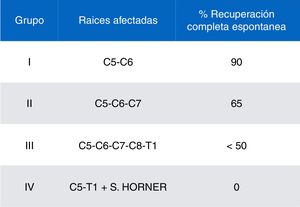
Recogimos datos demográficos (edad, sexo), antecedentes obstétricos (edad gestacional, tipo de parto, peso al nacimiento), tipo de PBO (lado afectado, raíces nerviosas implicadas y clasificación en grupos según la gravedad y pronóstico utilizando el esquema propuesto por Gilbert y Tassin/Narakas detallado en la figura 2)12,13 y factores de mal pronóstico (síndrome de Horner, parálisis diafragmática, parálisis completa, no mejoría con tratamiento conservador a los 3 meses de evolución y ausencia de fuerza antigravitatoria en deltoides y tríceps a final del tercer mes de vida).
ProcedimientoLas infiltraciones fueron realizadas siempre por el mismo facultativo, bajo guía ecográfica y sedoanalgesia consciente inhalada con Kalinox® (protóxido de nitrógeno medicinal, N2O al 50%, Air Liquide Healthcare, España) y analgesia tópica con Emla® (lidocaína 25mg/g + prilocaína 25mg/g crema. AstraZeneca Farmacéutica Spain, SA.) en pacientes colaboradores, o inconsciente con diversos fármacos intravenosos (ketamina, midazolam, propofol o fentanilo) de forma individualizada para minimizar complicaciones, efectos adversos y mejorar la eficacia.
- 1.
La selección muscular: individualizada según la exploración previa del miembro afectado, la funcionalidad y/o la deformidad o patrones anómalos de movimiento más frecuentes.
- a.
Rotación interna del hombro: músculos subscapularis, teres major (redondo mayor), latissimus dorsi (dorsal ancho) y/o pectoralis major (pectoral mayor).
- b.
Extensión del brazo: triceps brachii (tríceps braquial).
- c.
Pronación de antebrazo: pronator teres (pronador redondo) y/o pronator quadratus.
- d.
Flexión muñeca: músculo flexor carpi ulnaris o radialis (flexor cubital o radial del carpo).
- e.
Flexión de los dedos: flexor digitorum superficialis o profundus (flexor superficial o profundo de los dedos).
- a.
- 2.
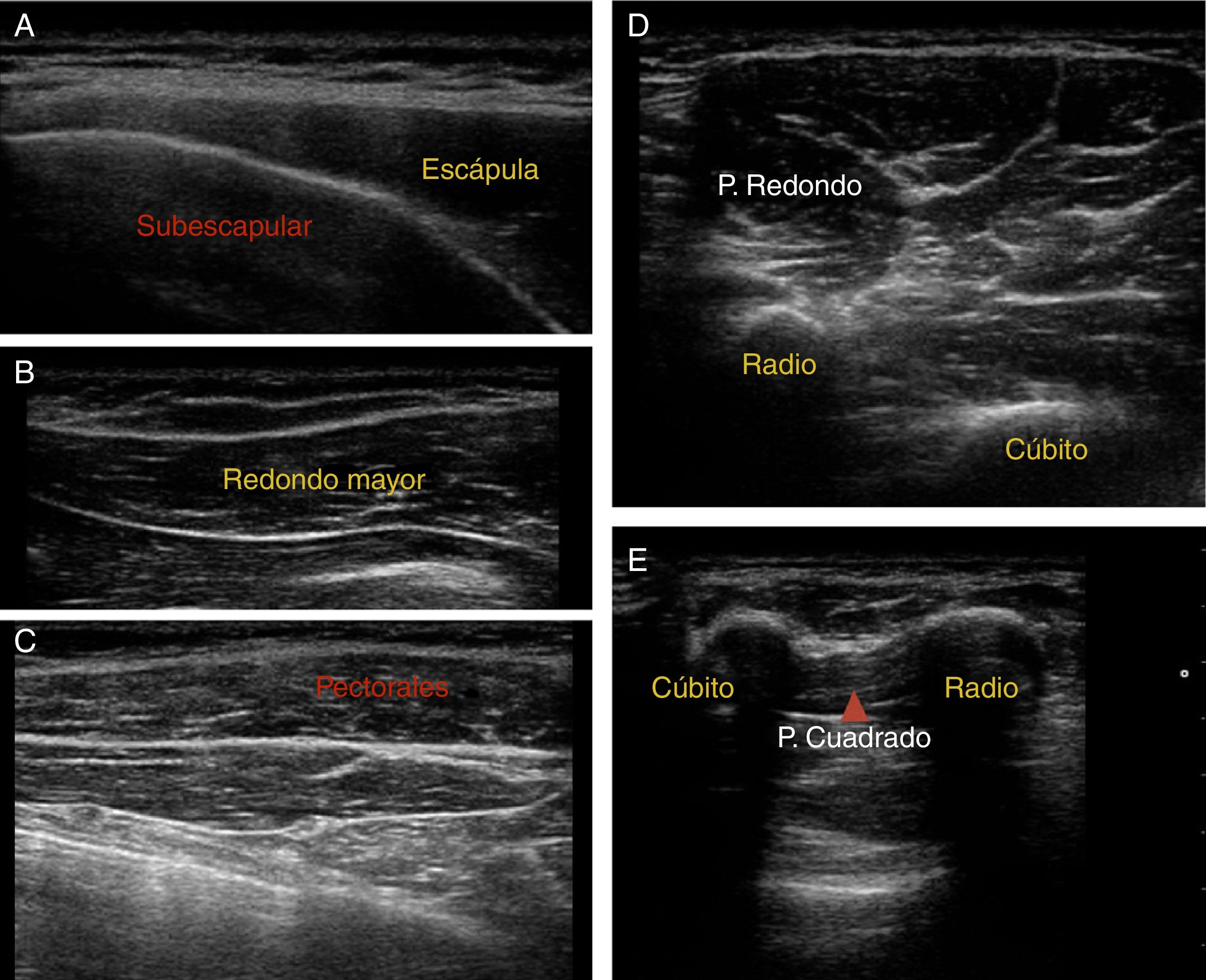
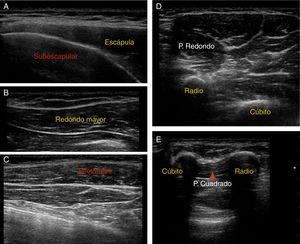
Localización muscular: se realizó localización de las dianas musculares y control de la técnica de infiltración mediante ecografía. Las imágenes ecográficas de los músculos más frecuentemente infiltrados se muestran en la figura 3.
- 3.
Dosificación: la dosis se individualizó según la toxina utilizada, Onabotulinum toxina A (Botox®, Allergan Pharmaceuticals Inc. TB-A, 100 U vial) o Abobotulinum toxina A (Dysport®, Ipsen Pharmaceuticals, Francia, 500 U vial), el peso del paciente, el músculo a infiltrar y el grado de afectación. Nos basamos en las recomendaciones establecidas en Guías de espasticidad elaboradas por expertos en el tema y fueron ajustadas según la experiencia personal del facultativo que realizó las infiltraciones14,15.
- 4.
Para los músculos subscapularis, teres major, pectoralis major, triceps brachii, pronator trees y/o flexor carpi ulnaris o radialis, utilizamos 1-2 U/kg Botox® o 2-4 U/kg Dysport®. Para el músculo latissimus dorsi 1-3 U/kg Botox® o 2-6 U/kg Dysport® y para el resto (pronator quadratus, etc.) 0,5-1 U/kg Botox® o 1-2 U/kg Dysport®.
- 5.
Dilución: reconstituimos ambas toxinas con volúmenes bajos para evitar, en la medida de lo posible, su difusión a otros músculos; 1ml de suero fisiológico (SSF) al 0,9% sin conservantes para el vial de 100 U de Onabotulinum toxina A (0,1ml = 10 U) y 2,5ml de SSF 0,9% para el vial de Abobotulinum toxina A, vial de 500 U (0,1 ml = 20 U).
- 1.
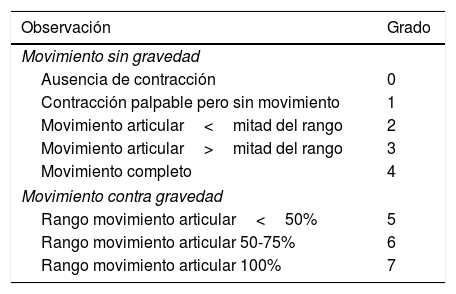
Escala de movimiento activo (EMA)16: basada en la observación del movimiento espontáneo y provocado tras estimulación estimulación en contra y sin gravedad, antes y después de cada infiltración. Valora el movimiento en un total de 8 puntos, en el que 0 indica ausencia de contracción muscular y 7 señala movimiento completo (tabla 1).
Tabla 1.Escala de movimiento activo (EMA)
Observación Grado Movimiento sin gravedad Ausencia de contracción 0 Contracción palpable pero sin movimiento 1 Movimiento articular<mitad del rango 2 Movimiento articular>mitad del rango 3 Movimiento completo 4 Movimiento contra gravedad Rango movimiento articular<50% 5 Rango movimiento articular 50-75% 6 Rango movimiento articular 100% 7 - 2.
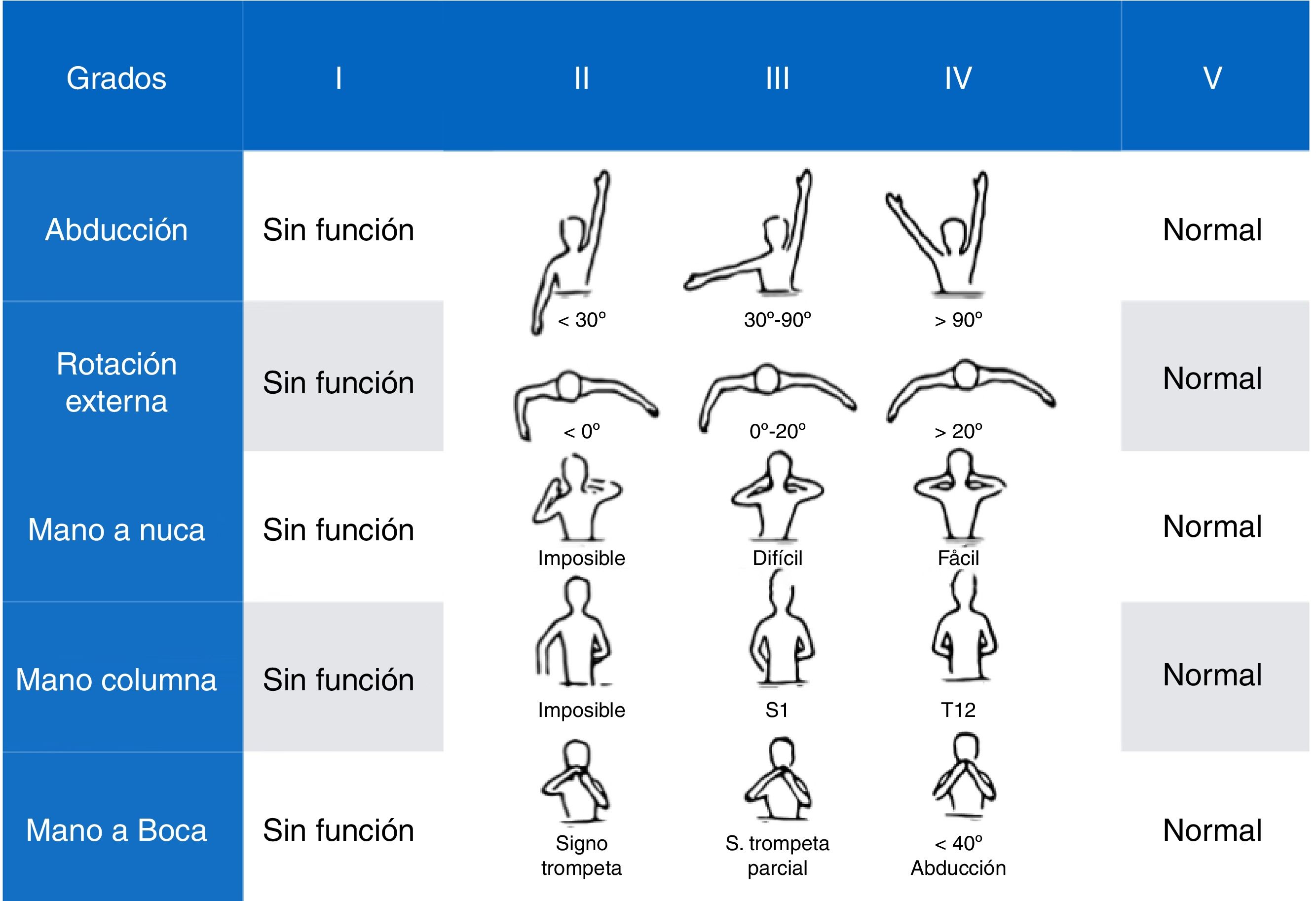
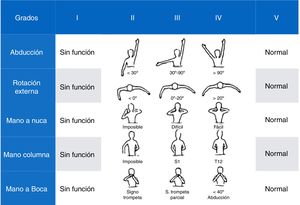
Escala Mallet Classification System17: evalúa la funcionalidad del hombro. Utiliza 5 ítems: abducción, rotación externa, mano a la nuca, a la columna y a la boca, cada uno de los cuales puntúa desde 1 (no movilidad) a 5 (movimiento normal y simétrico con el lado sano), con una puntuación global que oscila desde un mínimo de 5 a un máximo de 25 puntos totales (fig. 4).
- 3.
Videofilmación pre y postinfiltración (con consentimiento informado y firmado).
Se realizó una entrevista dirigida en las revisiones postinfiltración para detectar posibles efectos adversos a la toxina que clasificamos en leves, moderados o graves.
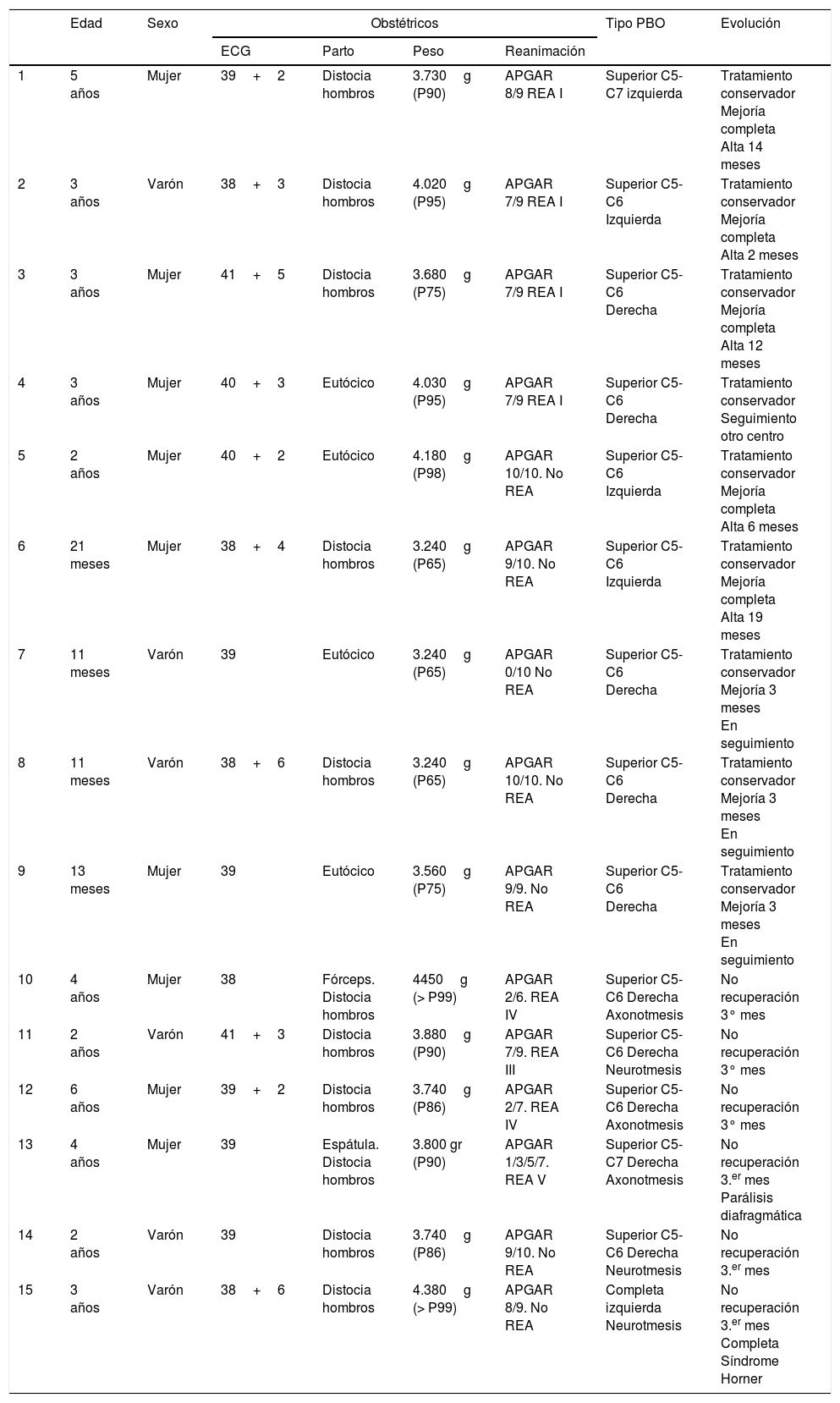
ResultadosEn los 4 años del estudio valoramos un total de 14.133 RN vivos, 15 de los cuales fueron diagnosticados en el periodo neonatal de PBO, lo que supone una incidencia de 1,06 casos por cada 1.000 RN vivos. Todos los casos nacidos de partos a término y vía vaginal, con un leve predominio en niñas (60%). Respecto a las características clínica de las PBO analizadas de forma global, la mayoría de los casos fueron superiores, incluyendo al 93% de la muestra dentro del grupo i-ii, con una preferencia del lado derecho (2/3). Las características demográficas y clínicas de la muestra se detallan en la tabla 2.
Características demográficas y clínicas de la muestra
| Edad | Sexo | Obstétricos | Tipo PBO | Evolución | ||||
|---|---|---|---|---|---|---|---|---|
| ECG | Parto | Peso | Reanimación | |||||
| 1 | 5 años | Mujer | 39+2 | Distocia hombros | 3.730g (P90) | APGAR 8/9 REA I | Superior C5-C7 izquierda | Tratamiento conservador Mejoría completa Alta 14 meses |
| 2 | 3 años | Varón | 38+3 | Distocia hombros | 4.020g (P95) | APGAR 7/9 REA I | Superior C5-C6 Izquierda | Tratamiento conservador Mejoría completa Alta 2 meses |
| 3 | 3 años | Mujer | 41+5 | Distocia hombros | 3.680g (P75) | APGAR 7/9 REA I | Superior C5-C6 Derecha | Tratamiento conservador Mejoría completa Alta 12 meses |
| 4 | 3 años | Mujer | 40+3 | Eutócico | 4.030g (P95) | APGAR 7/9 REA I | Superior C5-C6 Derecha | Tratamiento conservador Seguimiento otro centro |
| 5 | 2 años | Mujer | 40+2 | Eutócico | 4.180g (P98) | APGAR 10/10. No REA | Superior C5-C6 Izquierda | Tratamiento conservador Mejoría completa Alta 6 meses |
| 6 | 21 meses | Mujer | 38+4 | Distocia hombros | 3.240g (P65) | APGAR 9/10. No REA | Superior C5-C6 Izquierda | Tratamiento conservador Mejoría completa Alta 19 meses |
| 7 | 11 meses | Varón | 39 | Eutócico | 3.240g (P65) | APGAR 0/10 No REA | Superior C5-C6 Derecha | Tratamiento conservador Mejoría 3 meses En seguimiento |
| 8 | 11 meses | Varón | 38+6 | Distocia hombros | 3.240g (P65) | APGAR 10/10. No REA | Superior C5-C6 Derecha | Tratamiento conservador Mejoría 3 meses En seguimiento |
| 9 | 13 meses | Mujer | 39 | Eutócico | 3.560g (P75) | APGAR 9/9. No REA | Superior C5-C6 Derecha | Tratamiento conservador Mejoría 3 meses En seguimiento |
| 10 | 4 años | Mujer | 38 | Fórceps. Distocia hombros | 4450g (> P99) | APGAR 2/6. REA IV | Superior C5-C6 Derecha Axonotmesis | No recuperación 3° mes |
| 11 | 2 años | Varón | 41+3 | Distocia hombros | 3.880g (P90) | APGAR 7/9. REA III | Superior C5-C6 Derecha Neurotmesis | No recuperación 3° mes |
| 12 | 6 años | Mujer | 39+2 | Distocia hombros | 3.740g (P86) | APGAR 2/7. REA IV | Superior C5-C6 Derecha Axonotmesis | No recuperación 3° mes |
| 13 | 4 años | Mujer | 39 | Espátula. Distocia hombros | 3.800 gr (P90) | APGAR 1/3/5/7. REA V | Superior C5-C7 Derecha Axonotmesis | No recuperación 3.er mes Parálisis diafragmática |
| 14 | 2 años | Varón | 39 | Distocia hombros | 3.740g (P86) | APGAR 9/10. No REA | Superior C5-C6 Derecha Neurotmesis | No recuperación 3.er mes |
| 15 | 3 años | Varón | 38+6 | Distocia hombros | 4.380g (> P99) | APGAR 8/9. No REA | Completa izquierda Neurotmesis | No recuperación 3.er mes Completa Síndrome Horner |
El 60% (9 casos) tuvo una evolución favorable con recuperación espontánea y completa con tratamiento conservador y, por tanto, fueron excluidos del estudio. Todos fueron a término, normosomas, nacidos por parto vaginal no instrumentado, aunque en el 66,6% de los casos hubo distocia de hombro. No se objetivaron signos de sufrimiento fetal ni precisaron reanimación. En este subgrupo con buena evolución, el tipo de PBO más frecuente fue la del grupo i (8 casos), con predominio del lado derecho (5:4).
Finalmente, incluimos a un total de 6 pacientes con PBO moderada-grave (0,4/1000 RN). Todos RN a término con parto distócico (distocia de hombro), siendo necesaria la utilización de técnicas instrumentales (fórceps) para favorecer el expulsivo en 2 casos. El rango de peso osciló entre 3.740g y 4.450g, con un peso medio de 4.038g. En 2 de los pacientes se consideró peso elevado para la edad gestacional, encontrándose el resto entre percentiles 75-90. Tres de los 6 pacientes tuvieron un APGAR < 5 puntos asociado a sufrimiento fetal. El tipo de PBO más frecuente fue la superior derecha (grupo ii) en 5 pacientes y una parálisis completa izquierda (grupo iv). Ningún caso asoció lesiones óseas en pruebas de imagen, aunque sí objetivamos un caso de parálisis diafragmática en una de las superiores.
Todos los casos graves tuvieron como dato clínico común de mal pronóstico, la ausencia recuperación (contracción del bíceps) con tratamiento conservador al tercer mes de vida, y desde el punto de vista neurofisiológico, una pobre recuperación en el electromiograma por tratarse de lesiones nerviosas graves (neuronotmesis o axonotmesis).
La edad de inicio de las infiltraciones oscilo entre 6.° y el 18 mes de vida (media de 11,5 meses), con un número medio de infiltraciones de 3 por paciente. Los músculos más frecuentemente infiltrados fueron el subescapular, redondo mayor, pectoral mayor, dorsal ancho y pronador redondo, que se infiltraron al menos una vez en el 100% de los casos tratados, seguidos en orden de frecuencia por el pronador cuadrado y flexor cubital del carpo, respectivamente.
La dosis de TB-A se ajustó según las características propias del paciente, la respuesta en infiltraciones previas y el tipo de toxina utilizada. Utilizamos una dosis por sesión y peso del paciente que osciló entre 8-10 U/kg para Onabotulinum toxina A vial de 100 U y 18-22 U/kg para Abobotulinum toxina A vial de 500 U. Por músculo utilizamos como dosis de inicio 1 U/kg de Onabotulinum toxina A para el subscapularis, teres major, pectoralis major, flexor carpi ulnaris o radialis, flexor digitorum superficialis o profundus y pronator quadratus, y 2 U/kg para latissimus dorsi, bíceps, tríceps brachii y pronator teres. Para Abobotulinum toxina A 4 U/kg para latissimus dorsi y pronator teres, 3 U/kg para subescapularis, teres major y pectoralis major y 2 U/kg para el resto.
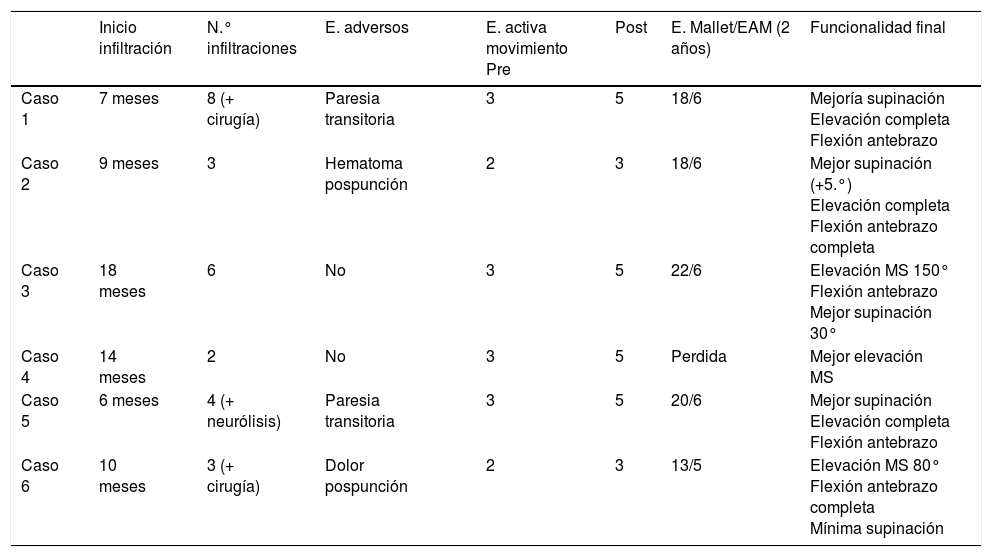
Todos los pacientes fueron infiltrados al menos 2 veces, manteniendo el tratamiento y el seguimiento clínico programado el 83,5% de los pacientes. Durante el periodo de seguimiento hubo una pérdida por cambio de residencia. Obtuvimos desde la primera infiltración un nivel de mejoría en la EMA en la PBO completa y 2 niveles en el resto de PBO superiores, con un inicio en torno a las 2-3 semanas y una duración media del efecto de unos 4 meses, con caída de un nivel en la escala a partir de ese momento. La reinfiltración antes de la recuperación de la situación basal, añadida al resto de tratamientos (terapia ocupacional, fisioterapia y/o cirugía), permitió mantener una progresión de la mejoría del miembro hasta alcanzar un nivel 6 en la EMA y una media de 19,5 puntos sobre 25 en la escala de Mallet a los 2 años en todos los casos de PBO superior que completaron el seguimiento.
Además, mediante las infiltraciones periódicas conseguimos evitar la cirugía en 3 pacientes y retrasarla hasta en 2 ocasiones según estaba planificada en uno (caso 1). Todos los pacientes mejoraron la funcionalidad del miembro y las posturas anormales. Los datos evolutivos de los pacientes se muestran en la tabla 3.
Evolución de los pacientes tratados con toxina botulínica A
| Inicio infiltración | N.° infiltraciones | E. adversos | E. activa movimiento Pre | Post | E. Mallet/EAM (2 años) | Funcionalidad final | |
|---|---|---|---|---|---|---|---|
| Caso 1 | 7 meses | 8 (+ cirugía) | Paresia transitoria | 3 | 5 | 18/6 | Mejoría supinación Elevación completa Flexión antebrazo |
| Caso 2 | 9 meses | 3 | Hematoma pospunción | 2 | 3 | 18/6 | Mejor supinación (+5.°) Elevación completa Flexión antebrazo completa |
| Caso 3 | 18 meses | 6 | No | 3 | 5 | 22/6 | Elevación MS 150° Flexión antebrazo Mejor supinación 30° |
| Caso 4 | 14 meses | 2 | No | 3 | 5 | Perdida | Mejor elevación MS |
| Caso 5 | 6 meses | 4 (+ neurólisis) | Paresia transitoria | 3 | 5 | 20/6 | Mejor supinación Elevación completa Flexión antebrazo |
| Caso 6 | 10 meses | 3 (+ cirugía) | Dolor pospunción | 2 | 3 | 13/5 | Elevación MS 80° Flexión antebrazo completa Mínima supinación |
Respecto a los efectos secundarios en relación con la técnica de infiltración, 2 de los pacientes (casos 2 y 6) refirieron efectos adversos leves y autolimitados (hematomas pospunción, dolor muscular en la 2.ª infiltración) y otros 2 casos (1 y 5), debilidad con parálisis casi completa del miembro, autolimitada y con recuperación funcional en torno a las 3 semanas, también en la 2.ª infiltración y en relación con un aumento de la dosis (tabla 3). Ningún paciente presentó efectos adversos relacionados con la sedoanalgesia.
DiscusiónLa lesión obstétrica del plexo braquial se debe a la tracción y la lateralización sobre las raíces nerviosas durante el parto. El pronóstico va a depender de la gravedad y la extensión de la lesión, y aunque en la mayoría de los casos suele ser favorable con una recuperación completa en los primeros meses de vida, casi un tercio de los pacientes presentan secuelas permanentes que limitan el movimiento, la fuerza e incluso el grosor y tamaño de músculo afectado5-8.
Tradicionalmente, se ha seguido una actitud conservadora a la espera de ver el grado de recuperación espontánea y después plantear tratamientos quirúrgicos paliativos, como la transferencia de tendones, osteotomías o artrodesis. Sin embargo, actualmente se tiende al tratamiento precoz en los primeros meses de vida18.
Esta actitud es un tema bastante controvertido por la dificultad de hacer una adecuada selección de pacientes candidatos y distinguir entre aquellos que van a tener una buena evolución de los que no. En este sentido, parece que la recuperación del bíceps es uno de los pilares básicos en la evolución natural, y es que su recuperación a los 2 meses de vida predice una recuperación espontánea y completa en la mayoría de los casos, mientras que la ausencia de contracción a los 3 meses pronostica la necesidad de realizar tratamiento quirúrgico12.
La TB nos plantea una alternativa intermedia entre la actitud expectante y la invasiva. Tradicionalmente, su indicación principal en Neurología ha sido el tratamiento de diversos síndromes que cursan con hiperactividad muscular, como la espasticidad de cualquier etiología, distonías, espasmo hemifacial, sincinesias faciales, tics y temblores, etc.19. Sin embargo, podría tener además utilidad en otras muchas indicaciones, como por ejemplo en el desequilibrio de fuerzas que generan la lesiones nerviosas entre músculos sanos y enfermos, como es el caso de la PBO9,20.
La TB-A consigue un bloqueo selectivo, temporal y reversible de neurotransmisión colinérgica en la unión neuromuscular de los músculos antagonistas sanos. Con ello intentamos compensar el desequilibro de fuerzas que genera la plexopatía y evitar el desarrollo de patrones de aprendizaje motores patológicos y una posible reinervación aberrante9,10,20.
Aunque la evidencia de la eficacia de la TB-A en esta patología está limitada por la escasez de estudios y la ausencia de ensayos clínicos controlados aleatorizados, los datos disponibles en la literatura muestran beneficios en la articulación del codo, con una mejoría en la flexión y supinación desde las primeras infiltraciones, que se mantiene durante más de un año cuando las infiltraciones son repetidas cada 3-5 meses9,10,21-23.
En nuestra serie, obtenemos mejoría en todos los pacientes valorados con las escalas utilizadas, tanto en la articulación del hombro como en la del codo desde la primera infiltración, y una mejoría progresiva de las mismas con las infiltraciones periódicas cada 3-6 meses. Este beneficio también fue señalado subjetivamente por los padres y objetivado al repasar el material audiovisual (videofilmación) de nuestros pacientes, con una mejoría significativa del patrón de movimiento y la funcionalidad del miembro.
Como en otras series publicadas, la TB-A pudo utilizarse de una manera independiente al resto de los tratamientos, incluso como tratamiento coadyuvante a la cirugía del plexo23,24. La combinación de ambos tratamientos en 2 de nuestros pacientes permitió obtener mejores puntuaciones en la escala activa de movimiento y mantener de forma continuada durante la evolución la elevación-abducción del hombro y la supinación del codo. En otro de nuestros pacientes, la TB-A permitió posponer la cirugía hasta en 2 ocasiones, consiguiendo alcanzar finalmente tras la misma un nivel de mejoría superior que solo con TB-A.
Aunque el estudio tiene sus limitaciones, como el tamaño muestral reducido (N=15), pensamos que nuestra serie es bastante homogénea y representativa de la práctica clínica habitual. Obtuvimos una incidencia similar a otras series publicadas, con una muestra que se obtuvo de una población similar respecto al nivel socioeconómico y cultural, y tanto la sintomatología como las disfunciones producidas por la enfermedad eran las esperables en este grupo de pacientes.
Nuestra principal aportación es la técnica de la infiltración, ya que actualmente se considera que la localización exacta de la TB en el músculo diana es el factor más importante por encima de la dosis y la dilución, para reducir los efectos adversos, la penalización de los músculos adyacentes y conseguir efectos terapéuticos máximos con la dosis más baja posible25. A diferencia de otros estudios, nuestros pacientes fueron infiltrados con guía ecográfica, aumentando la precisión de la técnica, y utilizando volúmenes de dilución bajos para evitar la difusión a otros músculos. Quizá por ello conseguimos mejorar la puntuación en las escalas y la funcionalidad del miembro en todos los casos tratados, con un aceptable perfil de efectos adversos. En relación con este aumento de precisión en la infiltración, pudimos utilizar dosis algo inferiores a las de otros estudios similares10 sin una disminución del resultado final.
Debemos concluir haciendo especial hincapié en la importancia de la identificación precoz de aquellas PBO que precisan tratamiento (quirúrgico-no quirúrgico) para evitar secuelas motoras permanentes. Parece razonable la utilización como indicación «off label» de TB-A como tratamiento adyuvante a las terapias físicas y/o tratamiento quirúrgico en las PBO moderadas-graves, por su seguridad y eficacia, teniendo en cuenta que nuestras conclusiones se ven limitadas por falta de estudios prospectivos, y aleatorizados, con seguimiento a largo plazo y que utilicen escalas de valoración funcional con sistemas de puntuación estandarizada que refuercen nuestros resultados.
Conflicto de InteresesNo existe conflicto de intereses entre los autores.