Estamos asistiendo a un cambio en el paradigma del diagnóstico de la enfermedad de Alzheimer (EA), de modo que tiende a realizarse en fases más precoces de la evolución, incluso antes de la aparición del síndrome completo de demencia. En nuestro entorno no se conoce en qué situación clínica se está realizando el diagnóstico de la EA. Por ese motivo, se ha llevado a cabo este estudio, para describir el estadio evolutivo de los pacientes con EA en el momento del diagnóstico.
MétodosEstudio multicéntrico, observacional y transversal. Se incluyeron pacientes que cumplían criterios NINCDS-ARDRA de EA probable, atendidos en consultas de Atención Especializada en España. Se recogieron los datos sobre los tiempos asistenciales y de evolución de la EA según el MMSE, el cuestionario NPI y la escala CDR.
ResultadosParticiparon 437 especialistas de todas las Comunidades Autónomas, que incluyeron un total de 1.707 pacientes, de los cuales 1.694 fueron incluidos en el análisis. La puntuación media del MMSE fue de 17,6±4,8 (IC 95%:17,4-17,9). El 64% de los pacientes presentaban deterioro cognitivo moderado (MMSE entre 10 y 20) y el 6% grave (MMSE<10). El tiempo medio desde los primeros síntomas hasta la primera consulta a Atención Primaria fue de 10,9±17,2 meses (IC 95%:9,9-11,8), y hasta el diagnóstico de la EA fue de 28,4±21,3 meses.
ConclusionesLos resultados del EACE ponen de manifiesto que en nuestro entorno la mayor parte de los pacientes con EA acuden a Atención especializada en un estado evolutivo moderado.
The diagnostic paradigm of Alzheimer disease (AD) is changing; there is a trend toward diagnosing the disease in its early stages, even before the complete syndrome of dementia is apparent. The clinical stage at which AD is usually diagnosed in our area is unknown. Therefore, the purpose of this study is to describe the clinical stages of AD patients at time of diagnosis.
MethodsMulticentre, observational and cross-sectional study. Patients with probable AD according to NINCDS-ARDRA criteria, attended in specialist clinics in Spain, were included in the study. We recorded the symptom onset to evaluation and symptom onset to diagnosis intervals and clinical status of AD (based on MMSE, NPI questionnaire, and CDR scale).
ResultsParticipants in this study included 437 specialists representing all of Spain's autonomous communities and a total of 1,707 patients, of whom 1,694 were included in the analysis. Mean MMSE score was 17.6±4.8 (95% CI:17.4-17.9). Moderate cognitive impairment (MMSE between 10 and 20) was detected in 64% of the patients, and severe cognitive impairment (MMSE<10) in 6%. The mean interval between symptom onset and the initial primary care visit was 10.9±17.2 months (95% CI:9.9-11.8), and the interval between symptom onset and diagnosis with AD was 28.4±21.3 months.
ConclusionsResults from the EACE show that most AD patients in our area have reached a moderate clinical stage by the time they are evaluated in a specialist clinic.
La Sociedad Española de Neurología (SEN) define la demencia como una alteración adquirida y persistente de las funciones cerebrales que afecta al menos 2 esferas cognitivas (memoria, lenguaje, función visuoespacial, funciones ejecutivas, conducta) con una intensidad suficiente para interferir con las actividades habituales de la persona afectada, en ausencia de alteración del nivel de conciencia1. Esta condición afecta al 4% de la población mayor de 60 años, con escasas diferencias según regiones geográficas, en todo el mundo, aunque la prevalencia global es mayor en los países desarrollados. El diagnóstico de enfermedad de Alzheimer (EA) se realiza en una proporción normalmente superior a las 2 terceras partes de los casos de demencia2.
Los tratamientos actuales para la EA han demostrado una eficacia estadísticamente significativa para mejorar la función cognitiva y la práctica totalidad de manifestaciones clínicas de dicha condición, incluyendo la calidad de vida de los pacientes y cuidadores, de modo coste-efectivo. Por ello, las guías disponibles recomiendan el inicio del tratamiento farmacológico tan pronto se diagnostique la EA1,3,4. No obstante, este tipo de trastornos suele tener un inicio insidioso que no pocas veces resulta difícil de distinguir de otras condiciones clínicas y dificulta el diagnóstico de la EA en sus fases más precoces5. El retraso en el diagnóstico de la EA supone también una demora en el inicio del tratamiento farmacológico específico. Existe, en cambio, una evidencia creciente de que el tratamiento precoz puede optimizar los beneficios terapéuticos y retrasar el deterioro cognitivo6, por lo que se han propuesto iniciativas para identificar la enfermedad en estadios más iniciales7,8. De hecho, en el ámbito científico de la EA, las propuestas de cambio de criterios diagnósticos de la EA en aras del diagnóstico precoz han tenido un impacto más que notable9–14. Aunque en la práctica clínica con frecuencia se tiene la impresión de que se diagnostican los casos en estados relativamente avanzados, lo cierto es que no disponemos de información cierta sobre este aspecto en nuestro ámbito geográfico. Para obtener este tipo de información se propuso la realización del estudio EA en Consulta Especializada (EACE), cuyo objetivo justamente fue el de describir el estadio evolutivo de los pacientes con EA en el momento del diagnóstico en nuestro medio, en el ámbito de las consultas especializadas en las que normativamente puede indicarse el tratamiento específico para la EA.
Pacientes y métodosEl EACE es un estudio multicéntrico, observacional y transversal realizado en Consultas de Atención Especializada en España. El objetivo principal del estudio fue describir el estadio evolutivo en el que acuden los pacientes afectos de EA a la Consulta Especializada para su diagnóstico y evaluar los tiempos asistenciales. Dada su naturaleza observacional, el estudio no implicó ninguna intervención clínica.
El estudio se realizó por especialistas de todas las Comunidades Autónomas del país, a los que se ofreció su participación en el estudio. Cada especialista pudo incluir entre mayo y noviembre de 2009, los 4 primeros pacientes atendidos en su consulta que, de forma consecutiva, cumplían los siguientes criterios de selección: cumplir en ese momento los criterios NINCDS-ARDRA de EA probable15 sin que dicho diagnóstico se hubiera realizado con anterioridad, ser neuropsicológicamente evaluables y contar con la disponibilidad de un informador fiable capaz de responder a las preguntas del cuestionario del estudio. Se asumió que los pacientes tratados previamente con fármacos específicos habían ya sido diagnosticados, por lo que se excluyeron del estudio, y evidentemente, tampoco se incluyeron casos con demencia producida por otras causas (enfermedad de Parkinson, hidrocefalia, ictus). Según las normas de la buena práctica médica y la declaración de Helsinki, los pacientes otorgaron su consentimiento informado para su participación en el estudio, cuyo protocolo fue aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario de Elche.
Los datos fueron registrados en una única visita por el profesional correspondiente. Para cada caso se recogieron las siguientes variables:
- 1.
Sociodemográficas: edad, sexo, escolarización (tiempo y nivel, distinguiendo analfabetos, analfabetos funcionales, estudios primarios, medios y superiores), convivencia al inicio de los síntomas y parentesco del cuidador principal.
- 2.
Antecedentes familiares, comorbilidad y tratamientos concomitantes.
- 3.
Datos de la consulta: especialidad que deriva al paciente, especialidad que atiende al paciente, lugar de la consulta, tanto a nivel organizativo (consulta extrahospitalaria general, hospitalaria general o específica, unidad de demencia, otras) como en cuanto a su situación geográfica y demográfica (localidad de más de 500.000 habitantes, entre 100.000 y 500.000 o menos de 100.000).
- 4.
Síntoma inicial de la enfermedad (trastorno de memoria, del lenguaje, de la conducta, del reconocimiento, otros).
- 5.
Datos retrospectivos de evolución:
- •
Fecha estimada del inicio de los síntomas.
- •
Fecha de la primera consulta.
- •
Fecha de la derivación al especialista.
- •
Fecha estimada de la necesidad de supervisión.
- •
Fecha de la evaluación por el especialista (diagnóstico-inclusión en el estudio).
- •
Razones de la posible demora en la remisión.
- •
- 6.
Descripción del estado cognitivo, conductual y global del paciente:
Se estimó un tamaño muestral de 1.600 casos con la intención de obtener estimaciones válidas para las puntuaciones de las escalas mencionadas, asumiendo un error de precisión no superior al 25%, un intervalo de confianza (IC) del 95% (IC 95%) en un escenario conservador con un porcentaje de pérdidas del 5%. Se analizaron todos los pacientes incluidos que cumplían los criterios de selección. La muestra se describió con medidas de tendencia central y dispersión para variables cuantitativas, y las frecuencias absolutas y relativas para variables cualitativas, con su correspondiente IC 95%. También se realizaron análisis bivariantes para explorar algunos subgrupos. Las variables cuantitativas se evaluaron con la prueba de Kolmogorov-Smirnov y se usaron métodos no paramétricos si no cumplían criterios de normalidad. Las pruebas estadísticas se realizaron con un nivel de significación del 5% y fueron bilaterales. Se utilizó el paquete estadístico SAS® versión 8.2 para realizar todos los análisis estadísticos.
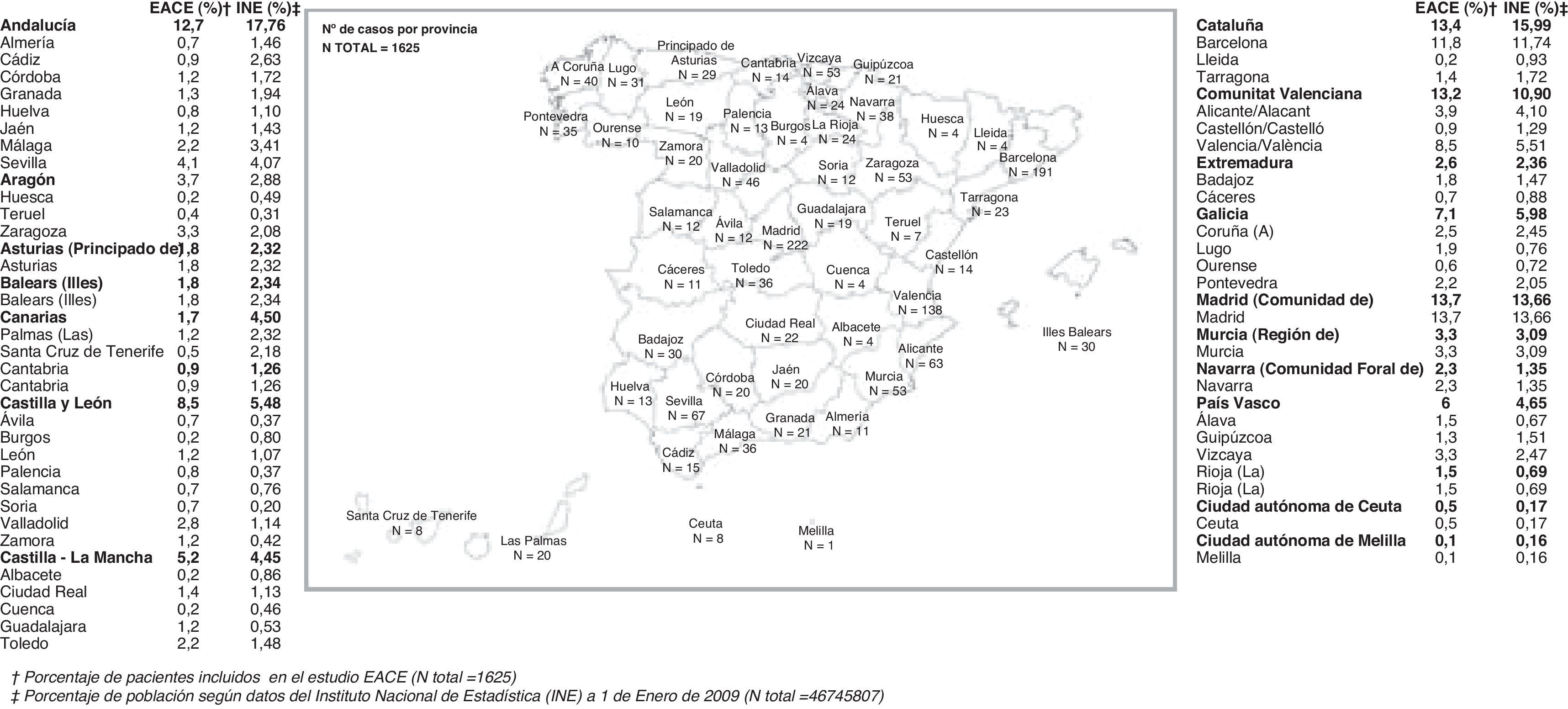
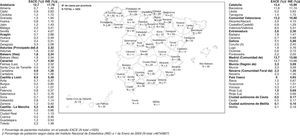
ResultadosCaracterísticas generalesSe evaluaron los 1.694 pacientes que cumplían los criterios de elegibilidad, de los 1.707 pacientes incluidos en el estudio. Los datos de los pacientes fueron recogidos por 437 profesionales procedentes de todas las Comunidades Autónomas, tal y como se recoge en la figura 1. La representación es aproximadamente la poblacional general, con algunas desviaciones entre las que quizá merezca citarse que Andalucía y Canarias están algo infrarrepresentadas.
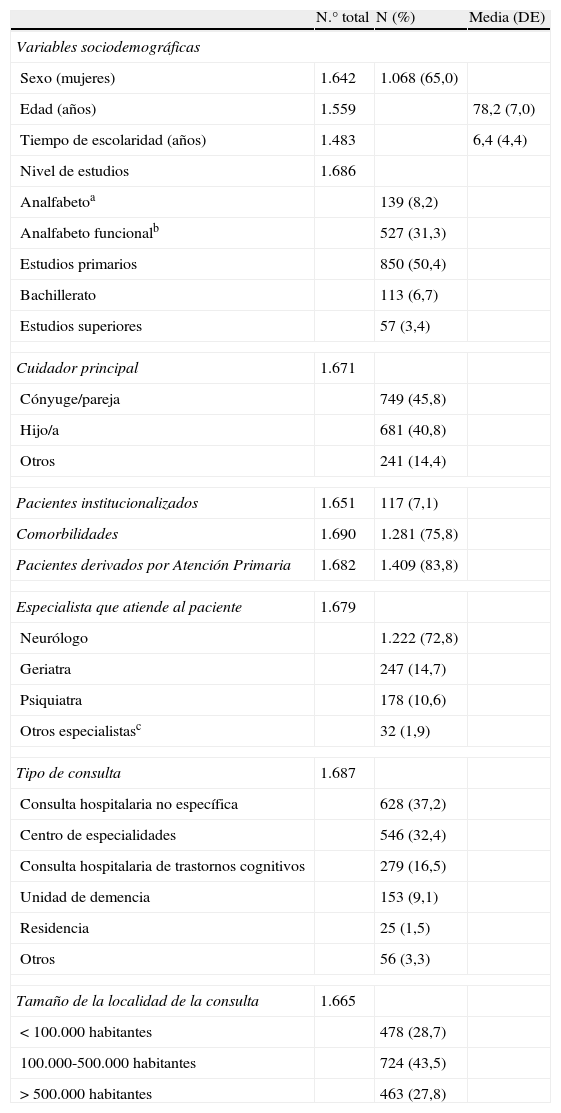
Las características generales de la muestra se recogen en las tablas 1 y 2. Cabe destacar como características llamativas de la muestra un porcentaje cercano al 40% de analfabetos y analfabetos funcionales, la atención mayoritaria por neurólogos y la discreta representación de las consultas específicas y unidades de demencia.
Características de la muestra
| N.° total | N (%) | Media (DE) | |
| Variables sociodemográficas | |||
| Sexo (mujeres) | 1.642 | 1.068 (65,0) | |
| Edad (años) | 1.559 | 78,2 (7,0) | |
| Tiempo de escolaridad (años) | 1.483 | 6,4 (4,4) | |
| Nivel de estudios | 1.686 | ||
| Analfabetoa | 139 (8,2) | ||
| Analfabeto funcionalb | 527 (31,3) | ||
| Estudios primarios | 850 (50,4) | ||
| Bachillerato | 113 (6,7) | ||
| Estudios superiores | 57 (3,4) | ||
| Cuidador principal | 1.671 | ||
| Cónyuge/pareja | 749 (45,8) | ||
| Hijo/a | 681 (40,8) | ||
| Otros | 241 (14,4) | ||
| Pacientes institucionalizados | 1.651 | 117 (7,1) | |
| Comorbilidades | 1.690 | 1.281 (75,8) | |
| Pacientes derivados por Atención Primaria | 1.682 | 1.409 (83,8) | |
| Especialista que atiende al paciente | 1.679 | ||
| Neurólogo | 1.222 (72,8) | ||
| Geriatra | 247 (14,7) | ||
| Psiquiatra | 178 (10,6) | ||
| Otros especialistasc | 32 (1,9) | ||
| Tipo de consulta | 1.687 | ||
| Consulta hospitalaria no específica | 628 (37,2) | ||
| Centro de especialidades | 546 (32,4) | ||
| Consulta hospitalaria de trastornos cognitivos | 279 (16,5) | ||
| Unidad de demencia | 153 (9,1) | ||
| Residencia | 25 (1,5) | ||
| Otros | 56 (3,3) | ||
| Tamaño de la localidad de la consulta | 1.665 | ||
| <100.000 habitantes | 478 (28,7) | ||
| 100.000-500.000 habitantes | 724 (43,5) | ||
| >500.000 habitantes | 463 (27,8) | ||
aAnalfabeto: no sabe leer ni escribir; bAnalfabeto funcional: sabe leer y escribir, pero con mucha dificultad; cOtros especialistas: datos obtenidos por 15 internistas, 12 neuropsicólogos y 5 médicos de Atención Primaria o médicos de familia.
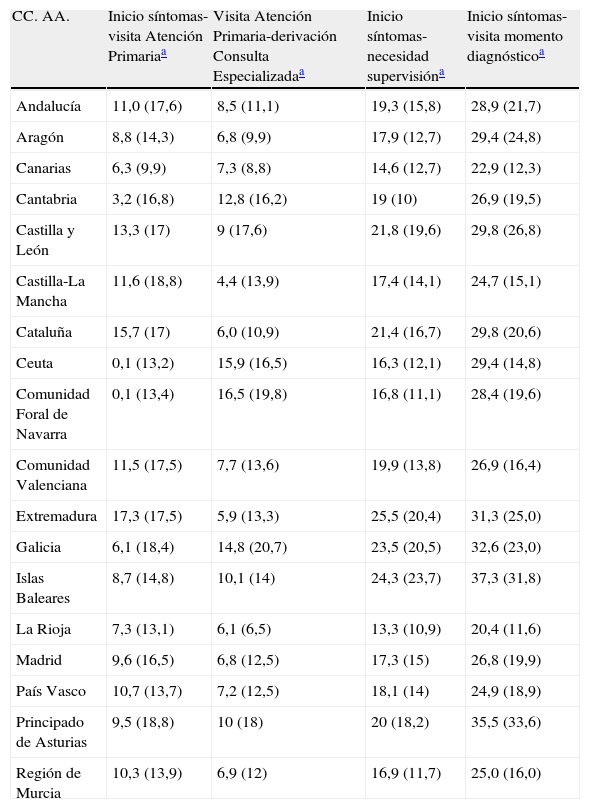
Tiempos asistenciales: dispersión por Comunidades Autónomas
| CC. AA. | Inicio síntomas-visita Atención Primariaa | Visita Atención Primaria-derivación Consulta Especializadaa | Inicio síntomas-necesidad supervisióna | Inicio síntomas-visita momento diagnósticoa |
| Andalucía | 11,0 (17,6) | 8,5 (11,1) | 19,3 (15,8) | 28,9 (21,7) |
| Aragón | 8,8 (14,3) | 6,8 (9,9) | 17,9 (12,7) | 29,4 (24,8) |
| Canarias | 6,3 (9,9) | 7,3 (8,8) | 14,6 (12,7) | 22,9 (12,3) |
| Cantabria | 3,2 (16,8) | 12,8 (16,2) | 19 (10) | 26,9 (19,5) |
| Castilla y León | 13,3 (17) | 9 (17,6) | 21,8 (19,6) | 29,8 (26,8) |
| Castilla-La Mancha | 11,6 (18,8) | 4,4 (13,9) | 17,4 (14,1) | 24,7 (15,1) |
| Cataluña | 15,7 (17) | 6,0 (10,9) | 21,4 (16,7) | 29,8 (20,6) |
| Ceuta | 0,1 (13,2) | 15,9 (16,5) | 16,3 (12,1) | 29,4 (14,8) |
| Comunidad Foral de Navarra | 0,1 (13,4) | 16,5 (19,8) | 16,8 (11,1) | 28,4 (19,6) |
| Comunidad Valenciana | 11,5 (17,5) | 7,7 (13,6) | 19,9 (13,8) | 26,9 (16,4) |
| Extremadura | 17,3 (17,5) | 5,9 (13,3) | 25,5 (20,4) | 31,3 (25,0) |
| Galicia | 6,1 (18,4) | 14,8 (20,7) | 23,5 (20,5) | 32,6 (23,0) |
| Islas Baleares | 8,7 (14,8) | 10,1 (14) | 24,3 (23,7) | 37,3 (31,8) |
| La Rioja | 7,3 (13,1) | 6,1 (6,5) | 13,3 (10,9) | 20,4 (11,6) |
| Madrid | 9,6 (16,5) | 6,8 (12,5) | 17,3 (15) | 26,8 (19,9) |
| País Vasco | 10,7 (13,7) | 7,2 (12,5) | 18,1 (14) | 24,9 (18,9) |
| Principado de Asturias | 9,5 (18,8) | 10 (18) | 20 (18,2) | 35,5 (33,6) |
| Región de Murcia | 10,3 (13,9) | 6,9 (12) | 16,9 (11,7) | 25,0 (16,0) |
El valor medio del MMSE de la muestra fue de 17,6±4,8 (IC 95%:17,4-17,9), con la siguiente distribución: leve (puntuación>20) 30%, moderado (puntuación entre 10-20) 64% y grave (puntuación<10) 6%. El valor medio de la versión ajustada por edad y escolaridad fue de 19,1±4,7 (IC 95%:18,8-19,3).
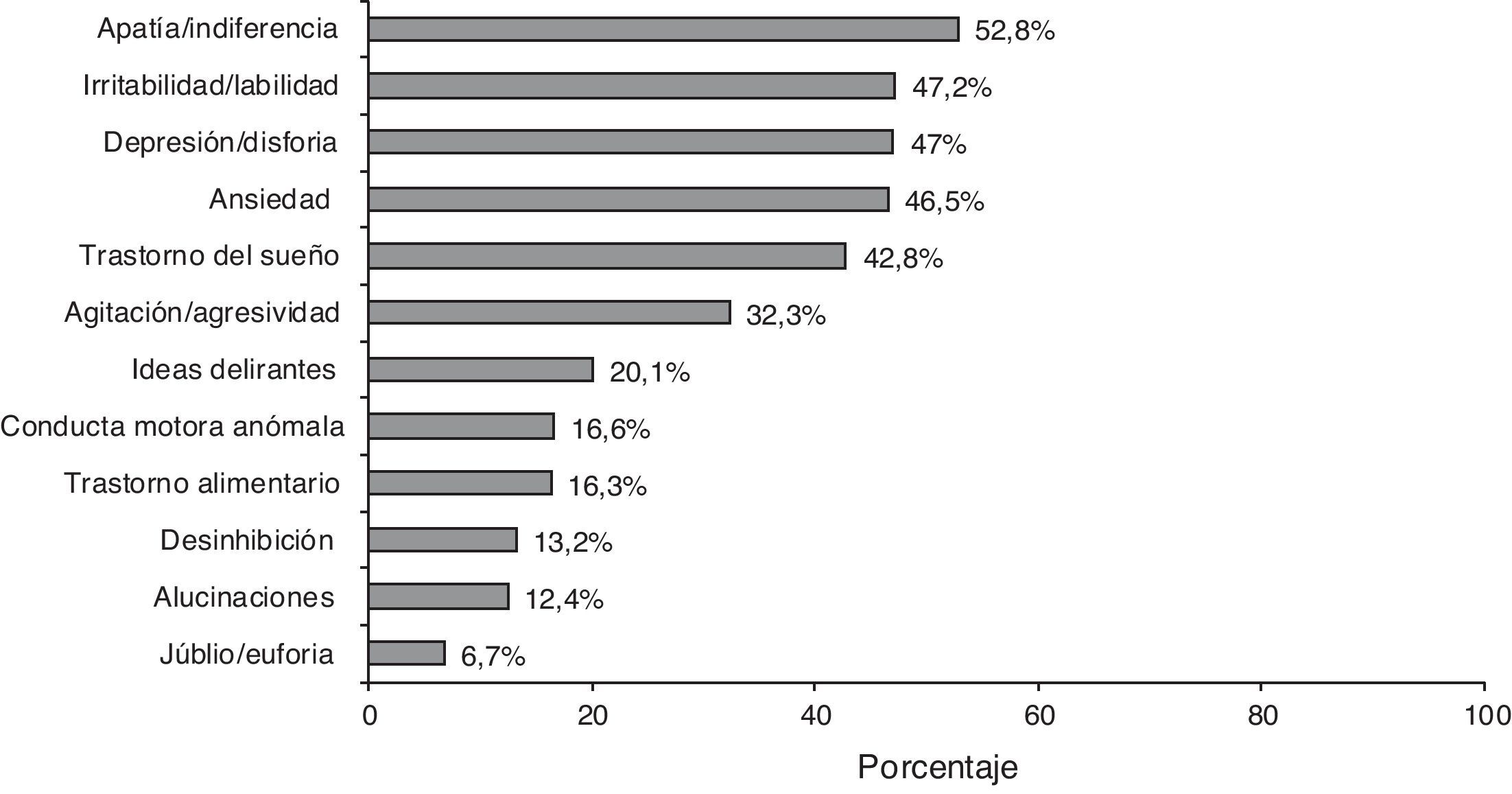
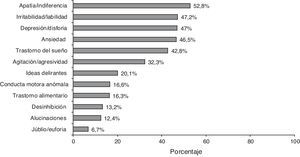
El 87,5% de los casos presentaban algún síntoma neuropsiquiátrico según la descripción del NPI; la frecuencia de cada síntoma se representa en la figura 2. La media de la puntuación total de la escala NPI fue de 12,3±13,2, mostrando de este modo gran dispersión (IC 95%:11,6-13,0).
El grado de demencia valorado según la escala CDR mostró: demencia posible en el 18%, demencia leve en el 52%, demencia moderada en el 25% y demencia severa en el 4% de los pacientes.
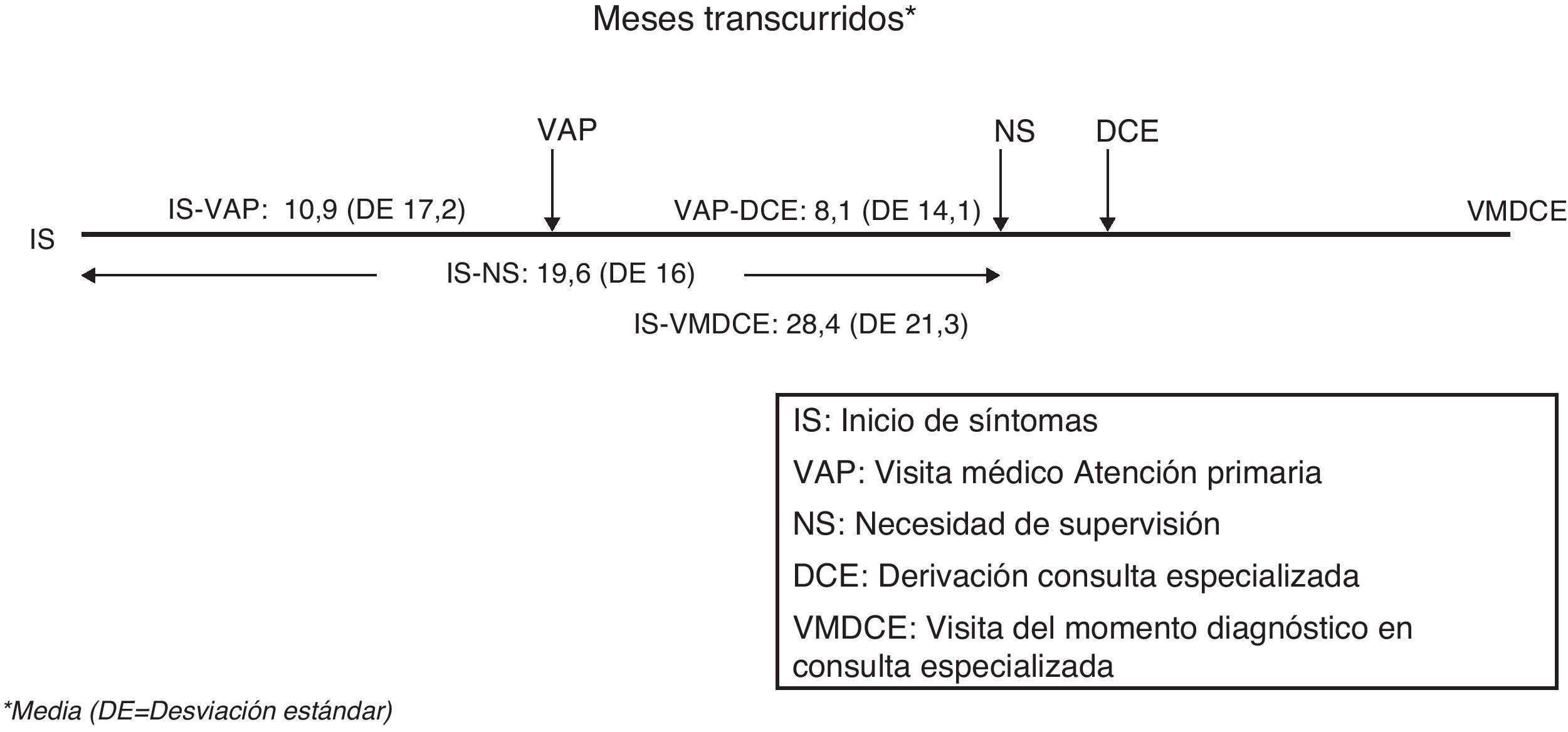
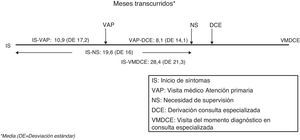
El tiempo medio entre los primeros síntomas y la primera consulta en Atención Primaria (inicio síntomas-visita Atención Primaria) se estimó en 10,9±17,2 meses (IC 95%:9,9-11,8). El tiempo medio entre la primera consulta en Atención Primaria y la derivación desde esa instancia a Atención Especializada (visita Atención Primaria-derivación Consulta Especializada) fue de 8,1±14,1 meses (IC 95%:7,3-8,8). El tiempo entre los síntomas iniciales y el momento del diagnóstico (inicio síntomas-visita momento diagnóstico en Consulta Especializada), que no necesariamente coincide con el de primera visita en Atención Especializada, fue de 28,4±21,3 meses. El tiempo de evolución hasta la necesidad de supervisión (inicio síntomas-necesidad supervisión) fue de 19,6±16 meses (IC 95%:18,8-20,4). Todos estos tiempos se representan en la figura 3. Se constata una gran dispersión de los tiempos asistenciales expresada en sus desviaciones estándar tanto a nivel inter como intraautonómico (tabla 2). Los tiempos asistenciales se obtienen a partir de los datos del protocolo de estudio: fechas de visita de inclusión, de la primera consulta con el médico de cabecera, de la derivación a la Consulta Especializada y de la estimación por historia de la duración de los síntomas.
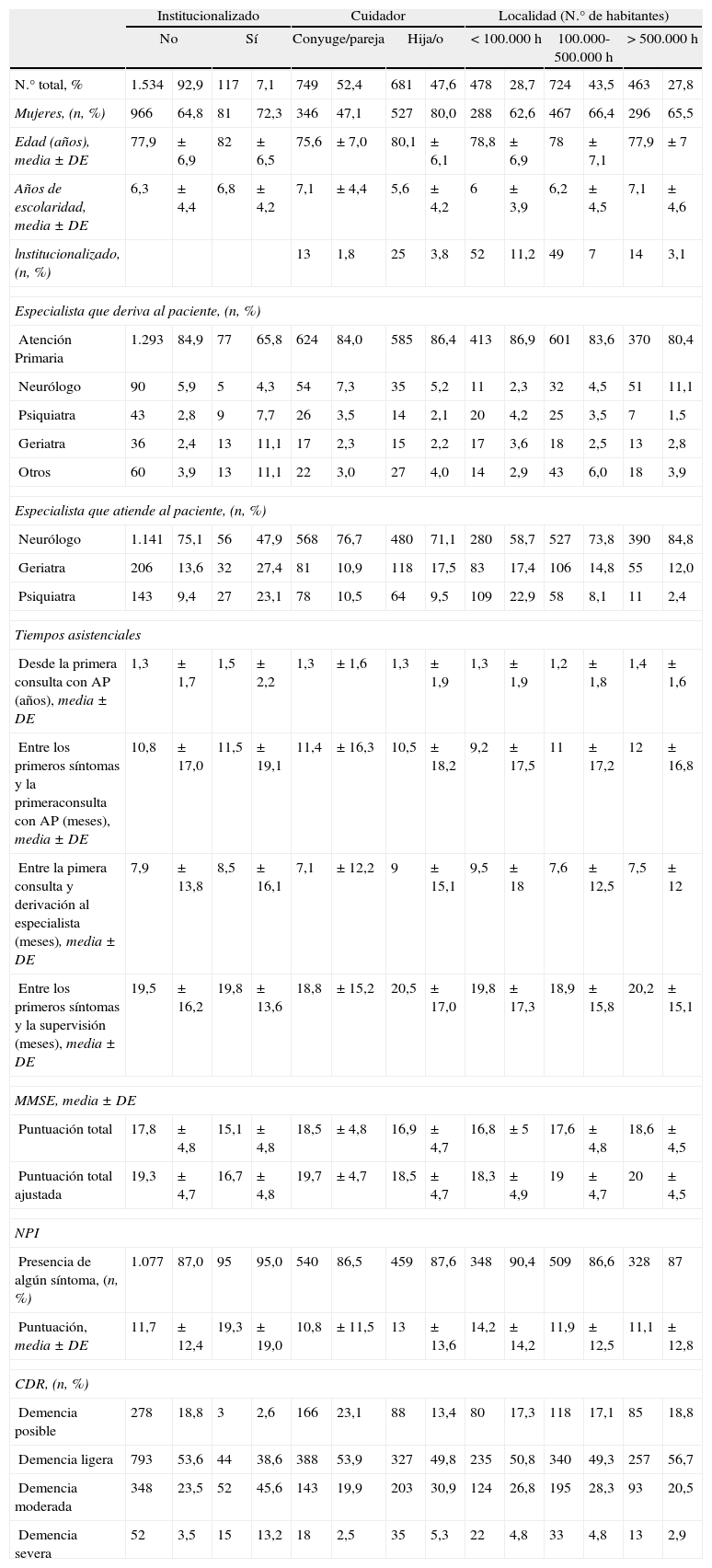
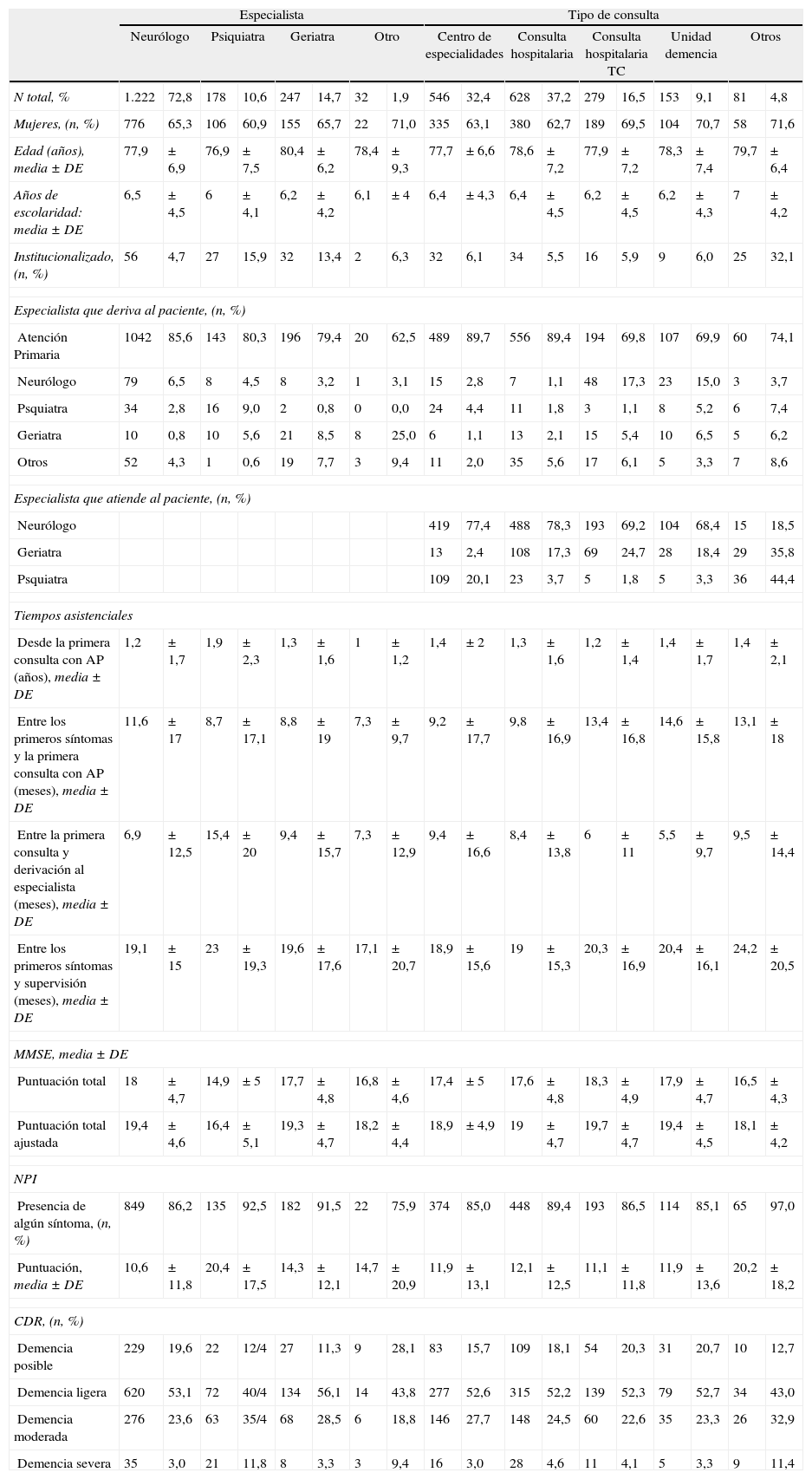
Análisis secundariosLos resultados de las comparaciones de las características generales de los pacientes y su estado en el momento del diagnóstico, en base a determinadas variables, se presentan en las tablas 3 y 4. En la tabla 3 se presentan las comparaciones en función de las características sociales, como el hecho de la institucionalización, la relación con el cuidador y el tamaño de la localidad en que ha sido atendido. En la tabla 4 se presentan las comparaciones de tipo asistencial, en función del especialista que ha atendido el caso y el tipo de consulta en el que se ha realizado la asistencia.
Comparación entre subgrupos según las características sociales
| Institucionalizado | Cuidador | Localidad (N.° de habitantes) | ||||||||||||
| No | Sí | Conyuge/pareja | Hija/o | <100.000h | 100.000-500.000h | >500.000h | ||||||||
| N.° total, % | 1.534 | 92,9 | 117 | 7,1 | 749 | 52,4 | 681 | 47,6 | 478 | 28,7 | 724 | 43,5 | 463 | 27,8 |
| Mujeres, (n, %) | 966 | 64,8 | 81 | 72,3 | 346 | 47,1 | 527 | 80,0 | 288 | 62,6 | 467 | 66,4 | 296 | 65,5 |
| Edad (años), media±DE | 77,9 | ±6,9 | 82 | ±6,5 | 75,6 | ±7,0 | 80,1 | ±6,1 | 78,8 | ±6,9 | 78 | ±7,1 | 77,9 | ±7 |
| Años de escolaridad, media±DE | 6,3 | ±4,4 | 6,8 | ±4,2 | 7,1 | ±4,4 | 5,6 | ±4,2 | 6 | ±3,9 | 6,2 | ±4,5 | 7,1 | ±4,6 |
| lnstitucionalizado, (n, %) | 13 | 1,8 | 25 | 3,8 | 52 | 11,2 | 49 | 7 | 14 | 3,1 | ||||
| Especialista que deriva al paciente, (n, %) | ||||||||||||||
| Atención Primaria | 1.293 | 84,9 | 77 | 65,8 | 624 | 84,0 | 585 | 86,4 | 413 | 86,9 | 601 | 83,6 | 370 | 80,4 |
| Neurólogo | 90 | 5,9 | 5 | 4,3 | 54 | 7,3 | 35 | 5,2 | 11 | 2,3 | 32 | 4,5 | 51 | 11,1 |
| Psiquiatra | 43 | 2,8 | 9 | 7,7 | 26 | 3,5 | 14 | 2,1 | 20 | 4,2 | 25 | 3,5 | 7 | 1,5 |
| Geriatra | 36 | 2,4 | 13 | 11,1 | 17 | 2,3 | 15 | 2,2 | 17 | 3,6 | 18 | 2,5 | 13 | 2,8 |
| Otros | 60 | 3,9 | 13 | 11,1 | 22 | 3,0 | 27 | 4,0 | 14 | 2,9 | 43 | 6,0 | 18 | 3,9 |
| Especialista que atiende al paciente, (n, %) | ||||||||||||||
| Neurólogo | 1.141 | 75,1 | 56 | 47,9 | 568 | 76,7 | 480 | 71,1 | 280 | 58,7 | 527 | 73,8 | 390 | 84,8 |
| Geriatra | 206 | 13,6 | 32 | 27,4 | 81 | 10,9 | 118 | 17,5 | 83 | 17,4 | 106 | 14,8 | 55 | 12,0 |
| Psiquiatra | 143 | 9,4 | 27 | 23,1 | 78 | 10,5 | 64 | 9,5 | 109 | 22,9 | 58 | 8,1 | 11 | 2,4 |
| Tiempos asistenciales | ||||||||||||||
| Desde la primera consulta con AP (años), media±DE | 1,3 | ±1,7 | 1,5 | ±2,2 | 1,3 | ±1,6 | 1,3 | ±1,9 | 1,3 | ±1,9 | 1,2 | ±1,8 | 1,4 | ±1,6 |
| Entre los primeros síntomas y la primeraconsulta con AP (meses), media±DE | 10,8 | ±17,0 | 11,5 | ±19,1 | 11,4 | ±16,3 | 10,5 | ±18,2 | 9,2 | ±17,5 | 11 | ±17,2 | 12 | ±16,8 |
| Entre la pimera consulta y derivación al especialista (meses), media±DE | 7,9 | ±13,8 | 8,5 | ±16,1 | 7,1 | ±12,2 | 9 | ±15,1 | 9,5 | ±18 | 7,6 | ±12,5 | 7,5 | ±12 |
| Entre los primeros síntomas y la supervisión (meses), media±DE | 19,5 | ±16,2 | 19,8 | ±13,6 | 18,8 | ±15,2 | 20,5 | ±17,0 | 19,8 | ±17,3 | 18,9 | ±15,8 | 20,2 | ±15,1 |
| MMSE, media±DE | ||||||||||||||
| Puntuación total | 17,8 | ±4,8 | 15,1 | ±4,8 | 18,5 | ±4,8 | 16,9 | ±4,7 | 16,8 | ±5 | 17,6 | ±4,8 | 18,6 | ±4,5 |
| Puntuación total ajustada | 19,3 | ±4,7 | 16,7 | ±4,8 | 19,7 | ±4,7 | 18,5 | ±4,7 | 18,3 | ±4,9 | 19 | ±4,7 | 20 | ±4,5 |
| NPI | ||||||||||||||
| Presencia de algún síntoma, (n, %) | 1.077 | 87,0 | 95 | 95,0 | 540 | 86,5 | 459 | 87,6 | 348 | 90,4 | 509 | 86,6 | 328 | 87 |
| Puntuación, media±DE | 11,7 | ±12,4 | 19,3 | ±19,0 | 10,8 | ±11,5 | 13 | ±13,6 | 14,2 | ±14,2 | 11,9 | ±12,5 | 11,1 | ±12,8 |
| CDR, (n, %) | ||||||||||||||
| Demencia posible | 278 | 18,8 | 3 | 2,6 | 166 | 23,1 | 88 | 13,4 | 80 | 17,3 | 118 | 17,1 | 85 | 18,8 |
| Demencia ligera | 793 | 53,6 | 44 | 38,6 | 388 | 53,9 | 327 | 49,8 | 235 | 50,8 | 340 | 49,3 | 257 | 56,7 |
| Demencia moderada | 348 | 23,5 | 52 | 45,6 | 143 | 19,9 | 203 | 30,9 | 124 | 26,8 | 195 | 28,3 | 93 | 20,5 |
| Demencia severa | 52 | 3,5 | 15 | 13,2 | 18 | 2,5 | 35 | 5,3 | 22 | 4,8 | 33 | 4,8 | 13 | 2,9 |
Pruebas de significación estadística utilizadas: para la comparación entre 2 grupos se utilizó la prueba t de Student para las muestras independientes y para las variables cuantitativas, y la prueba exacta de Fisher para las variables categóricas; para la comparación entre más de 2 grupos se utilizó el análisis de la varianza para variables cuantitativas y la prueba exacta de Fisher, Chi-cuadrado o prueba de Mantel-Haenszel, según proceda para las variables categóricas. Los resultados estadísticamente significativos (p<0,05) se señalan en negrita.
AP=Atención Primaria; CDR=Clinical Dementia Rating; DE=desviación estándar; MMSE=Minimental State Examination; NPI=Neuropsychiatric Inventory.
Comparación entre subgrupos según el tipo asistencial
| Especialista | Tipo de consulta | |||||||||||||||||
| Neurólogo | Psiquiatra | Geriatra | Otro | Centro de especialidades | Consulta hospitalaria | Consulta hospitalaria TC | Unidad demencia | Otros | ||||||||||
| N total, % | 1.222 | 72,8 | 178 | 10,6 | 247 | 14,7 | 32 | 1,9 | 546 | 32,4 | 628 | 37,2 | 279 | 16,5 | 153 | 9,1 | 81 | 4,8 |
| Mujeres, (n, %) | 776 | 65,3 | 106 | 60,9 | 155 | 65,7 | 22 | 71,0 | 335 | 63,1 | 380 | 62,7 | 189 | 69,5 | 104 | 70,7 | 58 | 71,6 |
| Edad (años), media±DE | 77,9 | ±6,9 | 76,9 | ±7,5 | 80,4 | ±6,2 | 78,4 | ±9,3 | 77,7 | ±6,6 | 78,6 | ±7,2 | 77,9 | ±7,2 | 78,3 | ±7,4 | 79,7 | ±6,4 |
| Años de escolaridad: media±DE | 6,5 | ±4,5 | 6 | ±4,1 | 6,2 | ±4,2 | 6,1 | ±4 | 6,4 | ±4,3 | 6,4 | ±4,5 | 6,2 | ±4,5 | 6,2 | ±4,3 | 7 | ±4,2 |
| Institucionalizado, (n, %) | 56 | 4,7 | 27 | 15,9 | 32 | 13,4 | 2 | 6,3 | 32 | 6,1 | 34 | 5,5 | 16 | 5,9 | 9 | 6,0 | 25 | 32,1 |
| Especialista que deriva al paciente, (n, %) | ||||||||||||||||||
| Atención Primaria | 1042 | 85,6 | 143 | 80,3 | 196 | 79,4 | 20 | 62,5 | 489 | 89,7 | 556 | 89,4 | 194 | 69,8 | 107 | 69,9 | 60 | 74,1 |
| Neurólogo | 79 | 6,5 | 8 | 4,5 | 8 | 3,2 | 1 | 3,1 | 15 | 2,8 | 7 | 1,1 | 48 | 17,3 | 23 | 15,0 | 3 | 3,7 |
| Psquiatra | 34 | 2,8 | 16 | 9,0 | 2 | 0,8 | 0 | 0,0 | 24 | 4,4 | 11 | 1,8 | 3 | 1,1 | 8 | 5,2 | 6 | 7,4 |
| Geriatra | 10 | 0,8 | 10 | 5,6 | 21 | 8,5 | 8 | 25,0 | 6 | 1,1 | 13 | 2,1 | 15 | 5,4 | 10 | 6,5 | 5 | 6,2 |
| Otros | 52 | 4,3 | 1 | 0,6 | 19 | 7,7 | 3 | 9,4 | 11 | 2,0 | 35 | 5,6 | 17 | 6,1 | 5 | 3,3 | 7 | 8,6 |
| Especialista que atiende al paciente, (n, %) | ||||||||||||||||||
| Neurólogo | 419 | 77,4 | 488 | 78,3 | 193 | 69,2 | 104 | 68,4 | 15 | 18,5 | ||||||||
| Geriatra | 13 | 2,4 | 108 | 17,3 | 69 | 24,7 | 28 | 18,4 | 29 | 35,8 | ||||||||
| Psquiatra | 109 | 20,1 | 23 | 3,7 | 5 | 1,8 | 5 | 3,3 | 36 | 44,4 | ||||||||
| Tiempos asistenciales | ||||||||||||||||||
| Desde la primera consulta con AP (años), media±DE | 1,2 | ±1,7 | 1,9 | ±2,3 | 1,3 | ±1,6 | 1 | ±1,2 | 1,4 | ±2 | 1,3 | ±1,6 | 1,2 | ±1,4 | 1,4 | ±1,7 | 1,4 | ±2,1 |
| Entre los primeros síntomas y la primera consulta con AP (meses), media±DE | 11,6 | ±17 | 8,7 | ±17,1 | 8,8 | ±19 | 7,3 | ±9,7 | 9,2 | ±17,7 | 9,8 | ±16,9 | 13,4 | ±16,8 | 14,6 | ±15,8 | 13,1 | ±18 |
| Entre la primera consulta y derivación al especialista (meses), media±DE | 6,9 | ±12,5 | 15,4 | ±20 | 9,4 | ±15,7 | 7,3 | ±12,9 | 9,4 | ±16,6 | 8,4 | ±13,8 | 6 | ±11 | 5,5 | ±9,7 | 9,5 | ±14,4 |
| Entre los primeros síntomas y supervisión (meses), media±DE | 19,1 | ±15 | 23 | ±19,3 | 19,6 | ±17,6 | 17,1 | ±20,7 | 18,9 | ±15,6 | 19 | ±15,3 | 20,3 | ±16,9 | 20,4 | ±16,1 | 24,2 | ±20,5 |
| MMSE, media±DE | ||||||||||||||||||
| Puntuación total | 18 | ±4,7 | 14,9 | ±5 | 17,7 | ±4,8 | 16,8 | ±4,6 | 17,4 | ±5 | 17,6 | ±4,8 | 18,3 | ±4,9 | 17,9 | ±4,7 | 16,5 | ±4,3 |
| Puntuación total ajustada | 19,4 | ±4,6 | 16,4 | ±5,1 | 19,3 | ±4,7 | 18,2 | ±4,4 | 18,9 | ±4,9 | 19 | ±4,7 | 19,7 | ±4,7 | 19,4 | ±4,5 | 18,1 | ±4,2 |
| NPI | ||||||||||||||||||
| Presencia de algún síntoma, (n, %) | 849 | 86,2 | 135 | 92,5 | 182 | 91,5 | 22 | 75,9 | 374 | 85,0 | 448 | 89,4 | 193 | 86,5 | 114 | 85,1 | 65 | 97,0 |
| Puntuación, media±DE | 10,6 | ±11,8 | 20,4 | ±17,5 | 14,3 | ±12,1 | 14,7 | ±20,9 | 11,9 | ±13,1 | 12,1 | ±12,5 | 11,1 | ±11,8 | 11,9 | ±13,6 | 20,2 | ±18,2 |
| CDR, (n, %) | ||||||||||||||||||
| Demencia posible | 229 | 19,6 | 22 | 12/4 | 27 | 11,3 | 9 | 28,1 | 83 | 15,7 | 109 | 18,1 | 54 | 20,3 | 31 | 20,7 | 10 | 12,7 |
| Demencia ligera | 620 | 53,1 | 72 | 40/4 | 134 | 56,1 | 14 | 43,8 | 277 | 52,6 | 315 | 52,2 | 139 | 52,3 | 79 | 52,7 | 34 | 43,0 |
| Demencia moderada | 276 | 23,6 | 63 | 35/4 | 68 | 28,5 | 6 | 18,8 | 146 | 27,7 | 148 | 24,5 | 60 | 22,6 | 35 | 23,3 | 26 | 32,9 |
| Demencia severa | 35 | 3,0 | 21 | 11,8 | 8 | 3,3 | 3 | 9,4 | 16 | 3,0 | 28 | 4,6 | 11 | 4,1 | 5 | 3,3 | 9 | 11,4 |
Pruebas de significación estadística utilizadas: para la comparación entre 2 grupos se utilizó la prueba t de Student para las muestras independientes y para las variables cuantitativas, y la prueba exacta de Fisher para las variables categóricas; para la comparación entre más de 2 grupos se utilizó el análisis de la varianza para variables cuantitativas y la prueba exacta de Fisher, Chi-cuadrado o prueba de Mantel-Haenszel, según proceda para las variables categóricas. Los resultados estadísticamente significativos (p<0,05) se señalan en negrita.
AP=Atención Primaria; CDR=Clinical Dementia Rating; DE=desviación estándar; MMSE=Minimental State Examination; NPI=Neuropsychiatric Inventory.
Puede destacarse entre estos datos el hecho de que si los cuidadores son hijos en vez de cónyuges, el paciente tiende a ser mayor, más frecuentemente mujer, de menor tiempo de escolarización y con algo mayor afectación. En otros términos, también puede mencionarse que las edades medias son mayores en los pacientes institucionalizados y en los atendidos por geriatras, y que en las localidades más grandes es más frecuente que los pacientes sean atendidos por neurólogos y diagnosticados en estados no tan evolucionados (en base a las puntuaciones MMSE y NPI).
DiscusiónLos resultados del estudio EACE sugieren que la mayor parte de los pacientes con EA en nuestro entorno son diagnosticados en la consulta del especialista en un nivel evolutivo moderado, como muestran tanto la media de la puntuación bruta del MMSE de 17,6 como el hecho de que más del 70% de los casos tengan una puntuación del MMSE menor de 20 puntos. El diagnóstico precoz es posible, y de hecho se ha realizado en la población de nuestro estudio en un bajo porcentaje de casos en pacientes con MMSE de 24 o más; pero, desde luego, esta situación está lejos de ser la común. La mayoría de los casos están evolucionados, puesto que se diagnostican más en estadio moderado que en estadio leve, y un porcentaje apreciable en estadio grave, donde las posibilidades de influir en el curso de la enfermedad son mucho menores.
Con relación a los síntomas neuropsiquiátricos, el perfil global que encontramos es el esperable en la literatura y similar a la fase de estado de la EA. Este dato también confirma que los pacientes están relativamente evolucionados en el momento del diagnóstico, ya que en fases menos avanzadas estos síntomas son menos frecuentes22. Si nuestros pacientes, en general, acceden al tratamiento en estadios evolutivos moderados, resulta obvio que existe un importante margen de mejora en este aspecto para poder hacer accesible a los pacientes con EA el plan de tratamiento que puede proporcionarles algún grado de mejoría con el objeto de influir en el curso de la enfermedad a todos los niveles. Dados los estadios en los que se llega al diagnóstico, estamos perdiendo muchas oportunidades de tratamiento y dejando de aprovechar muchas opciones de mejorar el estado clínico de un gran número de pacientes. El diagnóstico en un momento evolutivo relativamente precoz es clave para permitir aprovechar estas opciones3,4,8,23–25. Parece superado ya el momento de la controversia respecto al diagnóstico precoz y la distinción entre EA y deterioro cognitivo leve26,27, de modo que muchos de los actuales esfuerzos de la investigación se dirigen a intentar conseguir el diagnóstico de certeza de EA en fases no excesivamente avanzadas del deterioro cognitivo11,13.
El tiempo transcurrido desde el inicio estimado de los síntomas y el diagnóstico en Asistencia Especializada supera los 2 años (28,4 meses de media). Aunque la cifra es similar a la obtenida en otros estudios28, probablemente sea una infraestimación, ya que ha sido ponderada retrospectivamente por los informadores en cada caso. Este tiempo total hasta el diagnóstico se compone de diversos tramos cuya duración puede ser debida fundamentalmente a distintos factores sobre los que podría influirse específicamente. Por ejemplo, el tiempo de casi 11 meses en promedio que transcurre entre los primeros síntomas y la primera consulta en Atención Primaria seguramente se debe en gran parte a un escaso reconocimiento y/o sensibilización de la relevancia de dichos síntomas por parte de los cuidadores y la población en general. Las campañas de divulgación podrían influir positivamente sobre estos aspectos. Por otro lado, los 8,1 meses de promedio que se tarda en remitir el caso desde el primer escalón de atención al especialista podrían reducirse mediante la implementación de mecanismos adecuados de identificación y derivación de los pacientes a la Consulta Especializada. No obstante, cabe destacar la gran dispersión de los tiempos asistenciales observados (tabla 2), lo que consideramos refleja la gran variabilidad asistencial a lo largo y ancho del territorio español. En el ámbito de la Asistencia Especializada todavía existiría un margen de mejora no cuantificado en nuestro estudio, en cuanto a la posible gestión de pruebas complementarias al diagnóstico, fundamentalmente analítica y neuroimagen, si es que estas no están disponibles en la primera visita en la Consulta Especializada.
Con respecto a los aspectos sociodemográficos merece la pena destacar el alto porcentaje de analfabetos funcionales, como en otras series del mismo entorno geográfico29. Por otro lado, no puede extrañar que los geriatras atiendan a pacientes con un promedio de edad mayor, ni que también sea mayor la edad en los pacientes institucionalizados que en los no institucionalizados. El hecho de que los pacientes institucionalizados tengan comparativamente menor representación entre los neurólogos que entre los geriatras y los psiquiatras probablemente obedezca a que las instituciones no suelen ser lugar de trabajo común para los neurólogos.
Tampoco resulta ilógico que los pacientes atendidos por psiquiatras tengan un mayor grado de síntomas neuropsiquiátricos, que tengan también un estado clínico algo peor, y que requieran más frecuentemente tratamiento con antipsicóticos (datos no mostrados), aunque su edad media no sea mayor. Las diferencias entre los grupos de pacientes atendidos por distintos especialistas no reflejan un manejo distinto, sino que se explican mejor por los sesgos lógicos de derivación en función de la especialidad, y el lugar donde se desempeña la actividad asistencial.
Existe una diferencia estadísticamente significativa entre el estado de los pacientes según el tamaño de población en el que son atendidos: a menor tamaño el deterioro es mayor tanto a nivel cognitivo (existe un MMSE inferior en promedio) como conductual (existe una mayor puntuación NPI). El hecho puede ser debido a un buen número de causas. Podría corresponderse literalmente con la variable demanda de atención, de modo que en los ambientes más urbanos habría mayor demanda, quizá por mayor sensibilización ante la enfermedad, mientras que en los ambientes menos urbanos podría ser menor la demanda en casos más leves que podrían ser más apoyados y menos exigidos por las circunstancias del entorno. También pueden influir fenómenos organizativos, por ejemplo una eventual diferencia entre la disponibilidad de especialistas en estos ámbitos, o simplemente a diferencias en los patrones de remisión y en la práctica clínica de los profesionales en distintos medios.
El estudio EACE tiene algunas limitaciones evidentes. En primer lugar, hay un sesgo de selección derivada del diseño del estudio. En función de dicho diseño, el estudio infraestima la atención dada en unidades y consultas específicas, dado que aportaban 4 casos como las consultas generales de especialidad; probablemente también infraestime la atención en grandes ciudades y la representación geográfica, siendo muy amplia, no es exactamente poblacional. No obstante, dicho sesgo puede ser menos importante de lo que puede parecer, ya que los resultados son bastante homogéneos cuando se consideran por distintos subgrupos, y que el global de la muestra mantiene un nivel de dispersión general similar al de dichos subgrupos. Por las características del estudio, los datos de cada apartado ocasionalmente resultan incompletos. Algunos datos de evolución son estimaciones retrospectivas, pero cuadran bien con otros que se pueden obtener objetivamente como son los momentos de derivación y la consulta con Atención Primaria por síntomas de la EA. El uso del MMSE como herramienta para clasificar la gravedad de la demencia podría sobreestimarla en un grupo de pacientes con bajo nivel de instrucción. No obstante, lo consideramos más fiable que el CDR, escala que en nuestro medio tiene un uso mucho menos extendido y con la que muchos investigadores, creemos, están poco entrenados y familiarizados. Las fortalezas del estudio también son evidentes: el número de casos incluido y la amplísima representación de profesionales junto con el hecho de que los propios resultados tienen aspectos comunes a otras series, que les dan una veracidad más que destacable, al margen del reconocimiento de sesgos previamente hecho.
Consideramos que del panorama asistencial descrito por nuestro estudio, aun con las limitaciones mencionadas, se hace evidente que estamos lejos de que el diagnóstico de la EA se realice en estadios leves de modo generalizado. Para conseguir un diagnóstico en las fases no tan evolucionadas, deben volver a considerarse campañas de divulgación, ahora con los conocimientos actuales, y redoblarse los esfuerzos para coordinar niveles asistenciales, elaborando circuitos de atención y protocolos de derivación que puedan ayudar en la consecución de este objetivo. Objetivo que por otra parte es en sí mismo un objetivo de toda la sociedad, no solo desde el punto de vista humanitario, sino también desde el económico, ya que el brindar atención, apoyo y tratamiento a este grupo de pacientes gravemente afectos por una enfermedad tratable, además de una exigencia social y ética, redunda en una reducción de los costes derivados de esta afección.
Conflicto de interesesEl estudio EACE fue financiado por Pfizer España. Margarita González-Adalid es empleada de Pfizer España, el resto de los autores no presentan conflictos de interés.
Los autores agradecen la participación a los 437 investigadores que participaron en el estudio EACE.
Los resultados de este estudio fueron presentados como comunicación oral en la lxii Reunión Anual de la Sociedad Española de Neurología celebrada en Barcelona en 2010.