El espectro de la neuromielitis óptica (ENMO) es una enfermedad inflamatoria del sistema nervioso central con patogenia inmunomediada que implica a astrocitos, linfocitos B, anticuerpos antiacuaporina 4 y mediadores inflamatorios como la interleucina 6. En su tratamiento se utilizan distintos inmunosupresores. Tocilizumab, un antagonista del receptor de interleucina 6, podría ser una opción de tratamiento.
MétodoEstudio observacional y retrospectivo en el que se analizan parámetros de efectividad: tasa anualizada de recaídas, discapacidad y evolución radiológica, y seguridad de tocilizumab en pacientes con ENMO (Wingerchuk 2015) y fracaso de inmunosupresores previos. El objetivo es evaluar la efectividad y seguridad de tocilizumab en la práctica clínica en pacientes con diagnóstico de ENMO sin respuesta terapéutica a otros inmunosupresores.
ResultadosSe analizan 5 pacientes (60% mujeres) con ENMO. Características basales (media±DE): edad al diagnóstico 50±5,3 años; tiempo de evolución desde el diagnóstico 4,5±3,6 años; inmunosupresores previos rituximab (5), ciclofosfamida (2) y azatioprina (1); tiempo de exposición a tocilizumab 2,3±1 años; tasa anual de recaídas un año pretocilizumab vs. un año postocilizumab 1,8±1,3 vs. 0,2±0,4 (p <0,05). Reducción de la tasa anual de recaídas al año de postocilizumab: 88,9%.
ConclusionesEn nuestra experiencia, tocilizumab es seguro y efectivo en pacientes con ENMO sin respuesta a otros inmunosupresores.
Neuromyelitis optica spectrum disorders (NMOSD) are immune-mediated inflammatory disorders of the central nervous system involving astrocytes, B lymphocytes, anti-aquaporin 4, and such inflammatory mediators as interleukin-6. Several immunosuppressants are used in their treatment. Tocilizumab, an interleukin-6 receptor antagonist, may be a treatment option.
MethodWe performed an observational, retrospective study analysing parameters of effectiveness (annualised relapse rate, disability, and radiological progression) and safety of tocilizumab in patients with NMOSD in whom previous immunosuppressant treatment had failed. We aimed to evaluate the effectiveness and safety of tocilizumab in clinical practice in patients with NMOSD not responding to other immunosuppressants.
ResultsFive patients with NMOSD were analysed. Sixty percent of patients were women; mean age at diagnosis was 50±5.3 years and mean progression time was 4.5±3.6 years. Previously administered immunosuppressants were rituximab (in all 5), cyclophosphamide (2), and azathioprine (1). Mean time of exposure to tocilizumab was 2.3±1 years. Mean annualised relapse rate was 1.8±1.3 in the year prior to the introduction of tocilizumab and 0.2±0.4 the year after (P <.05), representing a reduction of 88.9%.
ConclusionsIn our experience, tocilizumab is safe and effective in patients with NMOSD showing no response to other immunosuppressants.
El espectro de la neuromielitis óptica (ENMO) es una enfermedad inflamatoria del sistema nervioso central cuyo mecanismo patogénico principal está mediado por la acción de anticuerpos antiacuaporina 4 (IgG-AQP-4) que tienen como diana los canales de acuaporina 4 (AQP-4), que son los canales de agua más abundantes del sistema nervioso central. Clínicamente cursa en brotes recurrentes (solo el 5-10% son monofásicos) de neuritis óptica o mielitis transversa, aunque hoy en día no se considera solo restringida a los nervios ópticos y la médula espinal, como se describió inicialmente, sino que también puede afectar a troncoencéfalo y hemisferios cerebrales. Los brotes suelen ser graves y con elevado riesgo de secuelas incapacitantes1.
Los fármacos inmunosupresores son el principal tratamiento modificador del curso de la enfermedad (TMCE), pero no existen ensayos clínicos aleatorizados y controlados que proporcionen un nivel de evidencia concluyente para la utilización un fármaco concreto. Probablemente la baja incidencia de la enfermedad, junto con la existencia de opciones terapéuticas que han demostrado eficacia, disminuye todavía más el número de casos disponibles para un estudio controlado con placebo. En la práctica clínica el manejo terapéutico se sustenta en los resultados de pequeñas series con diferentes inmunosupresores. Aunque se han descrito respuestas óptimas a tratamientos como azatioprina, micofenolato mofetilo, metotrexato y mitoxantrona, los mejores resultados se han obtenido con rituximab (RTX). RTX es un anticuerpo monoclonal contra el antígeno CD20 de los linfocitos B, con el que se han descrito tasas de respuesta entre un 50 y un 93%2-8. El metaanálisis de Damto et al.9, que incluye 46 estudios (n=438) de pacientes con ENMO tratados con RTX, demuestra que RTX es un tratamiento efectivo en la reducción de recaídas, pero al no existir trabajos controlados con resultados sobre su seguridad, se recomienda utilizarlo con precaución como primera opción. A pesar de estos resultados, entre el 7 y el 47% de los pacientes en tratamiento con RTX, según las distintas series, pueden presentar recaídas, incluso con una depleción completa de células B2-8.
En diferentes estudios sobre la patogenia de la enfermedad se ha comprobado un aumento de los niveles de la interleucina proinflamatoria 6 (IL-6) en suero y líquido cefalorraquídeo significativamente mayor que en otras enfermedades neurológicas autoinmunes10,11, lo que podría implicar que la IL-6 tiene un papel patogénico relevante en ENMO. La IL-6 actuaría prolongando la supervivencia de determinadas subclases de células B y la secreción de anticuerpos anti-AQP-412-14.
Tocilizumab es un anticuerpo monoclonal IgG1 recombinante humanizado antirreceptor de IL-6 humana. Tiene indicación como tratamiento de la artritis reumatoide, con una posología recomendada de 8mg/kg de peso corporal vía intravenosa administrados una vez cada 4semanas y ha demostrado eficacia en otras enfermedades autoinmunes, como el lupus eritematoso sistémico15.
Algunos estudios con tocilizumab en ENMO han demostrado una disminución de los niveles intratecales de IL-6 en líquido cefalorraquídeo, que se correlacionan con disminución de la actividad de la enfermedad tanto clínica como radiológica16. Tocilizumab también podría tener efectos beneficiosos en algunos de los síntomas más frecuentes que presentan estos pacientes, como la fatiga y el dolor neuropático14.
Material y métodosEl objetivo del estudio es evaluar la eficacia y seguridad del tratamiento con tociluzumab en pacientes con ENMO que no han respondido previamente a otros TMCE.
Se trata de un estudio observacional en el que se realiza un análisis retrospectivo de la serie de pacientes diagnosticados de ENMO en 3centros hospitalarios de referencia para el tratamiento de enfermedades inflamatorias y desmielinizantes del sistema nervioso central. Los criterios de inclusión fueron: presentar un diagnóstico de ENMO según los criterios de Wingerchuk 201517, ineficacia de uno o varios TMCE utilizados previamente y haber utilizado tocilizumab a una dosis de 8mg/kg de peso cada 4 semanas tras la suspensión del último TMCE por falta de respuesta terapéutica.
Se consideró falta de respuesta al TMCE previo a la presencia de una recaída clínica (neuropatía óptica, mielitis o síndrome troncoencefálico) durante la exposición a este.
Se recogieron datos retrospectivos demográficos y del curso de la enfermedad de las historias clínicas desde el diagnóstico de ENMO hasta el momento de realización de este estudio, por lo que el tiempo de exposición a tocilizumab es diferente en cada paciente. Desde el diagnóstico, los pacientes fueron valorados de forma periódica por un neurólogo especialista en enfermedades desmielinizantes.
La variable principal fue la tasa anualizada de recaídas (TAR), calculada mediante la división del número total de recaídas en un periodo de tiempo medido en años y calculado antes y después de cada tratamiento. Las variables secundarias fueron el grado de discapacidad, la evolución radiológica en resonancia magnética (RM) y grado de tolerancia y seguridad.
Para cuantificar el grado de discapacidad se aplicó la escala EDDS (acrónimo del inglés Expanded Disability Status Scale) utilizada habitualmente en esclerosis múltiple. Se recogieron todos los datos de RM cerebral y medular disponibles durante el seguimiento clínico, analizando secuencias potenciadas en T2, FLAIR y T1 tras la administración de gadolinio. También se analizaron todos los resultados analíticos y clínicos en relación con la seguridad desde el inicio de tocilizumab.
La diferencia entre variables cuantitativas se estableció utilizando el test t de Student para muestras pareadas.
Los pacientes dieron su consentimiento informado por escrito y el fármaco se inició tras la aprobación, por el estamento regulador correspondiente, como tratamiento sin indicación en ficha técnica.
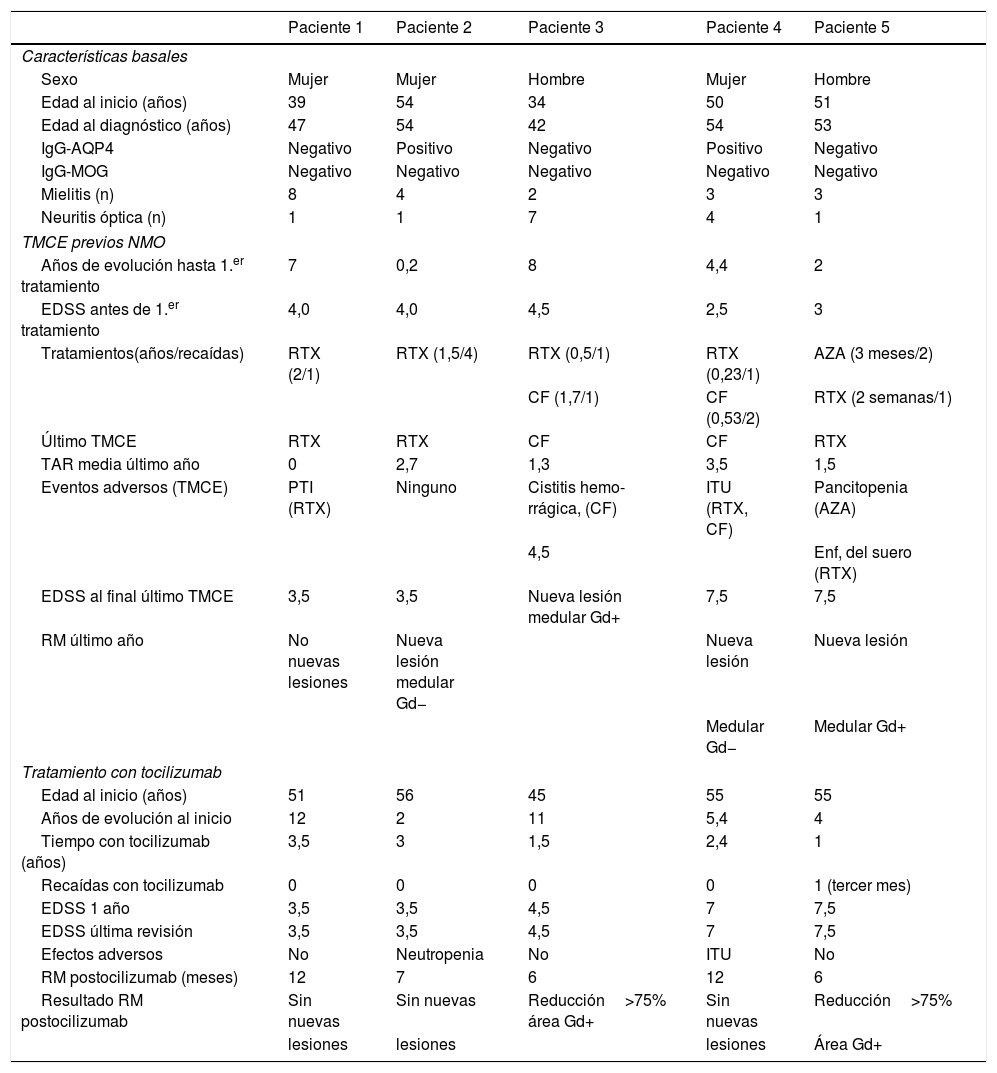
ResultadosCaracterísticas demográficas y clínicas basalesDe todos los pacientes con ENMO analizados, se incluyeron 5 que cumplían los criterios de selección del estudio. Tres pacientes (60%) eran mujeres. En el momento del diagnóstico la media (DE) de edad era de 50±5,3 años y todos habían presentado al menos un episodio de neuritis óptica y uno de mielitis transversa longitudinalmente extensa. Ningún paciente tenía comorbilidad con otras enfermedades autoinmunes. Dos de los pacientes presentaban IgG-AQP4 en suero y ninguno de ellos IgG-MOG. Para la cuantificación de IgG-AQP4 se utilizó la técnica de células transfectadas.
De forma análoga a otras enfermedades en las que se utiliza tocilizumab, se comprobó que en todos los pacientes se había descartado tuberculosis latente e infecciones activas antes del inicio del tratamiento. No se estableció un periodo de lavado concreto del tratamiento anterior (el mínimo tiempo transcurrido fue de 6 meses), pero los pacientes debían tener un recuento de leucocitos totales, linfocitos, neutrófilos y plaquetas dentro de los límites normales de forma previa a la administración del tratamiento.
Todos los pacientes habían recibido RTX como TMCE en algún momento de la evolución (dosis de 375mg/m2 semanal durante 4 semanas y al menos 1 gramo transcurrido un año). Dos de ellos también habían sido tratados con ciclofosfamida y uno con azatioprina. Uno de los pacientes había sido diagnosticado previamente de esclerosis múltiple, por lo que había recibido tratamiento secuencial con interferón β y natalizumab antes del diagnóstico de ENMO.
Pese a los TMCE administrados, la TAR media en el año previo fue de 1,8±1,3 y el grado de discapacidad medio (DE) de 5,3±2 puntos en la escala EDSS. Cuatro de los 5pacientes (80%) presentaban basalmente, antes de iniciar tocilizumab, una enfermedad muy activa en cuanto a número y gravedad de las recaídas (tabla 1).
Características demográficas y clínicas basales de los pacientes y respuesta a tocilizumab
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | |
|---|---|---|---|---|---|
| Características basales | |||||
| Sexo | Mujer | Mujer | Hombre | Mujer | Hombre |
| Edad al inicio (años) | 39 | 54 | 34 | 50 | 51 |
| Edad al diagnóstico (años) | 47 | 54 | 42 | 54 | 53 |
| IgG-AQP4 | Negativo | Positivo | Negativo | Positivo | Negativo |
| IgG-MOG | Negativo | Negativo | Negativo | Negativo | Negativo |
| Mielitis (n) | 8 | 4 | 2 | 3 | 3 |
| Neuritis óptica (n) | 1 | 1 | 7 | 4 | 1 |
| TMCE previos NMO | |||||
| Años de evolución hasta 1.er tratamiento | 7 | 0,2 | 8 | 4,4 | 2 |
| EDSS antes de 1.er tratamiento | 4,0 | 4,0 | 4,5 | 2,5 | 3 |
| Tratamientos(años/recaídas) | RTX (2/1) | RTX (1,5/4) | RTX (0,5/1) | RTX (0,23/1) | AZA (3 meses/2) |
| CF (1,7/1) | CF (0,53/2) | RTX (2 semanas/1) | |||
| Último TMCE | RTX | RTX | CF | CF | RTX |
| TAR media último año | 0 | 2,7 | 1,3 | 3,5 | 1,5 |
| Eventos adversos (TMCE) | PTI (RTX) | Ninguno | Cistitis hemo-rrágica, (CF) | ITU (RTX, CF) | Pancitopenia (AZA) |
| 4,5 | Enf, del suero (RTX) | ||||
| EDSS al final último TMCE | 3,5 | 3,5 | Nueva lesión medular Gd+ | 7,5 | 7,5 |
| RM último año | No nuevas lesiones | Nueva lesión medular Gd− | Nueva lesión | Nueva lesión | |
| Medular Gd− | Medular Gd+ | ||||
| Tratamiento con tocilizumab | |||||
| Edad al inicio (años) | 51 | 56 | 45 | 55 | 55 |
| Años de evolución al inicio | 12 | 2 | 11 | 5,4 | 4 |
| Tiempo con tocilizumab (años) | 3,5 | 3 | 1,5 | 2,4 | 1 |
| Recaídas con tocilizumab | 0 | 0 | 0 | 0 | 1 (tercer mes) |
| EDSS 1 año | 3,5 | 3,5 | 4,5 | 7 | 7,5 |
| EDSS última revisión | 3,5 | 3,5 | 4,5 | 7 | 7,5 |
| Efectos adversos | No | Neutropenia | No | ITU | No |
| RM postocilizumab (meses) | 12 | 7 | 6 | 12 | 6 |
| Resultado RM postocilizumab | Sin nuevas | Sin nuevas | Reducción>75% área Gd+ | Sin nuevas | Reducción>75% |
| lesiones | lesiones | lesiones | Área Gd+ | ||
AZA: azatioprina; CF: ciclofosfamida; DSS: Escala Ampliada del Grado de Discapacidad; Gd+: realce de la lesión con gadolinio; Gd−: sin realce de la lesión con gadolinio; IgG-AQP-4: anticuerpos antiacuaporina 4; ITU: infecciones del tracto urinario; PTT: púrpura trombocitopénica inmune; RTX: rituximab; RM: resonancia magnética; TAR: tasa anualizada de recaídas; TMCE: tratamiento modificador del curso de la enfermedad.
La duración media (DE) del tratamiento con tocilizumab fue de 2,3±1 años. Tras iniciar tocilizumab se observó una drástica reducción del número de recaídas; de hecho, 4 pacientes (80%) no presentaron recaídas durante el tiempo medio de seguimiento con tratamiento. La única recaída, a los 3 meses de iniciar tocilizumab (paciente 5, tabla 1), consistió en una mielitis cervical con afectación sensitiva en extremidades inferiores, que se resolvió completamente tras la administración de megadosis de esteroides. Aunque el periodo de seguimiento con tocilizumab fue variable, todos los pacientes completaron un año como mínimo (tabla 1). Durante el primer año con tocilizumab la TAR se redujo un 88,9% respecto al año previo (1,8±1,3 vs. 0,2±0,4; p <0,05) y no se apreciaron variaciones significativas en el grado de discapacidad cuantificado mediante la EDSS (5,3±2 vs. 5,2±1,9; p >0,05).
Se analizó la RM de seguimiento realizada al año iniciar tocilizumab (tiempo medio de realización desde el inicio: 8,6±3,1 meses) y se comparó con la última disponible durante el año anterior. No se apreciaron cambios en la RM cerebral. En la RM medular ningún paciente presentó nuevas lesiones en secuencia potenciada en T2. Los 2pacientes que presentaban una lesión activa realzada con gadolinio (Gd+) medular presentaron una reducción del área Gd+superior al 75% (tabla 1).
Los eventos adversos más relevantes y frecuentes fueron: un paciente con neutropenia leve asintomática durante 6 meses (con normalización posterior espontánea) y un paciente con persistencia de infecciones urinarias (que ya presentaba con TMCE previos).
Durante el seguimiento no se realizó determinación de IgG-AQP4 ni IL-6.
DiscusiónConsiderando que las recaídas en ENMO suelen ser incapacitantes y con alto riesgo de secuelas, la instauración de un TMCE inmunosupresor para evitar su recurrencia resulta de gran importancia. En la actualidad, la ausencia de ensayos clínicos aleatorizados para el tratamiento de ENMO hace que no se disponga del suficiente nivel de evidencia para recomendar un tratamiento inmunosupresor concreto, por lo que la experiencia clínica cobra una especial relevancia.
Hasta el momento, las series de pacientes descritas en la literatura muestran la efectividad de tocilizumab en tasa de recaídas, sin apreciarse efectos adversos relevantes, aunque en general se trata de la comunicación de casos aislados16 y series cortas de pacientes resistentes a otros tratamientos14,16,18-20.
Una de las series más larga, que incluye 7 pacientes14, proporciona una evidencia de clase IV de que el tratamiento con tocilizumab en ENMO reduce la TAR y mejora la puntuación EDSS. Aunque en la mayoría de los casos tocilizumab se utilizó en pacientes con enfermedad agresiva refractaria a tratamiento con anticuerpos anti-CD20, se plantea que debería considerarse como tratamiento en una etapa más temprana de ENMO para mejorar la calidad de vida de los pacientes. En la serie de Ringelstein et al.21, que incluye 8 pacientes, se demostró la efectividad y seguridad de tocilizumab particularmente en pacientes que no había respondido de forma adecuada a RTX. En ambas series14,21 se objetivó una mejoría de la actividad radiológica (Gd+), además de una disminución de la puntuación en la escala EDSS y de los títulos de anticuerpos (IgG-AQP-4) durante el tratamiento. En ambos estudios se observó una reducción del número e intensidad (leve-moderada) de recaídas, con recuperación sin secuelas. En ninguna de las series se comunicaron efectos adversos graves.
El resultado obtenido en nuestro estudio se asemeja a otras series en reducción de TAR, ausencia de progresión de la discapacidad, ausencia de nuevas lesiones en RM y mejoría radiológica en pacientes con lesiones Gd+.
Diferentes publicaciones señalan que la instauración de un tratamiento con indicación en esclerosis múltiple, como natalizumab, en pacientes con ENMO, no proporciona ningún beneficio en variables clínicas ni radiológicas e incluso puede producir un empeoramiento en estos parámetros, por lo que no se recomienda su utilización20,22,23. En nuestra serie, un paciente recibió tratamiento con interferón β y natalizumab de forma secuencial antes del diagnóstico de ENMO, y durante este periodo se produjo un elevado número de episodios de neuropatía óptica que determinaron un grave déficit de agudeza visual residual (paciente 3, tabla 1).
Se ha descrito que los pacientes con artritis reumatoide en tratamiento con tocilizumab tienen mayor riesgo de presentar infecciones, principalmente del tracto urinario y reactivación de tuberculosis latente24. En cambio, la proporción de infecciones graves en pacientes con artritis reumatoide en tratamiento durante 5 años es reducida, lo que demuestra un buen perfil de seguridad de tocilizumab a largo plazo25. Los pacientes incluidos en nuestra serie han presentado una buena tolerancia a tocilizumab y el número de efectos adversos de cualquier tipo ha sido escaso: destaca un caso de neutropenia transitoria que no conllevó ningún tipo de infección oportunista secundaria.
Los resultados de nuestro estudio, al igual que los de otras series previas, se caracterizan por una buena respuesta a tocilizumab en ENMO con evolución agresiva y refractaria, lo que nos lleva a preguntarnos sobre qué efecto tendría tocilizumab como TMCE de primera opción. Al finalizar la redacción de este artículo tenemos conocimiento de la existencia de un ensayo clínico fase 3 en marcha con la molécula SA237, un anticuerpo monoclonal antirreceptor de IL-6.
Las principales limitaciones del presente estudio son su carácter observacional y retrospectivo y la posible influencia de la reducción a la media en la mejoría de la TAR, aunque los buenos resultados radiológicos hacen pensar en una influencia menor en este sentido.
ConclusionesEn nuestra experiencia, el tratamiento con tocilizumab (8mg/ kg de peso vía intravenosa cada 4 semanas) en pacientes con ENMO activa, refractaria a tratamiento con otros inmunosupresores, parece seguro y efectivo, principalmente en pacientes que no responden a RTX. Se necesitan estudios controlados con un mayor número de pacientes y periodos de seguimiento más largos para comprobar la efectividad de tocilizumab en ENMO.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses en la realización de este estudio.