La trombectomía ha cambiado el manejo del ictus isquémico con oclusión de gran vaso1. La angiografía que forma parte del procedimiento precisa de agentes de contraste yodado (CY), si bien en aquellos pacientes en los que está contraindicado podría plantearse la utilización de gadolinio (GD). El uso angiográfico del GD se ha reportado ampliamente para los procedimientos intervencionistas y la arteriografía periférica2. Su manejo también se ha descrito en la angioplastia carotídea3,4, en el tratamiento de una fístula dural arteriovenosa5 e incluso para el estudio de pacientes con ictus isquémico y pruebas no invasivas no concluyentes6.
La angiografía cerebral con empleo de GD para la trombectomía en el ictus isquémico podría plantearse como una alternativa en enfermos con una reacción grave previa al CY. Su utilización con este fin, aunque conocida, apenas tiene mención en la bibliografía7. Recientemente hemos tratado a 2 pacientes mediante trombectomía con aspiración usando GD como agente de contraste.
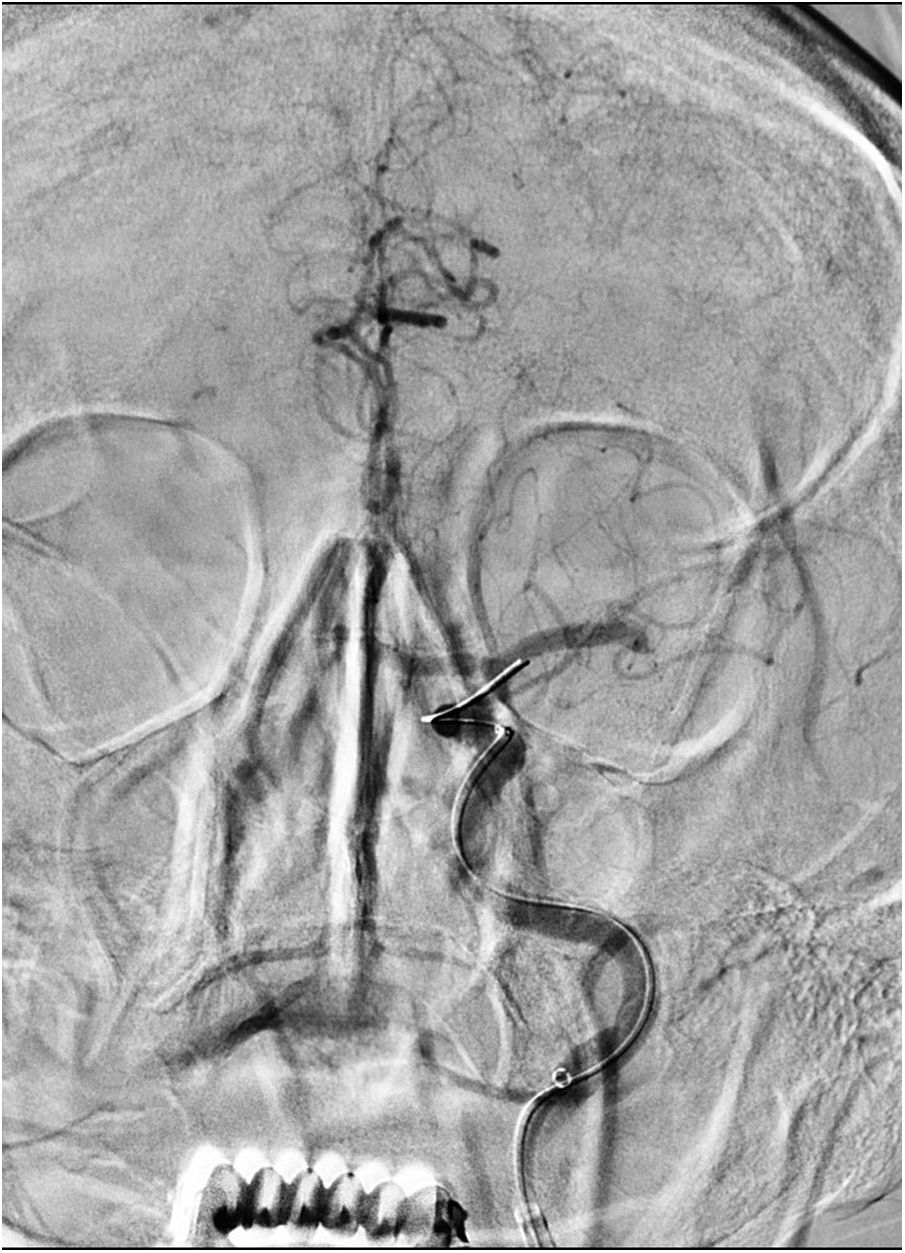
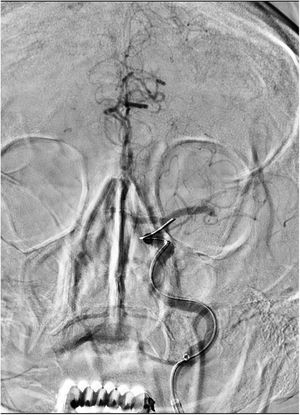
La primera paciente es una mujer de 69 años hipertensa y con un carcinoma papilar de tiroides operado hacía 20 años, que acude por un cuadro de inicio desconocido de alteración del lenguaje y debilidad en las extremidades derechas, vista bien 6horas antes. En la exploración neurológica presentaba una disfasia grave con hemiparesia faciobraquiocrural derecha, puntuando 17 en la escala NIHSS. En la TC se describió un ASPECTS de 8 con una ACM izquierda hiperdensa, sin realizarse angio-TC por el antecedente de una reacción anafiláctica al contraste durante el seguimiento de su enfermedad tiroidea. La analítica no presentaba alteraciones reseñables, con un aclaramiento de creatinina de 110ml/min. Con una alta sospecha de oclusión de gran vaso se decidió realizar el procedimiento angiográfico, utilizando gadobutrol (GDB) tras obtener el consentimiento informado para uso compasivo por parte de su familia. Se visualizó la oclusión de M1 distal izquierda (fig. 1). Con técnica de aspiración manual mediante catéter Sofia® 6F se consiguió TICI 3. Fueron necesarios 26ml de Gadovist® (GDB 604.72mg/ml) para realizar 3 series intracraneales en un equipo monoplano y sin requerir sedación. El NIHSS posprocedimiento fue 10 y 4 al alta. No hubo incidencias durante el ingreso, detectándose una fibrilación auricular no conocida y confirmándose una función renal normal. Se realizó una RM una semana después, objetivándose lesiones isquémicas subagudas puntiformes en núcleos caudado y lenticular, así como frontal subcortical izquierdo, sin signos de sangrado. Tras un año de seguimiento no se reportaron complicaciones, siendo el rankin modificado (mRS) de 0.
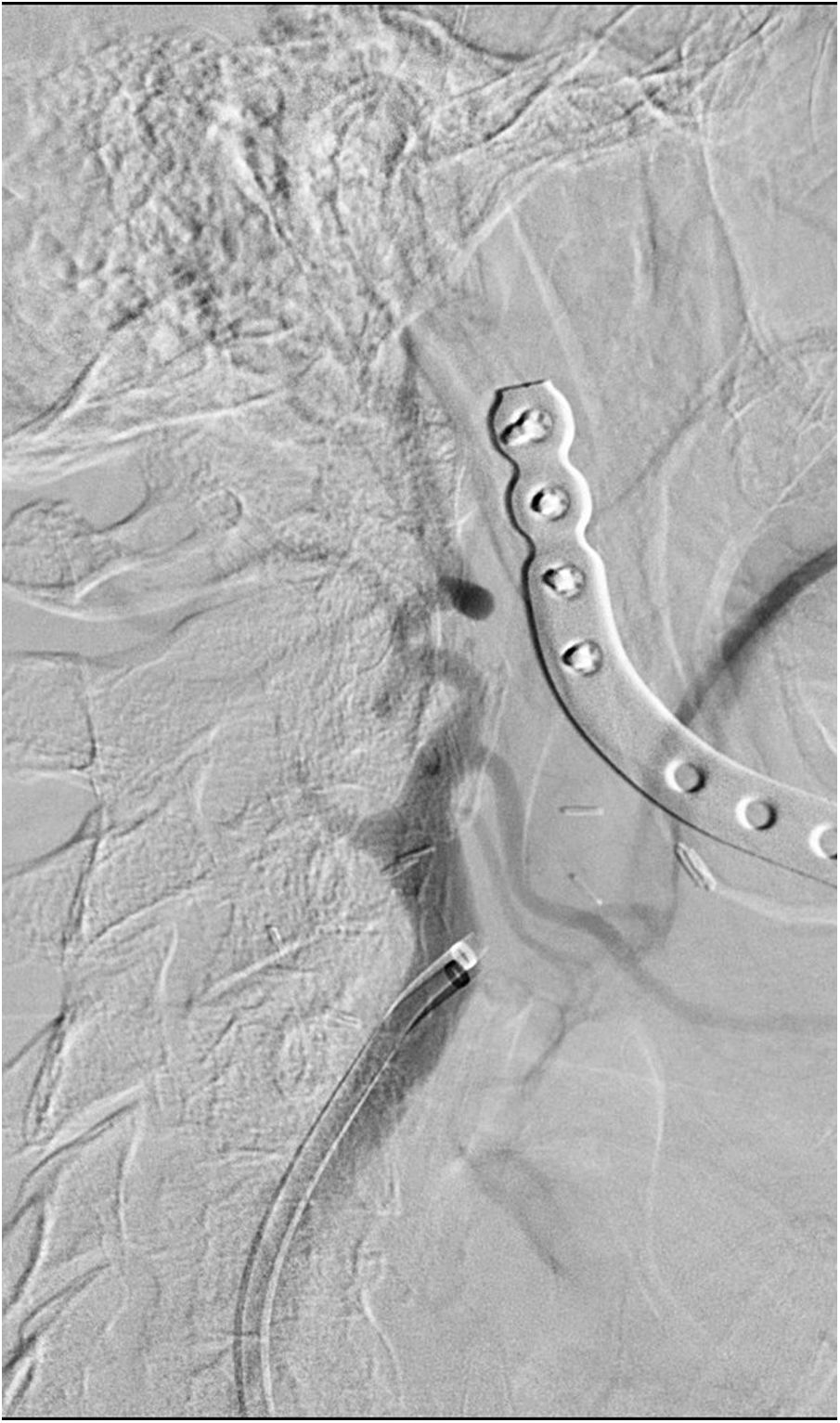
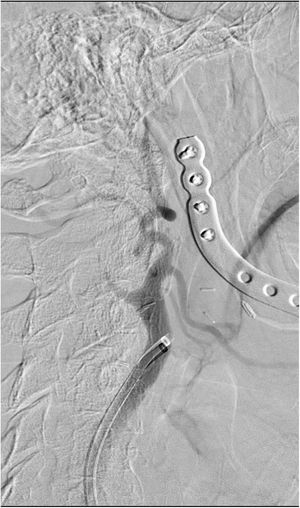
El segundo caso es el de un hombre de 68 años fumador, hipertenso y con antecedente de carcinoma epidermoide de cavidad oral intervenido e irradiado 7 años antes, que sufre un cuadro súbito de debilidad en las extremidades izquierdas, dificultad para articular el habla y anosognosia, siendo 18 el NIHSS. La TC mostró un ASPECTS 10 con una ACM derecha hiperdensa, sin poder completar el estudio vascular por una reacción grave al contraste durante su estudio oncológico. La analítica se encontraba dentro de los rangos de referencia, con un aclaramiento de creatinina de 90ml/min. La punción femoral se realizó 2horas y 15minutos tras el inicio de la clínica. Tras informar a la familia de su utilización como uso compasivo se recurrió al GDB como agente de contraste. En la fase diagnóstica se visualizó la oclusión de la carótida interna a nivel cervical (fig. 2). Se realizó una angioplastia con balón de 3×20mm sobre el segmento ocluido, para posteriormente navegar el catéter de aspiración Sofia® 6F hasta la carótida intracraneal terminal. Mediante un pase de aspiración manual se logró TICI 3. En las series cervicales se objetivó una estenosis subyacente sobre la que, tras nueva angioplastia con balón de 5×20mm, se colocó una endoprótesis Wallstent® de 9×40mm. Tras 20minutos de espera no aparecieron signos de agregación ni otras complicaciones. Se utilizaron en total 110ml de GDB sin diluir exclusivamente para las series de control postaspiración y de colocación de la endoprótesis, y con una dilución 50:50 de suero fisiológico para el resto de las series. Fueron necesarias 15 series que incluyeron el estudio de la carótida contralateral. Se administraron 900mg de acetilsalicilato de lisina intravenoso y no fue precisa la sedación. El enfermo presentó mejoría neurológica con un NIHSS 10 al alta. No hubo incidencias durante el ingreso, demostrándose la permeabilidad de la endoprótesis mediante Doppler, y confirmando la indemnidad de la función renal. Se llevó a cabo una RM 8 días más tarde, mostrando un infarto subagudo con afectación extensa temporolateral, insular y del núcleo lenticular derecho, con depósitos de hemosiderina en esta última localización. Tras un año de evolución presentó un mRS de 3, sin haber concurrido otros eventos reseñables.
Para ambos pacientes se obtuvo un consentimiento informado de su familia para la utilización de GD como uso compasivo.
En el ictus isquémico la necesidad de un tratamiento inmediato hace imposible la premedicación para el uso de agentes de CY, en caso de alergia grave y demostrada previamente. Male et al. han publicado un reporte similar al nuestro: la realización satisfactoria de una trombectomía mecánica para la oclusión de una M1 derecha usando GD intraarterial en un paciente con una reacción anafiláctica previa a CY7. Aunque esta alternativa sea conocida, no hemos encontrado otras publicaciones, por lo que parece oportuno acumular experiencias en este sentido.
El GD se utiliza ampliamente en estudio de RM para la caracterización de lesiones del sistema nervioso central, con especial significación en las enfermedades inflamatorias y tumorales. En la actualidad está cobrando relevancia la descripción de depósitos de GD en el SNC. A pesar de un significado clínico incierto, la posibilidad de acumulación cerebral de GD hace que la preferencia por tipos de GD molecularmente estables sea una opción razonable. Por ello, se ha optado globalmente por no-iónicos y macrocíclicos como el GDB, mientras que los lineales están siendo retirados en muchos países. Los depósitos de GD en núcleo dentado y globo pálido pueden estar asociados a la continua exposición a altas dosis de este contraste, y podría incluso tener implicación en la permeabilidad de la barrera hematoencefálica8,9. No se han descrito otras complicaciones específicas en su uso intraarterial.
En la ficha técnica del GDB se especifica la posibilidad de utilizar dosis de hasta 0,3ml/kg. En nuestro caso, y dadas las circunstancias, se utilizó 0,37ml/kg para la primera paciente (71kg de peso) y 0,77ml/kg para el segundo (85kg de peso). Esta diferencia se explica por la mayor dificultad que implica el tratamiento de las lesiones en tándem, siendo necesario la realización de series cervicales para la angioplastia, así como el estudio de la carótida contralateral para comprobar la situación del polígono de Willis. Por ello, se empleó una dilución 50:50 con suero fisiológico para el tratamiento del segundo paciente, con la intención de disminuir la cantidad total de GDB. En este caso, la calidad angiográfica de la imagen fue significativamente menor comparada con el estudio convencional. En cambio, la utilización de GDB sin diluir mostró imágenes en la práctica indistinguibles de las realizadas con CY. Esta última opción fue la elegida para las series de comprobación postrombectomía y de situación de la endoprótesis. No disponer de un equipo biplano en nuestro centro hizo necesario un mayor número de series y, por tanto, más cantidad de GDB.
La monitorización renal durante una semana no mostró alteraciones significativas. Después de un año desde ambos procedimientos ninguno de los pacientes desarrolló complicaciones atribuidas a dicho contraste, como la temida fibrosis sistémica nefrogénica10. Dada la excepcional utilización de GDB, consideramos realizar una RM durante la hospitalización sin encontrar ningún hallazgo inesperado.
Presentamos 2 trombectomías utilizando GDB como agente de contraste con éxito y sin complicaciones atribuibles a este uso. En el contexto de una contraindicación franca a CY, el GDB como uso compasivo puede suponer una alternativa.