Actualización de la guía para el tratamiento del infarto cerebral agudo de la Sociedad Española de Neurología basada en la revisión y análisis de la bibliografía existente sobre el tema. Se establecen recomendaciones en base al nivel de evidencia que ofrecen los estudios revisados.
DesarrolloLos sistemas de asistencia urgente extrahospitalaria se organizarán para asegurar la atención especializada de los pacientes y el ingreso en unidades de ictus (UI). Deben aplicarse cuidados generales para mantener la homeostasis (tratar la tensión arterial sistólica >185mmHg o diastólica>105mmHg, evitar hiperglucemia >155mg/dl y controlar la temperatura, tratando con antitérmicos cifras>37,5°C), y prevenir y tratar las complicaciones. La craniectomía descompresiva debe ser considerada en casos seleccionados de edema cerebral maligno. La trombólisis intravenosa con rtPA se administrará en las primeras 4,5 horas en pacientes sin contraindicación. La trombólisis intraarterial farmacológica puede indicarse en las primeras 6 horas de evolución y la trombectomía mecánica hasta las 8 horas. En el territorio posterior la ventana puede ampliarse hasta 12-24 horas. No hay evidencias para recomendar el uso rutinario de los fármacos denominados neuroprotectores. Se recomienda la anticoagulación en pacientes con trombosis de senos venosos. Se aconseja el inicio precoz de rehabilitación.
ConclusionesEl tratamiento del infarto cerebral se basa en la atención especializada en UI, la aplicación urgente de cuidados generales y el tratamiento trombolítico intravenoso en las primeras 4,5 horas. La recanalización intraarterial farmacológica o mecánica pueden ser útiles en casos seleccionados. Terapias de protección y reparación cerebral están en desarrollo.
Update of Acute Ischaemic Stroke Treatment Guidelines of the Spanish Neurological Society based on a critical review of the literature. Recommendations are made based on levels of evidence from published data and studies.
DevelopmentOrganized systems of care should be implemented to ensure access to the optimal management of all acute stroke patients in stroke units. Standard of care should include treatment of blood pressure (should only be treated if values are over 185/105mmHg), treatment of hyperglycaemia over 155mg/dl, and treatment of body temperature with antipyretic drugs if it rises above 37.5°C. Neurological and systemic complications must be prevented and promptly treated. Decompressive hemicraniectomy should be considered in cases of malignant cerebral oedema. Intravenous thrombolysis with rtPA should be administered within 4.5hours from symptom onset, except when there are contraindications. Intra-arterial pharmacological thrombolysis can be considered within 6hours, and mechanical thrombectomy within 8hours from onset, for anterior circulation strokes, while a wider window of opportunity up to 12-24hours is feasible for posterior strokes. There is not enough evidence to recommend routine use of the so called neuroprotective drugs. Anticoagulation should be administered to patients with cerebral vein thrombosis. Rehabilitation should be started as early as possible.
ConclusionTreatment of acute ischaemic stroke includes management of patients in stroke units. Systemic thrombolysis should be considered within 4.5hours from symptom onset. Intra-arterial approaches with a wider window of opportunity can be an option in certain cases. Protective and restorative therapies are being investigated
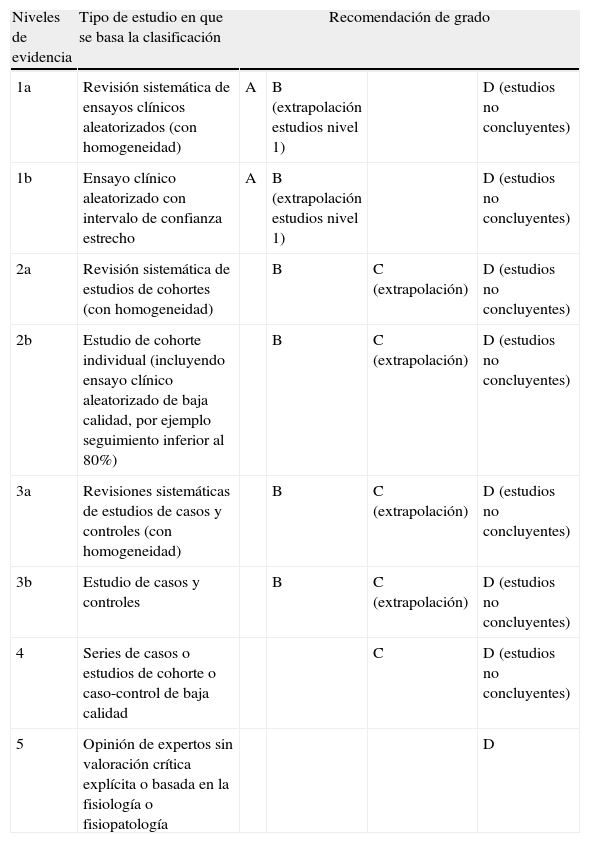
Desde la publicación de las últimas recomendaciones por parte del Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV)1 se han producido avances sustanciales en algunos aspectos del manejo agudo de los pacientes con isquemia cerebral. En este capítulo se actualizan las recomendaciones en lo que se refiere a la sistemática asistencial, los cuidados generales del paciente con ictus en fase aguda, así como al tratamiento específico de la isquemia y al tratamiento de la trombosis de senos venosos cerebrales. Los grados de recomendación y las evidencias científicas que los avalan se clasifican siguendo los criterios del Centro para la Medicina Basada en la Evidencia (Center for Evidence Based Medicine [CEBM]) (tabla 1)2.
Niveles de evidencia y grados de recomendación
| Niveles de evidencia | Tipo de estudio en que se basa la clasificación | Recomendación de grado | |||
| 1a | Revisión sistemática de ensayos clínicos aleatorizados (con homogeneidad) | A | B (extrapolación estudios nivel 1) | D (estudios no concluyentes) | |
| 1b | Ensayo clínico aleatorizado con intervalo de confianza estrecho | A | B (extrapolación estudios nivel 1) | D (estudios no concluyentes) | |
| 2a | Revisión sistemática de estudios de cohortes (con homogeneidad) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 2b | Estudio de cohorte individual (incluyendo ensayo clínico aleatorizado de baja calidad, por ejemplo seguimiento inferior al 80%) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 3a | Revisiones sistemáticas de estudios de casos y controles (con homogeneidad) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 3b | Estudio de casos y controles | B | C (extrapolación) | D (estudios no concluyentes) | |
| 4 | Series de casos o estudios de cohorte o caso-control de baja calidad | C | D (estudios no concluyentes) | ||
| 5 | Opinión de expertos sin valoración crítica explícita o basada en la fisiología o fisiopatología | D | |||
Fuente: Adaptación de Centre for Evidence Based Medicine (CEBM)2.
Recomendación de grado A: avalado por estudios de nivel 1.
Recomendación de grado B: avalado por estudios de nivel 2-3 (o extrapolación de estudios de nivel 1).
Recomendación de grado C: avalado por estudios de nivel 4 (o extrapolación de estudios de nivel 2-3).
Recomendación de grado D: avalado solo por estudios de nivel 5 o estudios no concluyentes de cualquier nivel.
El ictus es una urgencia neurológica debido a que los mecanismos lesionales que se desencadenan una vez ocurrida la isquemia o la hemorragia cerebral progresan muy rápidamente y es corto el período durante el que los tratamientos aplicados pueden tener eficacia. La disponibilidad de tratamientos específicos altamente eficaces, pero con un margen riesgo/beneficio estrecho, hace necesaria la adecuación de los sistemas de organización asistencial y de la dotación de los centros hospitalarios capacitados para atender pacientes con ictus.
La declaración de Helsinborg establece la recomendación de que todos los pacientes con ictus deben tener fácil acceso a las técnicas diagnósticas (tabla 2) y tratamientos con eficacia demostrada durante la fase aguda de la enfermedad y en concreto a la atención por neurólogos y a los cuidados aplicables en unidades de ictus (UI)3,4. Teniendo en cuenta el elevado coste de estos medios y la imposibilidad de su desarrollo en todos los centros hospitalarios en un sistema público con recursos limitados, es necesario organizar de forma adecuada los sistemas de atención para que cualquier paciente pueda acceder a los mismos, dependiendo de las características concretas de cada área sanitaria5. Este hecho y la estrecha ventana terapéutica de la mayor parte de los tratamientos disponibles, obliga a coordinar los diferentes niveles asistenciales para asegurar el mínimo tiempo de respuesta que permita la rápida evaluación y tratamiento del paciente en medio hospitalario por especialistas en neurología. En este sentido se ha mostrado útil la implantación del llamado «código ictus» que hace referencia a la actuación coordinada de los servicios de urgencias extrahospitalarios con los centros hospitalarios que atenderán al paciente. El procedimiento de actuación prehospitalaria mediante la aplicación de protocolos consensuados, reconocimiento de la urgencia y organización del transporte a centros capacitados (dotados con neurólogo de guardia, UI y posibilidad de aplicar tratamientos específicos como la trombólisis) con preaviso a los mismos, es lo que se denomina código ictus extrahospitalario6–8. Está demostrado que el código ictus extrahospitalario reduce los tiempos de atención y la demora en la aplicación del tratamiento. También las urgencias hospitalarias deben organizar la atención a estos pacientes con el objeto de reducir las demoras al máximo. Los protocolos de actuación dirigidos a este objetivo se denominan código ictus intrahospitalario y, de la misma manera, son muy eficaces9–12 (nivel de evidencia 2a).
Tratamiento trombolítico con rtPA
| Criterios de inclusión |
| Pacientes con ictus isquémico agudo de menos de 4,5 horas de evolución en los que no concurra alguno de los siguientes criterios de exclusión. |
| Criterios de exclusión |
| 1. Hemorragia intracraneal en TC. |
| 2. Evolución de los síntomas >4,5 horas o desconocimiento de la hora de inicio. |
| 3. Síntomas menores o en mejoría franca antes del inicio de la infusión. |
| 4. Ictus grave según criterios clínicos (NIHSS >25) o de neuroimagen. |
| 5. Síntomas sugestivos de hemorragia subaracnoidea aunque la TC sea normal. |
| 6. Tratamiento con heparina en las 48horas previas y TTPa elevado o con HBPM a dosis anticoagulantes en las 12horas previas. |
| 7. Ictus en los tres meses previos. |
| 8. Contaje de plaquetas por debajo de 100.000. |
| 9. Glucemia por debajo de 50mg/dl o por encima de 400mg/dl, que no se corrigen. |
| 10. Presión arterial sistólica>185mmHg, presión arterial diastólica>105mmHg o necesidad de medidas agresivas para bajar la tensión arterial a estos límites. |
| 11. Diatesis hemorrágica conocida. |
| 12. Tratamiento con anticoagulantes orales. Puede considerarse tratamiento con rtPA si INR ≤1,7. |
| 13. Sangrado grave reciente o manifiesto. |
| 14. Historia de hemorragia intracraneal. |
| 15. Antecedentes de HSA por rotura aneurismática. |
| 16. Historia de lesión del sistema nervioso central (aneurismas, neoplasias, cirugía intracraneal o espinal). |
| 17. Retinopatía hemorrágica (p. ej. retinopatía diabética). |
| 18. Antecedentes de masaje cardiaco, parto o punción en vaso sanguíneo no accesible en los 10 días previos. |
| 19. Endocarditis bacteriana, pericarditis. |
| 20. Pancreatitis aguda. |
| 21. Enfermedad ulcerativa gastrointestinal documentada en los tres meses previos. Varices esofágicas. Malformaciones vasculares intestinales conocidas. |
| 22. Neoplasia con aumento del riesgo de sangrado. |
| 23. Enfermedad hepática severa (insuficiencia hepática, cirrosis, hipertensión portal, hepatitis activa). |
| 24. Cirugía mayor o trauma significativo en los tres meses previos. |
| Pauta de administración de rtPA |
| – Se adminsitrarán 0,9mg/kg, siendo la dosis máxima 90mg; 10% de la dosis total se administra en bolo durante un minuto, el resto de la dosis se administra en infusión continua durante una hora. |
| Recomendaciones sobre manejo general y tratamientos concomitantes |
| – No se administrará heparina o anticoagulantes orales en las siguientes 24horas porque pueden aumentar el riesgo de hemorragia cerebral. |
| – El paciente debe ser monitorizado, preferiblemente en una unidad de ictus. |
| – Se realizará una exploración neurológica cada 15minutos durante la infusión, a las dos horas y a las 24horas y en cualquier momento en que haya un deterioro. |
| – La infusión debe ser interrumpida si hay sospecha clínica de sangrado (cefalea intensa, vómitos, disminución del nivel de conciencia, empeoramiento del déficit) y se realizará TC craneal urgente. |
| – Evitar en lo posible o retrasar al máximo la colocación de sondas urinarias o nasogástricas y punciones arteriales. |
| – En el caso de sobredosificación suele producirse consumo de fibrinógeno y otros factores de coagulación. Generalmente es suficiente con esperar la regeneración fisiológica de estos factores. Si se produce hemorragia seguir las recomendaciones para este caso. |
| – Si se produce una reacción anafiláctica suspender la infusión e iniciar las medidas oportunas. |
| – Se monitorizará la tensión arterial cada 15 minutos durante la infusión y la primera hora tras la misma, cada 30 minutos y durante las siguientes 6 horas y cada hora hasta completar un total de 24 horas. La frecuencia de los controles debe ser mayor si la TA>180/105. |
| Control de la tensión arterial |
| – La TA debe ser inferior a 185/105 antes de iniciar la infusión. |
| – En caso de tensión arterial>185/105 en dos determinaciones separadas 5-10min tratar según las recomedaciones vigentes (ver texto). Si con estas medidas no baja la TA, no debe administrarse trombólisis. Si se produce la elevación una vez iniciada la infusión y no se consigue bajar, se debe interrumpir el tratamiento. |
| Manejo de la hemorragia tras trombólisis |
| – Debe sospecharse hemorragia cerebral cuando aparece deterioro neurológico, cefalea intensa, vómitos o elevación aguda de la TA. |
| – Puede producirse hemorragia sistémica visible u oculta (alteración hemodinámica) |
| – Detener la infusión de rt-PA. |
| – Realizar TC craneal urgente (para la hemorragia cerebral). |
| – Determinar tiempos de coagulación, fibrinógeno, recuento plaquetario y realizar pruebas cruzadas. |
| – Administrar Haemocomplementan P® para reponer fibrinógeno: (1-2 viales de 1g). La dosis máxima es de 2-3g/día. |
| – Los crioprecipitados ricos en factor VIII y plaquetas, plasma fresco o sangre fresca no se recomiendan dado que no son útiles pues en estos casos no se consumen estos factores sino firbrinógeno. |
| – Los antifibrinolíticos (ácido tranexámico: Amchafibrin®) pueden producir fenómenos trombóticos. |
HBPM: heparinas de bajo peso molecular; HSA: hemorragia subaracnoidea; INR: International Normalized Ratio; NIHSS: Escala Neurológica del National Institute of Health; rtPA: activador tisular del plasminógeno recombinante; TA: tensión arterial; TC: tomografía computarizada; TTPa: tiempo de tromboplastina parcial activada.
Los sistemas de telemedicina que permitan la comunicación en directo entre centros hospitalarios sin disponibilidad continuada de neurólogo y hospitales de referencia de ictus, pueden ser útiles para acercar los recursos especializados cuando existen barreras geográficas que dificultan o retrasan el acceso directo a los mismos. De esta manera es posible incrementar el número de pacientes evaluados por neurólogos expertos y el número de tratamientos específicos aplicados, reduciendo la demora en la aplicación (nivel de evidencia 2a)13.
La mayoría de los pacientes con ictus precisan ingreso hospitalario, pudiendo exceptuarse pacientes con demencia previa, con una enfermedad terminal previamente diagnosticada o si expresan su deseo de no ser ingresados, siempre suponiendo que pueda asegurarse un cuidado adecuado fuera del hospital14.
El manejo debe hacerse en las UI puesto que está demostrado con una evidencia de nivel 1a, que ello mejora la evolución, en cuanto que reduce la morbimortalidad, disminuyendo la probabilidad de sufrir complicaciones, y también la probabilidad de dependencia con un balance coste/eficacia favorable15–19. Este beneficio se deriva de la monitorización neurológica no invasiva y de la aplicación de protocolos de cuidados generales dirigidos al mantenimiento de la homeostasis, además de la correcta aplicación de tratamientos específicos20–22. La atención en UI mejora también los indicadores de calidad asistencial (estancia media hospitalaria, readmisión hospitalaria, mortalidad y necesidad de institucionalización) y reduce de forma significativa los costes económicos en la atención al ictus19,23. La UI es una estructura geográficamente delimitada, dependiente del servicio de neurología, dedicada a la asistencia específica de los pacientes con ictus, coordinada y atendida por neurólogos expertos que cuentan con la colaboración de otras especialidades médicas relacionadas (cardiología, cirugía vascular, neurorradiología, neurocirugía, rehabilitación, urgencias, etc.), de fisioterapeutas para poder iniciar la fisioterapia precozmente y de trabajadores sociales. Dispone de monitorización continua no invasiva y de personal de enfermería entrenado, con una ratio enfermera/paciente recomendada de al menos 1/6. Cuenta con personal y servicios diagnósticos disponibles las 24 horas del día, con protocolos y vías clínicas para el manejo de los pacientes, basados en evidencias científicas. El número de camas en la UI debe ser planificado de acuerdo a las necesidades de la población atendida por el hospital, según el tamaño de ésta. Se recomienda una cama monitorizada en UI por cada 100.000 habitantes24,25.
Se consideran como criterios de ingreso: pacientes con ictus en fase aguda (<48horas de evolución), déficit neurológico leve o moderado, ataque isquémico transitorio, sin límite de edad. Son criterios de exclusión: daño cerebral irreversible, demencia o dependencia previa, enfermedades concurrentes graves o mortales y trauma craneal agudo.
- 1.
Se recomienda el ingreso en UI agudo con la dotación necesaria (nivel de evidencia 1a; recomendación de grado A).
- 2.
Se recomienda la atención urgente de todos los pacientes con ictus agudo en medio hospitalario (nivel de evidencia 3a; recomendación de grado B).
- 3.
Se recomienda reducir al mínimo la demora de la atención neurológica y establecer sistemas de coordinación de asistencia extra-intrahospitalaria específicos (nivel de evidencia 2a; recomendación de grado B).
- 4.
Los sistemas de telemedicina con asesoría remota de un neurólogo experto en directo pueden ser útiles para la evaluación del paciente y la decisión de tratamiento específico cuando no hay disponibilidad de asistencia in situ (nivel de evidencia 1b; recomendación de grado A).
El término hace referencia al mantenimiento dentro de los límites normales de: la presión arterial, la glucemia, la gasometría y la temperatura, así como a la prevención y detección precoz de las complicaciones. Esto mejora significativamente la mortalidad y morbilidad a medio plazo y por ello se deben monitorizar los signos vitales y el estado neurológico del paciente en las primeras 48 horas o mientras permanezca inestable21.
Mantener una adecuada función ventilatoria es una de las prioridades en el manejo general de estos pacientes. En la mayoría de los casos será suficiente con situarles en una posición semiincorporada. Sin embargo, cuando existe compromiso de la función respiratoria es necesaria la intubación orotraqueal y la asistencia ventilatoria. La hipoxia debida a obstrucción parcial de la vía aérea, neumonía o hipoventilación puede aumentar el área lesionada y empeorar el pronóstico26. Hay datos que indican que la administración suplementaria de oxígeno a bajo flujo en pacientes con ictus reduce la tasa de desaturaciones nocturnas, tan frecuentes en estos pacientes, lo que podría contribuir a mejorar la evolución27 y si se detecta hipoxia (<95% saturación de oxígeno [SatO2]), debe instaurarse oxigenoterapia10 (nivel de evidencia 2b).
Manejo de la presión arterialLa hipertensión arterial es muy frecuente en la fase aguda de un ictus. En muchos casos se produce una reducción espontánea de la presión arterial en los primeros días. En la fase aguda del ictus el uso de antihipertensivos debe ser cauteloso, ya que al estar deteriorados los mecanismos de regulación de la circulación cerebral en la zona isquémica el descenso de la presión de perfusión puede comprometer el flujo sanguíneo cerebral regional en el área de penumbra, agravando la isquemia y deteriorando el estado neurológico28. Diversos estudios indican que la relación entre el pronóstico funcional y la mortalidad tras el ictus y la presión arterial sistólica y diastólica tiene morfología en «U», de tal manera, que la probabilidad de muerte o dependencia es mayor para cifras más bajas o más altas de presión arterial durante la fase aguda, siendo las cifras más favorables entre 110-180/70-10529–32 (nivel de evidencia 2a). Es por ello, que solo se recomienda tratar si la tensión arterial (TA) sistólica es mayor de 185 o la diastólica mayor de 105.
Hay datos que demuestran que tratar la hipertensión de forma controlada en fase aguda es seguro33–36 aunque solo algún estudio muestra un beneficio35, mientras que otros no demuestran reducción de eventos vasculares ni tampoco efecto del tratamiento en cuanto a mejorar la evolución36 o incluso sugieren un posible efecto perjudicial37.
Cuando sea posible se utilizará la vía oral con fármacos con poco efecto sobre el flujo sanguíneo cerebral regional, como bloqueantes del receptor de angiotensina, inhibidores de la enzima convertasa de angiotensina o betabloqueantes35. Se evitarán fármacos que produzcan descensos bruscos e intensos de presión arterial como los antagonistas del calcio o el diazóxido. Si se precisa la vía intravenosa deben utilizarse fármacos de acción previsible y fácilmente reversible como labetalol, urapidil o nitroprusiato y siempre con monitorización estricta para evitar caídas bruscas y superiores al 20%1,32.
Existen excepciones que modifican el nivel de tensión arterial que supone indicación de tratamiento, como puede ser la coexistencia de isquemia miocárdica, insuficiencia cardiaca, disección aórtica o encefalopatía hipertensiva.
Una vez pasada la fase aguda, se debe iniciar el tratamiento de la hipertensión arterial como medida de prevención secundaria de acuerdo a las guías específicas.
La hipotensión es poco frecuente tras un ictus. Su causa suele ser la depleción de volumen o el fracaso de bomba y si se presenta deben descartarse complicaciones como infarto de miocardio, disección de aorta, embolia pulmonar o hemorragia digestiva. Además de tratar la causa, la hipotensión debe corregirse mediante expansores de volumen y, ocasionalmente, drogas vasopresoras (dopamina).
La hipertermia tiene un efecto negativo sobre el pronóstico del infarto cerebral, de tal manera que por encima de 37,5°C se aumenta la probabilidad de progresión y de muerte (nivel de evidencia 2a)38,39. Existen estudios que demuestran que el tratamiento con antitérmicos en caso de temperatura elevada, mejora la evolución de los pacientes tratados, pero que no son útiles de forma rutinaria en pacientes con temperatura normal (nivel de evidencia 1b)40. Ante la presencia de fiebre, debe investigarse y tratarse su causa y utilizar antitérmicos (paracetamol o metamizol y medidas físicas si es necesario) si la temperatura axilar es superior a 37,5°C. Datos experimentales demuestran que la hipotermia reduce el tamaño del infarto. En clínica hay estudios que demuestran que es posible inducir hipotermia con medidas físicas o farmacológicas, pero por el momento no hay datos que avalen la utilidad de la misma en cuanto a mejorar el pronóstico funcional o reducir la mortalidad y, por otra parte la hipotermia asocia un mayor riesgo de desarrollar complicaciones infecciosas, fundamentalmente neumonía41. Sin embargo, hay iniciativas para realizar más estudios que investiguen la utilidad de esta técnica optimizando las condiciones clínicas para el tratamiento42,43.
Control de la glucemiaLa hiperglucemia en fase aguda, pero también la hiperglucemia >155 persistente en las primeras 48 horas tras un ictus, empeoran el pronóstico funcional y la mortalidad (nivel de evidencia 2b)44–47. Se asocia a progresión del infarto45, disminuye la efectividad de la trombólisis e incrementan el riesgo de hemorragia tras la misma48,49 (nivel de evidencia 2b). El tratamiento con insulina en el ictus agudo permite corregir la hiperglucemia, pero no está demostrado que la intervención terapéutica permita mejorar la evolución (nivel de evidencia 1b)50,51. Con los datos disponibles se recomienda evitar la administración de sueros glucosados en las primeras 24-48 horas, salvo en pacientes diabéticos en los que es más fácil que ocurra hipoglucemia, especialmente si estaban previamente en tratamiento con antidiabéticos orales y mantener la glucemia por debajo de 155mg/dl46,47. Por otro lado, la hipoglucemia debe ser tratada mediante administración de sueros glucosados. Puede producir síntomas focales que remeden un ictus o agravar la sintomatología existente y, por el contrario, algunos pacientes con ictus no manifestarán síntomas de hipoglucemia. Por todo ello se recomienda monitorizar las cifras de glucemia en fase aguda en todos los pacientes al menos cada 6 horas, o más a menudo en casos en que la glucemia no se mantenga en límites normales.
Balance hídrico y nutricionalLa desnutrición tras el ictus facilita las complicaciones52–54. Los pacientes pueden tener serias interferencias en la nutrición debido a disfagia o bajo nivel de conciencia. Si estas condiciones se mantienen más de 48-72 horas debe iniciarse alimentación enteral por sonda nasogástrica54. La capacidad deglutoria debe examinarse diariamente para prevenir el riesgo de aspiración. Teniendo en cuenta que la disfagia a líquidos es más frecuente se evitarán estos en fases iniciales hasta comprobar que la deglución es normal. Mientras exista disfagia a líquidos estos se administrarán con espesantes o en forma gelificada para evitar deshidratación. Evitar el ayuno prolongado reduce la mortalidad y las complicaciones aunque no hay datos de que afecte a la evolución funcional54 (nivel de evidencia 1b).
Fisioterapia en fase agudaLa movilización precoz reduce la incidencia de otras complicaciones: hombro doloroso, úlceras de decúbito, contracturas, parálisis de presión, etc. Los trabajos existentes, así como los metaanálisis indican que la fisioterapia y rehabilitación son efectivas en la recuperación funcional a medio plazo, y que esta efectividad es mayor cuando el tratamiento se instaura precozmente y de forma específica para el reentrenamiento en tareas concretas55–57 (nivel de evidencia 1a). Si bien la fisioterapia pasiva debe instaurarse precozmente, la rehabilitación activa debe demorarse hasta que el paciente esté estable y sin riesgo de desestabilización hemodinámica.
Existen determinadas sustancias que por su potencial efecto depresor del sistema nervioso central (especialmente aquellos con accción agonista gabaérgica) pueden retrasar la recuperación tras un ictus, y por lo tanto, deben ser evitados en fase aguda en la medida de lo posible. Estas sustancias incluyen neurolépticos, benzodiacepinas y otros ansiolíticos, barbitúricos, fenitoina y otros anticonvulsivantes y antiespásticos. En caso de ser necesarios, su uso debe hacerse con precaución (nivel de evidencia 3a)58. Por el contrario, se ha visto que el uso de antidepresivos inhibidores de recaptación de serotonina (fluoxetina, citalopram) precozmente en casos en que estén indicados, mejoran los trastornos del humor y favorecen la recuperación funcional (nivel de evidencia 1a)59–61.
- 1.
Se recomienda la administración de oxígeno a los pacientes con hipoxia (SatO2<95%) e intubación y soporte ventilatorio en los pacientes con compromiso de la vía aérea (nivel de evidencia 2b; recomendación de grado B).
- 2.
El uso de antihipertensivos debe ser cauteloso durante la fase aguda del ictus; se recomienda tratar si las cifras de presión arterial superan 185mmHg de sistólica o 105 de diastólica (nivel de evidencia 2a; recomendación de grado B).
- 3.
Se recomienda evitar hipertermia superior a 37,5°C. Entre los fármacos estudiados, el paracetamol ha demostrado su utilidad y seguridad en la reducción de temperatura (nivel de evidencia 1b; recomendación de grado A).
- 4.
Evitar la administración de suero glucosado salvo en el tratamiento de hipoglucemia.
- 5.
Se recomienda evitar glucemias >155mg/dl (nivel de evidencia 2a; recomendación de grado B).
- 6.
Debe evaluarse la presencia de disfagia para prevenir la posibilidad de broncoaspiración. Se recomienda evitar la desnutrición y considerar la necesidad de alimentación enteral, si es necesario en los primeros días, con sonda nasogástrica (nivel de evidencia 1a; recomendación de grado A).
- 7.
Se recomienda la movilización pasiva precoz (nivel de evidencia 1a; recomendación de grado A).
- 8.
Se recomienda evitar el uso de fármacos con potencial efecto deletéreo sobre la recuperación funcional (nivel de evidencia 3a; recomendación de grado B).
Las complicaciones neurológicas más frecuentes son el edema y la hipertensión intracraneal, las crisis epilépticas y la conversión hemorrágica del infarto cerebral.
El edema cerebral post-isquémico con hipertensión intracraneal puede conducir a la herniación cerebral y suele ser causa de muerte durante la primera semana en infartos hemisféricos grandes, especialmente en pacientes jóvenes o en infartos cerebelosos, en los que se produce compresión del IV ventrículo y del acueducto de Silvio con posible hidrocefalia secundaria62. Se ha acuñado el término de infarto maligno de arteria cerebral media (IMACM) para designar los infartos de evolución tórpida en este territorio, debidos a oclusión del tronco principal de arteria cerebral media (ACM) o bien de la porción distal de arteria carótida interna (ACI) intracraneal63. El cuadro clínico se caracteriza por signos clínicos de infarto total de circulación anterior, con deterioro del nivel de conciencia y hallazgos radiológicos de isquemia afectando a más del 50% del territorio de la ACM. Posteriormente y, por lo general en relación con el deterioro, se observa edema franco con efecto de masa en mayor o menor grado y desplazamiento de línea media. La mortalidad del IMACM, incluso con tratamiento médico agresivo (intubación y medidas antiedema) es de 80%64. Los datos clínicos y radiológicos permiten predecir este mal pronóstico y ello facilita la posible selección del paciente para tratamientos agresivos. Por ello es fundamental una monitorización estrecha con el fin de detectar precozmente el deterioro y poder aplicar tratamientos antes de que sea irreversible.
El tratamiento inicialmente es preventivo y consiste en medidas generales como procurar una moderada restricción de líquidos evitando soluciones hipoosmolares (como las glucosadas al 5%), tratamiento de trastornos asociados que podrían empeorar el edema (hipoxia, hipercapnia, hipertermia, hipertensión arterial, retención urinaria, etc.), y elevación de la cabecera de la cama a 30°, para mejorar el retorno venoso y disminuir la presión intracraneal (PIC)65 (nivel de evidencia 3b).
Los corticoides a dosis altas no disminuyen la mortalidad ni las secuelas y, en cambio favorecen las infecciones y dificultan el control de la glucemia, por lo que no deben emplearse66–68 (nivel de evidencia 1a).
Los agentes osmóticos (manitol 20% o glicerol 10%) pueden bajar la PIC, pero producen un efecto transitorio y no han demostrado eficacia en reducir la mortalidad o las secuelas, por lo que no se recomienda su uso rutinario en caso de edema cerebral en ictus agudo (nivel de evidencia 1a)69–71. De la misma manera, la hiperventilación tras intubación para producir un descenso de la presión parcial del dióxido de carbono arterial (PaCO2) permite una reducir la presión intracraneal, pero por su efecto transitorio solo se utiliza como coadyuvante previo a la realización de craniectomía descompresiva.
La craniectomía descompresiva en IMACM ha demostrado disminuir la mortalidad y, en algunos casos, las secuelas, siempre que se realice precozmente (antes de las 48 horas desde el inicio de los síntomas), en pacientes jóvenes (≤60 años) y cuando no existen datos clínicos de herniación o situaciones clínicas concomitantes que pueden aumentar la probabilidad de complicaciones (como inestabilidad hemodinámica, riesgo de sangrado, comorbilidad grave, etc.) (nivel de evidencia 1a) (tabla 3)72–76. La craniectomía debe ser extensa (al menos 12cm) y asociar apertura dural. Colocar un sensor de PIC no ha demostrado utilidad (nivel de evidencia 2b)77.
Craniectomía descompresiva en el infarto maligno de arteria cerebral media
| Indicaciones |
| – Edad ≤60 años. |
| – Inicio de los síntomas ≤48 horas. |
| – Signos clínicos, radiológicos y neurosonológicos de infarto extenso de ACM o de infarto carotídeo (TACI) |
| • NIHSS >15 al ingreso. |
| • Deterioro de la situación neurológica respecto al ingreso (≥4p en la NIHSS) y/o del nivel de conciencia (≥1p en el ítem 1a de la NIHSS), habiendo descartado otras causas no neurológicas. |
| • Volumen de infarto ≥145cm3 en RM de difusión o bien: |
| • Signos en TC de afectación de ≥50% del territorio de ACM, especialmente si existe efecto de masa. |
| • Incremento del efecto de masa respecto a TC basal. |
| • Datos neurosonológicos o angiográficos de oclusión carotídea o del segmento M1 de la ACM. |
| – Situación hemodinámica estable. |
| – Firma del consentimiento informado por parte del familiar o del representante. |
| Contraindicaciones o criterios de exclusión |
| – Edad>60 años. |
| – Mala situación basal previa con puntuación en la escala de Rankin >2. |
| – Deterioro neurológico atribuible a otras causas tratables. |
| – Enfermedades concomitantes graves y/o con mal pronóstico vital. |
| – Coagulopatías o riesgo elevado de sangrado. |
| – Contraindicación para anestesia. |
| – Datos clínicos o radiológicos de herniación cerebral o muerte encefálica. |
| – Negativa del familiar o representante a otorgar el consentimiento. |
| – Deseo expreso del paciente en manifestaciones previas o testamento vital a no recibir cuidados que le permitan sobrevivir en situación de dependencia. |
ACM: arteria cerebral media; NIHSS: Escala Neurológica del National Institute of Health; RM: resonancia magnética; TACI: infarto total de la circulación anterior; TC: tomografía computarizada.
En el caso de los infartos cerebelosos grandes que produzcan hidrocefalia obstructiva o sufrimiento de tronco cerebral, la craniectomía suboccipital78 es efectiva para el tratamiento de la hidrocefalia y la compresión del tronco cerebral (nivel de evidencia 3a) y es el tratamiento recomendado frente a la colocación de un catéter de drenaje ventricular, que podría dar lugar a herniación transtentorial hacia arriba del cerebelo edematoso, por lo que el drenaje ventricular aislado en estos casos no se recomienda10. Los criterios de tiempo y edad no son tan restrictivos como en el caso de la hemicraniectomía en el IMACM.
Las crisis epilépticas pueden complicar la fase aguda de un ictus. Lo más frecuente es que sean parciales, con o sin generalización secundaria. El índice de recurrencia es bajo en las de aparición precoz tras el ictus, pero más alto en las que aparecen de forma tardía (3-5%, de los casos) y de los que presentan crisis tardías, entre el 54 y 66% desarrollarán epilepsia79,80. El tratamiento anticomicial solo debe utilizarse en crisis recurrentes y no está indicado como profilaxis en pacientes que no las hayan sufrido. Los antiepilépticos de primera generación, particularmente la fenitoína, no parecen los más indicados para el tratamiento durante la fase aguda, por su posible interferencia con la recuperación. Lamotrigina y gabapentina han sido evaluadas en crisis post-ictus y han demostrado mejor perfil de eficacia/seguridad que carbamacepina, oxcarbacepina y topiramato con menor grado de interacciones farmacológicas (nivel de evidencia 1a)80,81. Levetiracetam parece ser útil en pacientes con crisis tardías post-ictus y podría serlo también en la fase aguda (nivel de evidencia 3b)82,83.
- 1.
Se recomienda monitorización estrecha e inicio de medidas generales de prevención de desarrollo de edema en pacientes con infartos extensos de territorio anterior o infartos cerebelosos (nivel de evidencia 3b; recomendación de grado B).
- 2.
Los corticoides no deben emplearse en el edema cerebral de causa isquémica (nivel de evidencia 1a; recomendación de grado A).
- 3.
En caso de signos clínicos y radiológicos de IMACM debe considerarse la indicación de hemicraniectomía descompresiva, iniciando osmoterapia e hiperventilación previas, en pacientes por debajo de 60 años y en casos de menos de 48h de evolución, sin datos de herniación cerebral transtentorial (nivel de evidencia 1a; recomendación de grado A).
- 4.
Se recomienda craniectomía suboccipital descompresiva en infartos cerebelosos con sufrimiento de tronco cerebral por compresión o hidrocefalia obstructiva (nivel de evidencia 3b; recomendación de grado B).
- 5.
No se recomienda el tratamiento anticonvulsivante profiláctico en pacientes que no hayan tenido crisis (nivel de evidencia 1a; recomendación de grado A). Deben tratarse los pacientes con crisis recurrentes (nivel de evidencia 1a; recomendación de grado A). No hay datos suficientes para seleccionar un determinado tratamiento antiepiléptico de primera elección.
Las más frecuentes son la neumonía y la infección del tracto urinario. La neumonía se produce en pacientes que tienen alterado el nivel de conciencia o el reflejo tusígeno o que presentan disfagia. Es una importante causa de muerte en los pacientes con ictus. Es necesario identificar los pacientes de riesgo e implementar las medidas preventivas como aislamiento de vía aérea, en casos necesarios, fisioterapia respiratoria, aspiración de secreciones y evitar vómitos.
La infección urinaria puede ser causa de sepsis hasta en 5% de los pacientes con ictus. Es más frecuente en mujeres y en pacientes más afectados. Deben evitarse circunstancias que puedan favorecer la misma como el sondaje vesical, salvo casos en que sea estrictamente necesario84.
La presencia de fiebre obliga a descartar neumonía o infección urinaria y, en caso de sospecha, debe instaurarse tratamiento antibiótico precozmente (nivel de evidencia 2b)84. Se recomienda inciar antibioterapia empírica con amoxicilina clavulánico a dosis altas 1-2g iv/8h ya que este antibiótico cubrirá la mayor parte de los gérmenes responsables. En caso de alergias se recomienda el uso de quinolonas (ciprofloxicina 200-400mg/12h). Posteriormente en caso de falta de respuesta se adecuará el tratamiento en función de los cultivos o el cuadro clínico.
La trombosis venosa profunda es, así mismo, una complicación frecuente. En algunos casos es origen de un tromboembolismo pulmonar, que es causa de muerte en un 25% de los ictus. La administración de heparinas de bajo peso molecular es eficaz en la prevención de trombosis venosa85 (nivel de evidencia 1a). La aspirina también ha demostrado ser eficaz en la prevención de tromboembolismo pulmonar86,87 (nivel de evidencia 1a). No hay evidencia de que las medidas físicas como las medias elásticas o los sistemas de compresión neumática intermitente reduzcan significativamente la incidencia de trombosis venosa88 (nivel de evidencia 1a).
- 1.
Se recomienda el empleo precoz de antibióticos ante complicaciones infecciosas (nivel de evidencia 2b; recomendación de grado B).
- 2.
Se recomienda el uso de heparinas de bajo peso molecular o heparinoides y, en caso de contraindicación o como alternativa, la aspirina, para prevención de trombosis venosa profunda y embolismo pulmonar en pacientes inmovilizados (nivel de evidencia 1a; recomendación de grado A).
En función de la fisiopatología de la isquemia cerebral hay, al menos desde el punto de vista teórico, dos tipos de abordaje posibles para reducir el daño cerebral: mejorar o restablecer el flujo sanguíneo cerebral (FSC) en la zona isquémica y aplicar agentes farmacológicos dirigidos a inhibir los trastornos celulares y moleculares responsables del desarrollo del daño por isquemia-reperfusión en al área de tejido potencialmente salvable o área de penumbra isquémica (protección cerebral o cerebroprotección farmacológica)89. Ambas estrategias terapeúticas deben ser instauradas de manera precoz para evitar la progresión irreversible de los distintos mecanismos lesionales. Recientemente se ha incorporado el concepto de reparación en base a la potencial existencia de fenómenos de plasticidad que pueden ser activados o reforzados con intervención terapéutica90,91. Los tratamiento aplicados con este fin, podrían tener una ventana de oportunidad más amplia.
Medidas dirigidas a mejorar o restablecer el FSCComo medida general, es fundamental asegurar una adecuada presión de perfusión manteniendo una situación hemodinámica estable en la zona isquémica. Para conseguir la recanalización y reperfusión del tejido isquémico se han usado antitrombóticos, trombolíticos y trombectomía mecánica.
AntitrombóticosAnticoagulantesEl uso de heparinas en la fase aguda de la isquemia cerebral se ha fundamentado en su potencial efecto en cuanto a evitar la progresión o favorecer la resolución del trombo y evitar la recurrencias precoces en casos de ictus isquémico de mecanismo embólico.
Heparina no fraccionadaLos resultados del International Stroke Trial (IST) muestran que la heparina cálcica subcutánea no ofrece beneficio en la evolución y, aunque previene las recidivas precoces, este efecto es contrarrestado por el incremento del riesgo de hemorragias, especialmente si se asocia a la administración de aspirina (nivel de evidencia 1b)86. En un subanálisis de este estudio tampoco se demostró beneficio en pacientes con fibrilación auricular92. Otros estudios que evalúan heparina sódica (tiempo de cefalina 1,5-2 veces el control) demuestran eficacia en la prevención de recidivas precoces en pacientes con infarto cerebral de origen cardioembólico93,94, pero a costa de un incremento de hemorragias.
No se ha demostrado que la heparina intravenosa ofrezca beneficio alguno en el infarto cerebral progresivo95.
El metaanálisis de los estudios con heparina no fraccionada en la fase aguda del ictus de cualquier etiología96 no muestra beneficio global y, si bien, muestra una reducción de incidencia de trombosis venosa profunda, tromboembolismo pulmonar y recurrencias precoces, este beneficio se ve contrarrestado por el incremento del riesgo de hemorragias potencialmente graves (nivel de evidencia 1a). El metaanálisis de los estudios que evalúan específicamente el uso de heparina en fase aguda en pacientes con infarto cardioembólico97 concluye que no ofrece beneficio significativo frente a aspirina o placebo en cuanto a reducción de mortalidad o dependencia ni de ictus recurrente en los primeros 14 días, mientras que sí producen un incremento casi de tres veces en la aparición de hemorragia cerebral sintomática. Además, tampoco reducen significativamente en comparación con aspirina los casos de trombosis venosa profunda o embolia pulmonar (nivel de evidencia 1a).
Heparinas de bajo peso molecular y heparinoidesVarios ensayos han estudiado su efecto en el ictus isquémico agudo y los resultados en general han sido negativos. En un estudio con nadroparina (FISS), se observó una reducción en la mortalidad a los 6 meses en los pacientes tratados98, sin embargo estos resultados no fueron confirmados en un segundo ensayo clínico europeo (FISS bis), que además mostraba mayor tasa de complicaciones hemorrágicas con las dosis más altas99. El ensayo clínico TOAST (Trial of Org 10172 in Acute Stroke Treatment) con danaparoide intravenoso en pacientes con infarto cerebral de menos de 24h de evolución, demostró mayor número de complicaciones hemorrágicas en los pacientes tratados sin beneficio en cuanto a prevención de progresión del ictus ni de recurrencias precoces, ni tampoco en la evolución a los tres meses100. Otros estudios comparando dalteparina101 o tinazaparina102 frente a aspirina muestran resultados semejantes. Los metaanálisis de los estudios con heparinoides y heparinas de bajo peso confirman que, aunque reducen la incidencia de trombosis venosa profunda y tromboembolismo pulmonar, no mejoran la evolución, no disminuyen las recurrencias precoces y pueden aumentar las hemorragias intracraneales85,103 (nivel de evidencia 1a).
Los estudios con el fármaco hipofibrinogemiante Ancrod no han demostrado beneficio y sí un incremento del riesgo de hemorragias cerebrales104,105.
Antiagregantes plaquetariosEn la fase aguda de la isquemia cerebral el único antiagregante estudiado es la aspirina. El International Stroke Trial (IST)86 y el Chinese Acute Stroke Trial (CAST)87 demuestran un efecto beneficioso de la administración de aspirina a dosis de 300mg/día dentro de las primeras 48 horas y durante dos semanas, en la evolución de los pacientes a los 6 meses, así como reducción de recidivas precoces y de mortalidad. El metaanálisis de ambos estudios muestra una reducción absoluta del 0,7% en la tasa de recurrencias y del 0,4% en la de mortalidad. El incremento de hemorragias es del 0,2%. El beneficio global es una reducción absoluta del 0,9% en el riesgo de muerte o recurrencia106 (nivel de evidencia 1a).
Otros fármacos antiagregantes administrados por vía intravenosa como el abciximab o tirofibran se han estudiado en monoterapia o en combinación con trombólisis para conseguir recanalización arterial en el infarto cerebral agudo107,108. Pese a los primeros resultados esperanzadores, los ensayos clínicos con abciximab en las primeras 6 horas tras el ictus109, muestran un aumento de la tasa de hemorragias en los pacientes tratados110 (nivel de evidencia 1b).
En todos los ensayos clínicos con trombólisis, la administración de cualquier fármaco antitrombótico se demoró hasta pasadas 24 horas desde la administración del trombolítico, por lo que actualmente esta sigue siendo la pauta recomendada.
- 1.
Tras un infarto cerebral se recomienda el tratamiento con aspirina las primeras 48 horas salvo contraindicación (nivel de evidencia 1a; recomendación de grado A), pero no se recomienda la anticoagulación precoz en pacientes con infarto cerebral agudo (nivel de evidencia 1a; recomendación de grado A).
- 2.
En pacientes que reciban trombólisis el uso de cualquier antitrombótico se retrasará 24 horas (nivel de evidencia 1a; recomendación de grado B).
En la actualidad, existen evidencias suficientes basadas en estudios randomizados (NINDS, ECASS, ATLANTIS)111–115, en el metaanálisis de estos ensayos clínicos116–118 y en estudios de práctica clínica postcomercialización119,120, para recomendar el tratamiento trombolítico con activador tisular del plasminógeno recombinante (rtPA) (0,9mg/kg) por vía intravenosa en pacientes con infarto cerebral agudo de menos de 4,5 horas de evolución, ya que el tratamiento mejora la evolución clínica y funcional a los tres meses (nivel de evidencia 1a)1,10,111,120. Las complicaciones hemorrágicas y en concreto la hemorragia cerebral sintomática, son el principal riesgo del tratamiento con rtPA. En el registro SITS_ISTR, sobre casi 24.000 pacientes, la tasa de hemorragia cerebral sintomática fue de un 2%120. En general, la tasa de complicaciones hemorrágicas disminuye y el tratamiento tiene una margen de seguridad adecuado si se siguen estrictamente las recomendaciones de administración y los criterios de selección de los pacientes (tabla 2).
Actualmente no se considera la edad>80 años un factor de exclusión para el tratamiento trombolítico. La frecuencia de evolución funcional favorable en los pacientes del registro SITS mayores de 80 años que fueron tratados con rtPA iv fue significativamente mayor que en el caso de los pacientes de los ensayos con neuroprotectores (registro VISTA) que no recibieron trombólisis y el efecto fue similar al obtenido en los grupos de menor edad (nivel de evidencia 2a)121.
Tambien se ha cuestionado la coexistencia de historia de ictus con diabetes mellitus como criterio de exclusión122.
Las crisis epilépticas al inicio del ictus aumentan la probabilidad de error diagnóstico, pero se acepta que no deben ser un motivo para negar el tratamiento trombolítico si el infarto cerebral se confirma por técnicas de neuroimagen123,124.
Los beneficios de la trombólisis son mayores cuanto antes se administra el tratamiento117. Por ello se debe evitar cualquier retraso innecesario.
No se recomienda administrar otros agentes trombolíticos utilizados por vía sistémica, ya que se asocian a una elevada tasa de complicaciones hemorrágicas (nivel de evidencia 1a)1,10.
Hasta un tercio de los pacientes tratados con trombólisis intravenosa presentan reoclusión arterial. Esto es más frecuente en aquellos casos en que se produce una recanalización incompleta o cuando existe una lesión en tandem extra/intracraneal125. Se han estudiado diversas estrategias para mejorar la tasa de recanalización tras trombólisis intravenosa y para reducir la frecuencia de reoclusión. El estudio CLOTBUST demuestra que la aplicación de ultrasonidos sobre la arteria ocluida de forma simultánea con la administración de rtPA mejora la tasa de recanalización y la evolución de los pacientes (nivel de evidencia 1b)126. También se ha observado que la administración simultánea de ecopotenciadores puede mejorar la tasa de recanalización, aunque persisten dudas sobre su seguridad127 (nivel de evidencia 1b). Otros tratamientos como la asociación de anticoagulantes como el tirofibran o el argatroban o antiplaquetarios de acción rápida como el abciximab o el eptifibatide con el rtPA para evitar la reoclusión no muestran resultados favorables107,108,128.
Otros trombolíticos de síntesis modificados para mejorar la capacidad trombolítica y la afinidad y selectividad por la trombina unida al trombo con el fin de reducir las complicaciones hemorrágicas asociadas (desmoteplasa, reteplasa, tenecteplasa) están en fase de investigación en ensayos clínicos, con resultados prometedores, pero aun sin confirmar129–133.
Los resultados de estudios que evalúan la utilidad de trombólisis intraarterial aislada o en combinación con trombólisis intravenosa son prometedores y se está investigando su utilidad. Sin embargo, las técnicas endovasculares cada vez están más introducidas en la práctica clínica diaria. La evidencia disponible se basa en muy pocos ensayos randomizados y controlados, y en algunas series de casos y registros prospectivos. Con los datos existentes, apoyados en el ensayo randomizado controlado con placebo PROACT II, se puede afirmar que la trombólisis intraarterial con pro-urokinasa recombinante produce la recanalización eficaz de arterias ocluidas por un trombo y aumenta el porcentaje de pacientes independientes a los tres meses. Aumenta el riesgo de hemorragias cerebrales, pero no la mortalidad134,135 (nivel de evidencia 1b). Pese a ello no obtuvo la aprobación por las autoridades reguladoras. El procedimiento lleva implícito un mayor retraso en la administración del tratamiento. Por el momento no hay datos para asegurar que la trombólisis intraarterial ofrezca mejores resultados que la intravenosa, aunque se ha aplicado para pacientes con oclusiones de gran vaso, en pacientes con tejido salvable y evolución mayor de 4,5 horas o en pacientes con contraindicación para trombólisis intravenosa (nivel de evidencia 2b). La ventana terapéutica sería de 6 horas para el territorio anterior (nivel de evidencia 1b) y en el territorio posterior hasta 12 horas en el caso de déficit establecidos desde el inicio, y hasta 24 horas en el caso de déficit de instauración progresiva o fluctuante, sin bien algunas series de casos incluyen pacientes con ictus de territorio posterior de hasta 48 horas de evolución (nivel de evidencia 4)136–139.
Los datos existentes acerca de la combinación de trombólisis intravenosa con intraarterial son escasos, aunque indican que el tratamiento puede ser seguro140,141. En el estudio IMS I se encontró que una dosis parcial de rtPA intravenoso seguido de trombólisis intraarterial obtenía mejor resultado funcional que en los controles históricos del ensayo NINDS, pero no mejor que los pacientes que en el ensayo NINDS habían recibido trombolítico (nivel de evidencia 1b)142. El estudio IMS III que está en marcha y ha reclutado ya más de 300 pacientes evalúa si la terapia combinada intravenosa más intervención endovascular (trombólisis intraarterial o dispositivos mecánicos) ofrece ventaja sobre la intravenosa sola143.
También es posible realizar una trombectomía mecánica mediante dispositivos intraarteriales que realizan la fragmentación y extracción del coágulo. En el estudio MERCI se obtuvo recanalización en el 45% de los pacientes. Este porcentaje aumentó hasta el 64% en combinación con rtPA intra-arterial. El 50% de los recanalizados tuvieron mejoría significativa. No obstante, el resultado clínico no mejoró los resultados del PROACT144. El estudio Multi-Merci encontró recanalización en el 55% de los casos, con un porcentaje de buen resultado a los tres meses del 36%. Había también un incremento significativo de hemorragias y una mortalidad del 34%, que podría estar e relación con el hecho de que los pacientes presentaban ictus graves145. En un análisis combinado de los estudios MERCI y Multi MERCI comparando con PROACT II se concluye que los resultados de la embolectomía son similares al grupo de tratamiento del PROACT II, y la mortalidad no difiere del grupo control del PROACT146. El estudio de un solo brazo con el dispositivo PENUMBRA obtiene resultados mejores que los del MERCI con una tasa de recanalización del 81%, sin incremento significativo de la mortalidad, pero con pobre resultado clínico. El porcentaje de pacientes con resultado favorable clínico no difiere del grupo control del PROACT147. Están en marcha múltiples estudios randomizados y registros prospectivos que evalúan la eficacia y seguridad de diversos dispositivos de trombectomía mecánica tanto en territorio anterior como en posterior. Hoy en día, los procedimientos de recanalización intraarterial mecánica pueden ser considerados una opción en pacientes con contraindicación para trombólisis intravenosa, siempre que exista tejido salvable, con ventana terapéutica de 8 horas en el territorio anterior (nivel de evidencia 1b) y, aunque la casuística es menor, la ventana terapéutica para el territorio posterior se podría considerar igual que para la trombólisis intraarterial farmacológica (nivel de evidencia 4). Este tipo de procedimientos solo debe realizarse en centros capacitados con experiencia138.
- 1.
Se recomienda el tratamiento trombolítico con r-TPA iv a dosis de 0,9mg/kg para el tratamiento del infarto cerebral agudo de menos de 4 horas y media de evolución. La administración se realizará lo antes posible. La selección debe ser cuidadosa siguiendo estrictamente los criterios establecidos. Las normas de administración, así como el tratamiento de la hipertensión arterial o de las complicaciones hemorrágicas se indica en la tabla 3 (nivel de evidencia 1a; recomendación de grado A).
- 2.
La indicación debe hacerse por neurólogos expertos en el manejo del paciente con ictus y en centros con medios suficientes para el cuidado específico de estos pacientes, preferiblemente UI, así como para el tratamiento de las posibles complicaciones (extrapolación de estudios de nivel 1; recomendación de grado B).
- 3.
En pacientes tratados con trombólisis iv se recomienda no utilizar antitrombóticos (heparina o aspirina) en 24 horas (extrapolación de estudios de nivel 1; recomendación de grado B).
- 4.
La trombólisis intraarterial puede ser útil en pacientes no elegibles para trombólisis intravenosa en infartos con oclusión de gran vaso hasta las 6 horas de evolución (nivel de evidencia 1b; recomendación de grado B).
- 5.
La utilidad de la terapia intraarterial combinada con intravenosa no está aun bien establecida, pero puede considerarse una opción en pacientes que no responden a terapia intravenosa y que presentan una oclusión de gran vaso (nivel de evidencia 2b; recomendación de grado B).
- 6.
La trombectomía mecánica es una opción en pacientes no elegibles para trombólisis intravenosa o cuando ha fracasado ésta, hasta 8 horas de evolución (nivel de evidencia 1b; recomendación de grado B).
- 7.
Por el momento, solo se puede recomendar el tratamiento endovascular en centros con experiencia en neurointervencionismo y con UI y, preferiblemente bajo protocolo de registro de casos o ensayo clínico (nivel de evidencia 5; recomendación de grado D).
Los progresivos avances en el conocimiento de los trastornos celulares y moleculares que subyacen a la fisiopatología de la isquemia cerebral han dado lugar a la investigación de múltiples agentes farmacológicos con potencial capacidad para evitarlas y, por tanto, para inhibir los mecanismos responsables del daño por isquemia y reperfusión cerebral. Esto es lo que se denomina cerebroprotección o protección cerebral farmacológica1,110,148,149. Se han estudiado múltiples agentes farmacológicos denominados neuroprotectores que, al menos teóricamente, podían disminuir los daños causados tras la interrupción de FSC inhibiendo alguno o varios de los mediadores bioquímicos del daño por isquemia-reperfusión en más de 1.000 estudios experimentales, muchos de los cuales han mostrado resultados positivos que, posteriormente, no se han confirmado en la mayoría de los más de 400 estudios clínicos que se han llevado a cabo (tabla 4). La falta de confirmación clínica de los resultados procedentes de estudios experimentales se debe, en parte, a una mala adecuación entre las estrategias de investigación básica translacional y el diseño de ensayos clínicos150. No entraremos en detalle en la descripción de todos los estudios clínicos realizados con los diferentes fármacos por exceder el objetivo de esta guía terapéutica, y nos centraremos tan solo en aquellos que, por sus resultados prometedores, siguen en investigación o que pueden tener utilidad clínica.
Protección cerebral farmacológica en isquemia cerebral. Ensayos clínicos
| Fármacos | Mecanismo de acción | Resultado |
| Farmacos con acción sobre receptores iónicos | ||
| Antagonistas canales Ca++ | ||
| Nimodipino151–153,158 | Dihidropiridina | No eficacia/E. adversos |
| Nicardipina154 | “ | No eficacia/E. adversos |
| Darodipina155 | “ | No eficacia |
| Isradipina156 | “ | E. adversos |
| Flunarizina157 | Piperazina | No eficacia/E. adversos |
| Bloqueantes de otros canales iónicos | ||
| BMS-204352110,159 | Agonista canal maxi K | No eficacia |
| Antagonistas de receptor NMDA/AMPA de glutamato | ||
| Selfotel160 | Antagonista NMDA competitivo | E. adversos |
| Dextrorfan161 | Antagonista NMDA no competitivo | E. adversos |
| Aptiganel162 | “ | E. adversos |
| Magnesio110,149,163 | Antagonista NMDA no competitivo | No eficacia |
| Bloqueante de canales de calcio | En marcha fase III | |
| Gavestinel164,165 | Antagonista lugar de glicina | No eficacia |
| Fármacos con acción sobre la neurotransmisión | ||
| Inhibidores de la liberación presináptica de glutamato | ||
| Lubeluzol166,167 | Bloqueo canal Na+. Modula NOS | No eficacia |
| Inhibidores de otros neurotransmisores | ||
| Clometiazol168–170 | Agonista GABA | No eficacia |
| Diazepam171 | Agonista GABA | No eficacia |
| Bay x3702 (Repinotan)110 | Agonista 5-OHT | No eficacia |
| Nalmefene (Cervene)172 | Antagonista opiaceo Kappa-selectivo | No eficacia |
| Fármacos antioxidantes. Inhibidores de radicales libres | ||
| Tirilazad173–176 | Inhibe peroxidación lipídica dep. hierro | No eficacia/E. adversos |
| Ebselen110,177 | Acción tipo glutation peroxidasa | Cuestionable |
| Edaravone178 | Inhibe peroxidación lipídica | Fase II. No eficacia |
| NXY-059179,180 | Atrapador de protones | No efectivo |
| DP-b99(MACSI)110 | Atrapador de iones metálicos | En estudio |
| Moduladores de la respuesta inflamatoria | ||
| Enlimomab181 | Anticuerpos anti-ICAM1 | E. adversos |
| UK 279,276182 | Inhibidor del receptor CD11b/CD18 | No eficacia |
| Fármacos con acción trófica y/o reparadora | ||
| Citicolina183–189 | Síntesis de fosfatidilcolina | Fase II no concluyente |
| Fase III en estudio | ||
| Piracetam190 | Favorecedor de la fluidez de membrana | No eficacia |
| Factores neurotróficos | ||
| BFGF191 | Factor de crecimiento fibroblástico | No eficacia |
| GM-1192 | Monosialogangliósido | No eficacia/E. adversos |
| Cerebrolysin193–195 | Péptidos derivados de cerebro | Fase II no concluyente |
| Fase III en estudio | ||
| Miscelánea | ||
| Hemodilución196–198 | No eficacia | |
| Albúmina110,149,199,200 | Antioxidante, protección microvascularización | En estudio |
| Minociclina110,201 | Antibiótico con acción antiinflamatoria | En estudio |
| Estatinas110,202–206 | Efecto pleiotrópico | En studio |
AMPA: ácido alfa-amino-3-hidroxi-5-metil-4-isoxazolpropionico; GABA: gamma-aminobutyric acid; NMDA: antagonistas de la N-metil-D-aspartato.
Es un intermediario de la síntesis de fosfatidilcolina, mejora la síntesis de acetilcolina en el cerebro, reduce la acumulación de ácidos grasos libres en el tejido isquémico y tiene acción antioxidante183. Existen diversos ensayos clínicos con citicolina administrada en las primeras 24 horas tras el ictus con resultados prometedores, siendo la dosis aparentemente más favorable la de 2.000mg/día durante 6 semanas184–187. Estos datos, que sugieren el posible efecto terapéutico de citicolina188 (nivel de evidencia 2b) se están investigando en un nuevo estudio en fase III denominado estudio ICTUS110,189.
Albúmina humana a altas dosisLa albúmina tiene múltiples acciones con potencial efecto protector149 y ha mostrado eficacia en estudios experimentales. En clínica el estudio ALIAS I fue un pequeño ensayo piloto de escalado de dosis en el que se administraba albúmina humana en las primeras 16 horas tras el ictus. Un análisis en el que se compara la evolución de los pacientes tratados con controles históricos del estudio NINDS mostró que los pacientes con la dosis más alta y que recibían además tratamiento trombolítico tenían tres veces más probabilidad de evolución favorable (nivel de evidencia 2b)199. En base a estos datos, actualmente se está llevando a cabo otro estudio en fase III110,200.
MinociclinaEs un antibiótico derivado de tetraciclina, que ha demostrado efecto protector en estudios experimentales mediado por su acción antiinflamatoria y por su efecto antiapoptótico. En un pequeño ensayo clínico demostró mejor evolución de los pacientes tratados frente a los que recibieron placebo según la puntuación NIHSS, el índice de Barthel y la escala modificada de Rankin a los tres meses (nivel de evidencia 2b)201.
EstatinasLas estatinas tienen efectos protectores en isquemia cerebral además del hipolipemiante. Varios estudios han demostrado que el tratamiento previo al ictus conlleva mejor pronóstico y su retirada es un factor independiente de mal pronóstico (nivel de evidencia 2b) y también hay algunos que indican que su administración precoz mejora la evolución de los pacientes con ictus agudo202–206. Actualmente hay estudios en marcha110.
Reparación cerebralLa reparación cerebral es un proceso endógeno natural que se activa tras la lesión e incluye procesos de proliferación celular, neurogénesis, angiogénesis y sinaptogénesis, que pueden ser potenciados mediante rehabilitación, así como por la administración de factores tróficos, drogas con efecto trófico y células madre207. Las distintas técnicas de rehabilitación favorecen los fenómenos de plasticidad cerebral con lo que facilitan una mejor recuperación funcional57–59. Diversos factores tróficos como la eritropoyetina (EPO), el factor de colonias estimuladoras de granulocitos (G-CSF), el factor del crecimiento de insulina-I (IGF-1) o factor de crecimiento de fibroblastos básico (bFGF), han sido testados en ensayos clínicos después de los resultados prometedores obtenidos en los estudios animales. Algunos han tenido que ser interrumpidos por efectos adversos, otros han mostrado seguridad y otros efectos negativos191,192,208 (tabla 4). Fármacos con efecto trófico como citicolina183,189 o cerebrolysin193,195 también han mostrado que podrían actuar favoreciendo mecanismos de reparación.
Con respecto a la terapia celular, diversas estirpes celulares se han ensayado en el infarto cerebral en modelos animales con buenos resultados en cuanto a efecto reparador y de recuperación funcional209. Igualmente se han llevado a cabo diversos ensayos clínicos donde células madre transplantadas a pacientes con ictus han mostrado seguridad y tolerancia91. Actualmente, se están llevando a cabo diferentes ensayos con distintas estirpes celulares, como las células madre neurales (CTX0E03) en el estudio PISCES o células madre mesenquimales en el ISIS110,210,211.
- 1.
Se recomienda no retirar estatinas en pacientes con ictus isquémico que las recibían previamente (nivel de evidencia 2a; recomendación de grado B).
- 2.
Se recomienda el inicio precoz, tan pronto como el paciente esté estable, de un programa de rehabilitación adecuado (nivel de evidencia 1a; recomendación de grado A).
- 3.
Por el momento no hay datos suficientes para recomendar el uso general de ningún fármaco con potencial acción protectora o reparadora en el tratamiento del infarto cerebral.
- 4.
La terapia con células madre está actualmente bajo investigación y no se puede recomendar en práctica clínica.
Las trombosis venosas cerebrales tienen diversas presentaciones clínicas que pueden incluir cefalea, que es el síntoma más frecuente, trastornos visuales, papiledema y alteración del nivel de conciencia (en caso de aumento importante de la presión intracraneal), infarto venoso con déficits focales o crisis comiciales212–214.
Las pruebas radiológicas son fundamentales para el diagnóstico. Generalmente se observan signos compatibles en tomografía computarizada simple que es la prueba de elección en urgencias por ser más accesible. Ante la sospecha clínica se realizará sin y con contraste. Los nuevos tomógrafos helicoidales permiten la realización de venografía no invasiva que puede confirmar la existencia de trombosis de senos y la extensión de la misma al mostrar la ausencia de flujo en el seno afecto. Se debe indicar cuando existe sospecha para confirmar el diagnóstico desde urgencias. Las técnicas de resonancia magnética son las más sensibles para confirmar el diagnóstico de trombosis de senos213,214. Rara vez es necesario realizar una arteriografía convencional invasiva.
Posteriormente será necesario realizar todos los estudios específicos dirigidos a la investigación etiológica (estados protrombóticos, coagulopatías, otras enfermedades hematológicas, drogas, enfermedades autoinmunes o del tejido conectivo, cancer, infecciones, otras, etc.)214. Estos trastornos serán tratados específicamente.
En cuanto al tratamiento, se han realizado algunos ensayos clínicos randomizados. Un pequeño estudio doble ciego comparó heparina no fraccionada dosis-ajustada (tiempo parcial de tromboplastina activada al menos dos veces el control) frente a placebo en tan solo 20 pacientes, pues fue interrumpido prematuramente por demostrar mejor evolución en los pacientes tratados con heparina215.
El otro estudio randomizado comparó nadroparina (90 antiXa U/kg/12h) frente a placebo administrados durante tres semanas. Al cabo de 12 semanas el 13% de los pacientes (3 de 30) del grupo anticoagulado y 21% (6 de 29) del grupo placebo presentaron mala evolución, con un beneficio absoluto del 7% y reducción del riesgo relativo del 38% en el grupo de nadroparina. No hubo nuevas hemorragias cerebrales sintomáticas. Además, el doble de pacientes presentaron hipertensión intracraneal en el grupo placebo frente al de nadroparina (28 vs. 13%)216. El metaanálisis de estos dos estudios reveló una reducción no significativa del riesgo de muerte o dependencia con el tratamiento anticoagulante217. Los estudios sugieren bajo riesgo de hemorragia cerebral asociado al tratamiento con heparina en estos pacientes y también bajo riesgo de crecimiento de la hemorragia en caso de que sea la forma de presentación, indicando un balance beneficio/riesgo favorable del tratamiento con heparina (nivel de evidencia 1a). Un estudio no randomizado reciente que incluye 624 pacientes sugiere que la heparina de bajo peso molecular es más segura y eficaz que la heparina no fraccionada en pacientes con trombosis venosa cerebral, especialmente en el caso de que presenten lesiones hemorrágicas al inicio218 (nivel de evidencia 2b).
En cuanto a otras técnicas para la recanalización de los senos trombosados, una revisión sistemática sugiere que la trombólisis farmacológica local puede ser beneficiosa en casos más graves, reduciendo la mortalidad (nivel de evidencia 3a)219. La trombectomía mecánica es técnicamente factible, pero de momento la experiencia es solo anecdótica214.
En pacientes con lesiones parenquimatosas grandes con grave efecto de masa que conduce a herniación, la craniectomía descompresiva reduce la mortalidad y generalmente se asocia a buena evolución funcional (nivel de evidencia 2b)220.
- 1.
Se recomienda el tratamiento anticoagulante con heparina de bajo peso molecular o heparina iv en la trombosis venosa cerebral aunque existan lesiones hemorrágicas (nivel de evidencia 1a; recomendación de grado A). La heparina de bajo peso molecular se prefiere frente a heparina no fraccionada en caso de lesiones hemorrágicas (nivel de evidencia 2b; recomendación de grado B).
- 2.
La trombólisis farmacológica local podría ser una opción en casos graves (nivel de evidencia 3a; recomendación de grado B).
Ya ha sido mencionado que «el tiempo es cerebro» y no debemos olvidar que disponemos de tratamientos eficaces como el ingreso en UI y la trombólisis intravenosa, además de otras terapias prometedoras como intervencionismo neurovascular. Asimismo hay otros tratamientos en estudio actualmente.
Como se desprende de esta revisión, hay muchos aspectos del tratamiento del infarto cerebral claramente verificados y que, por tanto, tienen un alto recomendación de grado. Sin embargo, hay un gran número de posibilidades terapeúticas que están por comprobar. Debemos ser estrictos a la hora de tratar a nuestros pacientes y, por otro lado, animar a la realización de ensayos clínicos que puedan ofrecer nuevas perspectivas de tratamiento con suficiente grado de fiabilidad. El tratamiento del infarto cerebral según pautas de recomendación basadas en la evidencia permitirá un manejo más seguro y efectivo de estos procesos, además de ayudar a unificar criterios y reducir costes derivados del cuidado de los pacientes.
FinanciaciónEste trabajo no ha recibido financiación alguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comitéad hocdel Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV) de la SEN para la redacción de las Guías de actuación clínica en el ictus.
Coordinador: Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid.
A.1. Comisión de Redacción
Exuperio Díez-Tejedor (Coordinador), Hospital Universitario La Paz, Madrid; Blanca Fuentes (Secretaría), Hospital Universitario La Paz, Madrid; María Alonso de Leciñana, Hospital Universitario Ramón y Cajal, Madrid; José Álvarez-Sabin, Hospital Universitario Valle de Hebron, Barcelona; Juan Arenillas, Hospital Universitario Clínico, Valladolid; Sergio Calleja, Hospital Universitario Central de Asturias, Oviedo; Ignacio Casado, Hospital San Pedro, Cáceres; Mar Castellanos, Hospital Josep Trueta, Gerona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Antonio Dávalos, Hospital Universitario German Trias i Pujol, Badalona; Fernando Díaz-Otero, Hospital Universitario Gregorio Marañón, Madrid; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; José Antonio Egido, Hospital Clínico Universitario San Carlos, Madrid; Juan Carlos López Fernández, Hospital Universitario Dr. Negrín, Las Palmas; Mar Freijo, Hospital Universitario de Basurto, Bilbao; Blanca Fuentes, Hospital Universitario La Paz, Madrid; Jaime Gállego, Hospital General de Navarra, Pamplona; Andrés García Pastor, Hospital Universitario Gregorio Marañón, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; Francisco Gilo, Hospital Universitario La Princesa, Madrid; Pablo Irimia, Clínica Universitaria de Navarra, Pamplona; Aida Lago, Hospital Universitario La Fe, Valencia; José Maestre, Hospital Universitario Virgen de las Nieves, Granada; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Joan Martí-Fábregas, Hospital de la Santa Cruz y San Pablo, Barcelona; Patricia Martínez-Sánchez, Hospital Universitario La Paz, Madrid; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Carlos Molina, Hospital Universitario Valle de Hebron, Barcelona; Ana Morales, Hospital Universitario Virgen de la Arrixaca, Murcia; Florentino Nombela, Hospital Universitario La Princesa, Madrid; Francisco Purroy, Hospital Universitario Arnau de Vilanova, Lérida; Marc Ribó, Hospital Universitario Valle de Hebron, Barcelona; Manuel Rodríguez-Yañez, Hospital Clínico Universitario, Santiago de Compostela; Jaime Roquer, Hospital del Mar, Barcelona; Francisco Rubio, Hospital Universitario de Bellvitge, Barcelona; Tomás Segura, Hospital Universitario de Albacete, Albacete; Joaquín Serena, Hospital Joseph Trueta, Gerona; Patricia Simal, Hospital Clínico Universitario San Carlos, Madrid; Javier Tejada, Hospital Universitario de León, León; José Vivancos, Hospital Universitario La Princesa, Madrid.
A.2. Comisión de Revisión o Institucional
José Álvarez-Sabín, Hospital Universitario Valle de Hebron, Barcelona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; José Larracoechea, Hospital de Cruces, Bilbao; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Jorge Matías-Guiu, Hospital Clínico Universitario San Carlos, Madrid; Francisco Rubio, Hospital de Bellvitge, Barcelona.
Las filiaciones de los autores y composición del comité se relacionan en el addendum.